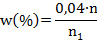Download Article
Download Article
Carbon dioxide (CO2) is colorless and odorless, so you can’t detect it through direct observation. You’ll need to collect an air sample (or a CO2 sample), then run one of several simple tests to identify the presence of the gas. You can bubble the gas through limewater, or you can hold a lit splint into the sample to see if it is extinguished by the presence of CO2.
-
1
Collect a CO2 sample. To begin your test, you will need a sealed test tube filled with collected gas. You can collect carbon dioxide in a gas jar, a boiling tube, or another airtight container. Collection is usually performed over water in a beaker. CO2 gas is denser than air, so you can collect it using “downward delivery” or a gas syringe.
-
2
Mix calcium carbonate with hydrochloric acid (HCl). The simplest way to collect carbon dioxide is to react calcium carbonate (or limestone chips) with hydrochloric acid. First, pour 20 mL of HCl into a conical flask. Add a spoonful of calcium carbonate (or limestone chips) to the HCL. When the reaction starts, cover the conical flask with a bung and delivery tube: you will collect the gas through the delivery tube and into an upturned test tube (which is immersed in bowl of water). If the water in the test tube is displaced, then gas is being collected.[1]
- You can continue to collect the gas for as long as the reaction occurs.
- For classroom demonstrations, you only need a small amount of hydrochloric acid, which is diluted to 1 M; a 2 M concentration works best, but should be used with extra care because it’s a strong acid. The equation is: CaCO3(s) + 2HCl(aq) ==> CaCl2(aq) + H2O(l) + CO2(g).
- Be very careful when working with hydrochloric acid – wear gloves, a lab coat, and protective goggles, and do not let the acid touch your skin! It’s best to only perform this reaction if you have access to a lab environment.[2]
Advertisement
-
3
Cover the test tube with a bung. Put the tube on a rack to keep it safe until you perform the test. The “bung” is essentially a small cork or cap that allows you to pipe the contents of the test tube elsewhere through a connected delivery tube. It’s important to seal the CO2 gas into the container. If you leave it open, the gas will mix with the air, and your test will be much less effective.
Advertisement
-
1
Bubble the gas through limewater. The most effective way to test for CO2 is to bubble the gas through “limewater”, a diluted solution of calcium hydroxide (slaked lime). When you bubble carbon dioxide through the solution, it forms a solid precipitate of calcium carbonate – chalk or limestone. Calcium carbonate is insoluble in water.[3]
Thus, if there is CO2 present in the sample, the limewater will turn milky, cloudy white.[4]
- Limewater is also called “white wash” or “milk of lime.” If you see these terms, you’ll know they mean limewater.[5]
- Limewater is also called “white wash” or “milk of lime.” If you see these terms, you’ll know they mean limewater.[5]
-
2
Make a limewater solution. The process is simple: dilute calcium hydroxide with water. Calcium hydroxide (Ca(OH)2) is a colorless white powder that you can buy from most chemistry suppliers. Pure limewater, once mixed, is clear and colorless, with a slight earthy smell and the bitter, alkaline taste of calcium hydroxide, as its pH is 12.3. Follow these steps to make your own limewater:
- Put 1 teaspoon (4.9 mL) of calcium hydroxide into a clean 1 gallon (3.8 L) or smaller glass jar. Limewater is a saturated solution, which means there will be some extra chemical that doesn’t dissolve. A teaspoon will result in a fully saturated solution, whether you use a gallon jar or a smaller container.
- Fill the jar with distilled water. It’s best to use distilled water for this experiment, as it will give you a purer solution.
- Put a lid on the jar. Shake the solution vigorously for 1-2 minutes, then let it stand for 24 hours.
- Pour the clearer solution off the top of the jar through a clean coffee filter or filter paper. Be very careful not to stir up the sediment. If necessary, repeat this filtering step until you obtain a clear limewater solution. Store in a clean jar or bottle.
-
3
Bubble the gas through the limewater. Half-fill a test tube with limewater – then boil it. Use a delivery tube to pipe the contents of the CO2 sample test tube directly into the boiling limewater. You can use a flexible pipe or a (metal) straw as a delivery tube, if nothing better is around. Let the captured gas “bubble” through the liquid, and wait for the reaction to take place.
- If you don’t want to boil anything, you can use a gas syringe to discharge the CO2 gas directly into the half-filled limewater test tube. Stopper the test tube, then shake vigorously for 1-2 minutes. If there is carbon dioxide in the sample, then the solution should grow cloudy.[6]
- If you don’t want to boil anything, you can use a gas syringe to discharge the CO2 gas directly into the half-filled limewater test tube. Stopper the test tube, then shake vigorously for 1-2 minutes. If there is carbon dioxide in the sample, then the solution should grow cloudy.[6]
-
4
Look for cloudy water. If CO2 is present, the limewater will turn milky white with calcium carbonate particulates, as the calcium carbonate solution is insoluble and will precipitate out of the solution. If the limewater is boiling, and the gas is piped directly into the limewater, then the reaction should begin immediately. If nothing happens after a minute or so, you can safely assume that there is no carbon dioxide in your sample.[7]
-
5
Know the chemical reaction. Understand what exactly is taking place to indicate the presence of CO2. The equation for the test is: Ca(OH)2 (aq) + CO2 (g) ==> CaCO3 (s) + H2O (l). In non-chemistry language: liquid limewater + gas (which contains CO2) react to solid lime (the particles) and liquid water.[8]
- If you bubble the CO2 through the limewater for an extended period of time, your water will eventually turn clear. That’s because of a chemical reaction! Here’s why:
- CO2 + H2O ==> H2CO3 (carbon dioxide + water = carbonic acid)
- H2CO3 + CaCO3 ==> Ca(HCO3)2 (carbonic acid + calcium carbonate = calcium hydrogen carbonate)
- Calcium hydrogen carbonate is soluble in water, making your solution clear!
- If you bubble the CO2 through the limewater for an extended period of time, your water will eventually turn clear. That’s because of a chemical reaction! Here’s why:
Advertisement
-
1
Try using the sample to extinguish fire. Carbon dioxide extinguishes fires, in high concentrations. You’ll simply need to hold a small lit flame inside a test tube that you suspect contains CO2. If the gas is present, the flame should go out immediately. Combustion (creation of a flame) is the reaction of oxygen with another substance; it is a rapid oxidation of the organic compound and a reduction of oxygen. The fire goes out because the oxygen is replaced by the CO2, which is not a combustible gas.
- Bear in mind that any oxygen-free gas will also extinguish a flame in this manner. Thus, this is an unreliable test for carbon dioxide, and it may lead you to misidentify the gas.[9]
- Bear in mind that any oxygen-free gas will also extinguish a flame in this manner. Thus, this is an unreliable test for carbon dioxide, and it may lead you to misidentify the gas.[9]
-
2
Collect the gas in an upside-down test tube. Make sure that the sample has been properly stored and stoppered before you try to test for CO2. Be reasonably certain that the test tube does not contain any flammable or explosive gases; in this case, the introduction of fire could be dangerous, or at least very frightening.
-
3
Place a small flame inside the test tube. Use a splint or any long, thin strip of wood. In a pinch, a match or a lighter will do – but the further your hands are from the opening of the test tube, the safer your experiment will be. If the flame immediately goes out, there’s likely a high concentration of CO2 in the test tube.
-
4
Alternately, try using a gas syringe to put out a candle. Fill a syringe with carbon dioxide. Then, use a drop of molten wax to affix a short candle to the surface of a coin. Next, place the candle and coin into a wide-mouthed cup – and light the candle. Equip the syringe with the tubing, and push the syringe to transfer the CO2 to the bottom of the cup. If you push out the entire contents of the syringe within a second or two, the flame should go out.
Advertisement
Add New Question
-
Question
Why should the test for carbon dioxide be performed immediately after collection of water sample?
Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.
Scientific Researcher
Expert Answer
-
Question
Is carbon dioxide harmful to humans?
Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.
Scientific Researcher
Expert Answer
Support wikiHow by
unlocking this expert answer.It depends on how much carbon dioxide is present. In small amounts, it’s not harmful to humans. However, if a large amount of carbon dioxide is present and displaces the oxygen in the air, it can cause respiratory issues for humans. The lack of oxygen can cause a person to breath rapidly and experience rapid heartbeat. If the lack of oxygen happens for a long time, the person might have damage to the brain, heart, and other organs.
-
Question
What happens to the calcium hydroxide solutions when carbon dioxide bubbles through it?
Calcium hydroxide, or limewater, will turn milky/cloudy when carbon dioxide is bubbled through it.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Things You’ll Need
- Limewater
- Heat-able test tube
- Gas syringe
- Delivery tube
- CO2 sample (or just water)
References
About This Article
Article SummaryX
To test for carbon dioxide, start by diluting some calcium hydroxide with water to make a limewater solution. Then, fill up a test tube halfway with the limewater and bring it to a boil. Next, use a delivery tube to pipe the contents of your sample into the boiling limewater. If the limewater turns cloudy and milky white, your sample has carbon dioxide in it. If no change occurs, there’s no carbon dioxide in the sample. To learn how to collect a carbon dioxide sample, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 336,566 times.
Reader Success Stories
-
“I like that all the answers are well detailed and are helpful. Good job, keep it up!”
Did this article help you?
Составная часть атмосферы, основное сырье для процесса фотосинтеза зеленых растений, продукт жизнедеятельности живых организмов.
По систематической международной номенклатуре (IUPAC) вещество с формулой СО2 получило название – Оксид углерода(IV). Тривиальные (общепринятые названия) – двуокись или диоксид углерода, угольный ангидрид (солеобразующий оксид, обладающий кислотными свойствами).
Формула углекислого газа
СО2
Молекула углекислого газа образована двумя атомами кислорода и атомом углерода. Структурная формула – О=С=О. Валентность углерода равна 4. Степень окисления – (+4). Тип связи – ковалентная полярная.
Получение углекислого газа
Природные источники углекислого газа
Углекислый газ образуется при медленном окислении в процессах дыхания, брожения, гниения органических веществ. Выделяется при разложении природных карбонатов, сгорании топлива, образовании дымовых газов. Содержится в воздухе, минеральных источниках.
В сутки организм человека выделяет 1 кг СО2. В воздухе содержится 0,03% углекислого газа.
Лабораторные способы получения
В лаборатории газ можно получить взаимодействием соляной кислоты с мелом, мрамором, содой. Собирается газ методом вытеснения воздуха.
CaCO3 + 2HCl → CaCl2+ H2O + CO2,
NaHCO3+ HCl → NaCl + H2O + CO2.
Промышленные способы получения
- Обжиг известняка: CaCO3 → CaO + CO2.
- Как побочный продут разделения воздуха при получении кислорода, азота, аргона.
Свойства углекислого газа
Физические свойства
Вещество нетоксичное, негорючее.
| Свойство | Описание |
|---|---|
| Агрегатное состояние при н.у. | Газ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Температура плавления | -750оC |
| Температура кипения | -56,50оC |
| Растворимость в воде | Растворяется частично. При t +150оC в 1 литре воды может раствориться 1,7 л углекислого газа |
| Плотность | 1,977 г/л |
| Молярная масса | 44г/моль |
Вещество в твердом агрегатном состоянии называется «сухим льдом».
Высокую концентрацию диоксида углерода можно определить органолептически – во рту, на языке появляется кисловатый привкус. Повышенное содержание опасно для организма – вызывает удушье.
Химические свойства
- Качественная реакция: при взаимодействии углекислого газа с известковым молочком (гидроксидом кальция) образуется карбонат кальция – осадок белого цвета.
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
- CO2, как кислотный оксид, реагирует с водой с образованием угольной кислоты. Эта кислота – соединение нестойкое, легко распадается на углекислый газ и воду. Тип реакции – реакция соединения, обратимая.
CO2 + H2O ↔ H2CO3.
-
При нагревании распадается на оксид углерода(II) и воду: 2CO2 = 2CO + O2.
-
Взаимодействует с основными оксидами, с образованием солей:
CaO + CO2 = CaCO3; Al2O3 + 3CO2 = Al2(CO3)3.
Тип реакции – реакция соединения.
- Взаимодействует со щелочами, с образованием кислых и средних солей:
CO2 + NaOH = NaHCO3;
CO2 + 2NaOH = Na2CO3 + H2O.
Средняя соль образуется при избытке щелочи. Кислая соль образуется при отношении количеств вещества оксида и щелочи – 1:1.
- При температуре реагирует с активными металлами:
CO2 + 2Mg = C + 2MgO
Углекислый газ в основном проявляет восстановительные свойства, но при взаимодействии с активными металлами является окислителем.
- Вступает в реакции взаимодействия с простыми веществами:
CO2 + 4H2 = CH4 + 2H2O (условия протекания реакции – высокая температура, катализатор Cu2O).
Применение углекислого газа
В пищевой промышленности:
- используется при производстве минеральной воды и газированных напитков;
- как пищевая добавка (Е290), повышает сроки хранения продуктов;
- в качестве разрыхлителя придает легкость и пышность кондитерским изделиям;
- как хладогент;
- для удаления из кофе кофеина.
В авиамоделировании используется как источник энергии для двигателей; применяется в пневматическом оружии; как заправка для углекислотных огнетушителей. Используется в качестве защитной среды при сварке.
Находит углекислый газ применение и в медицине – используется для криоабляции новообразований, служит стимулятором глубокого дыхания.
В химической промышленности газ используется в синтезе химических веществ, производстве солей угольной кислоты, процессах осушки и очистки полимеров, волокон растительного и животного происхождения. Применяется для очистки сточных вод, повышает проводимость сверхчистой воды.
Примеры решения задач
Задача 1
Найти массовую долю углерода в углекислом газе.
Решение
М(СО2) = 12+2х16 = 44 г/моль.
Аr(С) = 12 г/моль.
W(С) = 12/44 = 0,27 или 27%
Ответ: массовая доля углерода в углекислом газе равна 27%.
Задача 2
Вычислить объем углекислого газа, выделившегося при взаимодействии соляной кислоты с мрамором массой 100 г.
Решение
300 г — х л
CaCO3 + 2HCl → CaCl2+ H2O + CO2
1 моль — 1 моль
100 г/моль — 22,4 л/моль
100 г — 22,4 л
х(СО2) = 300х22,4/100 = 67, 2 (л).
Ответ: Объем углекислого газа равен 67, 2 л.
Тест по теме «Углекислый газ»
В атмосфере углекислого газа вспыхивает разогретый магний, т. к. СО2 – окислитель.
От углекислого газа мутнеет известковая вода, а от азота – нет.
Действительно, чтобы выявить, где находится углекислый газ, достаточно поджечь щепотку магния и опустить в сосуд с газом. Только сосуд должен быть закрыт в ходе эксперимента, чтобы исключить доступ кислорода извне. При этом кислород углекислого газа перейдёт в оксид магния по реакции:
2Mg + CO2 = 2MgO + C
Обратите внимание, что в результате протекания реакции высвобождается атомарный углерод, который осядет на стенки сосуда в виде легкого налёта сажи, и Вы этот налёт увидите.
Сродство магния к кислороду значительно выше, чем сродство углерода к кислороду. Вот магний и отбирает у СО2 кислород на правах сильного.
Естетственно, в сосуде с азотом магний гореть не будет, потухнет и всего делов-то.
Конечно, это не единственный способ, но единственно быстрый и подходящий для лабораторных работ. Современная техника позволяет просто опустить датчик газоанализатора в сосуд и через пару секунд получить результат, сколько какого газа в нём находится.
| Диоксид углерода | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Оксид углерода(IV) | |
| Традиционные названия |
углекислый газ диоксид углерода углекислота двуокись углерода сухой лёд (в твёрдом состоянии) |
|
| Хим. формула | CO2 | |
| Рац. формула | CO2 | |
| Физические свойства | ||
| Состояние | Газообразное | |
| Молярная масса | 44,01 г/моль | |
| Плотность |
газ (0 °C): 1,9768 кг/м3 жидкость (0 °С, 35,5 ат): 925 кг/м3 тв. (−78,5 °C): 1560 кг/м3 г/см³ |
|
| Динамическая вязкость | 8,5⋅10−5 Па·с (10 °C, 5,7 МПа) | |
| Энергия ионизации | 2,2E−18 Дж | |
| Скорость звука в веществе | 269 м/с | |
| Термические свойства | ||
| Температура | ||
| • сублимации | −78,5 °C | |
| Тройная точка | −56,6 °C, 0,52 МПа [1] | |
| Критическая точка | 31 °C, 7,38 МПа | |
| Критическая плотность | 467 кг/м3 см³/моль | |
| Уд. теплоёмк. | 849 Дж/(кг·К) | |
| Теплопроводность | 0,0166 Вт/(м·K) | |
| Энтальпия | ||
| • образования | -394 кДж/моль | |
| • плавления | 9,02 кДж/моль | |
| • кипения | 16,7 кДж/моль | |
| • сублимации | 26 кДж/моль | |
| Удельная теплота испарения | 379,5 кДж/кг | |
| Удельная теплота плавления | 205 кДж/кг | |
| Давление пара | 5 724 862,5 Па | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 1,48 кг/м3 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | 124-38-9 | |
| PubChem | 280 | |
| Рег. номер EINECS | 204-696-9 | |
| SMILES |
C(=O)=O |
|
| InChI |
InChI=1S/CO2/c2-1-3 CURLTUGMZLYLDI-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E290 | |
| RTECS | FF6400000 | |
| ChEBI | 16526 | |
| Номер ООН | 1013 | |
| ChemSpider | 274 | |
| Безопасность | ||
| Предельная концентрация |
9 г/м3 (5000 ppm) долговременное воздействие, 54 г/м3 (30 000 ppm) кратковременное воздействие (<15 мин.) [2] |
|
| ЛД50 | LC50: 90 000мг/м3*5 мин. (человек, ингаляция)[3] | |
| Токсичность | Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. | |
| Фразы безопасности (S) | S9, S23, S36 | |
| NFPA 704 |
0 1 0 SA |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Диокси́д углеро́да или двуо́кись углеро́да (также оксид углерода (IV), углеки́слый газ, у́гольный ангидри́д, углекислота́[4], химическая формула — CO2) — химическое соединение, представляющее собой кислотный оксид углерода, состоящий из одного атома углерода и двух атомов кислорода.
При нормальных условиях, диоксид углерода — это бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Плотность при нормальных условиях — 1,98 кг/м3 (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[5]. Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего должен участвовать в процессе глобального потепления[6]. Изначально, до появления жизни, углекислый газ составлял основу атмосферы Земли и его уровень снижался от десятков процентов до долей одного в результате процесса фотосинтеза. Постоянный рост содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи. Деятельность человека, прежде всего сжигание ископаемого топлива, увеличила его долю в атмосфере Земли примерно с 280 ppm (частей на миллион) в начале индустриализации до 407,8 ppm в 2018 году[7][8]. Рост содержания углекислого газа выше, до определённой концентрации, приводит к появлению облаков из углекислоты, что ведёт к похолоданию[9][нет в источнике]. Оба эти явления объясняют, почему температурные условия существования жизни на Земле относительно стабильны в течение миллиардов лет.[источник не указан 595 дней]
История[править | править код]
Двуокись углерода была одним из первых газов, получивших название. В XVII веке фламандский химик Йохан Баптиста ван Гельмонт заметил, что масса древесного угля уменьшалась, когда он сжигался, потому что масса оставшейся золы была меньше массы используемого древесного угля. Его интерпретация заключалась в том, что остальная часть древесного угля превратилась в невидимое вещество, которое он назвал газом или spiritus sylvestre («лесной дух»)[10].
Свойства углекислого газа более тщательно изучил шотландский врач Джозеф Блэк. В 1754 году он обнаружил, что при смешивании растворов карбоната кальция с кислотами выделяется газ, который он назвал неподвижным воздухом[11]. Он понял, что он тяжелее воздуха и не поддерживает процессы горения. Когда этот газ вводили в раствор гидроксида кальция, он мог образовывать осадок. С помощью этого явления он показал, что углекислый газ содержится в дыхании млекопитающих и выделяется в результате микробиологической ферментации. Его работа доказала, что газы могут участвовать в химических реакциях, и внесла свой вклад в дело теории флогистона[12].
Джозефу Пристли удалось создать первую газированную воду в 1772 году, переведя серную кислоту в известковый раствор и растворив полученный диоксид углерода в стакане с водой[13]. Однако Уильям Браунригг[en] обнаружил связь между углекислым газом и угольной кислотой гораздо раньше. В 1823 году Гэмфри Дэви и Майкл Фарадей сжижали углекислый газ, увеличив давление[14]. Первое описание твёрдого углекислого газа принадлежит Адриену Тилорье, который открыл в 1834 году герметичный контейнер с жидким углекислым газом и обнаружил, что при самопроизвольном испарении происходит охлаждение, с образованием в результате твёрдого СО2[15].
Нахождение в природе[править | править код]
Углекислый газ содержится в атмосфере, гидросфере, литосфере и биосфере. Обмен углерода между ними происходит в основном за счёт двуокиси углерода. В 2015 году в атмосфере содержалось примерно около 830 гигатонн (830 миллиардов тонн) углерода в форме двуокиси углерода[16]. Гидросфера содержит около 38 тератонн углерода в виде физически растворённого диоксида углерода, а также растворённых гидрокарбонатов и карбонатов. Литосфера содержит самую большую долю химически связанного диоксида углерода. Карбонатные породы, такие как кальцит и доломит, содержат около 60 петатонн углерода[17]. Кроме того, большие количества углерода хранятся в районах вечной мерзлоты, таких как тундры арктических и полярных антарктических регионов, в бореальных хвойных лесах или высоких горах и на болотах[18][19][20].
Свойства[править | править код]
Физические[править | править код]
Фазовая диаграмма диоксида углерода. В области давлений ниже давления в тройной точке на диаграмме имеется только линия сублимации, то есть твёрдый и жидкий диоксид углерода сосуществовать не могут. Это объясняет, почему при атмосферном давлении сухой лёд не плавясь возгоняется и превращается сразу в углекислый газ
Диоксид углерода (IV) (углекислый газ) — бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость. В тлеющем электрическом разряде светится характерным бело-зелёным светом.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щёлочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические[править | править код]
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует нестойкую угольную кислоту. Реагирует со щелочами с образованием её солей — карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) останавливает горение, вытесняя кислород из зоны реакции. В нём горят только некоторые активные металлы[21]:
.
Взаимодействие с оксидом активного металла:
.
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
.
Реагирует со щелочами с образованием карбонатов и гидрокарбонатов:
(качественная реакция на углекислый газ),
.
Биологические[править | править код]
Во вдыхаемом человеком воздухе углекислый газ практически отсутствует, а в выдыхаемом воздухе его содержится около 4 % (объёмных)
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[22].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[23].
Содержание углекислого газа в крови человека приблизительно таково:
-
Референтные значения или средние значения парциального давления углекислого газа в крови (pCO2)
Единицы измерения Газ венозной крови Альвеолярный лёгочный газ Газ артериальной крови кПа 5,5[24]—6,8[24] 4,8 4,7[24]—6,0[24] мм рт. ст. 41—51 36 35[25]—45[25]
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната[26] при помощи реакции
.
- Около 5—10 % углекислого газа растворено в плазме крови[26].
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин)[26].
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты)[источник не указан 1122 дня].
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя организм человека требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде[26].
Датчик содержания углекислого газа в помещении
Углекислый газ накапливается в помещении при недостаточной вентиляции. При содержании его в воздухе выше 1000 ppm, то есть 0,1% объёмной концентрации, человек ощущает вялость, затруднённое дыхание («духота»). Превышением по санитарным нормативам считается уровень выше 1400 ppm. При таком показателе уже трудно выполнять работу, трудно нормально засыпать. При уровне более 3000 ppm (0,3%) человек испытывает тошноту, учащается пульс[27]. Углекислый газ при концентрации его в воздухе 7-10% (70,000-100,000 ppm) может привести к удушью и потере сознания даже при присутствии достаточного количества кислорода[28].
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 50 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10—20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановятся, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению)[источник не указан 2057 дней]. Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение[править | править код]
- В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[29] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать
, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
- Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа[29]:
.
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления сухих напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется экзотермическая реакция горения углерода в кислороде[29]:
.
Применение[править | править код]
-
-
-
Бытовой баллончик со сжиженным углекислым газом
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
При сооружении московского метро в XX веке жидкая углекислота использовалась для заморозки грунта.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространённый метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[30].
Углекислый газ используется для газирования лимонада, газированной воды и других напитков. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 20 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см2). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см2), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при их посадке внатяжку) и так далее. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Методы регистрации[править | править код]
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации СО2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций СО2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[31].
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[32].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Физиологическое действие[править | править код]
Углекислый газ[33] нетоксичен, однако при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам (англ.) (рус..
В соответствии с ГОСТом 12.1.007-76 диоксид углерода относится к вредным веществам IV класса опасности[34][35].
Растворённый в крови углекислый газ активирует дыхательный центр мозга в физиологических и несколько повышенных концентрациях. Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости. В значительно более высоких концентрациях он приводит к снижению или устранению рефлекторного респираторного раздражителя, сначала к угнетению дыхания и, наконец, к остановке дыхания[36]. От 5 % углекислого газа во вдыхаемом воздухе возникают головные боли и головокружение, при более высоких концентрациях учащённое сердцебиение (тахикардия), повышение артериального давления, одышка и потеря сознания, так называемая углекислотная анестезия. Концентрация углекислого газа свыше 8 % приводит к отравлению с последующим смертельным исходом в течение 30-60 минут[37][38]. Накопление углекислого газа в крови называется гиперкапнией.
Для помещений нормальным является уровень CO2 около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга[39]. В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей[40], поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях[41].
| Влияние на взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Нормальный уровень на открытом воздухе | 350—450 |
| Приемлемые уровни | <600 |
| Жалобы на несвежий воздух | >1200 |
| Общая вялость | 1000—2500 |
| Максимально допустимая концентрация в течение 8 часового рабочего дня | 5000 |
| Лёгкое отравление, учащается пульс и частота дыхания, тошнота и рвота | 30 000 |
| Добавляется головная боль и лёгкое нарушение сознания | 50 000 |
| Потеря сознания, в дальнейшем — отравление с последующим смертельным исходом | 100 000 |
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[42].
Рекомендуемая ПДК в воздухе рабочей зоны для диоксида углерода составляет 9000 мг/м3[43].
В культуре[править | править код]
- CO2 – песня DJ Smash и Artik & Asti.
См. также[править | править код]
- Углекислый газ в атмосфере Земли
- Угольная кислота
- Выхлопные газы
- Лимнологическая катастрофа
- Глобальное потепление
- Торговля эмиссионными квотами
- Монооксид углерода
Примечания[править | править код]
- ↑ Carbon Dioxide – Thermophysical Properties. Дата обращения: 23 ноября 2018. Архивировано 24 ноября 2018 года.
- ↑ Carbon dioxide: Immediately Dangerous to Life or Health Concentrations (IDLH). Дата обращения: 7 марта 2020. Архивировано 20 апреля 2018 года.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования
- ↑ Раков Э. Г., Углерода диоксид, 2016.
- ↑ Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Дата обращения: 24 сентября 2013. Архивировано 5 февраля 2018 года.
- ↑ Jochem Marotzke; Martin Stratmann. Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft (нем.). — München: C. H. Beck, 2015. — S. 9—22. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- ↑ Eggleton, R. A. A short introduction to climate change (англ.). — Cambridge: CUP, 2012. — 240 p. — ISBN 978-1-139-52435-3, 1-139-52435-6, 978-1-139-62739-9, 1-139-62739-2, 978-1-283-94302-4, 1-283-94302-6, 978-1-139-62794-8, 1-139-62794-5, 1-139-62705-8, 978-1-139-62705-4. Архивная копия от 21 апреля 2020 на Wayback Machine
- ↑ Treibhausgas-Konzentration erreicht neuen Rekordwert (нем.). klimareporter°. Дата обращения: 22 сентября 2020. Архивировано 21 октября 2020 года.
- ↑ Chen Zhou, Mark D. Zelinka & Stephen A. Klein. Impact of decadal cloud variations on the Earth’s energy budget (англ.). Nature Geoscience. Дата обращения: 4 декабря 2019. Архивировано 13 октября 2019 года.
- ↑ Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 35. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑ Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 50. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑ Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 72. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- ↑ Joseph Priestley. XIX. Observations on different kinds of air. // Philosophical Transactions of the Royal Society of London. — 1772-01-01. — Т. 62. — С. 147–264. — doi:10.1098/rstl.1772.0021. Архивировано 12 октября 2020 года.
- ↑ XVIII. On the application of liquids formed by the condensation of gases as mechanical agents (EN) // Philosophical Transactions of the Royal Society of London. — 1823-12-31. — Т. 113. — С. 199–205. — ISSN 2053-9223 0261-0523, 2053-9223. — doi:10.1098/rstl.1823.0020.
- ↑ Joost Mertens. Du côté d’un chimiste nommé Thilorier // L’Année balzacienne. — 2003. — Т. 4, вып. 1. — С. 251. — ISSN 0084-6473. — doi:10.3917/balz.004.0251.
- ↑ Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft. — München: C.H. Beck, 2015. — С. 125. — 123-136 с. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- ↑ Kappas, M. (Martin). Klimatologie : Klimaforschung im 21. Jahrhundert – Herausforderung für Natur- und Sozialwissenschaften. — Heidelberg: Spektrum Akademischer Verlag, 2009. — С. 159. — 1 online resource с. — ISBN 978-3-8274-2242-2, 3-8274-2242-6.
- ↑ Permafrost – Auf dünnem Eis (нем.). Deutschlandfunk. Дата обращения: 22 сентября 2020. Архивировано 22 октября 2020 года.
- ↑ International Permafrost Association Country Reports (англ.). International Permafrost Association. Дата обращения: 22 сентября 2020. Архивировано 31 августа 2020 года.
- ↑ NABU – Moore und Klimawandel (нем.). NABU – Naturschutzbund Deutschland e.V.. Дата обращения: 22 сентября 2020. Архивировано 20 января 2021 года.
- ↑ Егоров А. С. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- ↑ 7. How much carbon dioxide do humans contribute through breathing? Frequent Questions – Emissions (англ.). US EPA. Дата обращения: 4 декабря 2019. Архивировано 2 февраля 2011 года.
- ↑ Charles Henrickson. Chemistry (англ.). — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- ↑ 1 2 3 4 Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- ↑ 1 2 Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- ↑ 1 2 3 4 Carbon dioxide. solarnavigator.net. Дата обращения: 12 октября 2007. Архивировано из оригинала 14 сентября 2008 года.
- ↑ Допустимое содержание СО2 в помещениях
- ↑ Carbon Dioxide as a Fire Suppressant: Examining the Risks, U.S. Environmental Protection Agency.
- ↑ 1 2 3 Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: “Himiâ”, 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- ↑ Большая Энциклопедия Нефти и Газа.
- ↑ ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. Определение состава методом газовой хроматографии с оценкой неопределённости. Часть 6. Определение водорода, гелия, кислорода, азота, диоксида углерода и углеводородов C1 — C8 с использованием трёх капиллярных колонок. Docs.cntd.ru. — М.: Стандартинформ, 2009.. Дата обращения: 4 декабря 2019. Архивировано 4 декабря 2019 года.
- ↑ Бялко А. В. Растения убыстряют рост // Природа. — 1996. — № 10. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- ↑ Carbon dioxide poisoning: a literature review of an often forgotten cause of intoxication in the emergency department. Дата обращения: 3 марта 2020. Архивировано 1 ноября 2020 года.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 8050-85 Двуокись углерода
- ↑ Rauchvergiftungen/Vergiftungen durch Gase (TK). web.archive.org (4 июня 2010). Дата обращения: 22 сентября 2020.
- ↑ Deutsches Rotes Kreuz. Vergiftungen und Hilfe bei Erbrechen – Erste Hilfe (нем.). DRK e.V. (17 июня 2020). Дата обращения: 22 сентября 2020. Архивировано 23 октября 2020 года.
- ↑ Carbon Dioxide – Life and Death. web.archive.org (22 мая 2013). Дата обращения: 22 сентября 2020.
- ↑ Greenwood, Veronique. Is Conference Room Air Making You Dumber? : [англ.] // The New York Times : газ. — 2019. — 6 May.
- ↑ Ventilation rates and carbon dioxide concentrations in schools. — In: Ventilation with Outdoor Air : [англ.] // Berkeley Lab : [сайт]. — 2019.
- ↑ Сорокин, Андрей. «Глобальное потепление отупляет. От этого уже страдают школьники и офисные работники» // Republic : [сайт]. — 2020. — 7 января.
- ↑ (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. Carbon Dioxide Tolerance Studies (англ.) // Brooks AFB, TX School of Aerospace Medicine Technical Report. — 1967. — Vol. SAM—TR—67—77. Архивировано 9 мая 2008 года.
- ↑ name=https://docs.cntd.ru_ПДК (недоступная ссылка) вредных веществ в воздухе рабочих помещений
Литература[править | править код]
- Вукалович М. П., Алтунин В. В. Теплофизические свойства двуокиси углерода. — М.: Атомиздат, 1965. — 456 с.
- Гродник М. Г., Величанский А. Я. Проектирование и эксплуатация углекислотных установок. — М.: Пищевая промышленность, 1966. — 275 с.
- Раков Э. Г. Углерода диоксид // Большая российская энциклопедия. — М.: Большая российская энциклопедия, 2016. — Т. 32. — С. 662—663.
- Тезиков А. Д. Производство и применение сухого льда. — М.: Госторгиздат, 1960. — 128 с.
- Талянкер Ю. Е. Особенности хранения баллонов со сжиженным газом // Сварочное производство. — 1972. — № 11.
Ссылки[править | править код]
- International Chemical Safety Card 0021 Архивная копия от 13 февраля 2008 на Wayback Machine (англ.)
- CID 280 Архивная копия от 18 января 2012 на Wayback Machine — PubChem (англ.)
- CO2 Диоксид углерода, свойства, применение Архивная копия от 13 февраля 2021 на Wayback Machine (англ.)
- Фазовая диаграмма (давление-температура) для диоксида углерода
- Диоксид углерода в 3D
- Dry Ice information Архивная копия от 3 апреля 2004 на Wayback Machine (англ.)
- Phase Diagram of Carbon Dioxide (англ.)
- Experiment 071 — Triple Point Phase Transition for Carbon Dioxide
- CO2 как природный рефрежерант — FAQs (англ.)
- Великобритания разрабатывает метод сохранения двуокиси углерода
- Онлайн калькулятор свойств CO2 Архивная копия от 30 сентября 2011 на Wayback Machine (англ.)
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Содержание
- ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ УГЛЕКИСЛОГО ГАЗА
- Дополнительные методы. Экспресс-методы определения углекислого газа в воздухе помещений [24]
- Метод определения концентрации углекислого газа и окисляемости
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ УГЛЕКИСЛОГО ГАЗА
Определением количества СО2 широко пользуются как критерием оценки чистоты воздуха в помещениях для сельскохозяйственных животных и при расчетах вентиляции.
Углекислота – бесцветный газ, без запаха, кисловата на вкус. Масса 1 литра диоксида углерода при нормальных условиях (температуре 0°С и давлении 760 мм. рт. ст. ) 1,9769 г, 1 миллиграмм его занимает объем 0,509 см 3 (мл). Основным источником углекислоты в помещениях для животных является выдыхаемый воздух. Содержание СО2 в воздухе животноводческих помещений допускается 0,25. 0,3 % или 2,5. 3 литра на 1м 3 воздуха (4911,51. 5893,91 мг/м 3 ).
Существуют несколько методов определения углекислого газа в воздухе: объемные методы – содержание СО2 определяется при помощи газоанализаторов Холдена, Кудрявцева, Калмыкова; титрометрические методы Субботина-Нагорского и Гесса; сравнительный метод Прохорова.
Принцип титрометрических методов состоит в том, что диоксид углерода, содержащийся в определённом объёме воздуха, связывается едкой щёлочью – гидроксидом бария (Ва(ОН)2). Концентрация едкого бария при этом меняется и по разности титров поглощающего раствора до и после поглощения СО2 определяется количество углекислоты во взятом для исследования объеме воздуха.
Метод Д.В. Прохорова может быть использован как экспресс метод, основанный на сравнительном исследовании воздуха помещений и воздуха наружной атмосферы, в котором содержание СО2 сохраняется на уровне 0,03. 0,04 %.
Дата добавления: 2015-10-21 ; просмотров: 11636 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Дополнительные методы. Экспресс-методы определения углекислого газа в воздухе помещений [24]
Экспресс-методы определения углекислого газа в воздухе помещений [24]
1 способ. Метод основан на реакции углекислоты с раствором кальцинированной соды.
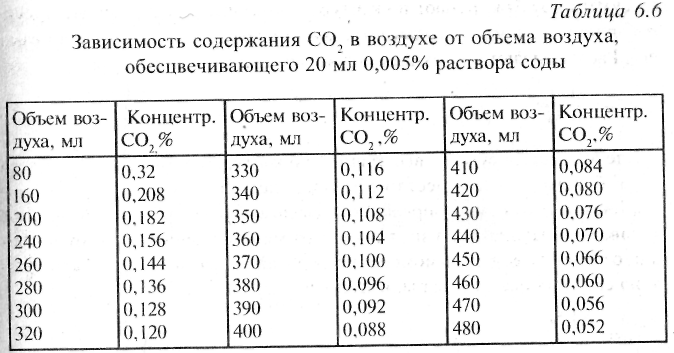
В шприц объемом 100 мл набирают 20 мл 0,005% раствора кальцинированной соды с фенолфталеином, имеющего розовую окраску, а затем засасывают 80 мл воздуха и встряхивают в течение 1 мин. Если не произошло обесцвечивания раствора, воздух из шприца осторожно выжимают, оставив в нем раствор, вновь набирают порцию воздуха и встряхивают еще 1 мин. Эту операцию повторяют 3-4 раза, после чего добавляют воздух небольшими порциями по 10-20 мл, каждый раз встряхивая содержимое 1 мин. до обесцвечивания раствора. Подсчитав общий объем воздуха, прошедшего через шприц, определяют концентрацию СO2 в воздухе по приводимой табл. 6.6.
2 способ. Принцип метода: определение основано на нейтрализации слабоаммиачного раствора углекислым газом в присутствии индикатора фенолфталеина. В дальнейшем производится сравнительное исследование изучаемого воздуха и воздуха открытой атмосферы, где содержание СО2 держится на уровне 0,04% в городе и 0,03% в сельской местности.
1. Пробирки вместимостью 30 см 3
2. Шприц вместимостью 20 см 3 .
Реактивы. 1. Аммиак — 25%-ный раствор. 2. Фенолфталеин — 1%-ный раствор спиртовый. 1 г фенолфталеина растворяют в 80 см 3 этанола и доводят объем до 100 см 3 водой. 3. Поглотительный раствор. К 500 см 3 дистиллированной воды добавляют 0,04 см 3 раствора аммиака и 1-2 капли 1%-ного раствора фенолфталеина.
Ход определения: в пробирку наливают 10 см 3 поглотительного раствора и закрывают резиновой пробкой, которую заранее протыкают иглой от шприца. Сначала исследование проводят с воздухом открытой атмосферы. Для этого воздух забирают шприцем до отметки 20 см 3 и под давлением вводят через иглу в пробирку с аммиачным раствором. Не отпуская поршня, пробирку энергично взбалтывают для поглощения СО2 из воздуха. Эти манипуляции проводят до полного обесцвечивания поглотительного раствора. Записывают, сколько раз (количество шприцев) пришлось вводить воздух из шприца в пробирку, чтобы раствор обесцветился.
После этого пробирку освобождают от использованного раствора, ополаскивают дистиллированной водой, заполняют 10 см 3 свежего поглотительного раствора и точно так же проводят определение с исследуемым воздухом. Снова записывают количество шприцев, пошедших на обесцвечивание раствора. Как правило, во втором случае для нейтрализации аммиачного раствора требуется меньшее количество шприцев воздуха.
Концентрацию оксида углерода (IV) в воздухе определяют по формуле:
где n — количество шприцев воздуха открытой атмосферы;
n1 — количество шприцев исследуемого воздуха.
Определение диоксида серы в воздухе лаборатории [24]
ПДК рабочей зоны SO2 = 10 мг/м 3 . Под действием сернистого газа происходит резкое раздражение слизистых оболочек, спазм голосовой щели.
Принцип метода — восстановление йода сернистым газом до йодоводорода.
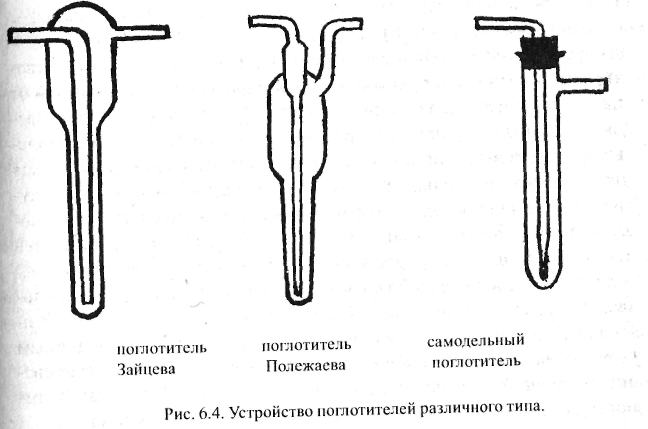
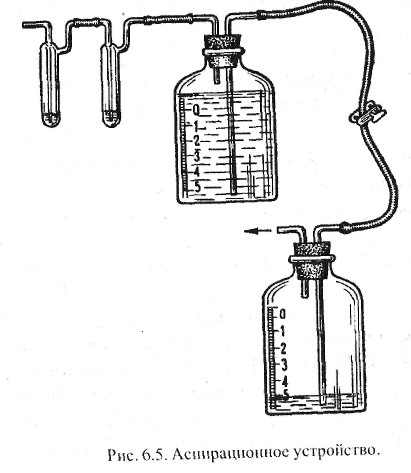
В поглотитель Полежаева (или иной подобный поглотитель, см. рис. 6.4) наливают 1 мл поглотительного раствора, состоящего из смеси 0,0001 н. раствора йода с крахмалом. Через поглотитель протягивают с помощью аспиратора (рис. 6.5) воздух со скоростью 10 мл/мин. (при такой скорости можно легко сосчитать проходящие через поглотительный раствор пузырьки воздуха) до исчезновения окраски поглотительного раствора.
Объем прошедшего через поглотитель воздуха можно определить по объему вытекающей из аспиратора воды.
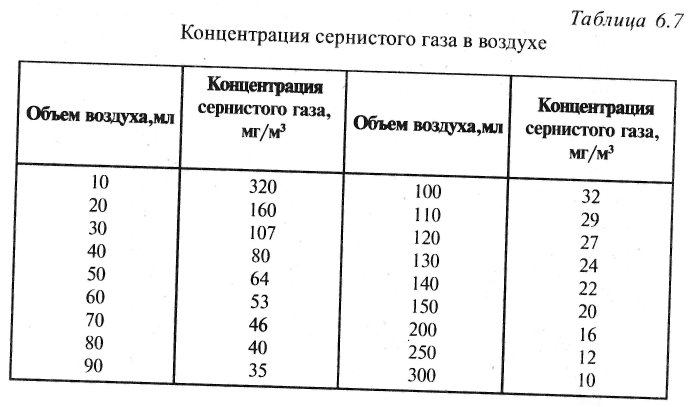
Концентрацию сернистого газа в воздухе определяют по табл. 6.7.
Дата добавления: 2015-04-11 ; просмотров: 8 ; Нарушение авторских прав
Источник
Метод определения концентрации углекислого газа и окисляемости
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
МЕТОД ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ СО2 И ОКИСЛЯЕМОСТИ ВОЗДУХА КАК ПОКАЗАТЕЛЕЙ АНТРОПОГЕННОГО ЗАГРЯЗНЕНИЯ ВОЗДУХА И ВЕНТИЛЯЦИИ ПОМЕЩЕНИЙ
Гигиенические показатели санитарного состояния и вентиляции помещений
- Химический состав атмосферного воздуха: азота – 78,08%; кислорода – 20,95%; углекислого газа – 0,03-0,04%; инертных газов (аргон, неон, гелий, криптон, ксенон) – 0,93%; влаги, как правило, от 40-60% до насыщения; пыль, микроорганизмы, естественные и техногенные загрязнения – в зависимости от промышленного развития региона, типа поверхности (пустыня, горы, наличие зеленых насаждений и др.)
- Основные источники загрязнения воздуха населенных мест, производственных помещений – выбросы промышленных предприятий, автотранспорта; пиле-, газообразование промышленных предприятий; метеорологические факторы (ветры) и тип поверхности регионов (пылевые бури пустынных мест без зеленых насаждений).
- Источники загрязнения воздуха жилых помещений, помещений коммунально-бытового назначения и общественных помещений – продукты жизнедеятельности организма людей, которые выделяются кожей и при дыхании (продукты распада пота, кожного сала, омертвелого эпидермиса, другие продукты жизнедеятельности, которые выделяются в воздух помещения пропорционально количеству людей, срока их пребывания в помещении и количества углекислого газа, который накапливается в воздухе пропорционально перечисленным загрязнителям), и поэтому используется как показатель (индикатор) степени загрязнения этими веществами воздуха помещений различного назначения.
- Учитывая, что через кожу и при дыхании выделяются, в основном, органические продукты обмена веществ, для оценки степени загрязнения воздуха помещений людьми было предложено определять другой показатель этого загрязнения – окисляемость воздуха, т.е. измерять количество миллиграммов кислорода, необходимого для окисления органических соединений в 1 м 3 воздуха с помощью титрованного раствора бихромата калия К2Сr2О7. Окисляемость атмосферного воздуха обычно не превышает 3-4 мг/м 3 , в хорошо проветриваемых помещениях окисляемость находится на уровне 4-6 мг/м 3 , а в помещениях с неблагоприятным санитарным состоянием окисляемость воздуха может достигать 20 и более мг/м 3 .
- Концентрация углекислого газа отображает степень загрязнения воздуха другими продуктами жизнедеятельности организма. Концентрация углекислого газа в помещениях увеличивается пропорционально количеству людей и времени их пребывания в помещении, но как правило, не достигает вредных для организма уровней. Только в замкнутых, недостаточно вентилируемых помещениях (хранилищах, подводных лодках, подземных выработках, производственных помещениях, канализационных системах и т.п.) за счет брожения, горения, гниения количество углекислого газа может достигать концентраций, опасных для здоровья и даже жизни человека.
Исследованиями М. П. Бресткина и ряда других авторов установлено, что повышение концентрации СО2 до 2-2,5% не вызывает заметных отклонений в самочувствии человека, его трудоспособности. Концентрации СО2 до 4% вызывают повышение интенсивности дыхания, сердечной деятельности, снижение трудоспособности. Концентрации СО2 до 5% сопровождаются одышкой, усилением сердечной деятельности, снижением трудоспособности, а 6% – способствуют снижению умственной деятельности, возникновению головной боли, умопомрачению, 7% – может вызвать неспособность контролировать свои действия, потерю сознания и даже смерть, 10% – вызывает быструю, а 15-20% мгновенную смерть из-за паралича дыхания.
Для определения концентрации СО2 в воздухе разработано несколько методов, среди которых метод Субботина-Нагорского с гидроокисью бария, методы Реберга-Винокурова, Калмыкова, интерферометрический. Вместе с тем в санитарной практике наиболее широко используется портативный экспрессный метод Лунге-Цеккендорфа в модификации Д.В.Прохорова (приложение 2).
Определение диоксида углерода в воздухе экспресс-методом Лунге-Цеккендорфа в модификации Д.В. Прохорова
Принцип метода основан на пропускании исследуемого воздуха через титрованный раствор углекислого натрия (или аммиака) в присутствии фенолфталеина. При этом происходит реакция Na2CO3+H2O+CO2=2NaHCO3. Раствор фенолфталеина, который имеет розовую окраску в щелочной среде, после связывания CO2 обесцвечивается (кислая среда).
Разведением 5,3 г химически чистого Na2CO3 в 100 мл дистиллированной воды готовят исходный раствор, к которому прибавляют 0,1% раствор фенолфталеина. Перед анализом готовят рабочий раствор разведением исходного раствора 2 мл до 10 мл дистиллированной водой.
Раствор переносят в склянку Дрекселя по Лунге-Цеккендорфу (рис. 11.1а) или в шприц Жанне по Прохорову (рис. 11.1б). В первом случае к длинной трубке склянки Дрекселя с утонченным носиком присоединяют резиновую грушу с клапаном или небольшим отверстием. Медленно сжимая и быстро отпуская грушу, продувают через раствор исследуемый воздух. После каждой продувки склянку встряхивают для полного поглощения CO2 из порции воздуха. Во втором случае (по Прохорову) в шприц, наполненный 10 мл рабочего раствора соды с фенолфталеином, держа его вертикально, набирают порцию исследуемого воздуха. Затем энергичным встряхиванием (7-8 раз) воздух приводят в контакт с поглотителем, после чего воздух выталкивается и вместо него набирается одна за другой порции исследуемого воздуха до полного обесцвечивания раствора в шприце. Считают количество объемов (порций) воздуха, пошедших на обесцвечивание раствора. Анализ воздуха проводят в помещении и за пределами помещения (атмосферный воздух).
Результат рассчитывают по обратной пропорции на основании сопоставления количества израсходованных объемов (порций) груш или шприцев и концентрации CO2 в атмосферном воздухе (0,04%) и в конкретном исследуемом помещении, где определяется концентрация СО2. Например, в помещении израсходовано 10 объемов груш, или шприцев, на улице – 50 объемов. Отсюда, концентрация CO2 в помещении = (0,04 x 50) : 10 = 0,2%.
Предельно допустимая концентрация (ПДК) CO2 в жилых помещениях разного назначения установленная в пределах 0,07-0,1%, в производственных помещениях, где CO2 накапливается от технологического процесса, до 1-1,5%.
Рис.11.1а. Прибор для определения концентрации СО2 по Лунге-Цеккендорфу (а – резиновая груша для продувки воздуха с клапаном; б – склянка Дрекселя с раствором соды и фенол-фталеина)
Рис. 11.1б. Шприц Жанне для определения концентрации СО2 по Д. В. Прохорову
Методика определения и гигиенической оценки показателей воздухообмена и вентиляции помещений
Воздух жилых помещений считается чистым, если концентрация CO2 не превышает предельно допустимых концентраций – 0,07% (0,7‰) по Петтенкоферу или 0,1% (1,0‰) по Флюге.
На этом основании рассчитывается необходимый объем вентиляции – количество воздуха (в м 3 ), которое должно поступать в помещение в течение 1 ч, чтобы концентрация CO2 в воздухе не превысила предельно допустимых концентраций для данного вида помещений. Его рассчитывают по формуле:
где: V – объем вентиляции, м 3 /час;
К – количество СО2, выделяемое одним человеком за один час (в покое 21,6 л/ч; во сне – 16 л/ч; при выполнении работы разной тяжести – 30-40 л/ч);
n – количество людей в помещении;
Р – предельно допустимая концентрация СО2 в промилле (0,7 или 1,0‰);
Р1 – концентрация СО2 в атмосферном воздухе в промилле (0,4‰).
При расчете количества СО2, которое выделяет один человек за один час, выходят из того, что взрослый человек при легкой физической работе производит в течение 1 минуты 18 дыхательных движений с объемом каждого вдоха (выдоха) 0,5 л и, следовательно, в течение часа выдыхает 540 л воздуха (18 х 60 х 0,5 = 540).
Учитывая, что концентрация углекислого газа в выдыхаемом воздухе примерно 4% (3,4-4,7%), то общее количество выдыхаемого углекислого газа за пропорцией составит:
х = (540*4)/100 = 21,6 л/час
При физических нагрузках пропорционально их тяжести и интенсивности возрастает количество дыхательных движений, а потому возрастает и количество выдыхаемого СО2 и необходимый объем вентиляции.
Необходимая кратность вентиляции – число, которое показывает, сколько раз в течение часа меняется воздух помещения, чтобы концентрация СО2 не превышала предельно допустимых уровней.
Необходимую кратность вентиляции находят путем деления рассчитанного необходимого объема вентиляции на кубатуру помещения.
Фактический объем вентиляции находят путем определения площади вентиляционного отверстия и скорости движения воздуха в нем (фрамуга, форточка). При этом учитывают, что через поры стен, щели в окнах и двери в помещение проникает объем воздуха, близкий к кубатуре помещения и его нужно прибавить к объему, который проникает через вентиляционное отверстие.
Фактическую кратность вентиляции рассчитывают делением фактического объема вентиляции на кубатуру помещения.
Сопоставляя необходимые и фактические объемы и кратность вентиляции, оценивают эффективность обмена воздуха в помещении.
Нормативы кратности обмена воздуха в помещениях разного назначения
- Cтруктуры внешней памяти, методы организации индексов
- II. Методы искусственной детоксикации организма
- II. Методы несанкционированного доступа.
- III. Методы искусственной физико-химической детоксикации.
- III. Методы манипуляции.
- IV. Традиционные методы среднего и краткосрочного финансирования.
- IX. Методы СТИС
- R Терапевтическая доза лазерного излучения и методы ее определения
- VΙ.Организация и методы выполнения процесса
- V. Способы и методы обеззараживания и/или обезвреживания медицинских отходов классов Б и В
| Помещение | Кратность обмена воздуха, ч | |
| вытяжка | приток | |
| СНиП 2.08. 02-89 – больничные помещения | ||
| Палата взрослых | 80 м 3 на 1 койку | |
| Предродовая, перевязочная | 1,5 раза/ч | 2 раза/ч |
| Родовая, операционная, предоперационная | 8 раз/ч | |
| Послеродовая палата | 80 м 3 на 1 кровать | |
| Палата для детей | 80 м 3 на 1 кровать | |
| Бокс, полубокс | 2,5 раза/ч в коридор | 2,5 раза/ч |
| Кабинет врача | 1 раз/ч | 1 раз/ч |
| СНиП 2.08. 01-89 – жилые помещения | ||
| Жилая комната | 3 м 3 /ч на 1 м 2 площади | |
| Кухня газифицирована | 90 м 3 /ч | |
| Туалет, ванная комната | 25 м 3 /ч | |
| ДБН В. 2.2-3-97 – дома и сооружения учебных заведений | ||
| Класс, кабинет | 16 м 3 на 1 человека | 1 раз/ч |
| Мастерская | 20 м 3 на 1 человека | 1 раз/ч |
| Спортзал | 80 м 3 на 1 человека | 1 раз/ч |
| Учительская | 1,5 раз/ч |
Необходимый объем и кратность вентиляции положены также в основу научного обоснования норм жилой площади. Учитывая, что при закрытых окнах и двери, как сказано выше, через поры стен, щели в окнах и двери в помещение проникает объем воздух, близкий к кубатуре помещения (т.е., его кратность равняется
1 раз/час), а высота помещения в среднем равняется 3 м, норма площади на 1 человека составляет:
Источник