Прикладное
значение постулата Планка состоит в
том, что он устанавливает
начало отсчета значений энтропии и
открывает путь определения абсолютной
величины этой термодинамической функции.
Если,
например, повышать температуру 1 моля
идеального кристалла вещества
от 0 до Т при р=1атм, то при отсутствии
полиморфных превращений и других
изменений фазовых состояний для
нахождения энтропии необходимо провести
интегрирование уравнения:
В общем же случае
приходится обращаться к более громоздкому
выражению:
*)
Поскольку, строго говоря, третий закон
термодинамики применим только к
ограниченному
классу веществ, а именно, к чистым
бездефектным кристаллам, некоторые
авторы
(А. Мюстер, Химическая термодинамика,
М.: Мир, 1971.—295 с.; с. 196-197,) полагают, что
третье начало должно быть сформулировано
не в виде закона, а в форме правила,
которое на практике “выполняется с
достаточной точностью”.
74
[p# 75]
где
sq
–
остаточная или нулевая энтропия;
а,р,.,8,… – символы, обозначающие полиморфные
модификации кристаллической фазы; Тнтк
– нормальная температура
кипения.
Графической
иллюстрацией записанного выше
уравнения являются данные
об энтропиях воды и брома, показанные
на рис.11
.
Рис.
11. Температурная зависимость энтропии
воды и брома
Как
видно из рис.11,
зависимость
энтропии от температуры имеет сложный
характер. В области низких температур,
когда теплоемкость возрастает
пропорционально температуре в третьей
степени, вторая производная
энтропии по температуре
3. Критерии (энтропия)
75
[p# 76]
положительна,
т.е. кривая S
= f
(Т) является вогнутой. Выше 200
К теплоемкость слабо зависит от
температуры. В этих условиях
/V
вторая
производная отрицательна и наблюдаемая
зависимость будет выпуклой. Процедура
нахождения абсолютной энтропии веществ
основывается на обработке
экспериментальных данных о
температурной зависимости их
теплоемкости.
С этой целью массив экспериментальных
данных представляют в
Ср
координатах
—*- = f(T)
либо Cp=f(lnT)
В результате получают сложную
зависимость. В
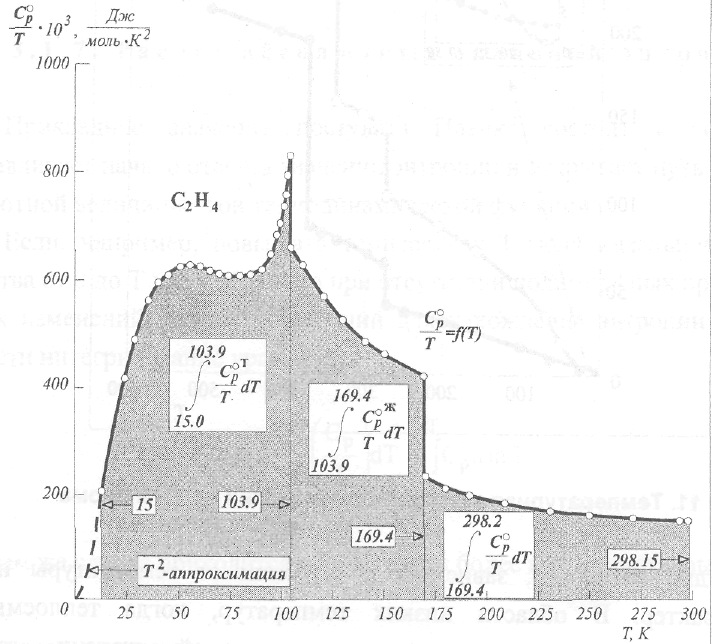
качестве примера на рис.12 приведены
данные для этилена.
Рис.
12. Интерирование зависимостис
целью нахождения величины
м.
Абсолютной энтропии
[p#
77]
76
[p# 78]
с°
V^.
rt
Как
видно, зависимость —~
= f
(Т) разделяется на несколько
участков,
характеризующих
поведение фаз, существующих в
рассматриваемом температурном
интервале. Суммируя интегралы, относящиеся
ко всем фазовым состояниям,
с учетом области экстраполяции к
абсолютному нулю температуры и
принимая во внимание энтропии всех
фазовых переходов, приходим к значению
S^gjs-
Современная
криогенная техника позволяет производить
измерения теплоемкости
при весьма низких, но все же отличных
от абсолютного нуля температурах.
Так как интегрирование должно быть
выполнено во всем интервале
температур, то всегда существует
необходимость экстраполировать данные
о теплоемкости к абсолютному нулю
температуры. С этой целью в случае
трехмерных кристаллических структур
используют Т3
– и для слоистых, т.е. двумерных структур
Т2
– экстраполяцию.
Если
при проведении экспериментов в качестве
хладоагента применяют жидкий
гелий, температура кипения которого
при атмосферном давлении составляет
4,22 К, то экстраполяция не является
далёкой и не вносит ощутимой ошибки
в значение энтропии.
За пределами
области экстраполяции для каждого из
участков проводят
С°
D
графическое
интегрирование зависимости — = f
(Т). Затем суммируют
значения
отдельных составляющих энтропии,
включают в сумму величины энтропии
всех фазовых переходов, имеющих место
в интервале температур О
– Т, и учитывают эффекты, связанные с
нагреванием газообразных веществ
В
качестве численной иллюстрации к
изложенному, ниже указаны величины,
суммирование которых приводит к значению
энтропии газообразного
азота при 298 К и давлении 1 атм. Слагаемыми
суммы, выраженными
в Дж/ (моль К), являются величины,
относящиеся к:
1) экстраполяции
экспериментальных данных от 10 К до О К
по
^
уравнению
Дебая (Т -экстраполяция) 1,92;
2) графическому
интегрированию от 10 К до 35.61 К, что
отвечает
нагреванию
твердого азота до температуры фазового
превращения
в
твердом состоянии 25,25
-
энтропии
фазового перехода при 35.61 К 6,43; -
графическому
интегрированию от температуры
фазового
перехода до температуры плавления азота
при 63.14 К 23,38;
5) энтропии
плавления 11,42;
3.
Критерии (энтропия) 77
[p# 79]
6) графическому
интегрированию в интервале 63.14-77.32
К,
которое
относится к температурной области
существования жидкого
азота
при давлении 1 атм 11,41;
-
энтропии
парообразования при нормальной
температуре
кипения 72,13; -
изобарическому
нагреванию азота как идеального газа
в
интервале
77.32-298.15 К 39.20; -
поправки
на неидеальность поведения газа 0,92
.
В
результате получаем S^g
=
192.06 Дж/(моль-К).
Измерения
низкотемпературной теплоёмкости очень
трудоемки, поэтому массив
справочных данных о величинах абсолютных
энтропии веществ значительно
меньше, чем по стандартным энтальпиям
образования.
В
некоторых справочных руководствах
наряду с данными о S^g
(будьте
внимательны:
это именно абсолютная энтропия, но не
AfS^g)
приводятся сведения
о высокотемпературных составляющих
энтропии Sj
– 8298 • Последнее
избавляет от необходимости интегрирования
в интервале температур 298
– Т и открывает возможность расчета Sj
по уравнению:
Если
требуется рассчитать величину мольной
энтропии при давлении, отличном
от стандартного, то вычисления проводят
по уравнению*):
•
*) Вывод уравнения
дан в разделе 3.2.8.
3.
Критерии (энтропия) 78
Как
уже отмечалось, для конденсированных
фаз влиянием давления на величину
энтропии можно пренебречь. В случае
идеальных газов расчет осуществляют
по уравнению:
[p# 80]
Для вычисления
энтропии реальных газов необходимо
знать
fdV]
соответствующее
уравнение состояния и, представив
— как функцию
давления, взять
интеграл, приведенный выше.
Так
как данные об абсолютных энтропиях
конденсированных фаз сравнительно
(с информацией о стандартных энтальпиях
образования) немногочисленны,
полезно принять во внимание эмпирическое
уравнение Веннера,
позволяющее оценить или уточнить
сомнительное по тем или иным причинам
значение энтропии. Это уравнение,
справедливое для ряда однотипных
неорганических веществ, имеет вид:
S
= AlgM
+ B,
где
М – – молярная масса соединения, А и В –
эмпирические константы, характеризующие
рассматриваемый ряд веществ.
Отметим
здесь же, что для газообразных веществ,
состояние которых близко
к идеальному, значения энтропии при
любых температурах и давлениях могут
быть вычислены методами статистической
термодинамики из данных о пространственном
строении молекулы и величинах ее
молекулярных постоянных.
Соответствующие уравнения будут выведены
при рассмотрении свойств
идеальных газов.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
ΔS = S(прод.) – S(исх.)
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
CaCO3(к) = CaO(к) + CO2(г)
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Для реакции:
С(графит) + 2Н2(г) = СН4(г)
(Δnг = -1) ΔV < 0, следовательно и ΔS < 0.
Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25оС). Энтропия в этом случае обозначается Sо298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (Sо) увеличивается при повышении температуры.
Стандартная энтропия образования
Стандартная энтропия образования ΔSоf,298 (или ΔSообр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
G = Н – ТS.
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG < 0). При достижении равновесия в системе ΔG = 0.
Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δGоf,298 (или δGообр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δGоf,298 = 0.
Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔGоТ = ΔНоТ — ΔТSоТ. При низких температурах ТΔSоТ мало. Поэтому знак ΔGоТ определяется в основном значением ΔНоТ (энтальпийный фактор). При высоких температурах ТΔSоТ – большая величина, знак Δ GоТ определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔНоТ) и энтропийного (ТΔSоТ) факторов существует четыре варианта процессов.
-
-
- Если ΔНоТ < 0, ΔSоТ > 0, то ΔGоТ < 0 всегда (процесс может протекать самопроизвольно при любой температуре).
- Если ΔНоТ > 0, ΔSоТ < 0, то ΔGоТ > 0 всегда (процесс не протекает ни при какой температуре).
- Если ΔНоТ < 0, ΔSоТ < 0, то ΔGоТ < 0 при Т < ΔНо/ΔSо (процесс идет при низкой температуре за счет энтальпийного фактора).
- Если ΔНоТ > 0, ΔSоТ > 0, то ΔGоТ < 0 при Т > ΔНо/ ΔSо (процесс идет при высокой температуре за счет энтропийного фактора).
-
Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
4NH3(г) + 5O2(г) = 4NО(г) + 6H2O(ж)
Объяснить знак и величину ΔSо.
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| Sо298,
Дж/(моль·К) |
192,66 | 205,04 | 210,64 | 69,95 |
ΔSох.р.,298 = 4Sо298(NО(г) ) + 6Sо298(H2O(ж)) — 4Sо298(NH3(г)) — 5Sо298(O2(г)) = 4× 210,64 + 6× 69,95 — 4× 192,66 — 5× 205,04 = — 533,58 Дж/К
В данной реакции ΔV < 0 (Δnг = — 5), следовательно и ΔSoх.р.,298 < 0, что и подтверждено расчетом.
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
N(г) + 2H2(г) + 3/2O2(г) = NH4NO3(к); δSоf,298(NH4NO3(к)) = ?
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| Sо298,
Дж/(моль·К) |
191,50 | 130,52 | 205,04 | 151,04 |
ΔSох.р.,298 = ΔSоf,298(NH4NO3(к)) = Sо298(NH4NO3(к)) — Sо298(N2(г)) — 2Sо298(H2(г)) – 3/2Sо298(O2(г)) = 151,04–191,50 —— 2× 130,52–3/2× 205,04 = — 609,06 Дж/(моль·К).
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония Sо298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ Sо298 всегда больше нуля, в то время как величины ΔS0f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
2Н2(г) + О2(г) = 2 Н2О(ж)
равно δGо298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔSо<0. Поскольку ΔGо298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔSо<0.
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
С4Н10(г) = 2С2Н4(г) + Н2(г)
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | С4Н10(г) | С2Н4(г) | Н2(г) |
| ΔGоf,298× , кДж/моль | — 17,19 | 68,14 | 0 |
| Sо298, Дж/(моль·К) | 310,12 | 219,45 | 130,52 |
ΔGох.р.,298 = 2ΔGоf,298(С2Н4(г)) + ΔGоf,298(Н2(г)) — ΔGоf,298(С4Н10(г)) = 2× 68,14 + 17,19 = 153,47 кДж.
ΔGох.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
ΔSох.р.,298 = 2Sо298(С2Н4(г)) + Sо298(Н2(г)) — Sо298(С4Н10(г)) = 2× 219,45 + 130,52 – 310,12 = +259,30 Дж/К.
Поскольку ΔSох.р.,298 > 0, то при температуре Т>ΔНо/ΔSо величина ΔGох.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔGоf,298 и Sо298, определите ΔHо298 реакции:
N2O(г) + 3H2(г) = N2H4(г) + H2O(ж)
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔGоf,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| Sо298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔGох.р.,298 = ΔGоf,298(N2H4(г)) + ΔGоf,298(H2O(ж)) – ΔGоf,298(N2O(г)) – 3ΔGоf,298(H2(г)) = 159,10 + (–237,23) – 104,12 – 0 = –182,25 кДж.
ΔSох.р.,298 = Sо298(N2H4(г)) + Sо298(H2O(ж)) – Sо298(N2O(г)) — 3Sо298(H2(г)) = 238,50 + 69,95 – 219,83 –3× 130,52 = –302,94 Дж/К.
ΔGо298 = ΔНо298 – ТΔSо298. Подставляя в это уравнение величины ΔНо298 и ТΔSо298, получаем:
ΔНо298 = –182,25× 103 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔSо298 выражена в Дж/(моль× К), то при проведении расчетов ΔG0298 необходимо также выразить в Дж или величину ΔS0298 представить в кДж/(мольK).
Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔSоf,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
а) NO(г) + 1/2O2(г) = NO2(г);
б) N2(г) + 2O2(г) = 2NO2(г);
в) 1/2N2(г) + O2(г) = NO2(г);
г) N(г) + O2(г) = NO2(г).
3. Используя справочные данные, вычислите при 298,15 К изменение энтропии в реакции:
2NH4NO3(к) = 2N2(г) + 4H2O(г) + О2(г).
Объясните знак и величину ΔSº реакции.
-
- .
|
δSох.р.,298 =1040,84 Дж/К. В данной реакции δV > 0 (D nг = 7), |
4. Используя справочные данные, определите принципиальную возможность протекания реакции при 298,15 К:
NiO(к) + C(графит) = Ni(к) + CO(г)
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
|
ΔGох.р.,298 = 74,45 кДж > 0, следовательно, при Т = 298,15 К |
5. Рассчитайте стандартную энергию Гиббса образования ΔGоf,298 C2H5OH(ж), используя справочные данные о величинах ΔНоf,298 и Sо298.
6. Используя справочные данные, определите стандартную энтропию образования ΔSоf,298 K2Cr2O7(к).
7. На основе расчетов термодинамических величин покажите, чем эффективнее восстанавливать при 298 К Cr2O3(к) до металла — алюминием или магнием:
1) Cr2O3(к) + 3Mg(к) = 3MgO(к) + 2Cr(к); ΔGо1;
2) Cr2O3(к) + 2Al(к) = Al2O3(к) + 2Cr(к); ΔGо2.
|
ΔGо1=-648,9 кДж; ΔGо2=-523,3 кДж. |
8. Используя справочными данными по величинам Sо298, определите возможность самопроизвольного протекания в изолированной системе при 298 К процесса:
KClO3(к) = KCl(к) + 3/2O2(к)
|
ΔSо298=247,1 Дж/К. |
9. Используя справочные данные, вычислите при 298 К изменение энтропии в процессе:
Н2(г) + 1/2О2(г) = Н2О(г)
10. На основе справочных данных оценить температуру восстановления WO3(к) водородом:
WO3(к) + 3H2(г) = W(к) + 3H2O(г).
Абсолютное значение – энтропия
Cтраница 2
Определение абсолютного значения энтропии различных веществ при тех или иных температурах возможно, если известны теплоемкости этих веществ при всех температурах от абсолютного нуля до интересующей нас температуры, а также тепловые эффекты и температуры всех фазовых переходов, если они имеют место в этом температурном интервале. В самом деле, пусть рас-с матриваемое вещество при интересующей нас температуре Т находится в кристаллическом состоянии и в той же модификации, что и при абсолютном нуле.
[16]
Чтобы определить абсолютное значение энтропии для какого-либо состояния тела, необходимо фиксировать начало ее отсчета.
[17]
Для вычисления абсолютных значений энтропии обычно необходимы экспериментальные значения теплоемкости в интервале от 0 К до исследуемой температуры. Поскольку измерение теплоемкости вблизи абсолютного нуля представляет значительные экспериментальные трудности, в литературе практически отсутствуют значения теплоемкостей ниже 4 – 10 К.
[18]
Для вычисления абсолютного значения энтропии какого-либо вещества надо знать теплоемкости, определенные до возможно более низких температур, и теплоты фазовых переходов. Значения теплоемкости вблизи О К находят путем экстраполяции.
[19]
Для вычисления абсолютных значений энтропии используют экспериментальные значения теплоемкости в интервале от О К до исследуемой температуры. Поскольку измерение теплоемкости вблизи абсолютного нуля представляет значительные экспериментальные трудности, в литературе практически отсутствуют значения теплоемкости ниже 4 – 10 К. Значение энтропии в этой области часто определяют методом экстраполяции, используя уравнение теплоемкости Дебая.
[20]
Для вычисления абсолютных значений энтропии обычно необходимы экспериментальные значения теплоемкости в интервале от 0 К до исследуемой температуры. Поскольку измерение теплоемкости вблизи абсолютного нуля представляет значительные экспериментальные трудности, в литературе практически отсутствуют значения теплоемкостей ниже 4 – 10 К.
[21]
Для вычисления абсолютных значений энтропии элементов и соединений в стандартных условиях существуют два способа. Первый способ основан на применении теоремы Нернста и использовании экспериментальных данных о теплоемкостях. Второй способ основан на статистических расчетах из спектральных данных.
[22]
Для нахождения абсолютных значений энтропии углеродистых тел необходимо знать, кроме температурной зависимости теплоемкости, остаточную энтропию, о которой говорилось в предыдущем параграфе.
[23]
Обычно определяют не абсолютное значение энтропии, а ее изменение ( 52 – Si) в том или ином процессе.
[24]
Необходимые для расчета абсолютные значения энтропии участвующих в реакции веществ находят в стандартных таблицах или вычисляют с помощью одного из рассмотренных выше способов.
[25]
Обычно определяют не абсолютное значение энтропии, а изменение ее в том или ином процессе. Увеличение энтропии свидетельствует об уменьшении работоспособности системы.
[26]
В отношении определения абсолютных значений энтропии уместно сделать еще одно замечание.
[27]
В технической термодинамике абсолютным значением энтропии не интересуются, а определяют только ее изменение в соответствующих процессах. Поэтому нулевое значение энтропии выбирают условно при / 0 С. Обычно значения s или As определяют расчетным путем и сводят их в таблицы или используют для построения диаграмм, которыми пользуются при практических расчетах.
[28]
В справочных таблицах находим абсолютные значения энтропии для всех участников реакций.
[29]
В отличие от энтальпии абсолютные значения энтропии могут быть определены экспериментально. Порядок значения энтропии S определяется величиной И, которая колоссальна. Обычно приходится иметь дело с объектами, содержащими 1023 частиц и более.
[30]
Страницы:
1
2
3