Активный хлор – это свободный растворенный
молекулярный хлор и некоторые соединения
хлора, которые являются сильными
окислителями, в которых хлор имеет
положительную степень окисления,
например, хлорамины, гипохлориты и
хлориты («связанный активный хлор»).
Содержание
так называемого «активного хлора»
определяется в дезинфицированной хлором
или его соединениями питьевой воде и в
некоторых сточных водах. В поверхностных
водах содержание хлора определяется в
местах ниже сброса упомянутых сточных
вод.
Остаточный
свободный хлор в воде централизованного
водоснабжения должен быть в пределах
0,3–0,5 мг/дм3,
остаточный связанный – в пределах
0,8-1,2 мг/дм3;
при одновременном присутствии в воде
свободного и связанного хлора их общая
концентрация не должна превышать 1,2
мг/дм3.
Для определения «активного хлора» можно
использовать йодометрический метод и
колориметрический метод с применением
о-толуидина. Йодометрический метод
рекомендуется для анализа вод, содержащих
выше 0,05 мг/дм3активного хлора.
Колориметрическим методом можно
пользоваться при концентрации активного
хлора в пробе от 0,01 до 7 мг/дм3.
Лабораторная работа № 10 Определение активного хлора в питьевой и сточной водах
Сущность метода. Активный
хлор как более сильный окислитель
вытесняет йод из раствора иодида калия.
Выделенный йод титруют раствором
тиосульфата натрия. В кислой среде
реакции протекают количественно.
Мешающие влияния.Определению
хлора в питьевых и поверхностных водах
с небольшим содержанием органических
веществ не препятствуют нитриты, марганец
и железо, если титруют с добавлением
раствора разбавленной уксусной кислоты.
В присутствии большого количества
органических веществ метод не дает
правильных результатов.
Реактивы и оборудование
Уксусная кислота
ч.д.а., ледяная.
Иодид калия, ч.д.а.
Тиосульфат натрия,
раствор с концентрацией 0,01 моль-экв/дм3.
Крахмал, 0,5%-ный
раствор.
Бюретки, мерные
пробирки
Конические колбы
Ход определения.
При предполагаемом содержании «активного
хлора» менее 1 мг/дм3берут 1 дм3пробы, при содержании его от 1 до 10 мг/дм3– 500 см3и т.д. (расход тиосульфата
натрия на титрование не должен превышать
20 см3).
Прибавляют к пробе 5 см3уксусной
кислоты и около 1 г твердого иодида
калия. Титрование проводят на белом
фоне 0,01 н. раствором тиосульфата натрия
до получения светло-желтой окраски.
Затем добавляют 1 см3раствора
крахмала и продолжают титрование до
исчезновения синего окрашивания. Нельзя
титровать при прямом солнечном свете,
так как прямые солнечные лучи катализируют
окисление тиосульфата кислородом
воздуха.
Таким же способом находят расход реактива
на холостое определение с дистиллированной
водой.
Расчет.
Содержание
активного хлора (Х) в мг/дм3
вычисляют по формуле:
гдеV1
– объем раствора тиосульфата натрия,
израсходованного на титрование см3;
V2–
объем раствора тиосульфата натрия,
израсходованного на титрование в
холостом определении, см3;
Н
– концентрация раствора тиосульфата
в моль-экв/дм3;
K
– поправочный коэффициент к концентрации
титранта;
Vпробы
– объем анализируемой пробы, см3;
ЭСl
– эквивалент хлора, г/моль-экв;
1000 – коэффициент
для перехода от граммов к миллиграммам.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ХЛОР АКТИВНЫЙ – это хлор, который выделяется в свободном виде при взаимодействии данного вещества с соляной кислотой. Выделение хлора происходит в результате окислительно-восстановительной реакции HCl с соединениями, в которых хлор имеет положительные степени окисления – чаще всего +1, +3 и +5. Массовая доля активного хлора в веществе (в процентах) численно равна массе молекулярного хлора, который выделяется из 100 г этого вещества при взаимодействии с избытком соляной кислоты.
Окислить HCl до Cl2 без потерь и проанализировать количество выделившегося хлора трудно. Поэтому на практике определяют активный хлор иначе – как массу хлора, которая способна выделить из раствора HI такое же количество иода, что и 100 г анализируемого вещества. Например, из сравнения двух реакций:
Cl2 + 2HI ® I2 + 2HCl и
NaOCl + 2HCl ® I2 + NaCl + H2O,
видно, что 1 моль иода выделяется под действием либо 70,9 г Cl2, либо 74,5 г NaClO, поэтому содержание активного хлора в NaClO равно (70,9/74,5)100 = 95,2% (считается, что в Cl2 «содержится» 100% активного хлора).
Иодоводородная кислота окисляется легко и полностью, а образующийся иод очень просто определить количественно. На практике поступают так: навеску анализируемого вещества растворяют в воде и добавляют избыток подкисленного раствора KI; затем выделившийся иод (который прекрасно растворяется в избытке раствора KI) титруют раствором тиосульфата известной концентрации (см. также ТИТРОВАНИЕ).
Хлорная вода и хлорноватистая кислота.
История применения веществ, содержащих активный хлор, насчитывает более двух столетий. Вскоре после открытия хлора шведским химиком Шееле в 1774 обнаружилось, что под действием этого газа смоченные водой желтоватые и некрасивые ткани из растительных волокон – льна или хлопка приобретают замечательную белизну. Впервые применил хлор для беления тканей и бумаги французский химик Клод Луи Бертолле. В своем имении в Аркее он открыл в 1785 фабрику по отбелке холста хлором, на которой работали, в частности, его сын вместе с молодым учеником Бертолле Гей-Люссаком.
Хлор, реагируя с водой, образует хлорноватистую кислоту HClO. Это было первое полученное химиками вещество, содержащее активный хлор. Из уравнения реакции HClO + HCl ® Cl2 + H2O следует, что теоретически из 52,5 г чистой HClO можно получить 71 г Cl2, то есть хлорноватистая кислота содержит 135,2% активного хлора. Но эта кислота неустойчива; максимально возможная ее концентрация в растворе – не более 30%. Скорость и направление распада хлорноватистой кислоты зависит от условий. В кислой среде при комнатной температуре идет медленная реакция 4HClO ® 2Cl2 + O2 + 2H2O. В присутствии соляной кислоты в растворе быстро устанавливается равновесие HClO + HCl Cl2 + H2O, сильно сдвинутое вправо. В слабокислых и нейтральных растворах идет распад
2HClO ® O2 + 2HCl, ускоряемый видимым светом. В слабощелочных средах, особенно при повышенной температуре, идет реакция диспропорционирования с образованием хлорат-ионов: 2HClO + ClO–® ClO3– + 2H+ + 2Cl–. Поэтому реально водные растворы хлора содержат лишь незначительные количества хлорноватистой кислоты и активного хлора в них немного.
В 19 в. было обнаружено, что хлорная вода обладает не только отбеливающим, но и дезинфицирующим действием. Впервые в этом качестве ее начали использовать в 1846 в одном из госпиталей в Вене, где была введена практика для врачей ополаскивать руки хлорной водой. После того, как в 1888 на Международном гигиеническом конгрессе в Вене было признано, что заразные болезни, в том числе холера, могут распространяться с питьевой водой, начались планомерные поиски наиболее эффективного способа обеззараживания воды. И когда в больших городах появился водопровод, хлору нашли новое применение – дезинфицировать питьевую воду. Впервые для этой цели его применили в Нью-Йорке в 1895, а в настоящее время для хлорирования воды расходуют ежегодно сотни тысяч тонн хлора. Хлор легко растворяется в воде, убивая в ней все живое. При этом выяснилось, что свободная хлорноватистая кислота почти в 300 раз более активна, чем гипохлорит-ионы ClO–; объясняется это уникальной способностью HClO проникать в бактерии через их мембраны. Хлорирование оказалось самым простым и дешевым способом обеззараживания воды. Поскольку обнаружить в воде болезнетворные бактерии непросто (для этого требуются сложные лабораторные исследования), обычно бактериальную безопасность воды после ее обработки хлором контролируют по косвенному признаку: числу неопасных, но хорошо различимых в микроскоп микроорганизмов – кишечных палочек. Если после хлорирования в 1 мл воды остается не более 3 палочек, то можно считать, что менее устойчивые болезнетворные бактерии полностью уничтожены. Обычно на один кубометр воды требуется примерно 1,5–2 г хлора. Но иногда хлора добавляют больше, чем обычно; это бывает, например, весной, во время паводка, когда талые воды смывают в реки и остатки удобрений с полей, и прочие загрязнители воды. Поэтому содержание активного хлора в водопроводной воде может изменяться в довольно широких пределах. Избыток хлора придает воде неприятный запах, особенно при ее нагревании, когда растворимость хлора снижается. Ничтожные концентрации хлора в питьевой воде не представляют опасности для здоровья, хотя пить такую воду неприятно. Проще всего избавиться от остатков хлора в водопроводной воде, выдержав её несколько часов в открытой посуде или доведя до кипения: из кипящей воды хлор улетучится быстро и без остатка.
Но если вода загрязнена некоторыми отходами химических производств, хлорирование ее может привести к нежелательным последствиям. Например, при хлорировании фенола могут образоваться дихлорфенолы, обладающие запахом в исключительно малых концентрациях – всего 1 мг в 10 тоннах воды! Еще в 1974 Агентство по защите окpужающей сpеды в США обследовало водоснабжение Нового Оpлеана и обнаpужило в питьевой воде 66 различных хлорорганических соединений (правда, по большей части в очень малых концентрациях – не более 1 мг на тонну). Некоторые примеси в воде после их хлорирования превращаются в чрезвычайно токсичные соединения (например, диоксины). Поэтому более перспективно вместо хлорирования применять озонирование воды (см. ОЗОН).
Хлорируют не только питьевую, но и сточные воды, чтобы патогенные микроорганизмы не попали в реки. Используют хлор и его соединения и для дезинфекции воды в бассейнах.
Гипохлориты щелочных металлов. Жавелевая вода.
Иметь дело с газом, да еще таким ядовитым, как хлор, неудобно и опасно. В 1789 Бертолле вместо хлорной воды, выделяющей хлор, начал для той же цели использовать щелочной отбеливающий раствор. Такой раствор получали путем пропускания хлора в калиевый щелок – раствор поташа (карбоната калия) до насыщения его хлором. Раствор получил название жавелевой воды (в то время Жавель был пригородом Парижа; в настоящее время это один из парижских районов). Отбеливающий раствор, получаемый действием хлора на раствор соды (карбоната натрия), получил название лабарраковой воды – по имени парижского аптекаря Антуана Жермена Лабаррака; его начали использовать с 1820. Впоследствии оба раствора обычно называли одинаково – жавелевой водой, а на практике применяли только более дешевую натриевую соль. Ее получали хлорированием раствора соды. В результате гидролиза карбоната натрия образуется щелочь:
Na2СО3 + Н2О NaНСО3 + NaОН, которая обратимо реагирует с хлором с образованием хлорида и гипохлорита – натриевой соли хлорноватистой кислоты:
Cl2 + 2NaOH NaClO + NaCl + Н2О. Такой отбеливающий раствор, содержащий смесь хлорида и гипохлорита, был очень неустойчивым, и его надо было применять непосредственно на месте получения. Причина нестабильности заключалась в присутствии в растворе при невысоких значениях рН значительных количеств хлорноватистой кислоты HClO. Поэтому со временем жавелевую воду стали получать путем насыщения хлором сильной щелочи – гидроксида натрия. Полученный раствор, содержащий небольшой (0,3%) избыток NaOH, был намного стабильнее.
В настоящее время для получения гипохлорита натрия используют электролиз растворов хлорида натрия без диафрагмы. При этом первичные продукты электролиза – Cl2 и NaOH реагируют непосредственно в электролитической ванне. Преимущество этого процесса в том, что хлорид натрия, один из продуктов реакции
Cl2 + 2NaOH ® NaClO + NaCl + Н2О, снова подвергается электролизу, так что суммарное уравнение процесса становится таким: NaCl + H2O ® NaClO + H2. Обычно жавелевая вода содержит от 8 до 15% активного хлора. Повышению его концентрации препятствует побочная реакция окисления гипохлорит-ионов на аноде:
6ClO– + 3H2O – 6e ® 2ClO3– + 4Cl– + 6H+ + 1,5O2.
Гипохлорит натрия (в виде кристаллогидратов) был выделен из его раствора путем отгонки воды без нагрева – при пониженном давлении. При этом сначала выделяются кристаллы состава NaClO·5H2O, которые при дальнейшем высушивании переходят в NaClO·H2O. При нагревании до 70оС эта соль разлагается со взрывом. Чистый NaClO содержит теоретически 95,2% активного хлора. Все гипохлориты – сильные окислители, особенно в щелочном растворе. Так, в кислой среде они окисляют иодиды до иода, в нейтральной – до иодата IO3–, в щелочной – до периодата IO4–.
Хлорноватистая кислота очень слабая, слабее даже угольной. Поэтому на воздухе из растворов гипохлоритов происходит частичное выделение этой кислоты под действием углекислого газа: NaOCl + CO2 NaHCO3 + HClO. Отбеливающее действие гипохлоритов основано на окислении хлорноватистой кислотой различных загрязняющих ткань веществ. В отсутствие углекислого газа жавелевая вода тоже разлагается. Так, при комнатной температуре в водном растворе за сутки разлагается около 0,1% NaClO. В присутствии щелочей скорость разложения замедляется. Концентрированные растворы NaClO выпускаются промышленностью в большом количестве – сотни тысяч тонн ежегодно. Его применяют как дезинфицирующее средство, для обеззараживания воды, для отбеливания тканей, бумаги, в химических синтезах, в зубоврачебной практике – для дезинфицирования каналов и отбеливания зубов. Более легкий гипохлорит лития содержит в чистом виде 121,6% активного хлора. Его применяют в производстве стиральных порошков, для дезинфекции воды в бассейнах.
Интересна и необычна реакция гипохлоритов с пероксидом водорода в щелочных растворах: ClO– + H2O2® H2O + Cl– + O2). Необычность ее в том, что энергия этой экзотермической реакции частично выделяется на молекулах кислорода, который образуется в электронно-возбужденном состоянии (такой кислород называется синглетным). Энергия возбуждения составляет 95 кДж/моль. При столкновении двух возбужденных молекул кислорода обе они переходят в основное состояние, а их избыточная энергия излучается в виде красного света с длиной волны 634 нм. Свечение, вызванное химической реакцией, называется хемилюминесценцией (см. также ЛЮМИНЕСЦЕНЦИЯ). Один химик неожиданно наблюдал это свечение, когда попытался вывести чернильное пятно с белого банного полотенца. Смочив пятно отбеливающим раствором, содержащим гипохлорит, он неожиданно увидел слабое розовое свечение, которое продолжалось более минуты. Оказалось, что ранее полотенце отбеливали другим средством, содержащим Н2О2, и частично пероксид остался на ткани, несмотря на полоскание и сушку.
Хлорная известь.
В Англии, в Ланкашире, с 18 в. применяли для отбеливания тканей вещество, получаемое действием хлора на другой щелочной раствор – известковое молоко. В 1788 английский химик Смитсон Теннант получил патент на получение сухого «отбеливающего порошка» путем абсорбции хлора гашеной известью (гидроксидом кальция). Этот порошок получил название белильной (или хлорной) извести. В 1799 в Глазго началось производство хлорной извести; за первый год ее получили 52 тонны. Гашеная известь стоила очень дешево, а вот хлор был дорог. В начале 19 в., одна тонна хлорной извести стоила 1300 золотых рублей; через сто лет ее цена снизилась в 30 раз, а сейчас это очень дешевое вещество.
Состав хлорной извести долгое время был неизвестен. Английский химик Уильям Одлинг, один из предшественников Д.И.Менделеева по открытию периодического закона, предположил, что хлорная известь – это смешанная соль, хлорид-гипохлорит кальция Ca(OCl)Cl. Однако состав этого вещества сложнее и зависит от способа получения. Сначала в реакции хлора с гидроксидом кальция образуется основной гипохлорит Ca(OCl)2·2Ca(OH)2 в смеси с основным хлоридом CaCl2·Ca(OH)2·H2O. При дальнейшем хлорировании первое из этих соединений постепенно превращается в Ca(OCl)2. В результате получается сложная смесь, состоящая из Ca(OCl)Cl, Ca(ClO)2, CaCl2, Ca(OH)2 и более сложных соединений на их основе.
Чистый гипохлорит кальция (впервые он был получен в 1875) – бесцветные кристаллы, устойчивые в отсутствие влаги и углекислого газа. При нагревании выше 50° С он разлагается с выделением кислорода. Химически чистое соединение содержит 99,2% активного хлора; присутствие в техническом продукте основного хлорида кальция снижает это значение до 50–70%, а присутствие влаги ускоряет разложение.
Значительно большее распространение получила хлорная известь (другое название – белильная известь). Ее получают хлорированием сухого Ca(OH)2. Получаемый продукт обычно содержит 28–36% активного хлора. Из-за медленного разложения, особенно во влажном состоянии, он всегда пахнет хлором. При хранении хлорной извести теряется до 10% активного хлора в год. Разложение ускоряется с повышением влажности и температуры, при освещении, в присутствии тяжелых металлов и углекислого газа. Раствор хлорной извести, стоящий на солнечном свету, за сутки теряет до 5% активного хлора. Применяют хлорную известь для отбеливания тканей, целлюлозы, бумаги, для очистки нефтепродуктов, дезинфекции сточных вод. В лаборатории ее можно использовать для получения хлора.
В России хлорную известь производили с 1890 на заводе Ушакова близ Елабуги на Каме. А до этого всего за три года было импортировано 15 тыс. т хлорной извести на сумму 1,25 млн. рублей. Несмотря на относительно низкое содержание активного хлора и неустойчивость при хранении, хлорную известь еще производят в довольно больших количествах – в основном в развивающихся странах. В США ее производство достигло максимума в 1923 (133 тыс. т), а уже через 30 лет снизилось в шесть раз за счет производства более эффективных средств, содержащих активный хлор.
Другие соединения с активным хлором.
Отбеливающим действием, помимо хлорноватистой кислоты и ее солей, обладает также хлористая кислота HClO2 и ее соли – хлориты. Кислота эта слабая и неустойчивая, особенно в кислой среде; ее распад идет по уравнению
4HClO2® HClO3 + 2ClO2 + HCl + H2O. Под действием света, как и в случае HClO, выделяется кислород: 10HClO2® 2HClO3 + 2HClO4 + 6HCl + 3O2. При получении гипохлоритов действием хлора на щелочи хлориты не накапливаются из-за быстрой реакции ClO2– + ClO–® ClO3– + Cl–. Получают хлориты действием ангидрида хлористой кислоты на щелочи: 2ClO2 + 2NaOH ® NaClO2 + NaClO3 + H2O. Одновременно образуется хлорат – соль хлорноватой кислоты HClO3. Из солей хлористой кислоты применяют в основном хлорит натрия NaClO2 (содержание активного хлора 156,8%), который используют для быстрого отбеливания искусственного волокна.
Для отбеливания древесной целлюлозы, растительных и животных жиров, стерилизации и дезодорации воды применяют также диоксид хлора (см. также ХЛОР). Чистый ClO2 содержит 262,8% активного хлора. Это, пожалуй, рекорд для соединений, имеющих практическое значение. Теоретически же из хлорсодержащих соединений на первое место выходит хлорный ангидрид Cl2O7 – 310%.
Дезинфицирующие и моющие свойства сочетает в себе хлорированный тринатрийфосфат состава Na3PO41·/4NaClO·11H2O, содержащий 4,7% активного хлора. Его добавляют в средства для мытья посуды, стерилизации фруктов и овощей в пищевой промышленности. Применяют, в основном для дезинфекции, и органические соединения, содержащие активный хлор – хлорамин Б (производное бензолсульфокислоты) C6H5SO2N(Na)Cl·3H2O, дихлорамин Б C6H5SO2NCl2, хлорамин Т (производное толуолсульфокислоты) CH3C6H4SO2N(Na)Cl·3H2O, дихлорамин Т CH3C6H4SO2NCl2, пантоцид HOOC6H4SO2NCl2. Хлорамины – сильные окислители и хлорирующие агенты, обладают запахом хлора. При действии влаги гидролизуются с выделением хлорноватистой кислоты.
Илья Леенсон
ГОСТ 18190-72
Группа Н09
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ВОДА ПИТЬЕВАЯ
Методы определения содержания остаточного активного хлора
Drinking water. Methods for determination of сhlorine residual content
МКС 13.060.20
Дата введения 1974-01-01
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. УТВЕРЖДЕН и ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 25.10.72 N 1967
2. ВВЕДЕН ВПЕРВЫЕ
3. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
|
Обозначение НТД, на который дана ссылка |
Номер пункта |
Обозначение НТД, на который дана ссылка |
Номер пункта |
|
ГОСТ 61-75 |
2.2 |
ГОСТ 9147-80 |
3.2 |
|
ГОСТ 84-76 |
2.2 |
ГОСТ 10163-76 |
2.2 |
|
ГОСТ 1770-74 |
2.2, 3.2, 4.2 |
ГОСТ 10652-73 |
4.2 |
|
ГОСТ 2874-82 |
1.1 |
ГОСТ 11773-76 |
4.2 |
|
ГОСТ 3118-77 |
3.2 |
ГОСТ 24481-80 |
1.1 |
|
ГОСТ 4198-75 |
4.2 |
ГОСТ 25336-82 |
2.2, 3.2 |
|
ГОСТ 4204-77 |
2.2, 4.2 |
ГОСТ 27068-86 |
2.2 |
|
ГОСТ 4208-72 |
4.2 |
ГОСТ 29169-91 |
2.2 |
|
ГОСТ 4220-75 |
2.2 |
ГОСТ 29251-91 |
2.2, 3.2, 4.2 |
|
ГОСТ 4232-74 |
2.2, 4.2 |
ТУ 6-09-5171-84 |
3.2 |
|
ГОСТ 6709-72 |
2.2, 3.2, 4.2 |
4. Ограничение срока действия снято Постановлением Госстандарта СССР от 25.12.91 N 2120
5. ПЕРЕИЗДАНИЕ. Ноябрь 2009 г.
Настоящий стандарт распространяется на питьевую воду и устанавливает методы определения содержания остаточного активного хлора.
1. МЕТОДЫ ОТБОРА ПРОБ
1.1. Пробы воды отбирают по ГОСТ 24481* и ГОСТ 2874**.
__________________
* На территории Российской Федерации действует ГОСТ Р 51593-2000.
** На территории Российской Федерации действует ГОСТ Р 51232-98.
1.2. Объем пробы воды для определения содержания активного хлора не должен быть менее 500 см
.
1.3. Пробы воды не консервируют. Определение следует проводить немедленно после отбора пробы.
2. ЙОДОМЕТРИЧЕСКИЙ МЕТОД
2.1. Сущность метода
Метод основан на окислении йодида активным хлором до йода, который титруют тиосульфатом натрия. Озон, нитриты, окись железа и другие соединения в кислом растворе выделяют йод из йодистого калия, поэтому пробы воды подкисляют буферным раствором с рН 4,5.
Йодометрический метод предназначен для анализа воды с содержанием активного хлора более 0,3 мг/дм
при объеме пробы 250 см
. Метод может быть рекомендован также для окрашенных и мутных вод.
2.2. Аппаратура, материалы и реактивы
Посуда мерная лабораторная стеклянная по ГОСТ 1770, ГОСТ 29169 и ГОСТ 29251, вместимостью: колбы мерные 100 и 1000 см
; пипетки без делений 5, 10, 25 см
; бюретка с краном 25, 50 см
; микробюретка 5 см
.
Колбы конические с пришлифованными пробками вместимостью 250 см
по ГОСТ 25336.
Калий йодистый по ГОСТ 4232, х.ч., в кристаллах.
Вода дистиллированная по ГОСТ 6709.
Хлороформ (трихлорметан).
Кислота салициловая.
Кислота уксусная ледяная по ГОСТ 61.
Калий двухромовокислый по ГОСТ 4220.
Кислота серная по ГОСТ 4204.
Крахмал растворимый по ГОСТ 10163.
Натрий углекислый кристаллический по ГОСТ 84.
Натрий серноватистокислый (тиосульфат натрия) по ГОСТ 27068.
Все реактивы, используемые в анализе, должны быть квалификации “чистые для анализа” (ч.д.а.).
2.3. Подготовка к анализу
2.3.1. Приготовление 0,1 н. раствора серноватистокислого натрия
25 г тиосульфата натрия
растворяют в свежепрокипяченной и охлажденной дистиллированной воде, добавляют 0,2 г углекислого натрия (
) и доводят объем до 1 дм
.
2.3.2. Приготовление 0,01 н. раствора серноватистокислого натрия
100 см
0,1 н. раствора тиосульфата натрия разбавляют свежепрокипяченной и охлажденной дистиллированной водой, добавляют 0,2 г углекислого натрия и доводят раствор до 1 дм
. Раствор применяют при содержании активного хлора в пробе более 1 мг/дм
.
2.3 3. Приготовление 0,005 н. раствора серноватистокислого натрия
50 см
0,1 н. раствора тиосульфата натрия разбавляют свежепрокипяченной и охлажденной дистиллированной водой, добавляют 0,2 г углекислого натрия и доводят раствор до 1 дм
. Раствор применяют при содержании активного хлора в пробе менее 1 мг/дм
.
2.3.4. Приготовление 0,01 н. раствора двухромовокислого калия
0,4904 г двухромовокислого калия
, взвешенного с точностью до ±0,0002 г, перекристаллизованного и высушенного при 180°С до постоянной массы, растворяют в дистиллированной воде и доводят объем до 1 дм
.
2.3.5. Приготовление 0,5%-ного раствора крахмала
0,5 г растворимого крахмала смешивают с небольшим объемом дистиллированной воды, приливают к 100 cм
кипящей дистиллированной воды и кипятят несколько минут. После охлаждения консервируют, добавляя хлороформ или 0,1 г салициловой кислоты.
2.3.6. Приготовление буферного раствора рН 4,5
102 cм
1 М уксусной кислоты (60 г ледяной уксусной кислоты в 1 дм
воды) и 98 cм
1 М раствора уксуснокислого натрия (136,1 г уксуснокислого натрия
в 1 дм
воды) наливают в мерную колбу вместимостью 1 дм
и доводят до метки дистиллированной водой (предварительно прокипяченной и охлажденной до 20°С, свободной от двуокиси углерода).
2.3.7. Поправочный коэффициент 0,01 н. раствора серноватистокислого натрия определяют по 0,01 н. pacтвopy двухромовокислого калия следующим образом: в коническую колбу и с пришлифованной пробкой помещают 0,5 г йодистого калия, проверенного на отсутствие йода, растворяют в 2 cм
дистиллированной воды, прибавляют 5 cм
серной кислоты (1:4), затем 10 cм
0,01 н. раствора двухромовокислого калия, добавляют 80 cм
дистиллированной воды, закрывают колбу пробкой, перемешивают и ставят в темное место на 5 мин. Выделившийся йод титруют тиосульфатом натрия в присутствии 1 cм
крахмала, прибавленного в конце титрования.
2.3.8. Поправочный коэффициент (
) (0,01; 0,005 н. растворов серноватистокислого натрия) вычисляют по формуле:
,
где
– количество серноватистокислого натрия, израсходованное на титрование, cм
.
2.4. Проведение анализа
В коническую колбу насыпают 0,5 г йодистого калия, растворяют его в 1-2 cм
дистиллированной воды, затем добавляют буферный раствор в количестве, приблизительно равном полуторному значению щелочности анализируемой воды, после чего добавляют 250-500 cм
анализируемой воды. Выделившийся йод оттитровывают 0,005 н. раствором тиосульфата натрия из микробюретки до появления светло-желтой окраски, после чего прибавляют 1 cм
0,5%-ного раствора крахмала и раствор титруют до исчезновения синей окраски. При определении щелочности воду предварительно дехлорируют с помощью тиосульфата натрия в отдельной пробе.
При концентрации активного хлора менее 0,3 мг отбирают для титрования большие объемы воды.
2.5. Обработка результатов
Содержание суммарного остаточного хлора (
), мг/дм
, вычисляют по формуле
,
где
– количество 0,005 н. раствора тиосульфата натрия, израсходованное на титрование, cм
;
– поправочный коэффициент нормальности раствора тиосульфата натрия;
0,177 – содержание активного хлора, соответствующее 1 cм
0,005 н. раствора тиосульфата натрия;
– объем пробы воды, взятый для анализа, cм
.
3. МЕТОД ОПРЕДЕЛЕНИЯ СВОБОДНОГО ОСТАТОЧНОГО ХЛОРА ТИТРОВАНИЕМ МЕТИЛОВЫМ ОРАНЖЕВЫМ
3.1. Сущность метода
Метод основан на окислении свободным хлором метилового оранжевого, в отличие от хлораминов, окислительный потенциал которых недостаточен для разрушения метилового оранжевого.
3.2. Аппаратура, материалы, реактивы
Посуда мерная лабораторная стеклянная по ГОСТ 1770 и ГОСТ 29251, вместимостью: колбы мерные 100 и 1000 cм
; микробюретка с краном 5 cм
.
Капельница по ГОСТ 25336.
Чашки фарфоровые выпарительные по ГОСТ 9147.
Кислота соляная по ГОСТ 3118, плотностью 1,19 г/cм
.
Метиловый оранжевый (пара-диметиламиноазобензолсульфокислый натрий) по ТУ 6-09-5171.
Вода дистиллированная по ГОСТ 6709.
Все реактивы, применяемые для анализа, должны быть квалификации “чистые для анализа” (ч.д.а.).
3.3. Подготовка к анализу
3.3.1. Приготовление 0,005%-ного раствора метилового оранжевого
50 мг метилового оранжевого растворяют в дистиллированной воде в мерной колбе и доводят дистиллированной водой до 1 дм
. 1 cм
этого раствора соответствует 0,0217 мг свободного хлора.
3.3 2. Приготовление 5 н. раствора соляной кислоты
В мерную колбу наливают дистиллированную воду, затем медленно добавляют 400 cм
соляной кислоты НСl и доводят дистиллированной водой до 1 дм
.
3.4. Проведение анализа
100 cм
анализируемой воды помещают в фарфоровую чашку, добавляют 2-3 капли 5 н. раствора соляной кислоты и, помешивая, быстро титруют раствором метилового оранжевого до появления неисчезающей розовой окраски.
3.5. Обработка результатов
Содержание свободного остаточного хлора (
), мг/дм
, вычисляют по формуле
,
где
– количество 0,005%-ного раствора метилового оранжевого, израсходованное на титрование, cм
;
0,0217 – титр раствора метилового оранжевого;
0,04 – эмпирический коэффициент;
– объем воды, взятый для анализа, cм
.
По разности между содержанием суммарного остаточного хлора, определенного йодометрическим методом, и содержанием свободного остаточного хлора, определенного методом титрования метиловым оранжевым, находят содержание хлораминового хлора (
):
.
4. МЕТОД РАЗДЕЛЬНОГО ОПРЕДЕЛЕНИЯ СВОБОДНОГО ХЛОРА, СВЯЗАННОГО МОНОХЛОРАМИНА И ДИХЛОРАМИНА ПО МЕТОДУ ПЕЙЛИНА
4.1. Сущность метода
Метод основан на способности разных видов хлора превращать в определенных условиях восстановленную бесцветную форму диэтилпарафенилендиамина в полуокисленную окрашенную форму, которую восстанавливают опять до бесцветной ионами двухвалентного железа. Используется серия титрований раствором соли Мора для определения свободного хлора, монохлорамина и дихлорамина в присутствии диэтилпарафенилендиамина, как индикатора. Свободный хлор образует окраску индикатора в отсутствии йодистого калия, монохлорамин дает окраску в присутствии очень маленьких количеств йодистого калия (2-3 мг), а дихлорамин образует окраску лишь в присутствии больших количеств KI (около 1 г) и при стоянии раствора в течение 2 мин. По количеству раствора соли Мора, израсходованному на титрование, определяют содержание того вида активного хлора, за счет которого образуется окрашенная форма индикатора.
4.2. Аппаратура, материалы, реактивы
Посуда мерная стеклянная лабораторная по ГОСТ 1770 и ГОСТ 29251, вместимостью: колбы мерные 100 и 1000 cм
; цилиндры мерные 5 и 100 cм
; микробюретки 1 и 2 cм
.
Колбы конические вместимостью 250 cм
; склянки из темного стекла вместимостью 100-200 cм
.
Двойная сернокислая соль закиси железа и аммония (соль Мора) по ГОСТ 4208.
Калий йодистый по ГОСТ 4232.
Калий фосфорнокислый однозамещенный по ГОСТ 4198, х.ч.
Кислота серная по ГОСТ 4204.
Натрий фосфорнокислый двузамещенный безводный по ГОСТ 11773.
Трилон Б (комплексон III, двунатриевая соль этилендиаминтетрауксусной кислоты) по ГОСТ 10652.
Вода дистиллированная по ГОСТ 6709.
Диэтилпарафенилендиамин оксалат или сульфат.
Все реактивы, применяемые для анализа, должны быть квалификации “чистые для анализа” (ч.д.а.).
4.3. Подготовка к анализу
4.3.1. Приготовление стандартного раствора соли Мора
1,106 г соли Мора
растворяют в дистиллированной воде, подкисляют 1 cм
25%-нoгo раствора серной кислоты
и доводят свежепрокипяченной и охлажденной дистиллированной водой до 1 дм
. 1 cм
раствора соответствует 0,1 мг активного хлора. Если определение проводится в 100 cм
воды, то количество кубических сантиметров соли Мора, израсходованное на титрование, соответствует мг/дм
хлора или монохлорамина, или дихлорамина. Раствор устойчив в течение месяца. Хранить его следует в темном месте.
4.3.2. Приготовление фосфатного буферного раствора
К 2,4 г фосфорнокислого натрия двузамещенного
и 4,6 г фосфорнокислого калия однозамещенного
приливают 10 cм
0,8%-ного раствора трилона Б и доводят дистиллированной водой до 100 cм
.
4.3.3. Приготовление индикатора диэтилпарафенилендиамина (оксалата или сульфата) 0,1%-ного раствора
0,1 г диэтилпарафенилендиамина оксалата (или 0,15 г сульфата) растворяют в 100 cм
дистиллированной воды с добавлением 2 cм
10%-ного раствора серной кислоты. Раствор индикатора следует хранить в склянке из темного стекла.
4.4. Проведение анализа
4.4.1. Определение содержания свободного хлора
В коническую колбу для титрования помещают 5 cм
фосфатного буферного раствора, 5 cм
раствора диэтилпарафенилендиамина оксалата или сульфата и приливают 100 cм
анализируемой воды, раствор перемешивают. В присутствии свободного хлора раствор окрашивается в розовый цвет, его быстро титруют из микробюретки стандартным раствором соли Мора до исчезновения окраски, энергично перемешивая. Расход соли Мора на титрование (
, cм
) соответствует содержанию свободного хлора, мг/дм
.
При наличии в анализируемой воде значительных количеств свободного хлора (более 4 мг/дм
) для анализа следует брать менее 100 cм
воды, так как большие количества активного хлора могут полностью разрушить индикатор.
4.4.2. Определение содержания монохлорамина
В колбу с оттитрованным раствором добавляют кристаллик (2-3 мг) йодистого калия, раствор перемешивают. В присутствии монохлорамина мгновенно появляется розовая окраска, которую тотчас же оттитровывают стандартным раствором соли Мора. Количество кубических сантиметров соли Мора, пошедшее на титрование (
, cм
), соответствует содержанию монохлорамина, мг/дм
.
4.4.3. Определение содержания дихлорамина
К оттитрованному раствору после определения содержания монохлорамина вновь добавляют около 1 г йодистого калия, перемешивают до растворения соли и оставляют раствор стоять в течение 2 мин. Появление розовой окраски свидетельствует о наличии в воде дихлорамина. Раствор титруют стандартным раствором соли Мора до исчезновения окраски. Расход соли Мора (
, cм
) соответствует содержанию дихлорамина, мг/дм
.
4.5. Обработка результатов
Содержание суммарного остаточного активного хлора (
), мг/дм
, вычисляют по формуле
,
где
– содержание свободного хлора, мг/дм
;
– содержание монохлорамина, мг/дм
;
– содержание дихлорамина, мг/дм
.
КОСВЕННЫЙ МЕТОД ОПРЕДЕЛЕНИЯ «АКТИВНОГО ХЛОРА»
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Баранова Е.И.
1
1 ФГБОУ ВО «Кубанский государственный технологический университет»
Целью работы является разработка методики определения активного хлора электрохимически обработанной жидкости косвенно потенциометрическим методом. Основная часть анализов остаточного активного хлора выполняется традиционным химическим методом, в основе которого – методика объемного титрования рабочим раствором тиосульфата натрия с визуальной индикацией точки эквивалентности по крахмалу. Главными недостатками методики являются малая химическая устойчивость растворов тиосульфата натрия, необходимость периодической проверки его титра, высокий предел определяемых содержаний активного хлора и соответственно низкая чувствительность метода, относительно большая ошибка определения. С целью устранения указанных недостатков объемного классического анализа, автоматизации метода, сокращения его трудоемкости проводятся исследования по разработке инструментальных методов контроля активного хлора. Предложен вариант косвенного потенциометрического метода определения общего содержания «активного хлора» в электрохимически обработанных хлоридсодержащих электролитах без применения буферной системы.
электрохимическая обработка
хлорид натрия
окислительно-восстановительный потенциал
1. Вода питьевая. Методы определения содержания остаточного активного хлора. ГОСТ 18190-72. – М.: Изд-во стандартов, 2010 (переиздание). – 12 с.
2. Доерфель К. Статистика в аналитической химии / пер. с нем. – М.: Мир, 1969. – 248 с.
3. Сериков Ю.А., Носкова Т.В. Потенциометрическое определение активного хлора в промышленных и сточных водах титаномагниевого производства // Зав.лаб. – 1988. – № 7. – С. 23–26.
4. Турьян Я.И., Малука Л.М., Маркова Т.Р. Окислительно-восстановительные процессы в системе I2 + KI + NaCl и потенциометрическое определение йодида калия в поваренной соли // Журн. аналит. химии. – 1992. – Т. 47, № 4. – С. 723–730.
5. Svintsova L.D., Chernyshova N.N. Sample preparation by electrochemical pretreatment in the membranous electrolyzer // Int. Congress on Analyt. Chem.: Abstracts / Moscow. St. Univ. – M., 1997. – Vol. 1. – P. 12.
С целью обеспечения санитарных, гигиенических показателей, предъявляемых к питьевой, бытовой, технической воде, технологическим жидкостям, решения экологических проблем проводится обеззараживание вод различного назначения хлором.
После операции хлорирования обязателен контроль содержания остаточного активного хлора. Под термином «активный хлор» понимают суммарное содержание в воде сильных хлорсодержащих окислителей: гипохлорита натрия, молекулярного растворенного хлора и хлорамина. Основная часть анализов остаточного активного хлора выполняется традиционным химическим методом, в основе которого – методика объемного титрования рабочим раствором тиосульфата натрия с визуальной индикацией точки эквивалентности по крахмалу. Главными недостатками методики являются малая химическая устойчивость растворов тиосульфата натрия, необходимость периодической проверки его титра, высокий предел определяемых содержаний активного хлора и соответственно низкая чувствительность метода, относительно большая ошибка определения. Систематическая ошибка йодид-крахмальной методики определения остаточного активного хлора составляет около 8 отн % при САХ = 0,3–0,7 мг/л и уменьшается до 4 отн % при САХ = 1,5 мг/л. Как известно, с целью устранения указанных недостатков объемного классического анализа, автоматизации метода, сокращения его трудоемкости проводятся исследования по разработке инструментальных методов контроля активного хлора.
Электрохимическая, особенно анодная обработка (активация) водных растворов электролитов нашла достаточно широкое применение на стадиях пробоподготовки в алгоритме различных электрохимических и других физико-химических методов анализа [5].
Целью нашей работы является разработка методики определения активного хлора электрохимически обработанной жидкости косвенно потенциометрическим методом.
Материалы и методы исследования
Электрохимическая генерация активного хлора в растворах хлорида натрия (с содержанием соли от 0,001 до 1,0 моль/дм3) проводилась в анодной камере двухкамерного проточного электролизера с электродами в виде графитовых дисков в режиме постоянного и импульсного тока (силой от 0,05 до 0,5 А, соответствующий интервал плотности тока от 8 до 70 А/м2). Формирование окислительно-восстановительного потенциала в этих условиях контролировалось потенциометрическими измерениями (индикаторный точечный платиновый электрод ЭПВ-1, хлоридсеребряный электрод сравнения ЭВЛ 1 МЗ) как в потоке анолита, фрагмент которого образует гальваническую ячейку, так и в пробоотборнике при перемешивании магнитной мешалкой.
Результаты исследования и их обсуждение
Аналитический контроль за содержанием «активного хлора» (mАХ или САХ, мг/дм3 или моль/дм3) в электрохимически обработанной жидкости – анолите осуществлялся методом йодометрического титрования с визуальной индикацией конечной точки титрования в соответствии с ГОСТ 18190-72 [1]. В отличие от данной стандартной методики нами на анализ отбирался в несколько раз меньший объем жидкой пробы.
Методика определения активного хлора объемным йодометрическим титрованием. 0,5–1,0 г сухого йодистого калия вносят в коническую колбу емкостью 100 см3, растворяют его в 1–2 см3 дистиллированной воды, затем добавляют 1 см3 буферного раствора с рН равным 4,5 и 25 см3 анолита или соответствующего модельного раствора. Выделившийся йод титруют раствором тиосульфата натрия с концентрацией С(Na2S2O3) = 0,005 моль/дм3 до появления светло-желтой окраски. После чего прибавляют 1 см3 0,5 % раствора крахмала и титруют до исчезновения синей окраски.
Массовую долю активного хлора (mАХ, мг/дм3) рассчитывали по формуле
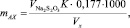
где 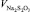
Молярную концентрацию активного хлора в анолите, САХ, моль/дм3, рассчитывали по формуле
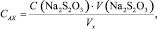
где V(Na2S2O3) – общий объем Na2S2O3, пошедший на титрование (до к.т.т.), см3; VX – объем анолита на анализ, см3.
Другой метод количественного определения активного хлора в электрохимически обработанном растворе (анолите) с различным содержанием хлористого натрия – косвенный потенциометрический метод без проведения титрования («одноточечное» ОВ-титрование), основанный на измерении двух значений окислительно-восстановительного потенциала E(I2/2I–) в обратимой (равновесной) электрохимической йод-йодидной системе с Pt-индикаторным электродом: после смешения пробы с реагентом (КI) (Е1) и после добавки дозы эталонного (фиксанального) раствора йода (Е2). Первоначальное выделение в испытуемой смеси (Е1) обусловлено реакцией активного хлора (окислитель) с йодид-ионами.
В литературе опубликованы различные варианты подобного определения для контроля остаточных количеств «активного хлора» в питьевых, производственных и сточных водах. Потенциометрическое же определение «активного хлора» в электрохимически обработанных хлоридсодержащих электролитах на основе потенциалов E(I2/2I–) до настоящей работы, по-видимому, не проводилось. Как уже отмечалось выше, обратимые потенциалы E(I2/2I–) являются к тому же важной характеристикой окислительно-восстановительных свойств электрохимически обработанной жидкости.
Согласно теоретическому анализу, проведенному в работах [3], в системе I2–KI–NaCl протекают следующие основные объемные равновесные реакции:
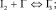
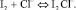
На поверхности платинового электрода локализуются электрохимические реакции:
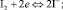
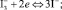
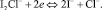
Так как указанное выделение йода в данных экспериментальных условиях происходит при значительном избытке солей NaCl и KI, концентрацию йода С(I2) в испытуемом растворе можно описать общим уравнением
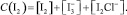
C учетом равновесий всех реакций (3)–(7) окислительно-восстановительный потенциал исследуемой системы выразим уравнением Нернста для электрохимической реакции (6). Выразив концентрацию 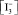
[I–] ≅ C(KI); (9)
[Сl–] ≅ C(NaCl), (10)
находим
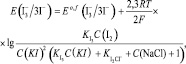
где 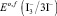
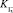

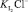
Принимая во внимание относительно высокую ионную силу испытуемого раствора из уравнения (11), получаем
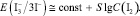
Соотношение (12) удовлетворительно согласуется с экспериментальными данными: опытная зависимость э.д.с. гальванического элемента от lg C(I2) является линейной в интервале значений С(I2) = 2•10–4–10–2 моль/дм3. Отсюда найдено среднее экспериментальное значение крутизны электродной функции S = 29,9 мВ. Таким образом, приведенные результаты подтверждают возможность применения косвенного потенциометрического метода определения активного хлора без проведения титрования в электрохимически обработанном солевом растворе.
Методика определения активного хлора электрохимически обработанной жидкости косвенно потенциометрическим методом
50 см3 раствора анолита помещают в химический стакан емкостью 100 см3, вносят 0,5 г сухого йодистого калия, после его растворения измеряют первое значение окислительно-восстановительного потенциала Е1. Затем вносят добавку 1 см3 стандартного (фиксанального) раствора йода с концентрацией С(I2) = 0,1 моль/дм3 и измеряют второе значение окислительно-восстановительного потенциала Е2. Находят разность потенциалов
ΔЕ = Е2 – Е1. (13)
Содержание активного хлора САХ, моль/дм3, рассчитывают по формуле
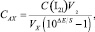
где С(I2) – концентрация фиксанального раствора йода, моль/дм3; 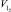
Для оценки содержания активного хлора по величине массовой доли mAX, мг/дм3, значения САХ умножаем на 0,0355.
Результаты определения активного хлора в анолите проточного двухкамерного электролизера при различных режимах электролиза методами йодометрического титрования и косвенной потенциометрии приведены в табл. 1 и 2.
Полученные результаты 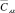
При условии 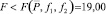
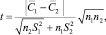
где n1 = n2 = 3, С1 и С2 – средние значения 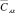
Таблица 1
Результаты определения массовой доли «активного хлора» в образцах анолита проточного двухкамерного электролизера методом йодометрического титрования (n = 3; P = 0,95; tp = 4,30)
|
№ п/п |
Условия электролиза |
|
S, мг/дм3 |
102•Sr |
|
|
I, A |
w, см3/мин |
||||
|
1 |
0,1 |
6,0 |
2,32 ± 0,33 |
0,13 |
5,60 |
|
2 |
0,1 |
25,0 |
4,35 ± 0,35 |
0,14 |
3,20 |
|
3 |
0,1 |
2,0 |
5,89 ± 0,94 |
0,38 |
6,50 |
|
4 |
0,1 |
2,0 |
7,25 ± 0,55 |
0,22 |
3,00 |
|
5 |
0,2 |
25,0 |
7,25 ± 0,55 |
0,22 |
3,00 |
|
6 |
0,2 |
25,0 |
9,29 ± 0,17 |
0,07 |
0,75 |
|
7 |
0,1 |
2,0 |
9,37 ± 0,45 |
0,18 |
1,90 |
|
8 |
0,1 |
4,0 |
9,59 ± 0,19 |
0,08 |
7,90 |
|
9 |
0,1 |
25,0 |
12,08 ± 0,07 |
0,03 |
0,25 |
|
10 |
0,4 |
4,0 |
13,03 ± 0,34 |
0,13 |
1,00 |
|
11 |
0,4 |
25,0 |
14,38 ± 0,94 |
0,38 |
2,60 |
|
12 |
0,2 |
2,0 |
18,99 ± 0,89 |
0,36 |
1,90 |
|
13 |
0,1 |
25,0 |
19,20 ± 1,51 |
0,61 |
3,20 |
|
14 |
0,4 |
2,0 |
22,28 ± 0,69 |
0,28 |
1,30 |
|
15 |
0,2 |
2,0 |
31,38 ± 1,56 |
0,63 |
2,00 |
|
16 |
0,4 |
4,0 |
44,69 ± 2,35 |
0,95 |
2,10 |
Таблица 2
Результаты определения массовой доли «активного хлора» в образцах анолита проточного двухкамерного электролизера методом косвенной потенциометрии (без титрования). Условия электролиза (табл. 1) (n = 3; P = 0,95; 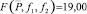
|
№ п/п |
|
S, мг/дм3 |
102•Sr |
F |
t |
|
1 |
2,54 ± 0,38 |
0,15 |
5,90 |
1,15 |
1,83 |
|
2 |
4,31 ± 1,22 |
0,49 |
1,14 |
12,00 |
0,14 |
|
3 |
5,11 ± 0,50 |
0,35 |
7,00 |
1,23 |
2,62 |
|
4 |
7,52 ± 1,74 |
0,70 |
9,30 |
9,80 |
0,64 |
|
5 |
8,86 ± 2,31 |
0,93 |
10,50 |
17,20 |
2,90 |
|
6 |
8,86 ± 2,31 |
0,93 |
10,50 |
172,00 |
0,80 |
|
7 |
9,40 ± 2,32 |
0,93 |
10,00 |
17,20 |
0,06 |
|
8 |
9,40 ± 2,32 |
0,93 |
10,50 |
143,00 |
0,35 |
|
9 |
11,36 ± 2,78 |
1,12 |
9,80 |
140,00 |
1,08 |
|
10 |
13,08 ± 4,38 |
1,76 |
13,50 |
163,00 |
0,05 |
|
11 |
14,11 ± 4,35 |
1,75 |
12,40 |
2,06 |
0,22 |
|
12 |
18,18 ± 6,63 |
2,67 |
14,70 |
16,50 |
0,53 |
|
13 |
18,18 ± 6,63 |
2,67 |
14,70 |
19,20 |
0,65 |
|
14 |
22,32 ± 9,13 |
3,67 |
16,40 |
168,00 |
0,02 |
|
15 |
30,26 ± 7,42* |
4,40 |
14,50 |
49,40 |
4,42 |
|
16 |
47,85 ± 14,82* |
8,78 |
18,30 |
86,75 |
0,62 |
Примечание. *) Р = 0,90; tp = 2,92.
При условии 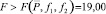
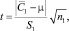
принимая, что результаты химического анализа С2 ближе всего к истинному значению концентрации m(АХ). Как следует из табл. 1, 2, условие электролиза (сила тока, скорость потока электролита) существенно не влияют на результаты определения САХ.
Заключение
Таким образом, предложенный в настоящей работе вариант косвенного потенциометрического метода определения общего содержания «активного хлора» без применения буферной системы дает вполне достоверные данные о САХ в электрохимически (анодно) обработанных хлоридсодержащих водных растворах с рН около 1,5–3,5 (образование HСl).
Данный метод может использоваться контрольно-аналитическими службами, что позволит значительно снизить трудоемкость анализа определения остаточного активного хлора и повысит чувствительность методики.
Библиографическая ссылка
Баранова Е.И. КОСВЕННЫЙ МЕТОД ОПРЕДЕЛЕНИЯ «АКТИВНОГО ХЛОРА» // Успехи современного естествознания. – 2016. – № 11-1.
– С. 9-13;
URL: https://natural-sciences.ru/ru/article/view?id=36175 (дата обращения: 15.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Тема: «Определение активного хлора в растворе хлорной извести. Хлорирование и дехлорирование воды»
Определение активного хлора в растворе хлорной извести
Принцип определения основан на вытеснении хлором хлорной извести из раствора йодистого калия эквивалентного количества свободного йода, который титруется раствором гипосульфита.
В колбу наливают 50 мл дистиллированной воды, 5 мл 1%-ного раствора хлорной извести, 1 мл 25%-ного раствора серной кислоты, 5 мл 5%-ного раствора йодистого калия и 20 капель раствора крахмала. Выделяющийся свободный йод окрашивает крахмал в синий цвет. Посиневшую жидкость титруют гипосульфитом до полного обесцвечивания.
Пример расчета: допустим, что на титрование 5 мл 1%-ного раствора хлорной извести ушло 34,5 мл 0,01 н. раствора гипосульфита.
1 мл 0,01 н. раствора гипосульфита соответствует 0,355 мг хлора,
А 34,5 мл 0,01 н. раствора гипосульфита соответствует х.
Х = 34,5 х 0,355 = 12,14 мг хлора.
1 мл 1%-ного раствора хлорной извести содержит 12,14 : 5 = 2,428 мг активного хлора.
В 1 мл 1%-ного раствора хлорной извести содержится 10 мг сухого вещества. Следовательно, в 10 мг хлорной извести содержится 2,428 мг активного хлора.
Чтобы узнать какой процент активного хлора содержится в данной извести, надо (2,428 х 100) : 10 = 24,28 %.
Хлорирование воды
Количество активного хлора, применяемое для хлорирования, зависит от степени загрязнения воды. Для хлорирования прудовой загрязненной воды мы будем применять 15 мг активного хлора из расчета на 1 л воды.
1 мл 1%-ного раствора хлорной извести содержит 2,43 мг активного хлора
Х 1%-ного раствора хлорной извести содержит 15 мг активного хлора
Х = 15 : 2,43 = 6,17 мл 1%-ного раствора хлорной извести.
В 1 л воды наливают 6,17 мл 1%-ного раствора хлорной извести, воду хорошо перемешивают и настаивают в течение 30 минут.
Дехлорирование воды
Качественное определение в воде остаточного хлора
Наличие остаточного хлора определяется по запаху и следующей реакцией: в пробирку наливают 10 мл хлорированной воды, 2-3 капли 5%-ного раствора йодистого калия и столько же крахмала. Голубое окрашивание указывает на наличие остаточного хлора.
Определение гипосульфита, необходимого для дехлорирования
В колбу наливают 100 мл хлорированной воды, 1 мл 5%-ного раствора йодистого калия, 20 капель раствора крахмала и титруют 0,01 н. раствором гипосульфита до обесцвечивания.
Предположим, что на дехлорирование 100 мл воды ушло 1,3 мл 0,01 н. раствора гипосульфита, тогда на дехлорирование 1 л воды уйдет (1,3 х 1000) : 100 = 13 мл 0,01 н. нормального раствора гипосульфита.
Дехлорирование производится сухим веществом гипосульфита.
В 1 мл 0,01 н. раствора гипосульфита содержатся 2,48 мг сухого вещества, а в 13 мл 0,1 н. раствора гипосульфита содержатся Х мг сухого вещества.
Х = 16 х 2,48 = 32,24 мг сухого вещества.
32,24 мг сухого вещества гипосульфита отвешиваются, высыпаются в воду и перемешиваются до полного растворения.
В дехлорированной воде качественно определяется остаточный хлор (методика указана выше, см. дехлорирование воды).
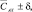 мг/дм3
мг/дм3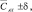 мг/дм3
мг/дм3