Первый этап в
определении первичной структуры белков
заключается в качественной и количественной
оценке аминокислотного состава данного
индивидуального белка.
Кислотный гидролиз
белка
Для определения
аминокислотного состава необходимо
провести разрушение всех пептидных
связей в белке. Анализируемый белок
гидролизуют в 6 мол/л НС1 при температуре
около 110 °С в течение 24 ч. В результате
разрушаются пептидные связи в белке, а
в гидролизате присутствуют только
свободные аминокислоты
Разделение
аминокислот с помощью ионообменной
хроматографииСмесь
аминокислот, полученных кислотным
гидролизом белков, разделяют в колонке
с катионообменной смолой.
Количественный
анализ полученных фракций.нагреваютотдельные
фракции аминокислот с нингидрином,
образующим соединение красно-фиолетового
цвета. Интенсивность окраски в пробе
пропорциональна количеству находящейся
в ней аминокислоты.
2. Определение аминокислотной последовательности в белке
Определение
N-концевой аминокислоты в белке и
последовательности аминокислот в
олигопептидах
Изучение первичной
структуры белков имеет важное
общебиологическое и медицинское
значение. Изучая порядок чередования
аминокислотных остатков в индивидуальных,
можно выявить общие фундаментальные
закономерности формирования
пространственной структуры белков.многие
генетические болезни – результат
нарушения в аминокислотной последовательности
белков. Информация о первичной структуре
нормального и мутантного белка может
быть полезна для диагностики и
прогнозирования развития заболевания.
Установление первичной
структуры белков включает 2 основных
этапа:
определение
аминокислотного состава изучаемого
белка;
аминокислотной
последовательности в белке.
Например,
при серповидноклеточной
анемии
в шестом положении β-цепи гемоглобина
происходит замена глутаминовой
кислоты
на валин.
Это приводит к синтезу гемоглобина S
(HbS)
– такого гемоглобина, который в
дезоксиформеполимеризуется и образует
кристаллы. В результате эритроциты
деформируются, приобретают форму серпа,
теряют эластичность и при прохождении
через капилляры разрушаются. Это в итоге
приводит к снижению оксигенации тканей
и их некрозу.
Последовательность
и соотношение аминокислот в первичной
структуре определяет формирование
вторичной,
третичной
и
четвертичной
структур.
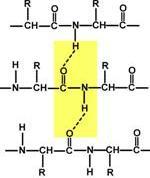
8. Вторичная
структура белка–пространственная
структура, образующаяся в результате
взаимодействий между функциональными
группами, входящими в состав пептидного
остова.регулярные структуры двух типов:
а-спираль и б-структура.
Вторичная
структура образуется только при
участии водородных связеймежду
пептидными группами: атом кислорода
одной группы реагирует с атомом водорода
второй, одновременно кислород второй
пептидной группы связывается с водородом
третьей и т.д.
α-Спираль
пептидный
остов закручивается в виде спирали за
счёт образования водородных связей
между атомами кислорода карбонильных
групп и атомами азота аминогрупп.
Водородные связи ориентированы вдоль
оси спирали. На один виток а-спирали
приходится 3,6 аминокислотных остатка.
В
образовании водородных связей участвуют
практически все атомы кислорода и
водорода пептидных групп. В результате
?-спираль “стягивается” множеством
водородных связей. связи относят к
слабых, их количество обеспечивает
максимально возможную стабильность
?-спирали. гидрофильность ?-спиралей
уменьшается, а их гидрофобность
увеличивается.
?-Спиральная структура
– наиболее устойчивая конформация
пептидного остова, отвечающая минимуму
свободной энергии. В результате
образования ?-спиралей полипептидная
цепь укорачивается.
Радикалы аминокислот
находятся на наружной стороне ?-спирали
и направлены от пептидного остова в
сторонынекоторые из них могут нарушать
формирование ?-спирали. К ним относят:
пролин. Его атом
азота входит в состав жёсткого кольца,
что исключает возможность вращения
вокруг -N-CH- связи. Кроме того, у атома
азота пролита, образующего пептидную
связь с другой аминокислотой, нет атома
водорода. В результате пролин не способен
образовать водородную связь в данном
месте пептидного остова, и ?-спиральная
структура нарушается. Обычно в этом
месте пептидной цепи возникает петля
или изгиб;
участки, где
последовательно расположены несколько
одинаково заряженных радикалов, между
которыми возникают электростатические
силы отталкивания;
участки с близко
расположенными объёмными радикалами,
механически нарушающими формирование
?-спирали, например метионин, триптофан
β-Складчатый слойСтруктура
формируется за счёт образования множества
водородных связей между атомами пептидных
групп линейных областей одной полипептидной
цепи, делающей изгибы, или между разными
полипептидными цепями, ?-Структура
образует фигуру, подобную листу,
сложенному “гармошкой”
Когда водородные связи образуются между
атомами пептидного остова различных
полипептидных цепей, их называют
межцепочечными связями. Водородные
связи, возникающие между линейными
участками внутри одной полипептидной
цепи, называют внутрицепочечными. В
?-структурах водородные связи расположены
перпендикулярно полипептидной цепи.
Если
связанные полипептидные цепи направлены
противоположно, возникает антипараллельная
?-структура, если же N- и С-концы полипептидных
цепей совпадают, образуется структура
параллельного ?-складчатог
9.
Третичная структура
– это укладка полипептидной цепи в
глобулу (“клубок”). Четкой границы
между вторичной и третичной структурами
провести нельзя, в основе третичной
структуры лежат стерические взаимосвязи
между аминокислотами, отстоящими далеко
друг от друга в цепи. Благодаря третичной
структуре происходит еще более компактное
формирование цепи. В стабилизации
третичной структуры белка принимают
участие:
ковалентные
связи(между двумя остаткамицистеина—дисульфидные
мостики);
ионные
связимежду противоположно заряженными
боковыми группами аминокислотных
остатков;
водородные
связи;
гидрофильно-гидрофобныевзаимодействия. При взаимодействии с
окружающими молекулами воды белковая
молекула «стремится» свернуться так,
чтобы неполярные боковые группы
аминокислот оказались изолированы от
водного раствора; на поверхности молекулы
оказываются полярныегидрофильныебоковые группы.
Связь с
первичной структурой. Третичная
структура в значительной степени
предопределенапервичной
структурой. Усилия по предсказанию
третичной структуры белка основываясь
на первичной структуре известна как
задачапредсказания
структуры белка. Однако, окружающая
среда, в которой белок сворачивается
существенно определяет конечную форму,
но обычно непосредственно не принимается
во внимание текущими методами предсказания.
Большинство таких методов полагаются
на сравнения с уже известными структурами,
и таким образом включают окружающую
среду косвенно. Супервторичная
структура белков. сравнение конформаций
разных по структуре и функциям белков
выявило наличие у них похожих сочетаний
элементов вторичной структуры. Такой
специфический порядок формирования
вторичных структур называют супервторичной
структурой белков.она формируется за
счёт межрадикальных взаимодействий.
Определённые
характерные сочетания а-спиралей и
б-структур часто обозначают как
“структурные мотивы”.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- ГЛАВНАЯ >
- ПРЕДМЕТЫ >
- БИОЛОГИЧЕСКАЯ ХИМИЯ >
- МЕТОДЫ ИССЛЕДОВАНИЯ АМИНОКИСЛОТНОГО СОСТАВА И АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ БЕЛКОВ И ПЕПТИДОВ. СРАВНИТЕЛЬНЫЙ АНАЛИЗ ГОМОЛОГИЧНЫХ БЕЛКОВ
Методы исследования аминокислотного состава и аминокислотной последовательности белков и пептидов. Сравнительный анализ гомологичных белков
Без воды — краткий вариант ответа,
легко понять и
запомнить
Качественный и количественный анализ аминокислотного состава белка
-
Гидролиз:
-
кислотный (HCl);
-
щелочной [Ва(ОН)2];
-
ферментативный.
-
-
Ионообменная хроматография:
-
катионообменники (карбоксиметилцеллюлоза);
-
анионообменники (диэтиламиноэтилцеллюлоза).
-
При значениях рН буфера ниже ИЭТ, белок имеет положительный заряд и адсорбируется на катионообменнике и наоборот.
Определение N-концевой АК
-
Метод Сенджера (присоединение к ФДНБ N-концевой аминокислоты).
-
Метод Эдмана (ФИТЦ) – фенилизотиоцианат взаимодействует с N-концевой группой в слабощелачной среде. Далее происходит отщепление только N-концевой аминокислоты с сохранением остальной части полипептидной цепи.
-
Взаимодействие N-концевой АК с дансилхлоридом с образованием флуоресцирующего соединения.
-
Ферментативный метод (использование аминопептидаз — это ферменты которые избирательно отщепляют N-концевые АК, например, аланиновая аминопептидаза).
-
Метод с использованием флуорескамина.
-
Аминопептидазы.
Определение C-концевой АК
-
Метод Акабори (гидразин разрушает все пептидные связи и реагирует со всеми АК, кроме концевой; концевую АК определяют после обработки смеси ФДНБ).
-
Ферментативный метод (карбоксипептидазы А отщепляют ароматические С-концевые АК, карбоксипептидазы В — основные С-концевые АК).
Избирательный гидролиз
-
Ферментативный метод (трипсин разрушает пептидные связи, образованные остатками основных кислот, а химотрипсин – ароматических аминокислот).
-
Химический метод (цианоген бромид разрушает пептидные связи, образованные остатками мет).
Определение последовательности аминокислот в пептидах
-
Секвенирование (секвенатор Эдмана-Бэга).
(Метод Ингрэма, метод пептидных карт, метод «отпечатков пальцев»)
Гомологичные белки выполняют одну и ту же функцию, но различаются по первичной структуре.
Метод сочетает в себе хроматографию (х/г) и электрофорез (э/ф) на бумаге продуктов неполного гидролиза сравниваемых белков.
Этапы:
-
Анализируемые белки расщепляются на пептиды.
-
Смесь пептидов каждого белка наносят на угол листа х/г бумаги.
-
Проводят э/ф в горизонтальном направлении.
-
Проводят распределение х/г в вертикальном направлении.
-
Полученные карты окрашивают и сравнивают.
-
Различающиеся пептидные пятна выделяют, анализируют их первичную структуру в секвенаторе.
Использование пептидных карт позволяет анализировать не всю молекулу белка, а только те фрагменты, которые различаются между собой.
Теперь на ZNZN можно делать свои конспекты
Легко создавать, делиться и просматривать с устройств
Доступно в ПК-версии сайта
Определение – аминокислотный состав
Cтраница 1
Определение аминокислотного состава пептида проводится после полного гидролиза вещества, в ходе которого все пептидные связи разрушаются, и пептид превращается в смесь аминокислот, составлявших его. Полученный гидролизат подвергают количественному анализу с помощью ионообменной хроматографии и таким образом устанавливают, какие аминокислоты и в каких соотношениях входят в исследуемый пептид.
[1]
Определение аминокислотного состава белка препаратов показало, что предлагаемый нами способ обезжиривания и денуклеинизации дрожжевой биомассы существенно не снижает аминокислотный скор белка. Исследована сорбционная способность белково-углеводных концентратов из хлебопекарных дрожжей по отношению к патогенной и условно патогенной микрофлоре, входящей в состав микробных биоценозов толстого и тонкого кишечника, и к тяжелым металлам. Полученные данные позволяют рекомендовать белко-во-углеводные концентраты для введения в пищевые продукты лечебно-профилактического назначения. Проведено определение содержания тяжелых металлов в этих концентратах, позволившее установить отсутствие свинца, кадмия, ртути и мышьяка, которые являются токсичными. Полученные значения функциональных свойств белково-углеводных концентратов ( растворимость, водосвязывающая и жирос-вязывающая способности) делают возможным их применение в качестве биологически активных добавок в хлебобулочных изделиях. Составлены рецептуры хлеба и пищевых крупяных концентратов с повышенной пищевой ценностью на основе полученных добавок. Проведенные опытные выпечки хлеба показали, что качество хлебобулочных изделий, приготовленных с добавлением 5 и 10 % полученных БАД, по основным орга-нолептическим и физико-химическим показателям соответствует требованиям, предъявляемым к данным видам изделий.
[2]
Если определение аминокислотного состава белка может быть в настоящее время проведено относительно быстро, то выяснение последовательности соединения аминокислотных остатков – задача исключительно сложная. Сочетанием из двух и трех букв на рисунке условно обозначаются остатки аминокислот. Черным показаны дисульфидные связи.
[3]
Для определения аминокислотного состава белка применяют различные физико-химические методы, например распределительную хроматографию и ионообменную хроматографию. Распределительная хроматография на бумаге имеет преобладающее значение. Длительное и сложное определение аминокислотного состава гидролизатов сейчас автоматизировано: по графику на ленте автомата находят абсолютное содержание аминокислот.
[4]
Однако определение аминокислотного состава белков дает лишь одностороннюю их характеристику.
[5]
Методика определения аминокислотного состава белков и условия их лабораторного получения из семян масличных к льгур – Обзор научно-исследовательских работ по масличным культурам.
[6]
Однако с определения аминокислотного состава изучение белка только начинается. Можно подсчитать, что сравнительно простой белок, построенный из 20 остатков разных аминокислот, может за счет различного порядка их чередования иметь 2 – 1018 изомеров.
[7]
Из результатов определения аминокислотного состава римопротелина и свиной панкреатической эластазы можно отметить, что оба фермента содержат большое количество гидрофобных аминокислот, которые составляют около 40 % от общего количества аминокислотных остатков в этих ферментах. В эластазе римопротелина по сравнению со свиной эластазой содержится в пять раз больше лизина и в два раза меньше полуцистина. Молекула эластазы римопротелина содержит только четыре остатка полуцистина, которые, по-видимому, образуют два дисульфидных мостика.
[8]
Из результатов определения аминокислотного состава фракций аминокислот и фракций пептидов, полученных после гидролиза протофра-дином казеина, альбумина и эластина, можно отметить следующее: после 72-часового протеолиза альбумина во фракции аминокислот не найден гистидин, обнаружено относительно небольшое количество тирозина и много лизина; во фракции аминокислот после 48-часового протеолиза казеина содержится весь полуцистин, очень небольшая часть глицина и полностью отсутствуют аспарагинрвая и глютаминовая кислоты, которые, как известно, образуют с Си2 1 отрицательно заряженные комплексы и потому могут элюироваться не во фракции аминокислот, а в одной из пептидных фракций. После 24-часового действия протофрадина на эластин во фракции аминокислот отсутствовали пролин, треонин, серии, глютаминовая кислота, которые полностью находились во фракции пептидов. Нейтральные аминокислоты с алифатическими цепями ( глицин, аланин, валин), на долю которых в эластине приходится около 70 % общего количества аминокислот, в основном также остаются во фракции пептидов; во фракции аминокислот найдено только около 5 % общего количества глицина, 14 % лизина и 30 % валина. В то же время большая часть тирозина и лизина обнаружена во фракции аминокислот. Такое распределение аминокислот по фракциям, не наблюдавшееся при гидролизе казеина и альбумина сои, по всей вероятности, зависит как от специфичности протеиназ протофрадина, так и от особенностей строения и аминокислотного состава эластина.
[9]
Установление первичной структуры начинается с определения аминокислотного состава и молекулярной массы выделенного и очищенного белка. Белки, состоящие из нескольких полипептидных цепей, разделяются с помощью денатурирующих реагентов ( концентрированный раствор мочевины или ДСН) на мономеры. Дисульфидные мостики расщепляют восстановлением меркаптоэтанолом. Для предотвращения дисульфидного обмена и окисления образующихся свободных меркаптогрупп их блокируют каким-либо методом, например алкилированием иодуксусной кислотой с образованием S-карбоксиметильного производного или цианэтилированием акри-лонитрилом. После определения N – и С-концевых аминокислот полипептидная цепь расщепляется химически или ферментативно ( в нескольких вариантах) на меньшие перекрывающиеся фрагменты. Для каждого фрагмента устанавливается аминокислотная последовательность. И наконец, комбинируя отдельные последовательности, приходят к полной последовательности исходной полипептидной цепи.
[10]
Кроме этой теоретической задачи, определение аминокислотного состава белков крайне важно для установления пищевой и кормовой ценности сельскохозяйственных продуктов. Часть аминокислот не может синтезироваться в животном организме, и такие аминокислоты человек и животные должны получать с пищей и кормом.
[11]
Что касается весьма распространенных методов определения аминокислотного состава с помощью хроматографии на бумаге ( БХ) [12] и хроматографии в тонком слое силикагеля ( ТСХ), то ими при исследовании пищевых продуктов для получения количественных данных пользоваться не рекомендуется, поскольку они не могут обеспечить необходимой точности анализа. При составлении настоящих таблиц данные, полученные этими методами, не использовались.
[12]
Изучение химического строения белка начинают с определения аминокислотного состава. Для этого проводят полный кислотный гидролиз белка с последующим разделением и идентификацией аминокислот гидролизата. С развитием методов хроматографии эта задача решается достаточно просто.
[13]
Изучение химического строения белка начинают с определения аминокислотного состава. С этой целью проводят полный кислотный гидролиз белка с последующим разделением и идентификацией аминокислот гидролизата. С развитием методов хроматографии эта задача решается достаточно просто.
[15]
Страницы:
1
2
3
4
ОПРЕДЕЛЕНИЕ ОБЩЕГО БЕЛКА
В настоящем справочнике под словом “белок” понимается количество общего азота, определенного по Кьель- далю, умноженное на соответствующий коэффициент пересчета, указанный в таблицах. Следует иметь в виду, что метод Кьельдаля позволяет выделять азот в виде аммиака только из аминов и их производных. Некоторые азотсодержащие соединения (нитро-, нитрозо-, азо-соединения и др.) в этих условиях образуют наряду с аммиаком также молекулярный азот, что приводит к получению заниженных данных [22]. Действительно, определение азота по методу Дюма, который не обладает подобным недостатком в некоторых пищевых продуктах, даст завышенные на 1-5% данные по общему азоту по сравнению с методом Кьельдаля.
Однако, несмотря на это, метод Кьельдаля нашел широкое применение в биохимии и при анализе пищевых продуктов. Метод относительно прост, легко поддается автоматизации и, главное, в руках опытного аналитика хорошо воспроизводим (до 1% отн.).
Метод Кьельдаля наиболее подробно описан в классическом руководстве Бредстрита [19) г где приводятся данные по влиянию различных факторов на точность и длительность анализа. В настоящее время процедура определения общего азота по Кьельдалю стандартизирована в международном масштабе [6,10,11] .
Хотя описание метода вошло в стандарты и во все руководства по технохимическому контролю пищевых продуктов, работы по уточнению некоторых его деталей продолжаются. Так, в работе [20] уточнено количество серной кислоты при сжигании пищевого продукта (4 мл на 1 г углеводов, 5 мл на 1 г белков и 10 мл на 1 г жиров продукта).
Для ускорения определения аммиака используется его фотометрическое определение с реактивом Неслера [9], а для массовых анализов аммиак определяют в чашках Конвея [2]. По-видимому, возможны и другие вариации основного метода. Однако безусловным требованием является предварительная проверка их на известной аминокислоте или нескольких аминокислотах {13] .
ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОГО СОСТАВА
Аминокислотный состав пищевых продуктов определяется в настоящее время исключительно с помощью ионообменной хроматографии. Методы бумажной, тонкослойной хроматографии, микробиологические, газохроматографические и ряд других [I, 2] в настоящее время практически не используются вследствие худшей воспроизводимости и большой длительности. Современные хроматографы позволяют определять аминокислотный состав с воспроизводимостью до 5 % отн. за 2-4 ч.
Однако данные по аминокислотному составу однотипных продуктов, полученных в разных лабораториях по отдельным аминокислотам, иногда различаются до 50 %.
Эти различия объясняются не только сортовыми, видовыми или технологическими различиями, а главным образом условием проведения гидролиза пищевого продукта. При стандартном кислотном гидролизе (6н. НС1, 110-120° С, 22-24 ч) происходит частичное разрушение некоторых аминокислот, в том числе треонина, серина (на 5-10%) и особенно метионина (30-60%) и цистина 56-60% (см., например, работу [14]), а также практически полное разрушение триптофана [16]. Этот процесс усиливается в присутствии больших (более 50% на сухую массу) количеств углеводов в продукте. Несколько уменьшить это разложение можно за счет более сильного разбавления образца серной кислотой (например, вместо 100 мг белка берут 2-5 мг), но границы этого разбавления определяются чувствительностью прибора и в большинстве случаев они не могут быть очень большими. Для количественного определения метионина и цистина рекомендуется проводить предварительное окисление их надмуравьиной кислотой [14, 24]. При этом цистин превращается в цистеиновую кислоту (цветовой выход 1,75), а метионин – в метионин – сульфон (цветовой индекс – 0,8), которые весьма устойчивы при последующем кислотном гидролизе. Окисление проводится по методике, описанной в работах [12, 14], при температуре 4°С в темноте в течение 1-10 ч из расчета 1 мл надмуравьиной кислоты на 2-5 мг белка. Немедленное и тщательное удаление надмуравьиной кислоты после окончания гидролиза (например, в роторе или вакуум-эксикаторе над NaOH) предотвращает потери.
Трудной задачей в аминокислотном анализе является определение триптофана. Как указывалось выше, при кислотном гидролизе происходит почти полное (на 80-90%) его разрушение. Поэтому для определения триптофана проводят один из вариантов щелочного гидролиза, в т. ч. 2 н. NaOH, 100 °С, 16-18 ч в присутствии 5 % хлорида олова или 4 н. Ва(ОН)2, при которых он разрушается незначительно (до 10%). Минимальное разрушение происходит в присутствии тиогликолевой киряоты или предварительно гидролизов энного крахмала [24]. Гидролизах после соответствующей нейтрализации смесью лимонной и соляной кислот немедленно (во избежание студнеобразования) анализируют на аминокислотном гидролизаторе.
Существуют и другие методы выделения триптофана из чистых белков, в том числе: гидролиз меркаптоэтанолсульфоновой кислотой (27), гидролиз продуктов с Р-толуолсуль фонов ой кислотой, содержащей 3-(2-аминоэтил) -индол; гидролиз 6 н. НС1, содержащей 5 % тиогликолевой кислоты. Описан также ферментный гидролиз с папаином в присутствии 8 М мочевины, 0,005 М тиогликолата, 002 М трилона Б, 0,1 М бората натрия; рН 7,6 [25] Однако подобный гидролиз не дает полного высвобождения триптофана из белков [26].
Что касается многочисленных химических методов определения триптофана [27], то они, как правило, в пищевых продуктах плохо воспроизводимы и поэтому их использовать не рекомендуется.
Для мясных продуктов дополнительной необходимой аминокислотой является оксипролин, который характеризует количество соединительных тканных белков в мясе. Его можно определять ионообменной хроматографией с помощью автоматических анализаторов или химическим колориметрическим методом [13, 15, 23]. Метод основан на нейтрализации кислотного гидролизата до рН 6,0, последующем окислении оксипролина с помощью 1,4% раствора хлорамина Т (или хлорамина Б) в смеси пропилового спирта и буфера и колориметрическом определении при 553 нм продуктов окисления оксипролина после реакции с 10 %-ным раствором шра-диметиламинобензальдегида в смеси хлорной кислоты и пропилового спирта (1:2).
В связи с тем, что тирозин, фенилаланин и пролин в присутствии кислорода могут частично окисляться, стандартный кислотный гидролиз рекомендуется проводить в атмосфере азота [26] .
Следует также учесть, что ряд аминокислот, в том числе лейцин, изолейцин и валин, требуют для своего полного выделения из белков более длительного кислотного гидролиза – до 72 ч.
Поэтому кислотный гидролиз рекомендуют проводить 24, 48, и 72 ч [24], а затем осуществлять интерполяцию на максимальную величину.
Для точного количественного определения всех аминокислот требуется проводить 5 различных гидролизов, что весьма удлиняет определение. Обычно же проводят 1-2 гидролиза (стандартный с соляной кислотой и с предварительным окислением надмуравьиной кислотой).
Во избежание потерь аминокислот удаление избытка кислоты при кислотном гидролизе следует проводить немедленно [1] многократным выпариванием в вакуум-эксикаторе с добавлением деионизированной воды. Следует иметь в виду, что в белках аспарагиновая и глутаминовая кислоты присутствуют в виде амидов, а при кислотном гидролизе происходит их полное выделение из амидов в виде соответствующих аминокислот [8].
При сравнении результатов анализов одних и тех же продуктов по одной и той же методике гидролиза также наблюдаются заметные различия. Вариабельность аминокислотного состава в этих случаях может быть вызвана особенностью конструкции оптической схемы анализатора, нестабильностью состава фирменных растворов стандартов аминокислот и множеством других причин, часть которых указана в литературе [4]. Как правило, это характерно для отдельных аминокислот. Поэтому периодически следует пропускать через анализатор несколько стандартов разных фирм и в сомнительных случаях целесообразно готовить стандартную смесь самостоятельно из чистых аминокислот (для получения однородной смеси ее сначала растворяют, а затем высушивают сублимацией).
При исследовании высокобелковых продуктов отмечалась меньшая вариабельность данных по аминокислотному составу [12] . Из них наименьшей вариабельностью обладает яичный белок [18], коэффициент вариации аминокислотного состава этого продукта у разных исследователей отличается не более чем на 5-10 %.
Поэтому при изучении продуктов животного происхождения для проверки правильности работы рекомендуется периодически проводить анализ яичного белка и сравнивать его с данными, приведенными в настоящем справочнике. При изучении растительных продуктов рекомендуется определять аминокислотный состав стандартного образца пшеницы и сравнивать его с паспортными данными.
При правильной работе анализатора ионообменные колонки работают без замены смолы довольно долго (годы). Однако, если образцы содержат заметные количества красящих веществ и липидов, то колонка быстро забивается и для восстановления ее разделительных способностей требуется многократная регенерация, иногда с перенабивкой колонки.
Поэтому для продуктов, содержащих более 5 % жира (в пересчете на сухие вещества) рекомендуется предварительно удалять липиды экстракцией серным эфиром. Обычно достаточна 2-5-кратная экстракция (в любом экстракторе) гомогенизированного препарата в отношении от 1:5 до 1:10. Использование для удаления липидов этилового спирта, метанола, ацетона, хлороформа или их смесей не рекомендуется, так как в экстракт может перейти часть свободных аминокислот и некоторых фракций белков, что приведет к неправильному представлению об аминокислотном составе продукта.
При анализе сильноокрашенных соков и напитков красящие вещества удаляют обработкой солями свинца или поливинилпирролидоном.
При анализе продуктов повышенной влажности (более 50%) рекомендуется предварительно удалить излишнюю воду как можно более мягким способом (сублимацией, подсушиванием и т. д.).
Если раствор нингидрина недостаточно устойчив, следует через каждые 3-4 анализа прогонять стандартные растворы аминокислот и использовать “внутренний” стандарт, который позволяет дополнительно учитывать ошибки при подготовке проб и проведении гидролиза. В качестве внутреннего стандарта часто используется норлейцин [16]. В случае отсутствия азота для вытеснения кислорода перед гидролизом следует предварительно заморозить смесь в ампуле, откачать под вакуумом из нее воздух и запаять подготовленную таким образом ампулу [ 16, 24].
Продукты относительно богатые белком представляют интерес с точки зрения содержания в них нуклеиновых кислот. Их определение производят по методу, описанному А. С. Спириным [5, 17] .
ВЫЧИСЛЕНИЕ АМИНОКИСЛОТНОГО СКОРА
Биологическая ценность белков пищевых продуктов определяется разными методами, одним из которых является сравнение состава незаменимых аминокислот этого белка с соответствующим аминокислотным составом “идеального” белка. В качестве “идеального” было предложено использовать белок куриного яйца [18], коровьего или женского молока. В настоящее время большинство исследователей используют в качестве “идеального” гипотетический (теоретический) белок, рекомендованный ФАО и ВОЗ в 1973 г. [24] . В 1 г такого белка содержится следующее количество незамешмых аминокислот (в мг) :
Для определения аминокислотного скора какого-либо продукта сначала вычисляют содержание аминокислот в 1 г белка этого продукта. Затем последовательно сравнивают содержание той или иной незаменимой аминокислоты с вышеуказанной стандартной шкалой ФАО/ВОЗ. Лимитирующими являются те незаменимые аминокислоты, скор которых меньше 100 %.
Пример. В 1 г исследуемого белка продукта содержится (в мг): изолейцина – 45, лейцина – 75, лизина – 40, метионина и цистина (в сумме) – 25, фенилаланина и тирозина (в сумме) – 70, треонина – 38, триптофана –11, валина – 50. При сравнении со стандартной шкалой находим, что скоры (в %) соответственно равны: ИЗ, 107, 73, 71, 95, 113, 100.
Следовательно, лимитирующими аминокислотами в данном продукте являются лизин (скор 73 %), сумма метионина и цистина (скор 71 %) и треонин (скор 95 %).
Обычно в справочных таблицах химического состава пищевых продуктов указывают 1 или 2 лимитирующие аминокислоты. В связи с тем, что точность аминокислотного анализа, как отмечалось выше, составляет примерно 5 % отн., то величина скора 95 % и выше приравнивается к 100 % и в настоящем издании таблиц (как и в предыдущем) в подобных случаях в соответствующей графе о наличии лимитирующей аминокислоты ставится слово “Нет”. Поэтому в вышеуказанном примере в таблицах должны быть указаны только две лимитирующие аминокислоты – метионин + цистин (скор 71 %) и лизин (скор 73 %).
В настоящем справочнике для всех продуктов, где приводится аминокислотный состав, одновременно указывается коэффициент пересчета азота на белок. Точно установить его чрезвычайно сложно. Более точно он определен для ограниченного числа продуктов. Для большинства же условно принят коэффициент пересчета 6,25. Эта условность вносит иногда кажущееся противоречие между содержанием белка и суммой аминокислот в таблицах. Если фактически коэффициент ниже условного, например 5,30, а пересчет сделан на условный (6,25), то получится завышенное количество белка в продукте и сумма определенных аминокислот может быть меньше данных по содержанию белка в соответствующей графе таблиц. С другой стороны, если фактический коэффициент (например, 6,38) выше условного, то сумма определенных аминокислот может быть выше табличных данных по белку.
К вышеуказанному следует добавить, что сравнение данных по белку и сумме аминокислот осложняется еще двумя обстоятельствами. Первое – это то, что в таблицах, как правило, приводятся данные, полученные на аминокислотных анализаторах по результатам исследования кислотных гидролнзатов продуктов, т. е. после присоединения к аминокислотным остаткам в белке воды. Следовательно, для сравнения суммы аминокислот с содержанием белка необходимо отнять от аминокислот присоединившуюся воду, количество которой варьирует в зависимости от природы аминокислоты.
Второе обстоятельство – наличие в продуктах других аминокислот, кроме указанных в таблицах. Действительно, абсолютное большинство белков состоит из 16 аминокислот и 2 амидов (аспарагина и глю- тамина). Именно они и представлены в таблицах. В высокобелковых продуктах животного и растительного происхождения белки представляют до 90-95 % азотистых веществ. А в низкобелковых продуктах, таких, как овощи, фрукты, ягоды, белки представляют только часть азотистых веществ (например, в винограде 7 %, в картофеле 30 %, капусте 40%). Остальную часть азотистых веществ представляют разнообразные полипептиды, главным образом (20-40 %), свободные аминокислоты. Состав свободных аминокислот в отличие от состава белка сильно варьирует, и в продукте могут в заметных количествах встретиться аминокислоты, не указанные в таблицах (например, ץ-амино- масляная кислота в винограде и продуктах его переработки). В результате в настоящих справочных таблицах для ряда низкобелковых продуктов сумма аминокислот не полностью отражает их фактический аминокислотный состав и может быть меньше данных, представленных в графе, где приведено содержание белка.
Учитывая важность более точного определения аминокислотного состава продуктов, коэффициентов пересчета азота на белок и способов выражения результатов аминокислотного анализа, проведение дальнейших методических работ в этой области весьма актуально.
* * *
Важным является также вопрос о вариабельности данных по содержанию белка и аминокислот в пищевых продуктах. На основании материалов, поступивших из отраслевых подкомиссий МВК нами были обобщены данные по вариабельности содержания белков и аминокислот в пищевых продуктах [12]. Вариабельность содержания белка зависит от природы продукта. В животных продуктах коэффициент вариации (относительное среднеквадратичное отклонение) равен 5-10%, для растительных (зерно, бобовые, фрукты) 15-20%. При этом внут- рилабораторная методическая ошибка сходимости (внутрилаборатор ный коэффициент вариации) при определении азота по Кьельдалю, как отмечалось выше, не превышает 1 %. Межлабораторная воспроизводимость (межлабораторный коэффициент вариации) не превышает 2– 3 % (в низкобелковых продуктах выше). Таким образом, общая вариабельность в содержании белка в основном отражает сортовые и видовые особенности продукта, условия выращивания и другие трудноучитываемые причины.
Аминокислотный состав продуктов колеблется значительно шире, чем белковый.
Кроме вариабельности в содержании непосредственно белков, что в той или иной степени отражается на содержании аминокислот, имеет большое значение видовая или сортовая вариабельность аминокислот одного и того же продукта. Кроме того, в отличие от метода определения белков метод определения аминокислот дает значительно большой вклад в общую вариабельность аминокислотного состава. Выше были подробно рассмотрены причины расхождений в аминокислотном анализе, в том числе проведение одного гидролиза вместо пяти, отсутствие анализа стандартных образцов продукта и внешнего стандарта и т. д. В результате в высокобелковых продуктах (мясо, рыба, птица, зерно и зернобобовые) при определении лизина, лейцина, изолейцина, треонина, валина, аргинина, глицина, пролина, серина, гистидина, аспарагиновой и глутаминовой кислот, фенилаланина, аланина, тирозина, общий коэффициент вариации (относительное среднеквадратичное отклонение) равен 10%, при определении метионина – 15 %, триптофана и цистина – 25 % [12]. Для низкобелковых (овощи и фрукт) вариабельность значительно выше – 20, 25 и 30% соответственно [12]. Эти расчеты хорошо совпадают с прямыми экспериментальными данными по межлабораторному испытанию определения состава аминокислот ряда высокобелковых продуктов (казеин, белок яиц, соя, мясо, мука) [28]. Для большинства аминокислот межлабораторный коэффициент вариации находился в пределах 5–10% отн., для цисти – на 11,0-17,6%, метионина – 4,0-16,1%, а для триптофана – 14,3-23,7 %. Следует указать, что на повышенную вариабельность аминокислотного состава низкобелковых продуктов оказывает также влияние то, что аминокислотный состав в них представлен в основном свободными аминокислотами, состав и содержание которых весьма изменчивы. Что касается вариабельности аминокислотного скора, то она значительно (примерно в 2 раза) меньше, поскольку он рассчитывается из расчета на 1 г белка и поэтому колебание на содержание белка в продукте на его величину не влияет.
ДНФ-фр акцию, полученную из смесей с известным количеством белка или пептида, хроматографируют вместе с определенным количеством контрольных ДНФ-аминокислот, после чего ДНФ-аминокислоты элюируют из бумаги и определяют их содержание фотометрически по калибровочной кривой, построенной для ДНФ-аминокислот. Таким способом можно определить концевые группы белков и пептидов, число полипептидных цепей белков, минимальный молекулярный вес белков и аминокислотный состав белковых гидролизатов. [c.272]
Растворимые белки монодисперсны, т. е. имеют строго определенный аминокислотный состав и чередование отдельных остатков аминокислот. [c.336]
В виде этих же производных на колонке с неподвижной жидкой фазой OV-225 на хромосорбе G-HP был определен аминокислотный состав гликопротеидов и белка мембран эритроцитов [54]. [c.51]
При выборе методов установления аминокислотной последовательности полипептидов предпочтительность метода зависит от свойств пептида или белка (растворимость, аминокислотный состав, длина цепи). Выбор метода анализа обусловлен также доступностью изучаемого материала и чувствительностью определения отщепленных производных. [c.401]
Аминокислотный состав белков. — Анализ гидролизата белков, содержащего до двадцати различных аминокислот (см. табл. 39), является чрезвычайно сложной задачей. Риттенберг (1940) разработал метод изотопного разбавления, согласно которому радиоактивную кислоту определенной удельной активности, например меченую глутаминовую кислоту, добавляют в известном количестве к анализируемой смеси, после чего выделяют глутаминовую кислоту обычным образом. Так как химические свойства природной и меченой кислоты одинаковы, то выделяемое вещество является смесью добавленной аминокислоты и первоначально присутствовавшей в пробе. Количество кислоты в гидролизате вычисляют по изотопному составу выделенной кислоты. Если добавляется рацемическая меченая кислота, то аминокислоты гидролизата перед выделением рацемизуют или же из выделенного рацемата отделяют чистую -форму. Точность анализа не зависит от метода выделения, выхода кислоты или концентрации ее в гидролизате. [c.655]
Определение точного аминокислотного состава является первичным обязательным моментом при изучении строения молекулы белка. Без такого определения прежде всего оказалось бы невозможным установление последовательности аминокислотных остатков в пептидной цепи. Помимо этого изучение аминокислотного состава белков позволяет сделать некоторые заключения о реакционной способности белковой молекулы. В табл. 5 представлен аминокислотный состав ряда белков. В графе А указано содержание аминокислот в %, в графе В — в грамм-молях на 10 г белка. Такой подсчет позволяет сопоставлять аминокислотный состав различных белков. В зависимости от содержания в белках аминокислот с различными функциональными группа.ми (кроме а-СООН и г,-NH2), в них могут преобладать кислые или основные, полярные или липотропные группы. [c.482]
Активный, нли каталитический, центр фермента — это сравнительно небольшой участок молекулы белка. Аминокислотный состав остальной части молекулы, особенно тех ее участков, которые находятся на поверхности структуры, может довольно сильно меняться в результате мутаций без изменения каталитической активности фермента. Тем не менее присоединение к различным участкам поверхности фермента других молекул может косвенно повлиять на катализ. В концентрированных растворах, каким является цитоплазма, молекулы могут агрегировать. Присоединение какой-либо молекулы к определенному участку на поверхности фермента способно изменить его структуру и в свою очередь вызвать увеличение или уменьшение каталитической активности. Так, при избыточном накоплении продукта какого-либо метаболического пути ингибитор, действующий по принципу обратной связи, взаимодействует указанным образом с ферментами и выключает их. Взаимодействия такого рода составляют один из распространенных способов регуляции. [c.64]
Для определения питательной ценности был установлен аминокислотный состав белков клубней, наиболее важных с агрономической точки зрения. В таблице 6Г.4 представлены некоторые заимствованные из литературы данные. Они указывают -на большие расхождения между разными видами и даже сортами в пределах одного вида растений. Более того, нередко аминокислотный состав определялся у всей суммарной азотсодержащей фракции клубня и поэтому лишь весьма приблизительно отражает фактический состав белков в клубнях разного географического происхождения. Это подтверждается недавно проведенным для ФАО исследованием [22], в котором отмечается, что клубни и корнеплоды тропических растений до сих пор мало изучены по сравнению с другими культурами, и в этой области информация ограничена. В отношении других клубней растений умеренных зон, исключая картофель, можно сделать следующее обобщение. [c.276]
Аминокислотный состав и последовательность аминокислот выяснены для многих тысяч белков. В связи с этим стало возможным вычисление их молекулярной массы химическим путем с высокой точностью. Однако для огромного количества встречающихся в природе белков химическое строение не выяснено, поэтому основными методами определения молекулярной массы все еще остаются физико-химические методы (гравиметрические, осмометрические, вискозиметрические, электрофоретические, оптические и др.). На практике наиболее часто используются методы седиментационного анализа, гель-хроматография и гель-электрофорез. Определение молекулярной массы белков методами седиментационного анализа проводят в ультрацентрифугах , в которых удается создать центробежные ускорения [c.44]
Аминокислотный состав белков растений изучался в течение нескольких десятилетий. До последнего времени для этой цели применялись обычные методы аналитической химии. Однако определение аминокислот в гидролизатах белков обычными химическими методами очень сложно и громоздко, и для количественного определения всех аминокислот в одном только образце белкового препарата обычно требуется не менее 100 г белка и несколько месяцев кропотливой работы научного сотрудника. При такой сложности и дороговизне химических методов исследователи очень редко ставили своей задачей установить содержание всех аминокислот в белке и чаще ограничивались определением лишь главных аминокислот. [c.216]
Известно, что каждый вид растений синтезирует специфические белки, характеризующиеся определенным аминокислотным составом, молекулярным весом и последовательностью аминокислот. Резервуаром, откуда берутся необходимые для синтеза белков аминокислоты и куда возвращаются продукты распада белков, является небелковая фракция, главным образом фракция свободных аминокислот. Некоторые исследователи считали раньше, что аминокислотный состав синтезируемых растениями белков зависит или в какой-то степени определяется содержанием свободных аминокислот в небелковой фракции. Однако детальное изучение содержания свободных аминокислот и аминокислотного состава белков различных растений показало, что какого-либо соответствия между содержанием свободных аминокислот и аминокислотным составом белков в растениях не наблюдается иными словами, состав небелковой фракции растений, очевидно, очень плохо приспособлен к тому, чтобы непосредственно давать необходимые для синтеза белков аминокислоты. [c.288]
Как известно, каждый белок органов и тканей имеет присущий ему аминокислотный состав. Для синтеза различных тканевых белков необходим поэтому вполне определенный ассортимент незаменимых аминокислот. Если в смеси аминокислот отсутствует хотя бы одна незаменимая аминокислота (стр. 308), белок не может быть синтезирован. [c.325]
Аминокислотный состав белка устанавливают методом его гидролиза кислотами, щелочами или ферментами. Широко применяется кислотный гидролиз (80% -ная серная или 20% -ная соляная кислота), протекающий наиболее полно. Для определения аминокислотного состава белка применяют различные физико-химические методы, например распределительную хроматографию и ионообменную хроматографию. Распределительная хроматография на бумаге имеет преобладающее значение. Длительное и сложное определение аминокислотного состава гидролизатов сейчас автоматизировано по графику на ленте автомата находят абсолютное содержание аминокислот. [c.278]
Однако определение аминокислотного состава белков дает лишь одностороннюю их характеристику. Биологические свойства белковых веществ определяются не только входящими в их состав аминокислотными звеньями, а в еще большей степени последовательностью их соединения, т. е. строением белка. [c.390]
Ионообменная хроматография аминокислот на колонках. Определить аминокислотный состав белка — значит установить массовое или молярное соотношение составляющих его аминокислот, для чего необходимо точно определить количество последних. Само по себе количественное определение аминокислот особых затруднений не представляет, так как для этой цели имеется несколько приемлемых способов. Основное препятствие состоит в разделении их смесей, чего, однако, избежать нельзя, поскольку пока нет методов, позволяющих определять аминокислотный состав белков без гидролиза. Поэтому полипептидные цепи белков сначала расщепляют с помощью кислот или щелочей и определяют аминокислоты в полученных смесях. ИОХ по существу представляет собой метод разделения весьма сходных по химическим и мало различающихся по физико-химическим свойствам аминокислот. В настоящее время ИОХ достигла высокой точности, составляющей 2—4% (относительных). Механизация аналитического процесса привела к созданию так называемых аминокислотных анализаторов, которые, постепенно совершенствуясь, стали полностью автоматизированными быстродействующими агрегатами, работающими по заданной программе. Разделение аминокислот, как правило, ведется на катионитах, из которых чаще всего используется сульфированный полистирол, сшитый дивинилбензолом, добавляемым при синтезе в количестве 8%. [c.189]
Определение аминокислот в биологических объектах также представляет собой важную область хроматографического анализа. Исследователей могут интересовать свободные аминокислоты, содержащиеся в биологических жидкостях, или аминокислотный состав выделенных белков и белковых тканей. Обычно вполне удовлетворительные ответы на такие вопросы дают ионообменные методы, в связи с чем газохроматографическим методам уделялось очень мало внимания. Однако результаты сравнительных исследований показали [112], что стан- [c.100]
Современные методы количественного определения аминокислот в гидролизате (особенно метод хроматографии) позволили достаточно полно изучить аминокислотный состав разнообразных белков. В настоящее время описано более 40 аминокислот, найденных в природе. Но не все они являются обязательными и постоянными частями белковой молекулы. Наиболее распространенных аминокислот насчитывается 23. Аминокислотный состав белков далеко не одинаков. [c.338]
Уникальные свойства белков определяются не только количественными соотношениями между различными аминокислотами, но и определенной последовательностью их расположения в полипептидных цепочках. Аминокислотный состав белка и последовательность расположения аминокислот в полипептидных цепочках называют первичной структурой белка. Первичная структура белка, помимо пептидных связей, содержит также некоторое число дисульфидных мостиков. Исследовать первичную структуру — это значит 1) определить число полипептидных цепей и установить, являются ли они открытыми или замкнутыми, 2.) установить линейную последовательность (порядок чередования) аминокислот в отдельных полипептидных цепях (или цепи) и 3) определить число и местоположение поперечных дисульфидных мостиков, соединяющих эти цепи в молекуле белка. Очевидно, что для разрешения этой задачи необходимо прежде всего иметь очищенные, гомогенные препараты белка, поскольку даже незначительная примесь посторонних белков может существенно исказить получаемые результаты. Кроме того, в распо- [c.77]
При перегонке происходят большие потери, вследствие чего этот способ не может служить количественным методом определения аминокислот. Следует, однако, указать, что при помощи именно этого метода удалось установить наличие в белках пептидных связей и определить аминокислотный состав белков. Трудности, связанные с перегонкой эфиров аминокислот, принудили искать другие, более простые методы разделения аминокислот. Ценные результаты были получены при помощи фракционного экстрагирования аминокислот из гидролизата бутанолом [32]. [c.28]
Белковые вещества. Аминокислотный состав. Знакомясь с аминокислотами, мы уже упоминали о том, что высокомолекулярные соединения, построенные из аминокислотных остатков, называются белковыми веществами — белками. Нет ни одного живого организма, растительного или животного, в котором белки не выполняли бы жизненно важных функций. В прошлом веке Ф. Энгельс дал свое известное определение, что жизнь есть способ существования белковых тел. Несмотря на то, что с тех пор наука несравненно глубже познала сущность жизни, это определение сохранило свою силу. Действительно, всюду, где есть жизнь — встречают и белковые вещества. [c.421]
Все изученные к настоящему времени опсины, которые были выделены из сетчатки многих видов животных, представляют собой небольшие белки с мол. массой 30 ООО—40 000. Для опсинов, выделенных из палочек некоторых видов животных, был определен аминокислотный состав (но не последовательность аминокислот). Углеводная часть комплекса, состоящая из одного (или нескольких) остатка глюкозамина и маннозы, прочно связана с аспарагиновым остатком молекулы белка. С белком ассоциировано также значительное количество липидов, главным образом фосфатидилхолин и фосфатидилэтаноламин. Вопрос о том, связаны ли эти фосфолипиды со зрительным пигментом, составляя часть его молекулы, или они просто являются загрязнениями, попавшими из липидной области рецепторной мембраны, остается открытым. [c.306]
Основными характеристиками белка служат аминокислотный состав и молекулярный вес. Надежное и достаточно точное определение молекулярного веса макромолекул — довольно сложная задача. Методы определения молекулярного веса, обычно используемые для небольших молеку,л, в частности эбулиоскоиический (повышение точки кипения) и криоскопиче-ский (понижепие точки замерзания), так ке как и метод, оспованный на изменении давления пара растворителя над раствором, малопригодны или даже вовсе не пригодны для макромолекул из-за очень большой величины этих последних, а также из-за их неустойчивости. Нанример, для того чтобы точка замерзания водного раствора белка с молекулярным весом 10 ООО [c.59]
Мы знаем, что в целом белки экстремальных галофилов являются сильно кислыми. Это было показано для суммарных цитоплазматических белков нескольких экстремально галофильных бактерий, для белков оболочки других экстремальных галофилов и для рибосомных белков Я. utirubrum (табл. 8.5), Был также определен аминокислотный состав белка газовых вакуолей и белка пурпурной мембраны Я. halobium. Ни один из этих белков ие обнаруживает заметной зависимости от присутствия солей. Фактически выделение пурпурной мембраны основано на том, что она устойчива в условиях низкой ионной силы, когда распадается большинство других клеточных структур. Создается впечатление, что все белки галофильных бактерий, за исключением двух указанных выше, имеют значительно более высокую кислотность (измеряемую по разнице между числом кислых и основных аминокислот), чем соответствующие белки негалофиль-ных бактерий. [c.389]
По данным исследований Шеффнера и соавторов [60], аминокислотный состав пепсинового гидролизата способен выявить различия между белками, которые не проявляются ни при анализе общего содержания незаменимых аминокислот, ни при анализе, проводимом после полного ферментативного гидролиза. Это наблюдение использовано для определения ППО (показатель пепсинового переваривания остатка). [c.576]
Информационные РНК служат матрицайтгдля синтеза различных белковых молекул. Перевод генетической информации с языка нуклеотидов на язык аминокислот — сложный многостадийный процесс, включающий активацию аминокислот, образование ими комплексов с особым видом РНК (транспортными РНК, или тРНК), взаимодействие этих комплексов с иРНК, связанной с рибосомой, приводящее в конечном итоге к формированию полипептидной цепи, аминокислотный состав которой изначально запрограммирован в определенном участке ДНК. В осуществлении каждой из стадий, ведущих к синтезу молекулы белка, участвует несколько различных ферментов. [c.143]
Исследование первичной структуры белка начинается с определения его молекулярной массы, аминокислотного состава, N- и С-кониевых аминокислотных остатков. Поскольку пока не существует метода, позволяющего установить полную первичную структуру белка на целой молекуле, полипептидную цепь подвергают специфичному расщеплению химическими реагентами или протеолитическими ферментами. Смесь образовавшихся пептидных фрагментов разделяют и для каждого из них определяют аминокислотный состав и аминокислотную последовательность. [c.33]
Нужно помнить, что методы определения аминокислот в белковых гидролизатах далеко не идеальны. Во время самого гидролиза при освобождении аминокислот происходят изменения разной глубины. Кроме того, в случае важных для питания белков, особенно растительного происхождения, следует помнить, что мог т иметь место большие колебания в составе в зависимости от вида растения или животного. Подобно тому как при псшощи отбора и культивирования можно изменить содержание витаминов и минеральных составных частей растения, так же можно, вероятно, изменять и аминокислотный состав белк( в в нем. Придет время, когда будут специально выращивать определенные растения из-за содержащихся в них незаменимых аминокислот, точно так же как сейчас их выводят из-за содержащихся в них витаминов. [c.366]
Осуществленный таким способом гидролиз пептидньк связей-это необходимый шаг в определении аминокислотного состава белков и последовательности составляющих их аминокислотных остатков. Пептидные связи могут быть гидро-лизованы также под действием некоторых ферментов, таких, как трипсин и химотрипсин, представляющие собой протеолитические (белок-расщепляю-щие) ферменты, секретируемые в кишечник и способствующие перевариванию, т. е. гидролитическому расщеплению, белков, входящих в состав пищи. Если кипячение пептидов с кислотой или щелочью приводит к гидролизу всех пептидных связей независимо от природы и последовательности соединенных при их помощи аминокислотных звеньев, то трипсин и химотрипсин осуществляют каталитическое расщепление пептидов избирательным образом. Трипсин гидролизует только те пептидные связи, в образовании которьсс участвуют карбоксильные группы лизина или аргинина. Химотрипсин же атакует только те пептидные связи, которые были образованы с участием карбоксильных групп фенилаланина, триптофана и тирозина. Как мы увидим дальше, такой избирательный ферментативный гидролиз оказьшается очень полезным при анализе аминокислотных последовательностей белков и пептидов. [c.130]
Второй важный вьшод заключается в том, что вторичная структура полипептидов, в частности а-спираль и Р-конформация, возникает самопроизвольно и автоматически вследствие того, что данный полипептид имеет определенный амщю-кислотный состав и определенную аминокислотную последовательность. Характерная вторичная структура белка-это его наиболее устойчивая форма при заданных биологических условиях. а-Спираль и р-структура стабилизируются множеством водородных связей-внутрицепочечных в случае а-спирали и межцепочечных в случае Р-структуры. Хотя водородные связи, взятые в отдельности, относительно слабы, все вместе они придают а-спирали и Р-структуре значительную устойчивость. [c.181]
Аминокислотный состав белковых фракций семян злаков к настоящему времени довольно хорошо изучен. В таблице 10, составленной по данным Е. Иемма (1958), приведены резз льтаты определений содержания аминокислот в некоторых белках, выделенных из семян. Эти данные показывают, что содержание почти всех аминокислот в отдельных белковых фракциях сильно различается. По своему аминокислотному составу особенно отличаются от других белковых фракций проламины. Эта группа белков характеризуется очень высоким содержанием глутаминовой кислоты и амидного азота. В глиадине пшеницы и гордеине ячменя, например, почти половина от общего содержания азота в белках приходится на долю глутаминовой кислоты и амидов. Амидные группы в белках связаны с глутаминовой кислотой, и, таким образом, в проламинах до половины общего количества азота содержится в виде этих комплексов. Проламины характеризуются также высоким содержанием пролина (до 15% в гордеине ячменя) и очень малым количеством серусодержащих аминокислот и основных аминокислот, особенно лизина. [c.355]
Наиболее хорошо изучены белки конопли, которые представлены в основном глобулинами, составляющими около 50% белков семени. Глобулин конопли был одним из первых белков, выделенных в кристаллическом состоянии, и получил название эдестина. В настоящее время определен молекулярный вес эдестина, изучен его аминокислотный состав и другие свойства Глобулин клещевины по свойствам близок к эдестину конопли [c.406]
Отсюда ясно, какое огромное значение в питании человека имеет подбор белков пищи таким образом, чтобы получился оптимальный состав аминокислот для удовлетворения всех потребностей человека. В Советском Союзе Б. И. Збарским и сотрудниками проделана большая работа по определению аминокислотного состава белков органов и тканей человека. Так как в белках одних пищевых продуктов некоторые аминокислоты встречаются в небольшом количестве, то, естественно, надо стремиться добавлять эти аминокислоты путем одновременного потребления таких пищевых продуктов, в белках которых эти аминокислоты находятся в большом количестве. А. Э. Шарпенак провел большую работу по определению аминокислотного состава белков различных пищевых продуктов и составлению на основании этого рационов для человека, в которых белки различных пищевых продуктов дополняют друг друга своими аминокислотами и дают, таким образом, биологически ценное пита[ше. [c.310]
Количественное определение белков. Для колич. онределения Б. устанавливают общее содержание азота по методу Кьельдаля (см. Ааота определение). Кроме того, используют колориметрич. методы, основанные на различных цветных реакциях Б., напр, биуретовой, а также реакции Лаури, представляющей сочетание биуретовой реакции и реакции Фолина на ароматич. аминокислоты. Концентрации Б. в р-рах можно установить по поглощению в УФ-области спектра, измерением плотности и показателей преломления р-ров. Количественно аминокислотный состав Б. определяют гидролизом Б. и после- [c.193]
Созинов А. А., Попереля Ф. А. Аминокислотный состав белка пщеницы и некоторые особенности его определения.— Научно-технический бюллетень Всесоюзного селекционно-генетического института, 1969 (1970), вып. 11, с. 36—40. [c.156]
Липоксидаза была обнаружена у бобовых, некоторых зерновых злаков, а также в семенах масличных растений. Липоксидаза сои была кристаллизована в виде однородного белка. Ее молекулярный вес равен 102 ООО. Был определен также аминокислотный состав этой липоксидазы. Анализ ее не выявил присутствия каких-нибудь необычных аминокислот, а также наличия простетической группы или ионов металлов. В отличие от липоксидазы бобовых липоксидазы, выделенные из маша, ингибируются сульфгидрильными реагентами. [c.189]
Определяли содержание обш его азота, а также его белковой и небелковой форм, состав и содержание свободных и свя.чан-ных аминокислот. Для этого из навески сухого растительного материала (1 г) проводили экстракцию небелковых форм азота после осаждения белков 5%-ной трихлоруксусной кислотой. Свободные аминокислоты определяли во фракции небелкового азота, а аминокислотный состав белков — в кислотном гидролизате фракции белкового азота [3]. Идентификация и количественное определение аминокислот проведены на автоматическом анализаторе НД-1200Е. Ошибка определения на приборе 2,0%. Расчеты аминокислотного состава — на электронно-вычислительной машине Минск-22 [4]. Все определения проведены в двухкратной повторности. [c.89]
Пасхина Т. С. Разделение и определение аминокислот методом хроматографии распределения. В прил. к кн. Р. Б л о к и Д. Боллинг. Аминокислотный состав белков и пищевых продуктов. ИЛ, [c.183]
Теперь уже выяснены первичные структуры и другие детали строения еще более сложных белков, относящихся к ферментам. Так, начало 60-х годов ознаменовалось полным выяснением структуры открытого еще в 1920 г. фермента рибонуклеазы, осуществляющего гидролиз рибонуклеиновых кислот (РНК, см.). Рибонукле-аза—белок, молекулярная масса 13 500, имеет одну полипептид-ную цепь, образованную 124 аминокислотными звеньями. Установлены последовательность этих звеньев и наличие четырех внутри-цепных дисульфидных связей, замыкающих определенные участки цепи в циклы. Выяснен аминокислотный состав и структура некоторых ферментов, содержащих около двух с половиной сотен аминокислотных звеньев (молекулярная масса 27 000—34 000), т. е. являющихся весьма сложными белками. [c.334]