Содержание
- Как правильно вычислить аналитический множитель (фактор пересчета) определяемого вещества и его весовой формы
- Вычисление аналитического множителя для определяемого вещества Fе3О4 и весовой формы Fe2O3
-
Вычисление аналитического множителя для определяемого вещества N и весовой формы (NH4)2PtCl6
- Вычисление аналитического множителя для определяемого вещества P2O5 и весовой формы (NH4)3PO4
Как правильно вычислить аналитический множитель (фактор пересчета) определяемого вещества и его весовой формы
Вычисление аналитического множителя для определяемого вещества Fе3О4 и весовой формы Fe2O3
Задача 301.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Fе3О4; весовая форма Fe2O3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Fe3О4) и гравиметрической (весовой) формы (Fe2О3), то аналитический множитель будет иметь следующее значение:
f = 2Мr(Fe3О4)/3Mr(Fe2O3) = (2 . 231,535)/(3 .159,69) = 0,9666,
где Мr(Fe2О4) = 231,535; Mr(Fe2O3) = 159,69.
Ответ: f = 0,9666.
Вычисление аналитического множителя для определяемого вещества N и весовой формы (NH4)2PtCl6
Задача 302.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество N; весовая форма (NH4)2PtCl6.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (N) и гравиметрической (весовой) формы (NH4)2PtCl6, то аналитический множитель будет иметь следующее значение:
f = 2Аr(N)/Mr[ (NH4)2PtCl6] = (2 . 14)/443,798 = 0,0631,
где Аr(N) = 14; Mr[ (NH4)2PtCl6] = 443,798.
Ответ: f = 0,0631.
Вычисление аналитического множителя для определяемого вещества P2O5 и весовой формы (NH4)3PO4
Задача 303.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Р2О5; весовая форма (NH4)3PO4.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой фор¬мы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Р2О5) и гравиметрической (весовой) формы (NH4)3PO4, то аналитический множитель будет иметь следующее значение:
f = Mr(P2O5)/Mr[(NH4)3PO4] = 141,948/(2 . 148,974) = 0,4764,
где Mr(P2O5) = 141,948; Mr[(NH4)3PO4] = 148,974.
Ответ: f = 0,4764.
Вычисление аналитического множителя для определяемого вещества CuO и весовой формы CuSCN
Задача 304.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество CuО; весовая форма CuSCN.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Cu) и гравиметрической (весовой) формы CuSCN, то аналитический множитель будет иметь следующее значение:
f = Мr(CuО)/Mr(CuSCN) = 79,546/121,612 = 0,6541,
где Мr(CuО) = 79,546; Mr(CuSCN) = 121,612.
Ответ: f = 0,6541.
Вычисление аналитического множителя для определяемого вещества Cu и весовой формы CuSCN
Задача 305.
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Cu; весовая форма CuSCN.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Cu) и гравиметрической (весовой) формы CuSCN, то аналитический множитель будет иметь следующее значение:
f = Аr(Cu)/Mr(CuSCN) = 63,546/121,612 = 0,5225,
где Аr(Cu) = 63,546; Mr(CuSCN) = 121,612.
Ответ: f = 0,5225.
Вычисление аналитического множителя (фактор пересчета)
Задача 281
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество СаО; весовая форма СаСО3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (СаО) и гравиметрической (весовой) формы (СаСО3), то аналитический множитель будет иметь следующее значение:
f = МrСаО/MrСоСО3 = 56,078/100,078 = 0,5603,
где МrСаО = 56,078; MrСаСО3 = 100,078.
Ответ: f = 0,5603.
Задача 282
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Са; весовая форма СаСО3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Са) и гравиметрической (весовой) формы (СаСО3), то аналитический множитель будет иметь следующее значение:
f = АrСа/MrСоСО3 = 40,078/100,078 = 0,40047,
где АrСаО = 40,078; MrСаСО3 = 100,078.
Ответ: f = 0,40047.
Задача 283
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество FeSO4; весовая форма Fe2O3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (FeSO4) и гравиметрической (весовой) формы (Fe2О3), то аналитический множитель будет иметь следующее значение:
f = 2МrFeSO4/MrFe2O3 = (2 . 151,911)/159,69 = 1,9026,
где МrFeSO4 = 56,078; MrFe2O3 = 159,69.
Ответ: f = 1,9026.
Задача 284
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Fе; весовая форма Fe2O3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Fe) и гравиметрической (весовой) формы (Fe2О3), то аналитический множитель будет иметь следующее значение:
f = 2АrFe/MrFe2O3 = (2 . 55,845)/159,69 = 0,6994,
где АrFe = 56,078; MrFe2O3 = 159,69.
Ответ: f = 0,6994.
Задача 285
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Н3РО4; весовая форма Mg2P2O7.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (H3PO4) и гравиметрической (весовой) формы (Mg2P2O7), то аналитический множитель будет иметь следующее значение:
f = 2МrH3PO4/MrMg2P2O7 = (2 . 97,074)/222,558 = 0,8804,
где МrH3PO4 = 97,074; MrMg2P2O7 = 222,558.
Ответ: f = 0,8804.
<
Задача 286
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество FеО; весовая форма Fe2O3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (FeО) и гравиметрической (весовой) формы (Fe2О3), то аналитический множитель будет иметь следующее значение:
f = 2МrFeО/MrFe2O3 = (2 . 71,845)/159,69 = 0,8998,
где МrFeО = 71,078; MrFe2O3 = 159,69.
Ответ: f = 0,8998.
Задача 287
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Са3(РО4)2; весовая форма СаО.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Са3(РО4)2) и гравиметрической (весовой) формы (СаО), то аналитический множитель будет иметь следующее значение:
f = МrСа3(РО4)2/3MrСаО = 312,948/(3 , 56,078) = 1,8574.
где МrСа3(РО4)2 = 312,948; MrСаО = 56,078.
Ответ: f = 1,8574.
Задача 288
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Na2S2O7; весовая форма BaSO4.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества ( Na2S2O7) и гравиметрической (весовой) формы (BaSO4), то аналитический множитель будет иметь следующее значение:
f = Мr Na2S2O7/2MrBaSO4 = 222,112/(2 , 233,393) = 0,4758.
где Мr Na2S2O7 = 222,112; MrBaSO4 = 233,393.
Ответ: f = 0,4758.
Задача 289
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Ва; весовая форма BaSO4.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Ва) и гравиметрической (весовой) формы (BaSO4), то аналитический множитель будет иметь следующее значение:
f = АrВа/MrBaSO4 = 137,237/233,393 = 0,5884.
где АrВа = 137Ю327; MrBaSO4 = 233,393.
Ответ: f = 0,5884.
Задача 290
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество BaCl2 . 2H2O; весовая форма BaSO4.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества BaCl2 . 2H2O) и гравиметрической (весовой) формы (BaSO4), то аналитический множитель будет иметь следующее значение:
f = МrBaCl2 . 2H2O /MrBaSO4 = 244,233/233,393 = 1,04645
где МrBaCl2 . 2H2O = 244,233; MrBaSO4 = 233,393.
Ответ: f = 1,04645.
| Таблица 2. Аналитические множители (факторы) | 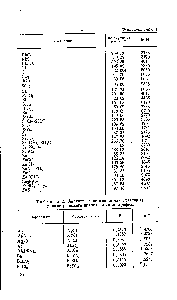 |
Общая схема для вычисления результатов гравиметрического анализа имеет вид т=аР, где т — масса определяемого элемента, г а — масса весовой формы, г F — фактор пересчета (аналитический множитель). [c.285]
Р — фактор пересчета, или аналитический множитель, он соответствует содержанию определяемого вещества в 1 г выделенного соедине ния а — масса весовой формы. [c.284]
Аналитический множитель, или фактор пересчета. [c.283]
Из приведенных примеров видно, что вычисляемое количество определяемого вещества (или элемента) х выражается произведением двух множителей. Один из них, найденная при анализе масс.) осадка (а), является величиной переменной, зависящей от величины взятой навески. Наоборот, другой множитель, именно отношение молекулярного (атомного) веса определяемого вещества (элемента) к молекулярному весу осадка (весовой формы), от навески не зависит и представляет собой величину постоянную, которую можно вычислить раз навсегда для всех подобных анализов. Ее называют аналитическим множителем или фактором пересчета и обозначают через F. Следовательно [c.155]
Отношение молекулярных масс 40,08/56,08=0,7147 является величиной постоянной она называется фактором пересчета или аналитическим множителем и обозначается буквой F его можно найти готовым в таблицах факторов пересчета. [c.118]
Отношение молярных масс, умноженных на соответствующие коэффициенты, называют фактором пересчета (аналитическим множителем) и обозначают буквой / [c.145]
Отношение мольных масс 40,08 56,08=0,7147 является величиной постоянной, оно называется фактором пересчета или аналитическим множителем и обозначается буквой F. Его можно найти в справочных таблицах. [c.100]
В практике химических лабораторий обычно пользуются методиками, в которых приведены готовые формулы для расчета рез-ультаа ов анализа. В ати формулы входит постоянный множитель, называемый фактором пересчета F (аналитический множитель), который служит для вычисления содержания какого-либо компонента в анализируемой пробе, если известна масса весовой формы этого компонента. Напомним, что весовой формой называют соединение, которое взвешивают для получения окончательного результата анализа. Например, при гравиметрическом определении кальция, если его осаждают в виде оксалата, весовой формой может быть оксид кальция, образующийся при прокаливании осадка [c.48]
Расчет факторов (аналитических множителей) [c.133]
Следовательно, при выражении аналитического множителя (фактора) весового анализа в числителе указывают формулу определяемого вещества, а в знаменателе—формулу его весовой формы. [c.270]
Если принять, что а = ар =0,0002, ag/g = 5-= = 0,05%. Однако обычно массы навески и весовой формы несколько меньше (р = 0,1 г — для аморфных осадков и 0,5 г — для кристаллических), поэтому погрешность гравиметрического метода на практике составляет 0,1%. В лучших же случаях она может достигать 0,01%. Так как g = Fp и если навеска т и масса весовой формы р являются величинами одного порядка, то увеличение аналитического множителя Р приводит к уменьшению суммарной погрешности вследствие или увеличения навески (фиксирована масса весовой формы), или весовой формы (фиксирована навеска). Благодаря высокой точности гравиметрический метод часто используют для аттестации эталонных образцов или как арбитражный. Систематические погрешности в гравиметрическом методе возникают за счет растворимости осадка при его осаждении и промывании, вследствие загрязненности реактивов, при работе с открытой посудой (разбрызгивание, пыль), взвешивании недостаточно охлажденных тиглей и т. д. В итоге в конкретном гравиметрическом методе сумма систематических погрешностей должна быть меньше случайной погрешности. [c.104]
Отношение эквивалентных весов определяемой составной части и ее весовой формы называют аналитическим множителем (или фактором) и обычно обозначают буквой Р. [c.39]
Значения величин аналитических множителей приводятся в соответствующих справочниках. [c.39]
Пользование аналитическими множителями особенно удобно в тех случаях, когда в лаборатории ежедневно анализируют большое число образцов одного и того же материала. [c.39]
В случае необходимости величину аналитического множителя подсчитывают по соотношению молекулярных весов. [c.45]
Нашему читателю хорошо известны. Таблицы логарифмов Ф. В. Кюстера, которые много раз переиздавались в нашем Союзе. Это прекрасное пособие стало незаменимым для каждого химика, особенно химика-аналитика, так как многие из таблиц (главным образом таблицы атомных и молекулярных весов, аналитических множителей) составлены в форме, очень удобной для практического их использования при химико-аналитических расчетах. [c.5]
Составить таблицу аналитических множителей и их логарифмов [c.133]
Например, если нужно определить содержание железа в анализируемом растворе по массе выделенного РСаОз, то аналитический множитель [c.269]
Аналитический множитель (фактор) весового анализа обозначают в данном случае ре/геаОз- Такое обозначение означает, что аналитический множитель пригоден для расчета содержания железа по массе весовой формы РеаОз. Если аналитический множитель обозначить / ре,Оз/ге. то его можно использовать для расчета РсаОз по массе выделенного железа. [c.270]
Для получения точных результатов анализа в производственных и исследовательских лабораториях никогда не удовлетворяются одним определением, а делают два или три параллельных определения и при получении сходящихся результатов берут средний результат. При анализе химически чистых веществ в учебной лаборатории есть возможность проверить результат анализа по формуле, поэтому можно ограничиться одним определением. Нужно приучить будущих лаборантов аккуратно записывать в лабораторный журнал ход анализа, результаты измерений и конечные результаты. Совершенно недопустима предварительная запись результатов взвешивания на отдельных листках, в случайных тетрадках с последующим переписыванием в журнал. Все расчеты результатов анализа следует вести в лабораторном журнале, с тем чтобы можно было восстановить ход расчета и проверить его. Нужно показать учащимся приемы расчета с помощью таблиц логарифмов и таблиц аналитических множителей, этими таблицами пользуются в производственных аналитических лабораториях. Сказрннор отнпгится не только к весовому, но и ко всему количественному анализу. [c.158]
Значения величин аналитических множителей сведены в таблицы. В этих таблицах (см. Приложения) первая графа обозначена словом определяют . В данном примере определяют алюминий, и в этой графе по алфавиту следует найти А. Вторая графа обозначена весовая форма . В нашей задаче получен осадок А12О3. Следовательно, против знака А1 нужно найти формулу А1г0з и против нее в той же строке в третьей графе помещен фактор 0,5290. В четвертой графе той же строки дана величина логарифма этого фактора. [c.55]
Аналитическая химия (1973) — [
c.2
,
c.283
]
Теоретические основы аналитической химии 1980 (1980) — [
c.145
]
Теоретические основы аналитической химии 1987 (1987) — [
c.152
]
Основы аналитической химии Часть 2 (1965) — [
c.63
]
Аналитическая химия (1965) — [
c.3
,
c.342
,
c.344
]
Количественный анализ (1963) — [
c.139
]
Аналитическая химия (1980) — [
c.246
]
Количественный анализ (0) — [
c.139
]
Основы аналитической химии Издание 3 (1971) — [
c.73
]
Основы аналитической химии Кн 2 (1965) — [
c.63
]
4.3.1.
Вычисление
процентного содержания определяемого
вещества.
Расчет процентного
содержания вещества в анализируемом
образце по данным гравиметрического
метода основан на точном знании состава
весовой формы.
Допустим,
требуется определить процентное
содержание элемента М в некотором
образце. Взята навеска образца, равная
а г.
Весовая форма имеет состав МnАm,
масса ее равна b
г. Обозначим через МB
молекулярную массу МnАm,
а через Ам –-атомную
массу элемента М. Найдем количество
определяемого элемента в г (х)
по следующей формуле:
|
г |
(4.9) |
Содержание
М в % будет
равно
|
г |
(4.10) |
Если
требуется найти содержание какого-либо
соединения элемента в образце
(например, MqLp),
то расчет может быть
проведен так:
|
г |
(4.11) |
Mq
–
молекулярная масса МqLp.
В
некоторых случаях (при большом содержании
определяемого вещества) проводят анализ
не всей навески, а только некоторой ее
части (аликвоты). Для этого после
растворения навески переносят раствор
в мерную колбу и разбавляют водой до
объема V
мл, затем берут для
анализа пипеткой определенную часть
раствора (v
мл). Расчет проводится
аналогично, с учетом того, что навеска
будет равна
г.
|
г |
(4.12) |
Пример
9. Найти
процентное содержание алюминия в
сплаве, если из навески его, равной
0.5618 г, получено 0.1012 г оксида алюминия.
Решение.
Молекулярная масса Аl2О3
равна 101.96, атомная масса алюминия –
26.98. По формуле (4.9)
находим содержание А1 в г (х)
г.
Определяем
%
алюминия
в сплаве
Пример
10. Вычислить
процентное содержание карбоната
кальция в известняке по следующим
данным. Навеска известняка равна 0.5120
г. После растворения ее, осаждения
кальция в виде оксалата и прокаливания
осадка получено 0.2160 г оксида кальция.
Решение.
Процентное содержание СаСО3
можно вычислить по формуле (4.11). В данном
случае МСаО
= 56.08;
=100.09;
п
= 1;
q
=1.
Пример
11. Рассчитать
процентное содержание магния в образце
по следующим данным. Навеска образца
0.8619 г растворена в кислотах, полученный
раствор перенесен в мерную колбу на 250
мл и разбавлен до метки. На анализ
взято 50 мл раствора. После осаждения
магния в виде MgNH4PO4
и прокаливания осадка получено 0.2516
г Mg2P2O7.
Решение.
Проводим расчет по формуле (4.12), учитывая,
что МВ=
222.5; Ам
= 24,.1; V
= 250
мл; v
= 50 мл;
З а
д а ч и
Рассчитать
процентное содержание
-
Бария
в барите, если навеска его 0.3115 г. В
результате анализа получено 0.2318 г
сульфата бария. -
Алюминия
в криолите, если навеска его 0.6118 г. В
результате анализа получено 0.1502 г
оксида алюминия. -
СаСО3
в доломите, если навеска его 1.0000 г. В
результате анализа получено 0.3515 г
оксида кальция.
-
Карбоната
магния в доломите, если навеска его
0.5000 г. В результате анализа получено
0,2856 г дифосфата магния. -
Серы
в чугуне, если навеска его 13.7400 г. В
результате анализа получено 0.1086 г
сульфата бария. -
Серы
в каменном угле, если навеска его 2.9440
г. В результате анализа получено 0.1526 г
сульфата бария.
-
Магния
в сплаве, если навеска его 4.3700 г. В
результате анализа получено 0,1323 г
дифосфата магния. -
Серной
кислоты в растворе (объемные проценты),
если для анализа было взято 10 мл этой
кислоты и разбавлено в мерной колбе до
100 мл. При осаждении сульфат-иона хлоридом
бария из 10 мл разбавленного раствора
было получено 0.2377 г сульфата бария. -
Полуторных
оксидов (R2O3)
в силикате, если навеска его 0.5692 г.
Фильтрат после отделения кремниевой
кислоты разбавлен в мерной колбе до
250 мл. При осаждении гидроксидов из 150
мл этого раствора получено 0.0688 г
полуторных оксидов. -
Оксида
кальция в силикате, .если навеска его
0.5692 г. Фильтрат после отделения кремниевой
кислоты и полуторных оксидов (Fe2O3
+ А12О3)
доведен в мерной колбе до 250 мл. После
осаждения кальция оксалатом из 150 мл
этого раствора было получено 0.0725 г
оксида кальция.
-
Фосфора
в чугуне, если навеска его 10.8160 г. В
результате анализа получено 0.1218 г
дифосфата магния. -
Магния
в сплаве, если для анализа была взята
навеска 5.2160 г. После растворения сплава
раствор доведен в мерной колбе до 250
мл. Магний определялся из 50 мл этого
раствора и в результате анализа было
получено 0.1218 г дифосфата магния. -
Марганца
в сплаве, если для анализа была взята
навеска 10.1800 г. После растворения сплава
раствор был доведен в мерной колбе до
250 мл. Марганец определялся из 50 мл этого
раствора и в результате анализа было
получено 0.1628 г дифосфата марганца. -
Цинка
в сплаве, если навеска его 5.8160 г. После
растворения сплава раствор доведен в
мерной колбе до 250 мл. Для определения
цинка взято 100 мл этого раствора, и в
результате анализа получено 0.1125 г
дифосфата цинка. -
Серебра
в сплаве, если навеска его 0.5868 г. В
результате анализа получено 0.1556 г
хлорида серебра. -
SiO2,
полуторных
оксидов (А12О3
+ Fe2O3),
СаО и MgO
в силикате, если навеска его 0.5686 г. В
результате анализа получено: SiO2
– 0.3184 г, полуторных оксидов – 0.1192 г, СаО
– 0.0856 г, Mg2P2O7
-0.1104 г. -
Карбонатов
кальция и магния в известняке, если
навеска его 0.9866 г. В результате анализа
получено оксида кальция 0.3755 г и дифосфата
магния 0.4105 г. -
Железа
в красном железняке, если навеска его
0.6114 г. В результате анализа было получено
0.5190 г Fe2O3. -
Алюминия
в техническом сульфате алюминия
A12(SO4)3×18H2O,
если навеска его 1.0925 г. В результате
анализа было получено 0.1289 г оксида
алюминия. -
Алюмокалиевых
квасцов в загрязненном образце, если
навеска его 0.4115 г. При анализе было
получено 0.3980 г сульфата бария. -
Кадмия
в техническом сульфате кадмия, если
навеска его 0.3456 г. В результате анализа
было получено 0.2086 г дифосфата кадмия. -
Алюминия
и железа в известняке, если навеска его
1.2400 г. В результате анализа было получено
0.0629 г суммы полуторных оксидов (А12О3
+ Fe2O3).
Из этого осадка был выделен алюминий
в виде оксида, вес которого 0.0252 г.
-
Примесей
в техническом образце хлорида натрия,
если навеска его 0.5721 г. В результате
анализа было получено 1.0261 г хлорида
серебра. -
Свинца
в руде, если навеска ее 0.5418 г. В результате
анализа получено 0.6819 г сульфата свинца. -
Серы
в галените, если навеска его 0.5418 г. В
результате анализа получено 0.5137 г
сульфата бария. -
Р2О6
в апатите,. если навеска его 1.0000 г. В
результате анализа получено 0.6255 г
дифосфата магния. -
СаО
в апатите, если навеска его 1.0000 г. После
растворения навески раствор доведен
в мерной колбе до 250 мл. Кальций был
осажден оксалатом из 150 мл этого раствора.
После прокаливания осадка было получено
0.3301 г оксида кальция. -
Железа
и алюминия в сплаве, если навеска его
1.5000 г. После растворения сплава раствор
доведен в мерной колбе до 250 мл. Из 100 мл
этого раствора были осаждены полуторные
оксиды, их вес 0.1015 г, в других 100 мл того
же раствора было найдено 0.0561 г Fe2O3. -
Р2О5
в апатите, если навеска его 0.2057 г. В
результате анализа было получено 2.0112
г осадка (NH4)3P(Mo3O10)4.
4.3.2.
Вычисление
аналитических множителей.
При серийных
анализах для ускорения расчетов часто
используют так называемый аналитический
множитель, или фактор пересчета (F).
Эта величина входит в качестве
постоянного множителя в уравнения
(4.10) и (4.11)
|
г |
(4.13) |
Для
однотипных расчетов уравнение (4.10) можно
преобразовать следующим образом:
|
г |
(4.14) |
Пример
12. Вычислить
аналитический множитель при
определении
магния в виде Мg2Р2О7.
Решение.
В данном случае АМ
=
24.31; МВ
=
222.55; п
=
2.
З а
д а ч и
Вычислить
аналитические множители для следующих
определений
-
Взвешен сульфат
бария, определяют барий. -
взвешен сульфат
бария, определяют серу. -
Взвешен сульфат
бария, определяют сульфат-ион. -
Взвешен
оксид кальция, определяют карбонат
кальция. -
Взвешен оксид
кальция, определяют кальций. -
Взвешен
дифосфат магния, определяют оксид
магния. -
Взвешен
дифосфат магрия, определяют карбонат
магния. -
Взвешен
дифосфат магния, определяют фосфор. -
Взвешен
дифосфат магния, определяют фосфорный
ангидрид. -
Взвешен оксид
железа, определяют железо. -
Взвешен
оксид железа, определяют оксид железа
(II). -
Взвешен
оксид железа, определяют соль Мора. -
Взвешен оксид
алюминия, определяют алюминий. -
Взвешен хлорид
серебра, определяют хлор. -
Взвешен хлорид
серебра, определяют серебро. -
Взвешен
хлорид серебра, определяют сульфат
серебра. -
Взвешен
хлорид серебра, определяют хлорид
натрия. -
Взвешен
сульфат свинца, определяют свинец. -
Взвешен кремнезем,
определяют кремний. -
Взвешен
Мn3О4,
определяют марганец. -
Взвешен
Р205×24МоO3,
определяют фосфор. -
Взвешен молибдат
свинца, определяют молибден.
563.
Взвешен
дифосфат цинка, определяют сульфат
цинка.
4.3.3.
Расчет
навески при заданных условиях.
Для
облегчения вычислений результатов
анализа целесообразно подобрать такую
навеску, чтобы количество весовой формы
в г арифметически равнялось бы числу %
определяемого
вещества (или какой-либо доли его). Для
расчета навески в этом случае, можно
воспользоваться уравнениями (4.10) или
(4.14).
Пример
13. Какова
должна быть навеска образца, содержащего
алюминий, чтобы вес полученного оксида
алюминия, умноженный на 100, численно
равнялся проценту алюминия в образце?
Решение.
Подставим в уравнение (4.10) следующие
данные: Ам
= 27; Мв
= 102; п
=
2.
По
условию %А1 = 100×b,
тогда
.
Аналогичный
образом проводится расчет навески,
которую следует взять для получения
заданного количества весовой формы. В
этом случае должно быть известно
содержание определяемого вещества.
Пример
14. Какова
должна быть навеска угля, содержащего
1% серы, чтобы после соответствующей
обработки получилось 0.2 г сульфата
бария?
Решение.
По уравнению (4.13) найдем фактор пересчета
Здесь
АМ
(атомная масса серы) = 32; МВ
(молекулярная масса BaSO4)
= 233.4.
Расчет
навески можно провести по уравнению
(4.14),
подставив
указанные в условии значения b
(0.2
г)
и % S
(1%),
г
З
а
д
а
ч
и
Вычислить навеску
-
Нитрата
бария для получения не менее 0.2 г сульфата
бария. -
Медного
купороса, чтобы при определении
сульфат-иона получилось 0.1 г сульфата
бария. -
Каменного
угля, содержащего 0.7% серы, чтобы после
соответствующей обработки и осаждения
хлоридом бария получилось 0.15 г сульфата
бария. -
Чугуна,
содержащего 0.1% серы, чтобы после
соответствующей обработки и осаждения
хлоридом бария получилось 0.1 г сульфата
бария. -
Вещества,
содержащего серу, чтобы после необходимой
обработки и осаждения хлоридом бария
вес полученного сульфата бария численно
равнялся процентному содержанию серы. -
Вещества,
содержащего алюминий, чтобы вес
полученного оксида алюминия, умноженный
на 100,
численно
равнялся проценту алюминия в исходном
веществе. -
Вещества,
содержащего железо, чтобы вес полученного
оксида железа, умноженный на 50, численно
равнялся проценту железа в исходном
веществе. -
Вещества, содержащего
хром, чтобы вес полученного оксида
хрома, умноженный на 200, численно равнялся
проценту хрома в исходном веществе. -
Вещества,
содержащего магний, чтобы вес полученного
дифосфата магния, умноженный на 100,
численно равнялся проценту оксида
магния в исходном веществе. -
Вещества,
содержащего магний, чтобы вес полученного
дифосфата магния, умноженный на 10,
численно равнялся проценту магния в
исходном веществе. -
Вещества, содержащего
бром, чтобы вес полученного бромида
серебра, умноженный на 5, численно
равнялся проценту брома в исходном
веществе. -
Доломита,
содержащего 60% СаСО3,
чтобы в результате анализа получилось
0.3620 г оксида кальция. -
Доломита,
содержащего 45% карбоната магния, чтобы
в результате анализа получилось 0.2056 г
дифосфата магния.
-
Сплава,
содержащего 25% железа, чтобы в результате
анализа получилось 0.2518 г оксида железа
(III). -
Сплава,
содержащего 9.5% алюминия, чтобы в
результате анализа получилось 0.1469 г
оксида алюминия. -
Вещества,
содержащего 4% фосфора, чтобы в результате
анализа получилось 0.1662 г дифосфата
магния. -
Бронзы,
содержащей 0.8% свинца, чтобы при
определении его в результате анализа
получить 0.1595 г сульфата свинца.
4.3.4.
Пересчет
на сухое вещество
Если
анализируемый образец наряду с основными
определяемыми частями содержит воду,
процент которой определен, то результат
анализа может быть пересчитан на
абсолютно сухое вещество.
Пример
15. При
анализе хлорида бария было определено
55.22% бария и 14.73% кристаллизационной
воды. Сколько процентов бария в абсолютно
сухом веществе?
Решение.
В 100 г анализируемого вещества содержится
14.73 г воды; следовательно, 56.22 г бария
содержится в 85.27 г абсолютно сухого
вещества,
З а
д а ч и
-
При
анализе карбоната магния было определено
17.39% магния и 39.13% кристаллизационной
воды. Сколько %
магния
в абсолютно сухом образце? -
При
анализе сульфата марганца было определено
21.23% марганца и 41.70% кристаллизационной
воды. Сколько % марганца в абсолютно
сухом образце? -
При
анализе хромата натрия было определено
15.21% хрома и 52.64% кристаллизационной
воды. Сколько % хрома в абсолютно сухом
образце? -
При
анализе каменного угля было определено
2.85% воды, 8.73% золы и 1.37% серы. Сколько %
золы и серы в абсолютно сухом образце?
-
При
анализе каменного угля было определено
1.87% воды, 6.28% золы и 0.72% серы. Сколько %
золы
и серы в абсолютно сухом образце? -
При
анализе бетона было определено 15.28%
воды, 70.12% нерастворимого остатка, 2.62%
суммы полуторных оксидов, 6.8% оксида
кальция и 1.72% оксида магния. Пересчитать
результат анализа на абсолютно сухой
образец. -
При
анализе мергеля было определено 6.41%
воды, 1.32% SiO2,
2.89% R2O3,
39.27% CaO,
9.34% MgO
и 0.44% SO3.
Пересчитать результат анализа на
абсолютно сухое вещество. -
При
анализе глины было найдено 9.48% воды,
52.73% SiO2,
25.42% А12О3,
1.83% Fe2O3,
0.88% CaO
и 0.48% MgO.
Пересчитать результат анализа на
абсолютно сухое вещество.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Аналитический множитель
Cтраница 1
Аналитические множители для различных весовых определений вместе с их логарифмами приводятся в химических справочниках.
[1]
Аналитический множитель или фактор выражает отношение эквивалентной массы определяемой составной части к эквивалентной массе ее весовой формы. При вычислении аналитических множителей обычно используют атомные и молекулярные массы.
[2]
Аналитические множители обычно приводятся в специальных таблицах. Если не имеется таблицы, то множитель очень легко рассчитать.
[3]
Аналитическим множителем, или фактором, называют отношение эквивалента определяемой составной части к эквиваленту ее весовой формы. Вычисляя аналитический фактор, обычно берут отношение масс соответственных количеств молекул ( или атомов) определяемой составной части и ее весовой формы.
[4]
Значения аналитических множителей приведены в соответствующих справочниках.
[5]
Значения аналитических множителей приводятся в соответствующих справочниках.
[6]
Пользование аналитическими множителями особенно удобно в тех случаях, когда в лаборатории ежедневно анализируют большое число образцов одного и того же материала.
[7]
Пользование аналитическими множителями особенно удобно в тех случаях, когда в лаборатории ежедневно анализируют большое число образцов одного и того же материала.
[8]
Чему равен аналитический множитель.
[9]
Значения величин аналитических множителей приводятся в соответствующих справочниках.
[10]
Значения величин аналитических множителей сведены в таблицы. В этих таблицах ( см. Приложения) первая графа обозначена словом определяют. Вторая графа обозначена весовая форма. В четвертой графе той же строки дана величина логарифма этого фактора.
[11]
При расчете аналитического множителя исходим из того, что в одной грамм-молекуле Fe2O3 ( 159 7 г) содержится 111 7 г железа.
[12]
Значения величин аналитических множителей приводятся в соответствующих справочниках.
[13]
Что называется аналитическим множителем.
[14]
Что называется аналитическим множителем, или фактором пересчета.
[15]
Страницы:
1
2
3
