Виталий
Ученик
(229),
на голосовании
13 лет назад
Вычислить атомную массу двухвалентного металла и определить, какой металл, если 8,34г металла окисляются 0,680л кислорода(условия нормальные)
Голосование за лучший ответ
Александр Максимов
Мыслитель
(7496)
13 лет назад
2Me + O2 –> 2MeO
на окисление металла идет
0,68/22,4 = 0.030357 моль кислорода, а
по уравнению реакции окисляется металла в 2 раза больше,
чем кислорода, т. е. 0,0607 моль
значит атомная масса металла равна 8,34/0,0607 = 137,36 г/моль
смотрим по таблице Менделеева – это барий (Ba).
- Назад
- 1
- 2
- Далее
-
Страница 1 из 2
Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
Помогите пожалуйста с решением 2 задач
1. Вычислить атомную массу двухвалентного металла и определить какой это металл, если 8,34г металла окисляются 0,680л кислорода(н.у.).
2. Какой газ и в каком количестве выделится на аноде при электролизе раствора CuSO4 с угольным анодом,если масса катода увеличится на 6,4г?
Учусь на 5 курсе технического вуза, специальность ни как не связана с химией, тем не менее её включили в список предметов, так как якобы не додали материал на первом курсе, то есть с первого курса я с химией не встречался, поэтому был бы очень благодарен, если бы кто-нибудь более-менее подробно расписал решение данных задач.
Изменено 10 Марта, 2012 в 12:31 пользователем fulcrum
Ссылка на комментарий
–>

-
- Поделиться
по решению задач: главное – знать закон сохранения массы и 3 формулы: n=m/M; n=V/Vm; n=N/Na
Vm = 22.4 л/моль, 3 формула не потребуется.
1. 2Me + O2 = 2MeO
n(O2) = 0.030357
n(Me) = 2n(O2) = 0.0607
M(Me) = m/n = 137.4
Металл – Барий.
2. Cu2+ + 2e- = Cu0
2SO42- + 2H2O -4e- = 2H2SO4 + O2
n(O2) = 0.5n(Cu) = 0.5*6.4/64 = 0.05 моль.
Выделится кислород в количестве 0.05 моль.
По формулам выше можете найти как массу, так и объём.
Во 2й задаче могу ошибаться.
Ссылка на комментарий
-
- Поделиться
по решению задач: главное – знать закон сохранения массы и 3 формулы: n=m/M; n=V/Vm; n=N/Na
Vm = 22.4 л/моль, 3 формула не потребуется.
1. 2Me + O2 = 2MeO
n(O2) = 0.030357
n(Me) = 2n(O2) = 0.0607
M(Me) = m/n = 137.4
Металл – Барий.
2. Cu2+ + 2e- = Cu0
2SO42- + 2H2O -4e- = 2H2SO4 + O2
n(O2) = 0.5n(Cu) = 0.5*6.4/64 = 0.05 моль.
Выделится кислород в количестве 0.05 моль.
По формулам выше можете найти как массу, так и объём.
Во 2й задаче могу ошибаться.
Чтобы не ошибаться, записывайте уравнения процессов, происходящих на электродах, в полной форме.
CuSO4 <=> Cu2+ + SO42-
катод (-) Cu2+ + 2e = Cu
анод (+) 2H2O – 4e = O2 + 4H+
2Cu2+ + 2H2O (электролиз)-> 2Cu + O2 + 4H+
2CuSO4 + 2H2O (электролиз)-> 2Cu + O2 + 2H2SO4
Изменено 10 Марта, 2012 в 16:40 пользователем Че Гулливер
Ссылка на комментарий

-
- Поделиться
А электроны уравнивать кто будет?
Ссылка на комментарий
-
- Поделиться
А электроны уравнивать кто будет?
А Вы хорошенько посмотрите.

Изменено 10 Марта, 2012 в 16:45 пользователем Че Гулливер
Ссылка на комментарий

-
- Поделиться
Ну обычно это прям в процессах пишут, ну точнее я только так видел, не суть как важно в принципе
Ссылка на комментарий
-
- Поделиться
Ну обычно это прям в процессах пишут, ну точнее я только так видел, не суть как важно в принципе

Ссылка на комментарий
- Автор
-
- Поделиться
спасибо огромное, многое понятно, но есть пара вопросов…
по 1 задаче: не понимаю, почему n(Me) = 2n(O2) ?
по 2 задаче: 2CuSO4 + 2H2O (электролиз)-> 2Cu + O2 + 2H2SO4 означает, что в процессе электролиза раствора CuSO4 получаем 2Cu + O2 + 2H2SO4, а куда делся водород с анода, соединился с кислотным остатком? В таком случае можно сказать, что на аноде выделится кислород и водород, или же только кислород? Не понимаю, что отражает эта запись 2Cu2+ + 2H2O (электролиз)-> 2Cu + O2 + 4H+ ?
И почему n(O2) = 0.5n(Cu) ? Вероятно из тех же соображений, из которых в первой задаче n(Me) = 2n(O2)…подскажите пожалуйста принцип
Изменено 11 Марта, 2012 в 13:04 пользователем fulcrum
Ссылка на комментарий
-
- Поделиться
спасибо огромное, многое понятно, но есть пара вопросов…
по 1 задаче: не понимаю, почему n(Me) = 2n(O2) ?
по 2 задаче: 2CuSO4 + 2H2O (электролиз)-> 2Cu + O2 + 2H2SO4 означает, что в процессе электролиза раствора CuSO4 получаем 2Cu + O2 + 2H2SO4, а куда делся водород с анода, соединился с кислотным остатком? В таком случае можно сказать, что на аноде выделится кислород и водород, или же только кислород? Не понимаю, что отражает эта запись 2Cu2+ + 2H2O (электролиз)-> 2Cu + O2 + 4H+ ?
И почему n(O2) = 0.5n(Cu) ? Вероятно из тех же соображений, из которых в первой задаче n(Me) = 2n(O2)…подскажите пожалуйста принцип
1. Такая зависимость вытекает из стехиометрического правила, которое дословно можно понять, как “вещества вступают в реакции между собой в определенных соотношениях”. Например, в первой задаче на 2 моль металла приходится 1 моль кислорода или на 1 моль металла приходится 0,5 моль кислорода и т.д. В этом и заключается применение стехиометрического правила.
2. Относительно первой части второго вопроса. Здесь тоже применяется стехиометрическое правило. Теперь об электролизе. На катоде будет восстанавливаться медь, а на аноде окисляться вода. Почему? Да потому что электролизу подвергается раствор, а не расплав. Естественно, сначала из раствора восстановится вся медь. Затем, если продолжать электролиз, на катоде начнет восстанавливаться вода. Вот тогда-то на катоде будет выделяться водород. 2Cu2+ + 2H2O (электролиз)-> 2Cu + O2 + 4H+ – это сокращенная форма записи процесса, протекающего на электроде.
Ссылка на комментарий
- Автор
-
- Поделиться
1. Такая зависимость вытекает из стехиометрического правила, которое дословно можно понять, как “вещества вступают в реакции между собой в определенных соотношениях”. Например, в первой задаче на 2 моль металла приходится 1 моль кислорода или на 1 моль металла приходится 0,5 моль кислорода и т.д. В этом и заключается применение стехиометрического правила.
хорошо, а как мне определить стехиометрию для моей реакции, откуда информация, что на 2 моля неизвестного металла приходится один моль кислорода?
2.Теперь об электролизе. На катоде будет восстанавливаться медь, а на аноде окисляться вода. Почему? Да потому что электролизу подвергается раствор, а не расплав. Естественно, сначала из раствора восстановится вся медь. Затем, если продолжать электролиз, на катоде начнет восстанавливаться вода. Вот тогда-то на катоде будет выделяться водород.
на аноде окисляется вода, и выделяется кислород и водород, так? так в итогде как с водородом-то быть, его учитывать, и рассчитывать количество тогда уже водорода и кислорода, или он сразу соединяется с кислотным остатком и учитывать его не надо?
Изменено 11 Марта, 2012 в 14:12 пользователем fulcrum
Ссылка на комментарий
- Назад
- 1
- 2
- Далее
- Страница 1 из 2
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение эквивалентной массы вещества
Задача №1
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Из условия задачи следует, что в оксиде металла на 5г металла приходится 4,44г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5г металла эквивалентны 4,44г кислорода
mЭ(Ме) г/моль металла эквивалентны 8г/моль кислорода
Откуда mЭ(Ме) = 8 . 5/4,44 = 9,01г/моль.
Ответ: mЭ(Ме) = 9,01г/моль.
Задача №2
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
I Вариант
Из условия задачи следует, что 0,200г кислорода и 3,17г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200г кислорода эквивалентны 3,17г галогена
mЭ(О2) 8г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Откуда: mЭ(Г) 8 . 3,17/0,200 = 126,8г/моль.
Ответ: mЭ(Г) = 126,8г/моль.
II Вариант
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
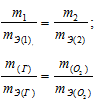
Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
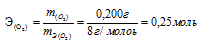
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
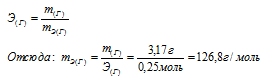
Ответ: 126,г/моль.
Задача №3
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) =24/2 = 12г/моль. Следовательно, 21г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 его эквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14г. Зная, что 1л кислорода по массе составляет 1,4г, рассчитаем объём кислорода расходуемого при сгорании 21г магния, составив пропорцию:
1,4 : 1 = 14 : х;
х = 14 . 1/1,4 = 10л.
Ответ: V(O2) = 10л.
Задача№4
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Из условия задачи следует, что в оксиде металла на 3,24г металла приходится 0,24г кислорода (3,48 – 3,24 = 0,24г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;
х = 8 . 3,24/0,24 =108г/моль.
В сульфиде металла на 3,24г металла приходится 0,48г серы (3,72 – 3,24 = 0,48г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;
х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108г/моль; mэ(S) = 16г/моль.
Задача№5
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Зная, что эквивалентный объём кислорода равен 5,6л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6;
х = 8,34 . 5,6/0,680 = 68,68г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) . В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4г/моль.
Определяем, какой это металл по таблице «Периодическая система химических элементов Д.И. Менделеева», учитывая, что его атомная масса составляет 137,4. Такой атомной массе соответствует барий – элемент№56.
Ответ: 137,4; Ba.
Задача№6
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у = 65,2/Ar(As) : 34,8/Ar(O2) = 65,2/74,92 : 34,8/16 = 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
M(As2O5) = 229,84г/моль.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 5 = 80г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
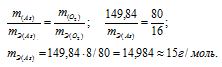
б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у = 75,7/74,92 : 24,3/16 = 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84г/моль.
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 3 = 48г.
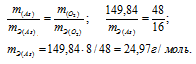
Ответ: а) 15г/моль; 24,97г/моль.
Задача№7
,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
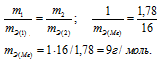
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
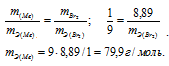
Ответ: 9г/моль; 79,9г/моль.
Задача№8
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Согласно закону эквивалентов:
mэ(соли) = mэ(Cu) + mэ(Cl2).
Отсюда mэ(Cl2) = mэ(соли) – mэ(Cl2) = 99,5 – 35,5 = 64г/моль.
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда: CuxCly = x : y = 63,5/63,546 : 35,45/35,5 = 0,992 : 0,999 = 1 : 1
Отсюда CuxCly = CuCl.
Ответ: CuCl.
Задача№9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
M(H2SO4) =98г/моль.
Находим массу водорода в 14,7г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:
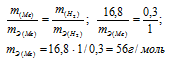
Учитывая, что эквивалентный объём водорода равен 11,2л/моль, рассчитаем объём который занимает 0,3г водорода: из пропорции:
1 : 11,2 = 0,3 : х;
х = 11,2 . 0,3/ 1 = 3,36л.
Ответ: mэ(Ме) = 56г/моль; V(H2) = 3,36л.
Задача№10
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
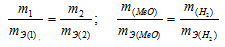
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 4л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000мл/моль.
Отношение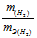 заменим равным ему отношением
заменим равным ему отношением 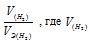 – объём водорода;
– объём водорода;
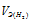 – эквивалентный объём водорода.
– эквивалентный объём водорода.
Тогда получим отношение 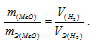
Находим эквивалентную массу оксида металла:
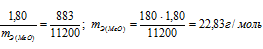
Согласно закону эквивалентов:
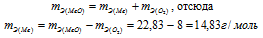
Ответ: 22,83г/моль; 14,83г/моль.
yvintinswhth760
Вопрос по химии:
вычислить атомную массу двухвалентного металла и определить какой это металл если 8,34 г металла окисляются 0,680 л кислорода у. н.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
wirhen583
8,34г 0,68л
2Me + O2=2MeO
2х 22,4л
х= 8,34*22,4/0,68*2=137
Ar(Ba)=137
это барий
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Содержание
- Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляется 0,68 л кислорода (условия нормальные)
- Задачи на эквивалент и закон эквивалентов
- Вопросы для самоконтроля
- Задачи на эквивалент и закон эквивалентов
- Вопросы для самоконтроля
- Как вычислить атомную массу двухвалентного металла
- Как написать хороший ответ?
- Вычислить атомную массу двухвалентного металла и определить какой это металл, если 8,34 г этого металла окисляются 0,680 л кислорода при нормальных условиях.
Составить электронную формулу и графическую схему заполнения электронами валентных валентных орбиталей атома азота (углерода, кислорода, фосфора, хлора, натрия).
Азот N 1s 2 2s 2 2p 3
Углерод C 1s 2 2s 2 2p 2
Кислород O 1s 2 2s 2 2p 4
Фосфор P 1s 2 2s 2 2p 6 3s 2 3p 3
Хлор Cl 1s 2 2s 2 2p 6 3s 2 3p 5
Натрий Na 1s 2 2s 2 2p 6 3s 1
2.Указать тип химической связи в молекулах: H2, Cl2, HCl. Привести схему перекрывания электронных облаков.
H2 – Ковалентная неполярная связь
Cl2 – Ковалентная неполярная связь.
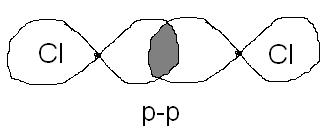
HCl – Ковалентная полярная связь.
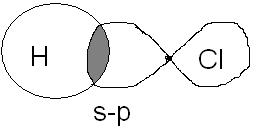
3. Эквивалентная масса хлора равна 35,5 г/моль, молярная масса меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Мэ(Cu)= 99.5-35.5 = 64 г/моль.
Валентность меди = 63,5/64 =1; => формула CuCl.
При сгорании 5г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Мэ(O2)= 32 * 1/4 = 8 г/моль.
Мэ(Me) = 5*8/4,44 = 9 г/моль.
Ответ: Мэ(Me) = 9 г/моль.
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляется 0,68 л кислорода (условия нормальные).
n(Me) = 2*n(O2) = 0.03*2 = 0.06 моль.
A(Me)=m(Me)/n(Me) = 8.34/0.06 = 137 г/моль. => Ba.
Источник
Задачи на эквивалент и закон эквивалентов
Задача №1.
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Задача №2.
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
Задача №3.
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Задача №4.
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Задача №5.
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Задача №6.
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
Задача №7.
1,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Задача №8.
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Задача №9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
Задача №10.
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, из-меренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Задача №11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Задача №12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Задача №13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Задача №14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Задача №15.
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты
Решение:
Задача №16.
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Задача №17.
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Задача №18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Вопросы для самоконтроля
Задача №19.
От чего зависит эквивалент химического элемента: а) от валентности элемента; б) всегда является постоянной величиной?
Решение:
Задача №20.
Какая формула правильно выражает закон эквивалентов:
а) ; б)
Решение:
Задача №21.
Фосфор образует два различных по составу хлорида. Эквивалент какого элемента сохраняется в этих соединениях постоянным: а) хлора; б) фосфора?
Решение:
Задача №22.
Выбрать правильные значения эквивалентных объемов кислорода и водоро-да при нормальных условиях: а) 11,2л O2 и 22,4л H2 б) 11,2л O2 и 11,2л H2 в.) 5,6л O2 и 11,2л H2.
Решение:
Задача №23.
Эквивалентная масса металла равна 12 г/моль. Чему равна эквивалентная масса его оксида: а) 24 г/моль; б) нельзя определить; в) 20 г/моль?
Решение:
Задача №24.
Эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кисло-рода. Во сколько раз масса оксида больше массы металла: а) в 1,5 раза; б) в 2 раза; в) в 3 раза?
Решение:
Задача25.
Сера образует хлориды S2Cl2 и SCl2, эквивалентная масса серы в SCl2 равна 16г/моль. Выбрать правильное значение эквивалентной массы серы в S2Cl2: а) 8 г/моль;
б) 16 г/моль; в) 32 г/моль.
Решение:
Задача26.
Одинаков ли эквивалент хрома в соединениях CrCl3 и Cr2(SO4)2: а) да; б) нет?
Решение:
Задача27.
Одинакова ли эквивалентная масса железа в соединениях FeCl2 и FeCl3: а) да; б) нет?
Решение:
Источник
Задачи на эквивалент и закон эквивалентов
Задача №1.
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Задача №2.
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
Задача №3.
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Задача №4.
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Задача №5.
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Задача №6.
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
Задача №7.
1,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Задача №8.
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Задача №9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
Задача №10.
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, из-меренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Задача №11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Задача №12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Задача №13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Задача №14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Задача №15.
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты
Решение:
Задача №16.
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Задача №17.
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Задача №18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Вопросы для самоконтроля
Задача №19.
От чего зависит эквивалент химического элемента: а) от валентности элемента; б) всегда является постоянной величиной?
Решение:
Задача №20.
Какая формула правильно выражает закон эквивалентов:
а) ; б)
Решение:
Задача №21.
Фосфор образует два различных по составу хлорида. Эквивалент какого элемента сохраняется в этих соединениях постоянным: а) хлора; б) фосфора?
Решение:
Задача №22.
Выбрать правильные значения эквивалентных объемов кислорода и водоро-да при нормальных условиях: а) 11,2л O2 и 22,4л H2 б) 11,2л O2 и 11,2л H2 в.) 5,6л O2 и 11,2л H2.
Решение:
Задача №23.
Эквивалентная масса металла равна 12 г/моль. Чему равна эквивалентная масса его оксида: а) 24 г/моль; б) нельзя определить; в) 20 г/моль?
Решение:
Задача №24.
Эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кисло-рода. Во сколько раз масса оксида больше массы металла: а) в 1,5 раза; б) в 2 раза; в) в 3 раза?
Решение:
Задача25.
Сера образует хлориды S2Cl2 и SCl2, эквивалентная масса серы в SCl2 равна 16г/моль. Выбрать правильное значение эквивалентной массы серы в S2Cl2: а) 8 г/моль;
б) 16 г/моль; в) 32 г/моль.
Решение:
Задача26.
Одинаков ли эквивалент хрома в соединениях CrCl3 и Cr2(SO4)2: а) да; б) нет?
Решение:
Задача27.
Одинакова ли эквивалентная масса железа в соединениях FeCl2 и FeCl3: а) да; б) нет?
Решение:
Источник
Как вычислить атомную массу двухвалентного металла
Вопрос по химии:
вычислить атомную массу двухвалентного металла и определить какой это металл если 8,34 г металла окисляются 0,680 л кислорода у. н.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
8,34г 0,68л
2Me + O2=2MeO
2х 22,4л
х= 8,34*22,4/0,68*2=137
Ar(Ba)=137
это барий
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Источник
| 🎓 Заказ №: 22200 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Вычислить атомную массу двухвалентного металла и определить какой это металл, если 8,34 г этого металла окисляются 0,680 л кислорода при нормальных условиях.
Решение: Обозначим неизвестный металл Me Записываем уравнение реакции 2Mе О2 2MeO Согласно закону эквивалентов вещества реагируют в эквивалентных количествах. Составляем пропорцию

Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:






















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник
