Download Article
Download Article
Atomic mass is the sum of all the protons, neutrons, and electrons in a single atom or molecule. However, the mass of an electron is so small, it is considered negligible and not included in the calculation.[1]
Though technically incorrect, the term is also often used to refer to the average atomic mass of all of the isotopes of one element. This second definition is actually the relative atomic mass, also known as the atomic weight, of an element.[2]
The atomic weight takes into account the average of the masses of naturally occurring isotopes of the same element. Chemists need to distinguish between these two types of atomic mass to guide their work – an incorrect value for atomic mass can, for instance, lead to an incorrect calculation of an experiment’s yield.
-

1
Understand how atomic mass is represented. Atomic mass, the mass of a given atom or molecule, can be expressed in standard SI mass units – grams, kilograms, etc. However, because atomic masses, when expressed in these terms, are incredibly small, atomic mass is often expressed in unified atomic mass units (usually shortened to “u” or “amu”) or in Dalton’s (Da). The standard for one atomic mass unit is equal to 1/12th of the mass of a standard carbon-12 isotope.[3]
- The atomic mass is the number of grams of the element in one mole of atoms of the element. This is a very useful property when it comes to practical calculations, as it allows easy conversion between the mass and moles of a given quantity of atoms or molecules of the same type.
-

2
Locate atomic mass on the periodic table. Most standard periodic tables list the relative atomic masses (atomic weights) of each element. This is almost always written as a number at the bottom of the element’s square on the table, under its one or two letter chemical symbol. This number is usually expressed as a decimal rather than as a whole number.
- Note that the relative atomic masses listed on the periodic table are average values for the associated element. Chemical elements have different isotopes – chemical forms that differ in mass because of the addition or subtraction of one or more neutrons to the atom’s nucleus.[4]
Thus, the relative atomic mass listed on the periodic table is suitable as an average value for atoms of a certain element, but not as the mass of a single atom of that element. - Relative atomic masses, as listed on the periodic table, are used to calculate molar masses for atoms and molecules. Atomic masses, when expressed in amu, as on the periodic table, are technically unitless. However, by simply multiplying an atomic mass by 1 g/mol, a workable quantity is obtained for an element’s molar mass – the mass (in grams) of one mole of an element’s atoms.
- For example, the atomic mass of iron is 55.847 amu, which means one mole of iron atoms would weigh 55.847 grams.
Advertisement
- Note that the relative atomic masses listed on the periodic table are average values for the associated element. Chemical elements have different isotopes – chemical forms that differ in mass because of the addition or subtraction of one or more neutrons to the atom’s nucleus.[4]
-

3
Understand that periodic table values are an average atomic mass for an element. As has been noted, the relative atomic masses listed for each element on the periodic table are average values of all of an atom’s isotopes. This average value is valuable for many practical calculations – like, for instance, calculating the molar mass of a molecule comprised of several atoms. However, when dealing with individual atoms, this number is sometimes insufficient.
- Because it’s an average of several different types of isotopes, the value on the periodic table isn’t the exact value for any single atom’s atomic mass.
- The atomic masses for individual atoms must be calculated by taking into account the exact number of protons and neutrons in a single atom.
Advertisement
-

1
Find the atomic number of the element or isotope. The atomic number is the number of protons in an element, and never varies.[5]
For example, all hydrogen atoms, and only hydrogen atoms, have 1 proton. Sodium has an atomic number of 11 because its nucleus has 11 protons, while oxygen has an atomic number of 8 because its nucleus has 8 protons. You can find the atomic number of any element on the periodic table – in nearly all standard periodic tables: it’s the number above an element’s 1 or 2-letter chemical symbol. This number will always be a positive whole number.- Let’s say that we’re working with the carbon atom. Carbon always has 6 protons, so we know its atomic number is 6. We can also see on the periodic table that the square for carbon (C) has a “6” at the top, signifying that carbon’s atomic number is 6.
- Note that an element’s atomic number doesn’t have any direct bearing on its relative atomic mass as listed on the periodic table. Though, especially among elements at the top of the periodic table, it may seem that an atoms’ atomic mass is about twice its atomic number, atomic mass isn’t ever calculated by doubling an element’s atomic number.
-

2
Find the number of neutrons in the nucleus. The number of neutrons can vary among atoms of a certain element. While 2 atoms with the same number of protons and differing numbers of neutrons are both the same element, they are different isotopes of that element. Unlike the number of protons in an element, which never changes, the number of neutrons in atoms of a certain element can vary often enough that the average atomic mass of the element must be expressed as a decimal value between two whole numbers.
- The number of neutrons can be determined by the isotope designation of the element. For example, carbon-14 is a naturally occurring radioactive isotope of carbon-12. You will often see an isotope designated with the number as a superscript before the element symbol: 14C. The number of neutrons is calculated by subtracting the number of protons from the isotope number: 14 – 6 = 8 neutrons.
- Let’s say the carbon atom we’re working with has six neutrons (12C). This is by far the most common isotope of carbon, accounting for nearly 99% of all carbon atoms.[6]
However, about 1% of carbon atoms have 7 neutrons (13C). Other types of carbon atoms with more or less than 6 or 7 neutrons exist in very small amounts.
-

3
Add the proton and neutron count. This is the atomic mass of that atom. Don’t worry about the number of electrons orbiting the nucleus – their combined mass is very, very small, so, in most practical cases, it won’t significantly affect your answer.[7]
- Our carbon atom has 6 protons + 6 neutrons = 12. The atomic mass of this specific carbon atom is 12. If it was a carbon-13 isotope, on the other hand, we would know that it has 6 protons + 7 neutrons = an atomic weight of 13.
- The actual atomic weight of carbon-13 is 13.003355[8]
, and is more precise because it was determined experimentally. - Atomic mass is very close to the isotope number of an element. For basic calculation purposes, isotope number is equal to atomic mass. When determined experimentally, the atomic mass is slightly higher than the isotope number due to the very small mass contribution from electrons.
Advertisement
-

1
Determine which isotopes are in the sample. Chemists often determine the relative proportions of isotopes in a given sample by using a special tool called a mass spectrometer. However, at student-level chemistry, this information is often provided for you on school tests, etc., in the form of established values from scientific literature.
- For our purposes, let’s say we’re working with the isotopes carbon-12 and carbon-13.
-

2
Determine the relative abundance of each isotope in the sample. Within a given element, different isotopes appear in different proportions. These proportions are almost always expressed as percentages. Some isotopes will be very common, while others will be very rare – at times, so rare that they can barely be detected. This information can be determined through mass spectrometry or from a reference book.
- Let’s say that the abundance of carbon-12 is 99% and the abundance of carbon-13 is 1%. Other carbon isotopes do exist, but they exist in quantities so small that, for this example problem, they can be ignored.
-

3
Multiply the atomic mass of each isotope by its proportion in the sample. Multiply the atomic mass of each isotope by its percent abundance (written as a decimal). To convert a percentage to a decimal, simply divide it by 100. The converted percentages should always add up to 1.
- Our sample contains carbon-12 and carbon-13. If carbon-12 makes up 99% of the sample and carbon-13 makes up 1% of the sample, multiply 12 (the atomic mass of carbon-12) by 0.99 and 13 (the atomic mass of carbon-13) by 0.01.
- A reference book will give percent proportions based on all the known amounts of an element’s isotopes. Most chemistry textbooks include this information in a table at the end of the book. A mass spectrometer can also yield the proportions for the sample being tested.
-

4
Add the results. Sum the products of the multiplications you performed in the previous step. The result of this addition is the relative atomic mass of your element – the average value of the atomic masses of your element’s isotopes. When discussing an element in general, and not specific isotopes of that element, this value is used.
- In our example, 12 x 0.99 = 11.88 for carbon-12, while 13 x 0.01 = 0.13 for carbon-13. The relative atomic mass of our example is 11.88 + 0.13 = 12.01.
Advertisement
Add New Question
-
Question
How do I find the mass number of an atom?

Add the protons and neutrons together to find the mass, or add the masses of the isotopes multiplied by the atom’s natural abundance.
-
Question
If 1 amu is 1/12 of a carbon 12 atom, why is it that when I add the masses of the individual parts of a carbon 12 atom, I get more than 12 amu?

1 u = 1/12 the mass of carbon 12 by definition. You’re adding the masses of uncombined protons and neutrons, 1.0073 u and 1.0087 u respectively. But when those particles fuse together to form an atom, some of the mass is converted into energy according to E=mc^2. The lost mass is called the “mass defect”, and the equivalent amount of energy is the “binding energy.”
-
Question
How can I find the mass of any atom to convert it in a.m.u.?

We can find the mass of any atom by adding the electrons, protons and neutrons.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Things You’ll Need
- Chemistry reference book
- Calculator
References
About This Article
Article SummaryX
To calculate atomic mass, start by finding the atomic number of the element, which is the number above the element on the periodic table. Next, find the number of neutrons in the nucleus by subtracting the atomic number from the isotope number. Finally, add the atomic number and the number of neutrons to get the atomic mass. To learn how to locate an element’s atomic mass on the periodic table, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 953,628 times.
Reader Success Stories
-

“I couldn’t do my homework for my science teacher without this article, it has helped me understand the topic…” more
Did this article help you?
Загрузить PDF
Загрузить PDF
Атомной массой называется сумма масс всех протонов, нейтронов и электронов, из которых состоит тот или иной атом или молекула.[1]
По сравнению с протонами и нейтронами масса электронов очень мала, поэтому она не учитывается в расчетах.[2]
Хотя это и некорректно с формальной точки зрения, нередко данный термин используется для обозначения средней атомной массы всех изотопов элемента. На самом деле это относительная атомная масса, называемая также атомным весом элемента.[3]
Атомный вес – это среднее значение атомных масс всех изотопов элемента, встречающихся в природе. Химики должны различать эти два типа атомной массы при выполнении своей работы – неправильное значение атомной массы может, к примеру, привести к неправильному результату для выхода продукта реакции.
-

1
Изучите как записывается атомная масса. Атомная масса, то есть масса данного атома или молекулы, может быть выражена в стандартных единицах системы СИ – граммах, килограммах и так далее. Однако в связи с тем, что атомные массы, выраженные в этих единицах, чрезвычайно малы, их часто записывают в унифицированных атомных единицах массы, или сокращенно а.е.м. – атомные единицы массы. Одна атомная единица массы равна 1/12 массы стандартного изотопа углерод-12.[4]
- Атомная единица массы характеризует массу одного моля данного элемента в граммах. Эта величина очень полезна при практических расчетах, поскольку с ее помощью можно легко перевести массу заданного количества атомов или молекул данного вещества в моли, и наоборот.
-

2
Найдите атомную массу в периодической таблице Менделеева. В большинстве стандартных таблиц Менделеева содержатся атомные массы (атомные веса) каждого элемента. Как правило, они приведены в виде числа в нижней части ячейки с элементом, под буквами, обозначающими химический элемент. Обычно это не целое число, а десятичная дробь.
- Обратите внимание, что все относительные атомные массы, указанные в таблице Менделеева, для каждого элемента являются средними значениями. У химических элементов есть различные изотопы – химические разновидности, имеющие разные массы из-за дополнительных или отсутствующих нейтронов в атомном ядре.[5]
Следовательно, относительные атомные массы, перечисленные в периодической таблице, могут использоваться как среднее значение для атомов определенного элемента, но не как масса одного атома данного элемента. - Относительные атомные массы, приведенные в периодической таблице, используются для расчета молярных масс атомов и молекул. Атомные массы, выраженные в а.е.м. (как в таблице Менделеева), по существу безразмерны. Однако просто умножив атомную массу на 1 г/моль, мы получаем полезную характеристику элемента – массу (в граммах) одного моля атомов этого элемента.
- Обратите внимание, что все относительные атомные массы, указанные в таблице Менделеева, для каждого элемента являются средними значениями. У химических элементов есть различные изотопы – химические разновидности, имеющие разные массы из-за дополнительных или отсутствующих нейтронов в атомном ядре.[5]
-

3
Помните о том, что в периодической таблице приведены средние атомные массы элементов. Как было отмечено ранее, относительные атомные массы, указанные для каждого элемента в периодической системе, являются средними значениями масс всех изотопов атома. Это среднее значение ценно для многих практических целей: к примеру, оно используется при расчете молярной массы молекул, состоящих из нескольких атомов. Однако когда вы имеете дело с отдельными атомами, этого значения, как правило, бывает недостаточно.
- Поскольку средняя атомная масса представляет собой усредненное значение для нескольких изотопов, величина, указанная в таблице Менделеева не является точным значением атомной массы любого единичного атома.
- Атомные массы отдельных атомов необходимо рассчитывать с учетом точного числа протонов и нейтронов в единичном атоме.
Реклама
-

1
Найдите атомный номер данного элемента или его изотопа. Атомный номер – это количество протонов в атомах элемента, оно никогда не изменяется.[6]
Например, все атомы водорода, причем только они, имеют один протон. Атомный номер натрия равен 11, поскольку в его ядре одиннадцать протонов, тогда как атомный номер кислорода составляет восемь, так как в его ядре восемь протонов. Вы можете найти атомный номер любого элемента в периодической таблице Менделеева – практически во всех ее стандартных вариантах этот номер указан над буквенным обозначением химического элемента. Атомный номер всегда является положительным целым числом.- Предположим, нас интересует атом углерода. В атомах углерода всегда шесть протонов, поэтому мы знаем, что его атомный номер равен 6. Кроме того, мы видим, что в периодической системе, в верхней части ячейки с углеродом (C) находится цифра “6”, указывающая на то, что атомный номер углерода равен шести.
- Обратите внимание, что атомный номер элемента не связан однозначно с его относительной атомной массой в периодической системе. Хотя, особенно для элементов в верхней части таблицы, может показаться, что атомная масса элемента вдвое больше его атомного номера, она никогда не рассчитывается умножением атомного номера на два.
-

2
Найдите число нейтронов в ядре. Количество нейтронов может быть различным для разных атомов одного и того же элемента. Когда два атома одного элемента с одинаковым количеством протонов имеют разное количество нейтронов, они являются разными изотопами этого элемента. В отличие от количества протонов, которое никогда не меняется, число нейтронов в атомах определенного элемента может зачастую меняться, поэтому средняя атомная масса элемента записывается в виде десятичной дроби со значением, лежащим между двумя соседними целыми числами.
- Количество нейтронов можно определить по обозначению изотопа элемента. Например, углерод-14 представляет собой радиоактивный изотоп углерода-12, встречающийся в природе. Часто номер изотопа указывается в виде надстрочного числа, стоящего перед символом элемента: 14C. Количество нейтронов находится путем вычитания числа протонов из номера изотопа: 14 – 6 = 8 нейтронов.
- Допустим, что интересующий нас атом углерода имеет шесть нейтронов (12C). Это наиболее распространенный изотоп углерода, насчитывающий около 99% всех атомов данного элемента.[7]
Однако около 1% атомов углерода имеют 7 нейтронов (13C). Другие виды атомов углерода имеют больше 7 или меньше 6 нейтронов и существуют в очень малых количествах.
-

3
Сложите количество протонов и нейтронов. Это и будет атомной массой данного атома. Не обращайте внимания на количество электронов, которые окружают ядро – их суммарная масса чрезвычайно мала, поэтому они практически не влияют на ваши расчеты.
- Наш атом углерода имеет 6 протонов + 6 нейтронов = 12. Таким образом, атомная масса данного атома углерода равна 12. Если бы это был изотоп “углерод-13”, то мы бы знали, что у него есть 6 протонов + 7 нейтронов = атомная масса 13.
- В действительности атомная масса углерода-13 составляет 13,003355[8]
, причем это значение является более точным, поскольку было определено экспериментальным путем. - Атомная масса очень близка к номеру изотопа. Для удобства вычислений номер изотопа часто полагают равным атомной массе. Экспериментально определенные значения атомной массы немного превышают номер изотопа из-за очень малого вклада со стороны электронов.
Реклама
-

1
Определите, какие изотопы содержатся в образце. Химики часто определяют соотношение изотопов в конкретном образце с помощью специального прибора под названием масс-спектрометр. Однако при обучении эти данные будут предоставлены вам в условиях заданий, контрольных и так далее в виде значений, взятых из научной литературы.
- В нашем случае допустим, что мы имеем дело с двумя изотопами: углеродом-12 и углеродом-13.
-

2
Определите относительное содержание каждого изотопа в образце. Для каждого элемента различные изотопы встречаются в разных соотношениях. Эти соотношения почти всегда выражают в процентах. Некоторые изотопы встречаются очень часто, тогда как другие очень редки – временами настолько, что их с трудом можно обнаружить. Эти величины можно определить с помощью масс-спектрометрии или найти в справочнике.
- Допустим, что концентрация углерода-12 равна 99%, а углерода-13 – 1%. Другие изотопы углерода действительно существуют, но в количествах настолько малых, что в данном случае ими можно пренебречь.
-

3
Умножьте атомную массу каждого изотопа на его концентрацию в образце. Умножьте атомную массу каждого изотопа на его процентное содержание (выраженное в виде десятичной дроби). Чтобы перевести проценты в десятичную дробь, просто разделите их на 100. Полученные концентрации в сумме всегда должны давать 1.
- Наш образец содержит углерод-12 и углерод-13. Если углерод-12 составляет 99% образца, а углерод-13 – 1%, то необходимо умножить 12 (атомная масса углерода-12) на 0,99 и 13 (атомная масса углерода-13) на 0,01.
- В справочниках даются процентные соотношения, основанные на известных количествах всех изотопов того или иного элемента. Большинство учебников по химии содержат эту информацию в виде таблицы в конце книги. Для изучаемого образца относительные концентрации изотопов можно также определить с помощью масс-спектрометра.
-

4
Сложите полученные результаты. Просуммируйте результаты умножения, которые вы получили в предыдущем шаге. В результате этой операции вы найдете относительную атомную массу вашего элемента – среднее значение атомных масс изотопов рассматриваемого элемента. Когда рассматривается элемент в целом, а не конкретный изотоп данного элемента, используется именно эта величина.
- В нашем примере 12 x 0,99 = 11,88 для углерода-12, и 13 x 0,01 = 0,13 для углерода-13. Относительная атомная масса в нашем случае составляет 11,88 + 0,13 = 12,01.
Реклама
Советы
- Некоторые изотопы менее стабильны, чем другие: они распадаются на атомы элементов с меньшим количеством протонов и нейтронов в ядре с выделением частиц, входящих в состав атомного ядра. Такие изотопы называют радиоактивными.
Реклама
Что вам понадобится
- Справочник по химии
- Калькулятор
Об этой статье
Эту страницу просматривали 136 503 раза.
Была ли эта статья полезной?
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.

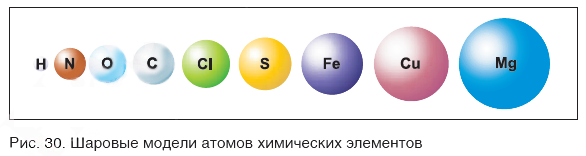
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
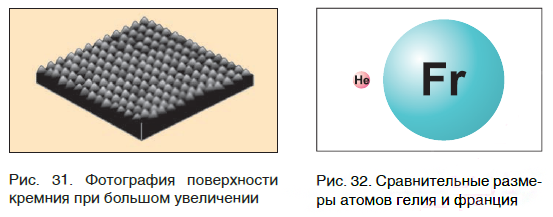
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.

В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
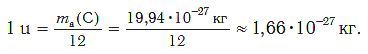
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
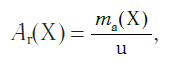
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
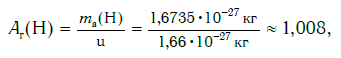
а кислорода:
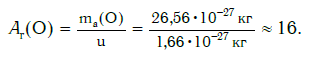
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
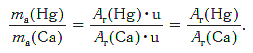
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
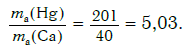
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Масса атома обозначается символом
ma
и может выражаться в единицах массы: килограммах или граммах.
Массы атомов малы. Так, масса атома водорода равна
ma(H)=1,67⋅10−24г
, а масса атома углерода —
ma(C)=19,94⋅10−24г
. Использовать такие числа неудобно, поэтому в химии применяется относительная атомная масса
Ar
.
Относительная атомная масса — это отношение массы атома к атомной единице массы.
В качестве атомной единицы массы (а. е. м.) выбрана (1/12) часть массы атома углерода. Эта единица обозначается буквой (u) (от английского «unit» — единица):
.
Относительная атомная масса — безразмерная величина, которая показывает, во сколько раз масса атома больше атомной единицы массы.
Относительные атомные массы химических элементов приведены в Периодической таблице. В расчётах обычно используют их значения, округлённые до целых.
Пример:
в Периодической таблице приведено значение относительной атомной массы магния — (24,305). Округлённое значение — (24). Значение атомной массы углерода — (12,011), а её округлённое значение — (12).
Исключение — относительная атомная масса хлора:
Ar(Cl)=
(35,5).
Значения относительных атомных масс некоторых элементов
| Элемент | H | He | Li | C | N | O | F | Ne | Na | Mg | Al | P | S | Cl | Ar | Ca | Fe | Cu | Zn |
|
Ar |
1 |
4 |
7 |
12 |
14 |
16 |
19 |
20 |
23 |
24 |
27 |
31 |
32 |
35,5 |
40 |
40 |
56 |
64 |
65 |
Относительная молекулярная масса
Mr
— это отношение массы молекулы или формульной единицы к атомной единице массы.
,
Относительная молекулярная масса показывает, во сколько раз масса молекулы или формульной единицы больше атомной единицы массы. Это тоже безразмерная величина. Она равна сумме относительных атомных масс всех химических элементов с учётом индексов в формуле вещества.
Пример:
относительная молекулярная масса углекислого газа:
.
Относительная молекулярная масса фосфата натрия:
.
Относительная молекулярная масса сульфата алюминия:
.
Вас могут попросить вычислить атомную массу в химии или физике. Есть несколько способов найти атомную массу. Какой метод вы используете, зависит от предоставленной вам информации. Во-первых, неплохо понять, что именно означает атомная масса.
Что такое атомная масса?
Атомная масса – это сумма масс протонов, нейтронов и электронов в атоме или средняя масса в группе атомов. Однако масса электронов намного меньше массы протонов и нейтронов, поэтому они не учитываются при расчетах. Итак, атомная масса – это сумма масс протонов и нейтронов. Есть три способа найти атомную массу, в зависимости от вашей ситуации. Какой из них использовать, зависит от того, есть ли у вас один атом, естественный образец элемента или просто нужно знать стандартное значение.
3 способа Найти атомную массу
Метод, используемый для определения атомной массы, зависит от того, смотрите ли вы на отдельный атом, на природный образец или образец, содержащий известное соотношение изотопов:
1) Найдите атомную массу в Периодической таблице.
Если это ваше первое знакомство с химией, ваш инструктор попросит вас научиться использовать периодическую таблицу для определения атомной массы (атомной массы) элемента. Этот номер обычно указывается под символом элемента. Найдите десятичное число, которое представляет собой средневзвешенное значение атомных масс всех природных изотопов элемента.
Пример: если вас попросят указать Для определения атомной массы углерода сначала нужно узнать символ элемента C. Найдите C в периодической таблице. Одно число – это номер элемента углерода или атомный номер. Атомный номер увеличивается по мере того, как вы переходите через стол. Это не то значение, которое вам нужно. Атомная масса или атомный вес – это десятичное число. Количество значащих цифр варьируется в зависимости от таблицы, но значение составляет около 12,01.
Это значение на периодическая таблица дается в атомных единицах массы или а.е.м., но для химических расчетов вы обычно записываете атомную массу в граммах на моль или г/моль. Атомная масса углерода составляет 12,01 грамма на моль атомов углерода.
2) Сумма протонов и нейтронов для одного атома
Чтобы вычислить атомную массу отдельного атома элемента, сложите массу протонов и нейтронов.
Пример: найдите атомную массу изотопа углерода, который имеет 7 нейтронов. Из периодической таблицы видно, что углерод имеет атомный номер 6, что соответствует числу протонов. Атомная масса атома равна массе протонов плюс масса нейтронов, 6 + 7 или 13.
3 ) Средневзвешенное значение для всех атомов элемента
Атомная масса элемента – это средневзвешенное значение всех изотопов элемента на основе их естественных избыток. С помощью этих шагов легко вычислить атомную массу элемента.
Обычно в этих задачах вам предоставляется список изотопов с их массой. и их естественное содержание в виде десятичной дроби или процента.
- Умножьте массу каждого изотопа на его содержание. Если у вас процентное содержание, разделите ваш ответ на 100.
- Сложите эти значения вместе.
ответ – это общая атомная масса или атомный вес элемента.
Пример: вам дан образец, содержащий 98% углерода-12 и 2% углерода-13 . Какова относительная атомная масса элемента?
Сначала преобразуйте проценты в десятичные значения, разделив каждый процент на 100. Образец становится 0,98 углерода-12 и 0,02 углерода-13. (Совет: вы можете проверить свои математические расчеты, убедившись, что сумма десятичных знаков равна 1. 0,98 + 0,02 = 1,00).
Затем умножьте атомную массу каждый изотоп пропорцией элемента в образце:
0,98 x 12 = 11,76
0,02 x 13 = 0,26
Чтобы получить окончательный ответ, сложите их вместе:
11,76 + 0,26 = 12,02 г/моль
Примечание для опытных пользователей: эта атомная масса немного выше, чем значение, указанное в периодической таблице для элемента углерода. Что это вам говорит? Образец, который вам дали для анализа, содержал больше углерода-13, чем в среднем. Вы знаете это, потому что ваша относительная атомная масса выше, чем значение в таблице Менделеева, хотя номер в таблице Менделеева включает более тяжелые изотопы, такие как углерод-14. Также обратите внимание, что числа, указанные в таблице Менделеева, относятся к земной коре/атмосфере и могут иметь мало отношения к ожидаемому соотношению изотопов в мантии, ядре или других мирах.
Со временем вы можете заметить, что значения атомной массы, перечисленные для каждого элемента в периодической таблице, могут немного измениться. Это происходит, когда ученые пересматривают расчетное соотношение изотопов в коре. В современных периодических таблицах иногда указывается диапазон значений, а не одна атомная масса.
Найти больше отработанных примеров
