поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Запрос «Ca» перенаправляется сюда; см. также другие значения.
| Кальций | |||
|---|---|---|---|
| ← Калий | Скандий → | |||
|
|||
| Внешний вид простого вещества | |||

Образец кальция в атмосфере аргона |
|||
| Свойства атома | |||
| Название, символ, номер | Ка́льций/Calcium (Ca), 20 | ||
| Группа, период, блок |
2 (устар. 2), 4, s-элемент |
||
| Атомная масса (молярная масса) |
40,078(4)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация |
[Ar] 4s2 1s22s22p63s23p64s2 |
||
| Радиус атома | 197 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 174 пм | ||
| Радиус иона | (+2e) 99 пм | ||
| Электроотрицательность | 1,00 (шкала Полинга) | ||
| Электродный потенциал | −2,76 В | ||
| Степени окисления | 0, +2 | ||
| Энергия ионизации (первый электрон) |
589,4 (6,11) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 1,55 г/см³ | ||
| Температура плавления | 1112 К; 838,85 °C | ||
| Температура кипения | 1757 К; 1483,85 °C | ||
| Уд. теплота плавления | 9,20 кДж/моль | ||
| Уд. теплота испарения | 153,6 кДж/моль | ||
| Молярная теплоёмкость | 25,9[2] Дж/(K·моль) | ||
| Молярный объём | 29,9 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | Кубическая гранецентрированная | ||
| Параметры решётки | 5,580 Å | ||
| Температура Дебая | 230 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) (201) Вт/(м·К) | ||
| Номер CAS | 7440-70-2 | ||
| Эмиссионный спектр | |||
|
|
Ка́льций (химический символ — Ca, от лат. Calcium) — химический элемент 2-й группы (по устаревшей классификации — главной подгруппы второй группы, IIA), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20.
Простое вещество кальций — это умеренно твёрдый[3], очень лёгкий химически активный щёлочноземельный металл серебристо-белого цвета.
Впервые получен в чистом виде Г. Дэви в 1808 году.
Кальций относится к числу жизненно важных элементов для организмов.
История и происхождение названия[править | править код]
Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Гемфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом. Дэви подверг электролизу смесь влажной гашёной извести с оксидом ртути HgO на платиновой пластине, которая являлась анодом. Катодом служила платиновая проволока, погружённая в жидкую ртуть. В результате электролиза получалась амальгама кальция. Отогнав из неё ртуть, Дэви получил металл, названный кальцием.
Соединения кальция — известняк, мрамор, гипс (а также известь — продукт обжига известняка) применялись в строительном деле уже несколько тысячелетий назад. Вплоть до конца XVIII века химики считали известь простым телом. В 1789 году А. Лавуазье предположил, что известь, магнезия, барит, глинозём и кремнезём — вещества сложные.
Нахождение в природе[править | править код]
Из-за высокой химической активности кальций в свободном виде в природе не встречается.
На долю кальция приходится 3,38 % массы земной коры (5-е место по распространенности после кислорода, кремния, алюминия и железа). Содержание элемента в морской воде — 400 мг/л[4].
Изотопы[править | править код]
Кальций встречается в природе в виде смеси шести изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca и 48Ca, среди которых наиболее распространённый — 40Ca — составляет 96,97 %. Ядра кальция содержат магическое число протонов: Z = 20. Изотопы 40
20Ca20
и 48
20Ca28
являются двумя из пяти существующих в природе дважды магических ядер.
Из шести природных изотопов кальция пять стабильны. Шестой изотоп 48Ca, самый тяжёлый из шести и весьма редкий (его изотопная распространённость равна всего 0,187 %), испытывает двойной бета-распад с периодом полураспада (4,39 ± 0,58)⋅1019 лет[5][6][7].
В горных породах и минералах[править | править код]
Кальций, энергично мигрирующий в земной коре и накапливающийся в различных геохимических системах, образует 385 минералов (четвёртое место по числу минералов).
Большая часть кальция содержится в составе силикатов и алюмосиликатов различных горных пород (граниты, гнейсы и т. п.), особенно в полевом шпате — анортите Ca[Al2Si2O8].

Довольно широко распространены такие минералы кальция, как кальцит CaCO3, ангидрит CaSO4, алебастр CaSO4·0.5H2O и гипс CaSO4·2H2O, флюорит CaF2, апатиты Ca5(PO4)3(F,Cl,OH), доломит MgCO3·CaCO3. Присутствием солей кальция и магния в природной воде определяется её жёсткость.
Осадочная порода, состоящая в основном из скрытокристаллического кальцита — известняк (одна из его разновидностей — мел). Под действием регионального метаморфизма известняк преобразуется в мрамор.
Миграция в земной коре[править | править код]
В естественной миграции кальция существенную роль играет «карбонатное равновесие», связанное с обратимой реакцией взаимодействия карбоната кальция с водой и углекислым газом с образованием растворимого гидрокарбоната:
(равновесие смещается влево или вправо в зависимости от концентрации углекислого газа).
Огромную роль играет биогенная миграция.
В биосфере[править | править код]
Соединения кальция находятся практически во всех животных и растительных тканях (см. ниже). Значительное количество кальция входит в состав живых организмов. Так, гидроксиапатит Ca5(PO4)3OH, или, в другой записи, 3Ca3(PO4)2·Са(OH)2 — основа костной ткани позвоночных, в том числе и человека; из карбоната кальция CaCO3 состоят раковины и панцири многих беспозвоночных, яичная скорлупа и др. В живых тканях человека и животных 1,4—2 % Са (по массовой доле); в теле человека массой 70 кг содержание кальция — около 1,7 кг (в основном в составе межклеточного вещества костной ткани).
Физические свойства[править | править код]
Металл кальций существует в двух аллотропных модификациях. До 443 °C устойчив α-Ca с кубической гранецентрированной решёткой (параметр а = 0,558 нм), выше устойчив β-Ca с кубической объёмно-центрированной решёткой типа α-Fe (параметр a = 0,448 нм). Стандартная энтальпия 
При температуре выше 839 °C плавится, превращаясь в блестящую жидкость[источник не указан 144 дня].
При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является). При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы). Уникальное поведение кальция похоже во многом на стронций (то есть параллели в периодической системе сохраняются)[8].
Химические свойства[править | править код]
Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем у более тяжёлых щёлочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло-серая, поэтому в лаборатории кальций обычно хранят, как и другие щёлочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca2+/Ca0 −2,84 В, так что кальций активно реагирует с водой, но без воспламенения:
С активными неметаллами (кислородом, хлором, бромом, иодом) кальций реагирует при обычных условиях:
Как и для всех остальных металлов, так и для кальция характерно вытеснение менее активных металлов из их солей:
При нагревании на воздухе или в кислороде кальций воспламеняется и горит красным пламенем с оранжевым оттенком («кирпично-красным»). С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
Кроме получающихся в этих реакциях фосфида кальция Ca3P2 и силицида кальция Ca2Si, известны также фосфиды кальция составов СаР и СаР5 и силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты. Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
Ион Ca2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция СаСО3, кислый карбонат кальция (гидрокарбонат) Са(НСО3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение, а в тех местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция
Так в природе происходит перенос больших масс веществ. В результате под землёй могут образоваться огромные карстовые полости и провалы, а в пещерах образуются красивые каменные «сосульки» — сталактиты и сталагмиты.
Наличие в воде растворённого гидрокарбоната кальция во многом определяет вре́менную жёсткость воды. Вре́менной её называют потому, что при кипячении воды гидрокарбонат разлагается, и в осадок выпадает СаСО3. Это явление приводит, например, к тому, что в чайнике со временем образуется накипь.
Получение[править | править код]
Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75—80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C

Применение[править | править код]
Главное применение металлического кальция — это использование его как восстановителя при получении металлов, особенно никеля, меди и нержавеющей стали[источник не указан 144 дня]. Кальций и его гидрид широко[источник не указан 144 дня] используются также для получения трудно восстанавливаемых металлов, таких, как хром, торий, уран, титан, цирконий. Сплавы кальция со свинцом применяются в некоторых видах аккумуляторных батарей и при производстве подшипников. Кальциевые гранулы используются также для удаления следов воздуха из электровакуумных приборов[источник не указан 144 дня]. Чистый металлический кальций широко[источник не указан 144 дня] применяется в металлотермии[источник не указан 144 дня] при получении редкоземельных элементов[9].
Соединения кальция в его различных формах используются для создания произведений искусства, таких как скульптуры[источник не указан 144 дня].
Кальций широко применяется в металлургии для раскисления стали наряду с алюминием или в сочетании с ним. Внепечная обработка кальцийсодержащими проволоками занимает ведущее положение в связи с многофакторностью влияния кальция на физико-химическое состояние расплава, макро- и микроструктуры металла, качество и свойства металлопродукции и является неотъемлемой частью технологии производства стали[10]. В современной металлургии для ввода в расплав кальция используется инжекционная проволока, представляющая собой кальций (иногда силикокальций или алюмокальций) в виде порошка или прессованного металла в стальной оболочке. Наряду с раскислением (удалением растворённого в стали кислорода) использование кальция позволяет получить благоприятные по природе, составу и форме неметаллические включения, не разрушающиеся в ходе дальнейших технологических операций[11].
Cоединения кальция используются в качестве строительных и отделочных материалов[источник не указан 144 дня].
Изотоп 48Ca — один из эффективных и употребительных материалов для производства сверхтяжёлых элементов и открытия новых элементов таблицы Менделеева. Это связано с тем, что кальций-48 является дважды магическим ядром[12], поэтому его устойчивость позволяет ему быть достаточно нейтроноизбыточным для лёгкого ядра; при синтезе сверхтяжёлых ядер необходим избыток нейтронов.
Биологическая роль[править | править код]
Кальций — распространённый макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита[13]. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Концентрация кальция в цитоплазме клеток человека составляет около 10−4 ммоль/л, в межклеточных жидкостях около 2,5 ммоль/л, но некоторые соединения (например, его фосфид) чрезвычайно токсичны.
Потребность в кальции зависит от возраста. Для взрослых в возрасте 19—50 лет и детей 4—8 лет включительно дневная потребность (RDA) составляет 1000 мг[14], а для детей в возрасте от 9 до 18 лет включительно — 1300 мг в сутки[14]. В подростковом возрасте потребление достаточного количества кальция очень важно из-за интенсивного роста скелета. Однако по данным исследований в США всего 11 % девочек и 31 % мальчиков в возрасте 12—19 лет достигают своих потребностей[15]. В сбалансированной диете большая часть кальция (около 80 %) поступает в организм ребёнка с молочными продуктами. Оставшийся кальций приходится на зерновые (в том числе цельнозерновой хлеб и гречку), бобовые, апельсины[источник не указан 2804 дня], зелень[источник не указан 2804 дня], орехи.
Всасывание кальция в кишечнике происходит двумя способами: через клетки кишечника (трансцеллюлярно) и межклеточно (парацелюллярно). Первый механизм опосредован действием активной формы витамина D (кальцитриола) и её кишечными рецепторами. Он играет большую роль при малом и умеренном потреблении кальция. При большем содержании кальция в диете основную роль начинает играть межклеточная абсорбция, которая связана с большим градиентом концентрации кальция. За счёт чрезклеточного механизма кальций всасывается в большей степени в двенадцатиперстной кишке (из-за наибольшей концентрации там рецепторов в кальцитриолу). За счёт межклеточного пассивного переноса абсорбция кальция наиболее активна во всех трёх отделах тонкого кишечника. Всасыванию кальция парацеллюлярно способствует лактоза (молочный сахар).
Кальций составляет до 2% веса человека и животных[источник не указан 144 дня].
Усвоению кальция препятствуют некоторые животные жиры[16] (включая жир коровьего молока и говяжий жир, но не сало) и пальмовое масло. Содержащиеся в таких жирах пальмитиновая и стеариновая жирные кислоты отщепляются при переваривании в кишечнике и в свободном виде прочно связывают кальций, образуя пальмитат кальция и стеарат кальция (нерастворимые мыла)[17]. В виде этого мыла со стулом теряется как кальций, так и жир. Этот механизм ответственен за снижение всасывания кальция[18][19][20], снижение минерализации костей[21] и снижение косвенных показателей их прочности[22][23] у младенцев при использовании детских смесей на основе пальмового масла (пальмового олеина). У таких детей образование кальциевых мыл в кишечнике ассоциируется с уплотнением стула[24][25], уменьшением его частоты[24], а также более частым срыгиванием[26] и коликами[23].
Концентрация кальция в крови из-за её важности для большого числа жизненно важных процессов точно регулируется, и при правильном питании и достаточном потреблении обезжиренных молочных продуктов и витамина D дефицита не возникает. Длительный дефицит кальция и/или витамина D в диете приводит к увеличению риска остеопороза, а в младенчестве вызывает рахит.
Избыточные дозы кальция и витамина D могут вызвать гиперкальцемию. Максимальная безопасная доза для взрослых в возрасте от 19 до 50 лет включительно составляет 2500 мг в сутки[27] (около 340 г сыра Эдам[28]).
Основные источники кальция в пище[править | править код]
Содержание кальция в продуктах определяется исходя из усреднённой порции для каждого вида пищевого продукта. Помимо собственно содержания кальция важна также его биодоступность. В целом в продуктах животного происхождения содержится больше кальция, чем в растительных. Наибольшее количество кальция содержится в молочных продуктах (но из них усваивается только 27–30 % кальция), консервированной рыбе (за счет съедобных косточек), орехах и семенах (биодоступность кальция в среднем 20 %), бобовых (фасоль, нут, чечевица, маш, горох, соя, эдамамэ, в которых содержатся также вещества, затрудняющие усвоение кальция, и, чтобы повысить его биодоступность, их лучше подвергнуть тепловой обработке), некоторые овощи (кресс-салат, капуста бок-чой, листовой салат, брокколи), некоторые фрукты и ягоды[29]:
| Продукт | Стандартная порция | Содержание кальция, мг | Доля от суточной нормы кальция, % |
|---|---|---|---|
| нежирный йогурт без добавок | 227 г (8 весовых унций) | 415 | 32 |
| апельсиновый сок, обогащённый кальцием | 200 мл (1 чашка) | 349 | 27 |
| фруктовый нежирный йогурт | 227 г | 344 | 27 |
| сыр моцарелла | 42,5 г (1,5 унции) | 333 | 26 |
| сардины консервированные в масле с костями | 85 г (3 унции) | 325 | 25 |
| обезжиренное молоко и соевое молоко | 200 мл | 299 | 23 |
| соевое молоко, обогащённое кальцием | 200 мл | 299 | 23 |
| цельное молоко 3,25 % жирности | 200 мл | 276 | 21 |
| твёрдый тофу, приготовленный на растворе сульфата кальция | 100 мл | 253 | 19 |
| розовый косервированный лосось с костями | 85 г | 181 | 14 |
| творог жирностью 1 % | 200 мл | 138 | 11 |
| мягкий тофу, приготовленный на растворе сульфата кальция | 100 мл | 138 | 11 |
| варёные соевые бобы | 100 мл | 131 | 10 |
| отварной шпинат | 100 мл | 123 | 9 |
| мягкий замороженный йогурт (ванильный) | 100 мл | 103 | 8 |
| отварная свежая зелёная репа | 100 мл | 99 | 8 |
| свежая капуста после тепловой обработки | 200 мл | 94 | 7 |
| семена чиа | 1 столовая ложка | 76 | 6 |
| свежая китайская капуста бок-чой (измельчённая) | 100 мл | 74 | 6 |
| консервированная фасоль (без жидкости) | 100 мл | 54 | 4 |
| кукурузная лепёшка диаметром 15 см | 46 | 4 | |
| маложирная сметана | 2 столовые ложки | 31 | 2 |
| цельнозерновой хлеб | 1 ломтик | 30 | 2 |
| сырая рубленая капуста | 200 мл | 24 | 2 |
| сырая брокколи | 100 мл | 21 | 2 |
| яблоко сорта Голден | плод среднего размера | 10 | 0 |
Содержание кальция в молоке сильно зависит от его жирности — в жирном молоке меньше концентрация кальция[30].
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 293. — 671 с. — 100 000 экз.
- ↑ Твёрдость по Бринеллю 200—300 МПа
- ↑ Riley J.P. and Skirrow G. Chemical Oceanography V. 1, 1965.
- ↑ Pritychenko B. Systematics of Evaluated Half-lives of Double-beta Decay // Nuclear Data Sheets. — 2014. — Июнь (т. 120). — С. 102—105. — ISSN 0090-3752. — doi:10.1016/j.nds.2014.07.018. [исправить]
- ↑ Pritychenko B. List of Adopted Double Beta (ββ) Decay Values. National Nuclear Data Center, Brookhaven National Laboratory. Дата обращения: 6 декабря 2015. Архивировано 28 апреля 2017 года.
- ↑ Справочник химика / Редкол.: Никольский Б. П. и др. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- ↑ Газета. Ру: Элементы под давлением. Дата обращения: 9 апреля 2010. Архивировано 9 апреля 2010 года.
- ↑ Кальций // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ Дюдкин Д. А., Кисиленко В. В. Влияние различных факторов на усвоение кальция из порошковой проволоки с комплексным наполнителем СК40 // Электрометаллургия : журнал. — 2009. — Май (№ 5). — С. 2—6. Архивировано 2 марта 2016 года.
- ↑ Михайлов Г. Г., Чернова Л. А. Термодинамический анализ процессов раскисления стали кальцием и алюминием // Электрометаллургия : журнал. — 2008. — Март (№ 3). — С. 6—8. Архивировано 2 марта 2016 года.
- ↑ Shell Model of Nucleus. Дата обращения: 22 марта 2013. Архивировано 10 сентября 2018 года.
- ↑ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium; Ross A.C., Taylor C.L., Yaktine A.L., Del Valle H.B., editors. Dietary Reference Intakes for Calcium and Vitamin D (англ.) : journal. — National Academies Press (US), 2011. — P. 35. — PMID 21796828. Архивировано 15 августа 2018 года.
- ↑ 1 2 U.S. Department of Agriculture and U.S. Department of Health and Human Services. Dietary Guidelines for Americans, 2010 (неопр.). — 7th. — Washington, DC: U.S. Government Printing Office, 2010. — С. 76. Архивировано 12 января 2013 года.
- ↑ Greer F.R., Krebs NF; American Academy of Pediatrics Committee on Nutrition. Optimizing bone health and calcium intakes of infants, children, and adolescents (англ.) // Pediatrics (англ.) (рус. : journal. — American Academy of Pediatrics (англ.) (рус., 2006. — February (vol. 117, no. 2). — P. 578—585. — PMID 16452385.
- ↑ Southgate D.A., Widdowson E.M., Smits B.J., Cooke W.T., Walker C.H., Mathers N.P. Absorption and excretion of calcium and fat by young infants (англ.) // The Lancet : journal. — Elsevier, 1969. — Vol. 293, no. 7593. — P. 487—489. — PMID 4179570. Архивировано 25 мая 2013 года.
- ↑ Holt L.E., Tidwell H.C., Kirk C.M., Cross D.M., Neale S. Studies in fat metabolism: I. Fat absorption in normal infants (англ.) // J Pediatr (англ.) (рус. : journal. — 1935. — Vol. 6, no. 4. — P. 427—480.
- ↑ Nelson S.E., Frantz J.A., Ziegler E.E. Absorption of fat and calcium by infants fed a milk-based formula containing palm olein (англ.) // J Am Coll Nutr : journal. — 1998. — Vol. 17, no. 4. — P. 327—332. — PMID 9710840. (недоступная ссылка)
- ↑ Nelson S.E., Rogers R.R., Frantz J.A., Ziegler E.E. Palm olein in infant formula: absorption of fat and minerals by normal infants (англ.) // Am J Clin Nutr (англ.) (рус. : journal. — 1996. — Vol. 64, no. 3. — P. 291—296. — PMID 8780336.
- ↑ Ostrom K.M., Borschel M.W., Westcott J.E., Richardson K.S., Krebs N.F. Lower calcium absorption in infants fed casein hydrolysate- and soy protein-based infant formulas containing palm olein versus formulas without palm olein (англ.) // J Am Coll Nutr : journal. — 2002. — Vol. 21, no. 6. — P. 564—569. — PMID 12480803. (недоступная ссылка)
- ↑ Koo W.W., Hammami M., Margeson D.P., Nwaesei C., Montalto M.B., Lasekan J.B. Reduced bone mineralization in infants fed palm olein-containing formula: a randomized, double-blinded, prospective trial (англ.) // Pediatrics (англ.) (рус. : journal. — American Academy of Pediatrics (англ.) (рус., 2003. — Vol. 111, no. 5 Pt 1. — P. 1017—1023. — PMID 12728082.
- ↑ Litmanovitz I., Davidson K., Eliakim A., Regev R.H., Dolfin T., Arnon S., Bar-Yoseph F., Goren A., Lifshitz Y., Nemet D. High Beta-Palmitate Formula and Bone Strength in Term Infants: A Randomized, Double-Blind, Controlled Trial (англ.) // Calcified Tissue International (англ.) (рус. : journal. — 2012. — Vol. 92, no. 1. — P. 35—41. — ISSN 0171-967X. — doi:10.1007/s00223-012-9664-8. Архивировано 27 декабря 2022 года.
- ↑ 1 2 Litmanovitz I., Davidson K., Eliakim A., Regev R., Dolfin T., Bar-Yoseph F., et al. The effects of infant formula beta-palmitate structural position on bone speed of sound, Anthropometrics and infantile colic: A double-blind, Randomized control trial (англ.) // Journal of Pediatric Gastroenterology and Nutrition [Internet] : journal. — 2011. — Vol. 52. — P. E215—6.
- ↑ 1 2 Lloyd B., Halter R.J., Kuchan M.J., Baggs G.E., Ryan A.S., Masor M.L. Formula tolerance in postbreastfed and exclusively formula-fed infants (англ.) // Pediatrics (англ.) (рус. : journal. — American Academy of Pediatrics (англ.) (рус., 1999. — Vol. 103, no. 1. — P. E7. — PMID 9917487. Архивировано 14 ноября 2018 года.
- ↑ Carnielli V.P., Luijendijk I.H., Van Goudoever J.B., Sulkers E.J., Boerlage A.A., Degenhart H.J., Sauer P.J. Structural position and amount of palmitic acid in infant formulas: effects on fat, fatty acid, and mineral balance (англ.) // J Pediatr Gastroenterol Nutr (англ.) (рус. : journal. — 1996. — Vol. 23, no. 5. — P. 553—560. — PMID 8985844. Архивировано 22 марта 2013 года.
- ↑ Vandenplas Y., Gutierrez-Castrellon P., Velasco-Benitez C., Palacios J., Jaen D., Ribeiro H et al. Practical algorithms for managing common gastrointestinal symptoms in infants (англ.) // Nutrition : journal. — 2013. — Vol. 29, no. 1. — P. 184—194. — PMID 23137717.
- ↑ Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium; Ross A.C., Taylor C.L., Yaktine A.L., Del Valle H.B., editors. Dietary Reference Intakes for Calcium and Vitamin D (англ.) : journal. — National Academies Press (US), 2011. — P. 419. — PMID 21796828. Архивировано 15 августа 2018 года.
- ↑ U.S. Department of Agriculture National Nutrient Database for Standard Reference. Дата обращения: 29 декабря 2012. Архивировано 5 января 2013 года.
- ↑ Вишнякова, В. 6 продуктов, богатых кальцием : [арх. 14 мая 2022] // Тинькофф-журнал. — 2022. — 12 мая.
- ↑ 1 2 Table 2: Calcium Content of Selected Foods. // Calcium : Fact Sheet for Health Professionals. : [англ.] : [арх. 13 мая 2022] / Office of Dietary Supplements of National Institutes of Health. — NHS, 2021. — 17 November.
Литература[править | править код]
- Доронин Н. А. Кальций. — М.: Госхимиздат, 1962. — 191 с.
Ссылки[править | править код]
- Кальций на Webelements
- Кальций в Популярной библиотеке химических элементов
- Рекомендуемое потребление кальция
- UK Food Standards Agency: Calcium
- Nutrition fact sheet from the National Institutes of Health
Вычислите относительную атомную массу кальция
Maxim Ivanovskiy
Ученик
(103),
на голосовании
2 года назад
Пж срочно и с решением
Голосование за лучший ответ
Лиза Миронюк
Гуру
(4602)
2 года назад
35.5 (атомная маса это циферки внизу)
Лиза МиронюкГуру (4602)
2 года назад
ОЙ ПОДОЖДИ 40. Перепутала с хлором. ЭТО 40!
Вячек
Высший разум
(391245)
Лиза Миронюк, на такие элементарные вопросы лучше не отвечать! Это азы химии – изучение таблицы Менделеева, в которой написаны атомные массы
ВячекВысший разум (391245)
2 года назад
Тогда зачем ему эти знания? На мойках машин можно и без образования работать
Лиза Миронюк
Гуру
(4602)
Вячек, Химия не всем пригодится, я тебе скажу так) Может человек идет в ту индустрию (думает о ней), туда где это совершенно не нужно.
ВячекВысший разум (391245)
2 года назад
химия не хуже физики и математики развивает мыслительные способности, это уже давно психологи выяснили! А без них, этих способностей, у нас в стране и так довольно много стало субъектов… лет через десять такого обучения мыслящих людей нужно будет с фонарём искать
Лиза Миронюк
Гуру
(4602)
Вячек, верно подметил)) ну, это же его уже дело учить, не учить и тд тп. У человека собственный выбор, пусть и неправильный.
← Молярная и молекулярная масса
- Относительная молекулярная масса Ca: 40.078
- Молярная масса Ca: 40.078 г/моль (0.04008 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Ca (кальций) | 1 | 40.078 | 40.078 |
| 40.078 |
Расчёт молярной и относительной молекулярной массы Ca
- Mr[Ca] = Ar[Ca] = 40.078 = 40.078
- Молярная масса (в кг/моль) = Mr[Ca] : 1000 = 40.078 : 1000 = 0.04008 кг/моль
Электронная конфигурация атома кальция
Калькулятор массы
Химическая формула соединения
Рассчитать
![]()
Поделитесь информацией с друзьями
![]()
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
C12H10N4O7 [322.2304]
Ca3N2 [148.2474]
Калькулятор молекулярной массы

В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.

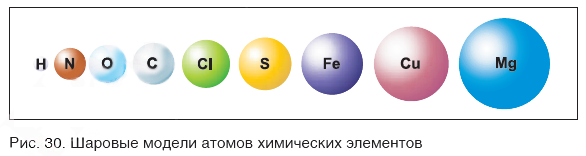
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
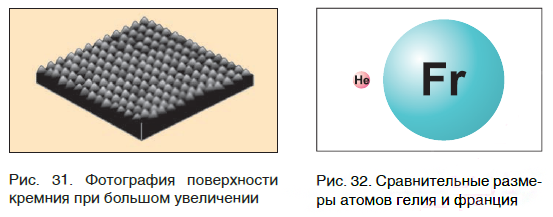
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10−27 кг и 9,8·10−10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10−27 кг, а атома кислорода — ma(О) = 26,56·10−27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.

В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
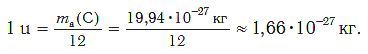
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10−27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar (А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
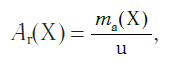
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
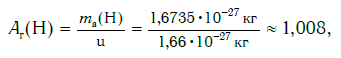
а кислорода:
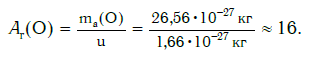
Как видите, относительная атомная масса показывает, во сколько раз масса атома данного элемента больше атомной единицы массы u.
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах (ma(O) = 26,56·10−27 кг) или атомных единицах массы (ma(O) = 16·u).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
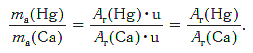
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
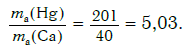
Ответ: в 5,03 раза.
Краткие выводы урока:
- Атомная единица массы представляет собой 1/12 часть массы атома углерода.
- Относительная атомная масса химического элемента равна отношению массы его атома к 1/12 части массы атома углерода.
- Относительная атомная масса химического элемента является величиной безразмерной и показывает, во сколько раз масса атома данного элемента больше атомной единицы массы.
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.















