Одноосновная кислота, в которой азот имеет степень окисления +3. Эта кислота слабая. Соли ее называются нитритами.
Формула
HNO2
Свойства азотистой кислоты
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Голубоватая жидкость в водном растворе, в чистом виде – газ |
| Молярная масса, г/моль | 47,013 |
| Плотность при 20°С, г/см3 | 1,685 |
| Температура разложения, °С | 0 |
| Температура кипения, °С | 82,6 |
| Растворимость в воде при 20°С, г/100 г | 548 |
Азотистая кислота крайне нестойка и ее растворы окрашены в голубой цвет из-за присутствия азотистого ангидрида (оксида азота (III)) N2O3. Существует в виде двух таутомерных формах. Для каждой из них известны свои ряды комплексных соединений и органических производных, содержащих соответственно нитрогруппу NO2 и нитритогруппу ONO. При 298 К равновесная смесь содержит 0,309 мольных долей I и 0,691 мольных долей II.
Химические свойства
В водных растворах азотистая кислота диссоциирует на ионы:
HNO2 ⇄ H+ + NO2–.
Азотистая кислота крайне нестойка и в водных растворах существует равновесие:
2HNO2 ⇄ H2O + N2O3 ⇄ H2O + NO + NO2.
При нагревании раствор HNO2 распадается:
3HNO2 = HNO3 + H2O + 2NO↑.
При действии окислителей азотистая кислота окисляется до азотной кислоты:
HNO2 + Cl2 + H2O = HNO3 + 2HCl;
HNO2 + H2O2 = HNO3 + H2O.
Азотистая кислота может проявлять окислительные свойства. В зависимости от природы восстановителя она может восстанавливаться до NO, N2O, NH2OH, NH3, например:
2HNO2 + 2HI = 2NO + I2 + 2H2O,
HNO2 + 4[H] = NH2OH + H2O.
При реакции с гидразином получается азотистоводородная кислота:
HNO2 + N2H4 = HN3 + 2H2O.
С ароматическими аминами при действии азотистой кислоты образуются соли диазония:
C6H5NH2 + HNO2 + HCl = [C6H5–N=N]Cl + H2O.
Получение
Лабораторные способы получения
Азотистую кислоту в лаборатории получают из оксида азота (III):
N2O3 + H20 = 2HNO2.
Другой способ получения – взаимодействие нитритов с сильными кислотами:
NaNO2 + HCI = NaCI + HNO2.
Получение в промышленности
Необходимости в промышленном получении нет, так как она крайне неустойчива, поэтому в тех случаях, когда она необходима для органического синтеза, ее получают непосредственно реакцией между нитритом натрия и соляной кислотой.
Применение
Азотистая кислота применяется при производстве азокрасителей.
Соли диазония легко обменивают диазогруппу на многие другие, что позволяет получать простые эфиры, фенолы, галогенпроизводные, нитрилы и др. Это позволяет получать из ароматических аминов эти соединения при органическом синтезе
Пример решения задачи
Осуществите следующие превращения:
NaNO2 → HNO2 → HN3 → NaN3.
Решение
NaNO2+HCI = NaCI+HNO2;
HNO2 + N2H4 = HN3 + 2H2O;
HN3 + NaOH = NaN3+ Н2О.
Тест по теме «Азотистая кислота»
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 октября 2020 года; проверки требуют 17 правок.
| Азотистая кислота | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Азотистая кислота | |
| Хим. формула | HNO2 | |
| Физические свойства | ||
| Состояние |
в водном растворе — жидкость; в чистом виде — газ |
|
| Молярная масса | 47,0134 г/моль | |
| Плотность | 1,685 (жидкость) | |
| Термические свойства | ||
| Температура | ||
| • плавления | 42,35 °C | |
| • кипения | 158 °C | |
| Химические свойства | ||
Константа диссоциации кислоты  |
3,4 | |
| Растворимость | ||
| • в воде | 548 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | 7782-77-6 | |
| PubChem | 24529 | |
| Рег. номер EINECS | 231-963-7 | |
| SMILES |
N(=O)O |
|
| InChI |
InChI=1S/HNO2/c2-1-3/h(H,2,3) IOVCWXUNBOPUCH-UHFFFAOYSA-N |
|
| ChEBI | 25567 | |
| ChemSpider | 22936 | |
| Безопасность | ||
| ЛД50 | 35 мг/кг | |
| Токсичность | Высокотоксична, сильнейший неорганический яд, мутагенна | |
| Пиктограммы ECB |
|
|
| NFPA 704 |
0 4 2 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Азо́тистая кислота́ (химическая формула — HNO2) — слабая одноосновная высокотоксичная неорганическая кислота. При стандартных условиях неустойчива.
Строение[править | править код]
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций: цис- и транс-.
-
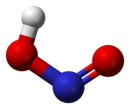
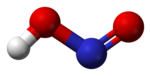
цис-изомер транс-изомер
При комнатной температуре преобладает транс-изомер: эта структура является более устойчивой. Так, для цис-HNO2(г) ΔG°f = −42,59 кДж/моль, а для транс-HNO2(г) ΔG°f = −44,65 кДж/моль.
Физические свойства[править | править код]
Азотистая кислота — это неустойчивая кислота, существующая только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Кислота весьма токсична (в больших концентрациях).
Химические свойства[править | править код]
В водных растворах существует равновесие:
При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:
По действием щелочей образует соли, называемые нитритами (или азотистокислыми), которые гораздо более устойчивы, чем HNO2:
HNO2 является слабой кислотой. В водных растворах диссоциирует (KD = 4,6⋅10−4), немного сильнее уксусной кислоты:
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту:
В то же время она способна окислять вещества, обладающие восстановительными свойствами. Реакция с соляной кислотой при незначительном нагревании протекает обратимо, а при температуре выше +100°C идёт необратимо:
![{displaystyle {ce {2HNO_2 + 2HCl ->[> +100^oC]Cl_2 ^ + 2NO ^ + 2H_2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/717bf56a68b106288561233bbfafb0f5a14f583e)
Получение[править | править код]
Растворение оксида азота (III) N2O3 в воде:
Растворение оксида азота (IV) NO2 в воде:
Применение[править | править код]
- Диазотирование первичных ароматических аминов и образование солей диазония;
- Применение нитритов в органическом синтезе при производстве органических красителей.
Физиологическое действие[править | править код]
Азотистая кислота (HNO2) весьма токсична, причём обладает ярко выраженным мутагенным действием, поскольку является дезаминирующим агентом.
ПДК в рабочей зоне 5 мг/м3 (по диоксиду азота).
Источники[править | править код]
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
Ссылки[править | править код]
- Азотистая кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Азотистая кислота
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства
1. Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 + 2NO + H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 + NaOH → NaNO2 + H2O
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 + 4H2O
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O
Материал из Википедии — свободной энциклопедии
Перейти к: навигация,
поиск
| Азотистая кислота | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Азотистая кислота |
| Химическая формула | HNO2 |
| Отн. молек. масса | 47.0134 а. е. м. |
| Молярная масса | 47.0134 г/моль |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Плотность | 1.685 (жидк) г/см³ |
| Термические свойства | |
| Температура плавления | 42.35 °C |
| Температура кипения | 158 °C |
| Химические свойства | |
| pKa | 3.4 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7782-77-6] |
Азо́тистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
Содержание
- 1 Строение
- 2 Химические свойства
- 3 Получение
- 4 Применение
- 5 Физиологическое действие
- 6 Источники
- 7 Ссылки
[править] Строение
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-. При комнатной температуре преобладает транс-изомер.
Вторая структура является более устойчивой. Так, для цис-HNO2(г) DG°f = -42,59 кДж/моль, а для транс–HNO2(г) DG = -44,65 кДж/моль.
[править] Химические свойства
В водных растворах существует равновесие:
- 2HNO2 ↔ N2O3 + H2O ↔ NO↑ + NO2↑ + H2O
При нагревании раствора азотистая кислота распадается с выделением NO и NO2:
- 3HNO2 ↔ HNO3 + 2NO↑ + H2O.
HNO2 в водных растворах диссоциирует (KD=4,6×10−4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
- H2SO4 + NaNO2 → NaHSO4 + HNO2.
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (Н2О2, KMnO4) окисляется в HNO3:
- 2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O;
- 5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O;
- HNO2 + Cl2 + H2O → HNO3 + 2HCl.
[править] Получение
Азотистую кислоту можно получить при растворении оксида азота (III) N2O3 в воде:

Также она получается при растворении в воде оксида азота (IV) NO2:

[править] Применение
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе при производстве органических красителей.
[править] Физиологическое действие
Азотистая кислота токсична, причём обладает ярко выраженным мутагенным действием, поскольку является деаминирующим агентом.
[править] Источники
- Карапетьянц М. Х., Дракин С.И. Общая и неорганическая химия. М.: Химия1994
[править] Ссылки
- Азотистая кислота // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
 |
|
| Имена | |
|---|---|
| Предпочтительное название IUPAC Азотистая кислота | |
| Систематическое название IUPAC Hydroxidooxidonitrogen | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| 3DMet |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.057 |
| Номер ЕС |
|
| Справочник Гмелина | 983 |
| KEGG |
|
| MeSH | Азот + кислота |
| PubChem CID |
|
| UNII |
|
| Панель управления CompTox (EPA ) |
|
InChI
|
|
УЛЫБКИ
|
|
| Свойства | |
| Химическая формула | HNO 2 |
| Молярная масса | 47,013 г / моль |
| Внешний вид | Бледно-голубой раствор |
| Плотность | Прибл. 1 г / мл |
| Температура плавления | Известен только в растворе или как газ |
| Кислотность (pK a) | 3,398 |
| Основание конъюгата | Нитриты |
| Опасности | |
| NFPA 704 (огненный алмаз) |  0 4 2 OX 0 4 2 OX |
| Температура вспышки | Невоспламеняющийся |
| Родственные соединения | |
| Другие анионы | Азотные кислота |
| Прочие катионы | Нитрит натрия. Нитрит калия. Нитрит аммония |
| Родственные соединения | Триоксид диазота |
| Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на ink | |
Азотистая кислота (молекулярная формула H N O. 2) представляет собой слабую и монопротоновую кислоту, известную только в растворе, в газовой фазе и в форме нитрита (NO. 2) соли. Азотистая кислота используется для получения солей диазония из аминов. Полученные соли диазония являются реагентами в реакциях азосочетания с образованием азокрасителей.
Содержание
- 1 Структура
- 2 Получение
- 3 Реакции
- 3.1 Разложение
- 3.2 Восстановление
- 3.3 Органическая химия
- 4 Атмосфера Земли
- 5 См. Также
- 6 Ссылки
Структура
В газовой фазе планарная молекула азотистой кислоты может принимать оба цис и транс форма. Трансформация преобладает при комнатной температуре, и ИК-измерения показывают, что она более стабильна примерно на 2,3 кДж / моль.

Размеры трансформы. (из микроволновый спектр )

Модель транс-формы

цис-формы
Получение
Азотистая кислота обычно образуется подкислением водных растворов нитрита натрия с помощью a минеральная кислота. Подкисление обычно проводят при температуре льда, и HNO 2 расходуется на месте. Свободная азотистая кислота нестабильна и быстро разлагается.
Азотистая кислота кислоту также можно получить растворением триоксида диазота в воде в соответствии с уравнением
- N2O3+ H 2 O → 2 HNO 2
Реакции
Азотистая кислота основной химфор в реактиве Либермана, используемый для выборочного теста на алкалоиды.
Разложение
Газообразная азотистая кислота, которая встречается редко, разлагается на диоксид азота, оксид азота и вода:
- 2 HNO 2 → NO 2 + NO + H 2O
Диоксид азота диспропорционирует до азотной кислоты и азотистой кислоты в водной среде. раствор:
- 2 NO 2 + H 2 O → HNO 3 + HNO 2
В теплых или концентрированных растворах вся реакция сводится к производству азотной кислоты, воды и оксида азота:
- 3 HNO 2 → HNO 3 + 2 NO + H 2O
Оксид азота впоследствии может быть повторно окислен воздухом в азотную кислоту, образуя общую реакцию:
- 2 HNO 2 + O 2 → 2 HNO 3
Восстановление
ионами I и Fe, NO образуется:
- 2 KNO 2 + 2 KI + 2 H 2SO4→ I 2 + 2 NO + 2 H 2 O + 2 K 2SO4
- 2 KNO 2 + 2 FeSO 4 + 2 H 2SO4→ Fe 2 (SO 4)3+ 2 NO + 2 H 2 O + K 2SO4
С ионами Sn образуется N 2 O:
- 2 KNO 2 + 6 HCl + 2 SnCl 2 → 2 SnCl 4 + N 2 O + 3 H 2 O + 2 KCl
С газом SO 2, NH 2 OH образуется:
- 2 KNO 2 + 6 H 2 O + 4 SO 2 → 3 H 2SO4+ K 2SO4+ 2 NH 2OH
С Zn в растворе щелочи образуется NH 3 :
- 5 H 2 O + KNO 2 + 3 Zn → NH 3 + KOH + 3 Zn (OH) 2
С N. 2H. 5, HN 3, и впоследствии образуется газ N 2 :
- HNO 2 + [N 2H5] → HN 3 + H 2 O + H 3O
- HNO 2 + HN 3 → N 2 O + N 2 + H 2O
Окисление азотистой кислотой имеет кинетический контроль над термодинамический контроль, это лучше всего иллюстрирует, что разбавленная азотистая кислота способна окислять I до I 2, но разбавленная азотная кислота не может.
- I2+ 2 e ⇌ 2 IE = +0,54 V
- NO. 3+ 3 H + 2 e ⇌ HNO 2 + H 2 OE = +0,93 V
- HNO 2 + H + e ⇌ NO + H 2 OE = +0.98 V
Видно, что значения E. ячейки для этих реакции аналогичны, но азотная кислота является более сильным окислителем. Основываясь на том факте, что разбавленная азотистая кислота может окислять иодид до йода, можно сделать вывод, что закись азота является более быстрым, а не более мощным окислителем, чем разбавленная азотная кислота.
Органическое соединение. химия
Азотистая кислота используется для получения солей диазония :
- HNO 2 + ArNH 2 + H → ArN. 2+ 2 H 2O
где Ar представляет собой арильную группу.
Такие соли широко используются в органическом синтезе, например, для реакции Сандмейера и при получении азокрасителей, ярко окрашенных соединений, которые являются основой качественного теста на анилины. Азотистая кислота используется для разрушения токсичного и потенциально взрывоопасного азида натрия. В большинстве случаев азотистая кислота обычно образуется in situ под действием минеральной кислоты на нитрит натрия : она в основном синего цвета
- NaNO 2 + HCl → HNO 2 + NaCl
- 2 NaN 3 + 2 HNO 2 → 3 N 2 + 2 NO + 2 NaOH
Реакция с двумя α-атомами водорода в кетонах создает оксимы, которые могут быть дополнительно окислены до карбоновой кислоты или восстановлены с образованием аминов. Этот процесс используется в промышленном производстве адипиновой кислоты.
Азотистая кислота быстро реагирует с алифатическими спиртами с образованием алкилнитритов, которые являются сильнодействующими вазодилататорами :
- (CH 3)2CHCH 2CH2OH + HNO 2 → (CH 3)2CHCH 2CH2ONO + H 2O
Канцерогены, называемые нитрозамины, обычно образуются не намеренно, реакцией азотистой кислоты с вторичными аминами :
- HNO 2 + R 2 NH → R 2 N-NO + H 2O
Атмосфера Земли
Азотистая кислота участвует в бюджете озона нижней атмосферы, тропосферы. гетерогенная реакция оксида азота (NO) и воды дает азотистую кислоту. Когда эта реакция происходит на поверхности атмосферных аэрозолей, продукт легко фотолизируется в гидроксил радикалы.
См. Также
| На Викискладе есть материалы, связанные с азотистой кислотой . |
- перегруппировкой Демьянова
- Азотной кислотой (H N O 3)
- Перегруппировка Тиффно-Демьянова














