Загрузить PDF
Загрузить PDF
В химии электроотрицательность — это способность атомов притягивать к себе электроны других атомов.[1]
Атом с высокой электроотрицательностью притягивает электроны сильно, а атом с низкой электроотрицательностью притягивает электроны слабо. Значения электроотрицательности используются при прогнозировании поведения различных атомов в химических соединениях.
-
1
Химические связи. Такие связи возникают, когда электроны в атомах взаимодействуют друг с другом, то есть два электрона (по одному из каждого атома) становятся общими.
- Описание причин взаимодействия электронов в атомах выходит за рамки данной статьи. Для получения подробной информации по этому вопросу прочитайте, например, эту статью.
-
2
Влияние электроотрицательности. Когда два атома притягивают электроны друг друга, то сила притяжения не является одинаковой. Атом с более высокой электроотрицательностью притягивает два электрона сильнее. Атом с очень высокой электроотрицательностью притягивает электроны с такой силой, что об общих электронах речь уже не идет.
- Например, в молекуле NaCl (хлорид натрия, обычная соль) атом хлора имеет достаточно высокую электроотрицательность, а атом натрия — довольно низкую. Таким образом, электроны притягиваются к атому хлора и отталкиваются от атомов натрия.
-
3
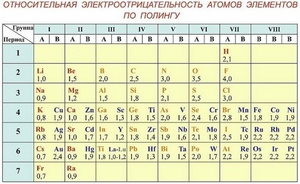
Таблица электроотрицательности. Эта таблица включает химические элементы, расположенные так же, как в таблице Менделеева, но для каждого элемента приведена электроотрицательность его атомов. Такую таблицу можно найти в учебниках по химии, справочных материалах и в сети.
-
Здесь вы найдете отличную таблицу электроотрицательности. Обратите внимание, что в ней используется шкала электроотрицательности по Полингу, которая наиболее распространен.[2]
Тем не менее существуют и другие способы вычисления электроотрицательности, об одном из которых будет рассказано ниже.
-
Здесь вы найдете отличную таблицу электроотрицательности. Обратите внимание, что в ней используется шкала электроотрицательности по Полингу, которая наиболее распространен.[2]
-
4
Тенденции электроотрицательности. Если у вас под рукой нет таблицы электроотрицательности, вы можете оценить электроотрицательность атома по расположению элемента в таблице Менделеева.
- Чем правее расположен элемент, тем больше электроотрицательность его атома.
- Чем выше расположен элемент, тем больше электроотрицательность его атома.
- Таким образом, атомы элементов, расположенных в правом верхнем углу таблицы Менделеева, имеют самые высокие электроотрицательности, а атомы элементов, расположенных в нижнем левом углу — самые низкие.
- В нашем примере NaCl можно сказать, что хлор имеет более высокую электроотрицательность, чем натрий, потому что хлор расположен правее натрия.
Реклама
-
1
Вычислите разницу между электроотрицательностями двух атомов, чтобы понять характеристики связи между ними. Для этого вычтите меньшую электроотрицательность из большей.
- Например, рассмотрим молекулу HF. Вычтите электроотрицательность водорода (2,1) из электроотрицательности фтора (4,0): 4,0 – 2,1 = 1,9.
-
2
Если разница меньше 0,5, то связь ковалентная неполярная, при которой электроны притягиваются практически с одинаковой силой. Такие связи образуются между двумя одинаковыми атомами. Неполярные связи, как правило, очень трудно разрушить.[3]
Все потому, что атомы делятся электронами, что делать их связь стабильной. Чтобы разрушить ее, нужно много энергии.[4]
- Например, молекула O2 имеет этот тип связи. Поскольку два атома кислорода имеют одинаковую электроотрицательность, разница между ними равна 0.
-
3
Если разница лежит в пределах 0,5 – 1,6, то связь ковалентная полярная. В этом случае один из двух атомов притягивает электроны сильнее и поэтому приобретает частичный отрицательный заряд, а второй — частичный положительный заряд. Такой дисбаланс в зарядах позволяет молекуле участвовать в некоторых реакциях.[5]
- Например, молекула H2O (вода) имеет такой тип связи. Атом О более электроотрицательный, чем два атома H, поэтому кислород притягивает электроны сильнее и приобретает частичный отрицательный заряд, а водород — частичный положительный заряд.
-
4
Если разница больше 2,0, то связь ионная. Это связь, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью, который приобретает отрицательный заряд, а атом с меньшей электроотрицательностью приобретает положительный заряд. Молекулы с такими связями хорошо реагируют с другими атомами и даже могут быть разрушены полярными атомами.
- Например, молекула NaCl (хлорид натрия) имеет такой тип связи. Атом хлора настолько электроотрицательный, что притягивает к себе оба электрона и приобретает отрицательный заряд, а атом натрия приобретает положительный заряд.
- NaCl может быть разрушен полярной молекулой, такой как H2O (вода). В молекуле воды водородная сторона молекулы положительна, а кислородная сторона отрицательна. Если смешать соль с водой, молекулы воды расщепят молекулы соли, в следствие чего она растворится.[6]
-
5
Если разница лежит в пределах 1,6 – 2,0, проверьте наличие металла. Если в молекуле присутствует атом металла, то связь ионная. Если в молекуле атомов металла нет, то связь полярная ковалентная.
- Металлы расположены слева и в центре таблицы Менделеева. В этой таблице металлы выделены.[7]
- В нашем примере HF разница между электроотрицательностями попадает в этот диапазон. Так как H и F не являются металлами, то связь полярная ковалентная.
Реклама
- Металлы расположены слева и в центре таблицы Менделеева. В этой таблице металлы выделены.[7]
-
1
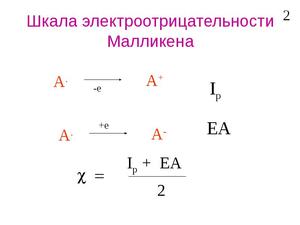
Найдите первую энергию ионизации атома. Шкала электроотрицательности по Малликену немного отличается от шкалы по Полингу, которая упоминалась выше. Первая энергия ионизации требуется для удаления одного атома из электрона.
- Значение такой энергии можно найти в справочниках по химии или в сети, например, здесь.[8]
- В качестве примера найдем электроотрицательность лития (Li). Его первая энергия ионизации равна 520 кДж/моль.
- Значение такой энергии можно найти в справочниках по химии или в сети, например, здесь.[8]
-
2
Найдите энергию сродства к электрону. Это энергия, выделяющаяся в процессе присоединения электрона к атому. Значение такой энергии можно найти в справочниках по химии или в сети, например, здесь.[9]
- Энергия сродства к электрону у лития равна 60 кДж/моль.
-
3
Воспользуйтесь уравнением электроотрицательности Малликена: ENMulliken = (1,97×10−3)(Ei+Eea) + 0,19.
- В нашем примере:
-
- ENMulliken = (1,97×10−3)(Ei+Eea) + 0,19
- ENMulliken = (1,97×10−3)(520 + 60) + 0,19
- ENMulliken = 1,143 + 0,19 = 1,333
-
Реклама
- В нашем примере:
Советы
- Кроме шкал по Полингу и Малликену, существуют шкалы электроотрицательности по Оллреду-Рочоу, Сандерсону, Аллену. Все они имеют свои собственные формулы для расчета электроотрицательности (некоторые из них довольно сложные).
- Электроотрицательность не имеет единиц измерения.
Реклама
Об этой статье
Эту страницу просматривали 88 395 раз.
Была ли эта статья полезной?
Электроотрицательность — это характеристика атома, показывающая, насколько высока его способность притягивать к себе электроны. Когда химическая связь образована двумя разными элементами, электроны у одного из них всегда расположены более плотно, чем у другого. Тот атом, у которого электронная плотность выше, называется электроотрицательным, тот, у кого ниже — соответственно, электроположительным.
Содержание:
- Как определить электроотрицательность
- Самые высокие значения электроотрицательности
- Как определить валентные электроны
- Видео
Как определить электроотрицательность
Существует несколько шкал, ориентируясь на которые, можно определить электроотрицательность того или иного элемента. Попробуем их перечислить:
- Таблица Менделеева.
- Шкала Малликена.
- Шкала Полинга.
- Шкала Олреда-Рохова.
Чтобы определить параметр «электроотрицательность» по таблице Менделеева, нужно всего лишь знать, что наиболее электроотрицательные свойства имеют те элементы, которые располагаются вверху таблицы и в правой ее части. То есть, чем выше и правее элемент находится в таблице Менделеева, тем выше у него электроотрицательность и наоборот, чем ниже и левее — тем выше у него электроположительность.
Шкала Полинга — наиболее часто используемая таблица электроотрицательности. Названа она в честь американского химика Лайнуса Полинга, который впервые ввел понятие электроотрицательности. Согласно шкале Поллинга, электроотрицательность всех имеющихся в природе элементов лежит в интервале от 0,7 (таковой она является у щелочного металла франция) до 4,0 (у газа-галогена фтора). В таблице приводятся относительные и неточные величины.
Шкала Малликена рассматривает электроотрицательность как величину энергии связи между валентными электронами. Приводятся максимально точные расчеты.
Расположение элементов в каждой из таблиц является идентичным, несмотря на то, что методы определения отличаются друг от друга, и величины тоже.
Самые высокие значения электроотрицательности
Фтор, один из галогенов — это элемент, обладающий наивысшей электроотрицательностью, а точнее — 3,98. Его химическая активность невероятно высока, настолько, что химики называют его не иначе как «все разгрызающий».
Следом за фтором идет кислород. Электроотрицательность кислорода немного пониже — 3,44, но тоже достаточно высока.
Следом за ними (спускаясь все ниже по правой части таблицы Менделеева) идут:
- хлор (3,16);
- азот (3,04);
- бром (2,96);
- йод (2,66);
- ксенон (2,60);
- и так далее.
Большая часть неметаллов имеет электроотрицательность, колеблющуюся между значениями 2 и 3. У отличающихся наиболее высокой активностью металлов, от франция до бериллия, она колеблется от значения 0,7 до 1,57.
Как определить валентные электроны
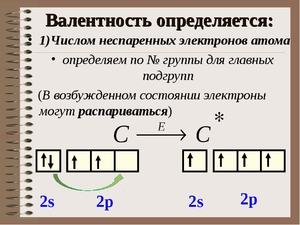
Валентностью называют способность атома вступать во взаимодействие с другими атомами, образуя с ними определенные химические связи. Валентными электронами именуются электроны, непосредственно участвующие в образовании химической связи. Основными создателями, внесшими в теорию валентности наибольший вклад, являются русский ученый Бутлеров и немецкий ученый Кекуле. Электроны, которые принимают участие в образовании химической связи, называют валентными.
Атом, как мы все знаем из школьного курса, устроен таким образом, что довольно-таки напоминает по своему устройству Солнечную систему. В центре атома находится огромное ядро, чья масса чуть менее, чем полностью равняется массе всего атома, а вокруг него по орбиталям вращаются мелкие электроны, неодинаковые по своим внутренним характеристикам. Ядро атома окажется не таким уж и большим, если сравнить его размеры с длиной расстояния до орбиталей, по которым вращаются атомы. Чем дальше от ядра и чем ближе к внешней электронной оболочке находится электрон конкретно взятого атома, тем быстрее он вступает во взаимодействие с электронами других атомов.
Итак, перед нами таблица Менделеева. Найти на ней нужно третий период. Последовательно перебираем элементы главных подгрупп в нем. Существует правило, согласно которому валентность элемента определяется по номеру его группы и равняется количеству электронов на внешней оболочке его атома.
- У щелочного металла натрия на внешней оболочке всего только один электрон, принимающий участие в химической связи между элементами. Исходя из этого, мы определяем, что он одновалентен.
- У щелочноземельного металла на внешней оболочке уже два электрона. Это означает, что его валентность равна двум.
- У амфотерного металла алюминия ровно три электрона на внешней оболочке. Его валентность так же, как и у предыдущих элементов, соответствует этому числу.
- У кремния четыре электрона, он четырехвалентен.
- Фосфор может образовывать различные связи и иметь разные валентности, но высшая валентность фосфора равна пяти.
- Сера точно так же, как и фосфор, может иметь разные валентности, но высшая равняется шести.
- Возьмем хлор. Когда, к примеру, он состоит в молекуле соляной кислоты (HCl), он находится в одновалентном состоянии. А вот в молекуле хлорной кислоты (HClO4) он сразу же становится семивалентным.
Помимо главных, есть еще и побочные подгруппы. Когда дело касается их, учитываются еще и d-электроны на предыдущем подуровне. В таблице Менделеева все эти значения легко можно отыскать. Попробуем определить высшую валентность хрома. На внешнем уровне у хрома находится 1 электрон, на d-подуровне — 5. Следовательно, его высшая валентность равна 6. У марганца на внешнем уровне 2 электрона, на d-подуровне — 5. Значит, его высшая валентность — 7.
Все вышеописанное, за некоторыми исключениями, действительно для элементов всех других побочных подгрупп (помимо тех, в которые включены марганец и хром). Вот исключения:
- кобальт;
- платина;
- палладий;
- родий;
- иридий.
Видео
Это видео поможет вам лучше усвоить такое понятие, как электроотрицательность.
Все известные химические элементы можно разделить на металлы и неметаллы.
Металлы — элементы, атомы которых способны отдавать электроны.
Неметаллы — элементы, атомы которых могут принимать электроны.
При взаимодействии металла с неметаллом атом первого теряет электроны, а атом второго их присоединяет.
А что происходит, если взаимодействуют атомы двух неметаллов?
Сравним атомы серы и кислорода:
O8+8)2)6;
S16+16)2)8)6.
Радиус атома серы больше, валентные электроны слабее связаны с ядром. При образовании связи произойдёт сдвиг электронов от серы к кислороду.
Сравним атомы углерода и кислорода:
C6+6)2)4;
O8+8)2)6.
Заряд ядра атома кислорода больше, и притягивать к себе электроны он будет сильнее.
Значит, атомы разных неметаллов притягивают к себе электроны неодинаково.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется электроотрицательностью (ЭО).
Так как общие электронные пары образуются валентными электронами, то можно сказать, что электроотрицательность — это способность атома притягивать к себе валентные электроны от других атомов.
Обрати внимание!
Чем больше электроотрицательность, тем сильнее у элемента выражены неметаллические свойства.
Шкала относительной электроотрицательности Полинга
Абсолютные значения ЭО — неудобные для работы числа. Поэтому обычно используют относительную электроотрицательность по шкале Полинга. За единицу в ней принята ЭО лития.
По шкале Полинга наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, а наименее электроотрицательным — франций. ЭО франция равна (0,7), а ЭО фтора — (4). ЭО остальных элементов изменяются в пределах от (0,7) до (4).
Как правило, неметаллы имеют ЭО больше двух. У металлов значение ЭО меньше двух. Некоторые элементы (B,Si,Ge,As,Te) со значениями электроотрицательности, близкими к (2), способны проявлять промежуточные свойства.
Элементы с высокой и низкой электроотрицательностью считаются активными. С высокой — активные неметаллы, с низкой — активные металлы. У первых ЭО близка к (3)–(4), у вторых — к (1).
Изменение электроотрицательности в Периодической системе
С увеличением порядкового номера элементов ЭО изменяется периодически.
В периоде она растёт слева направо при накоплении электронов на внешнем слое.
В группе она убывает сверху вниз при увеличении числа электронных слоёв и увеличении атомных радиусов.
Наибольшей ЭО в каждом периоде обладают самые маленькие атомы с семью внешними электронами — атомы галогенов (инертные газы соединений не образуют).
Наименьшая ЭО в периоде у самого большого атома с одним внешним электроном — атома щелочного металла.
Обрати внимание!
Значения электроотрицательности элементов позволяют определить:
— заряды атомов в соединении;
— сдвиг электронов при образовании химической связи.
Установим, как происходит сдвиг электронов при взаимодействии атомов хлора и серы, cеры и кислорода.
Пример:
хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы, значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным:
Проверим вывод по шкале Полинга. Электроотрицательность хлора равна (3), а электроотрицательность серы — (2,5). Хлор более электроотрицательный.
Пример:
кислород и сера расположены в шестой А группе. Электроотрицательность по группе сверху вниз уменьшается. ЭО кислорода больше ЭО серы, значит, электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
По шкале Полинга электроотрицательность кислорода равна (3,5), а электроотрицательность серы — (2,5). Более электроотрицательный — кислород.
При сравнении ЭО элементов часто используют ряд электроотрицательности, расположив элементы в порядке убывания её значения:
.
Как рассчитать электроотрицательность?
Анонимный вопрос
1 марта 2019 · 6,3 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · 29 мая 2019 ·
🔥электроотрицательность-это способность атомов притягивать электроны
🔥существует множество шкал ,например,шкала Полинга, Малликена, Олреда-Рохова
🔥для того,чтобы определить ,какой атом более электроотрицательный,а какой менее ,можно воспользоваться таблицей Менделеева
🔥в группе сверху вниз уменьшается ,в периоде справа налево уменьшается
🔥самый электроотрицательный -фтор
5,8 K
Комментировать ответ…Комментировать…
Эле́ктроотрица́тельность (χ) (относительная электроотрицательность) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов притягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (p-элементов, F, O, N, Cl), а низкая — у активных металлов (s-элементов I группы, Na, K, Cs).[источник не указан 630 дней]
Описание[править | править код]
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B (A, B — символы любых химических элементов) в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B.[источник не указан 630 дней]
Первая и широко известная (самая распространённая) шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,2[1]. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0. Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных подгрупп. Существует также несколько других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.[источник не указан 630 дней]
Теоретическое определение электроотрицательности было предложено американским физиком Р. Малликеном. Исходя из очевидного положения о том, что способность атома в молекуле притягивать к себе электронный заряд зависит от энергии ионизации атома и его сродства к электрону, Р. Малликен ввёл представление об электроотрицательности атома А как о средней величине энергии связи наружных электронов при ионизации валентных состояний (например, от А− до А+) и на этой основе предложил очень простое соотношение для электроотрицательности атома[2][3]:
- где
— энергия ионизации атома,
— сродство к электрону.
В настоящее время для определения электроотрицательностей атомов существует много различных методов, результаты которых хорошо согласуются друг с другом, за исключением относительно небольших различий, и во всяком случае внутренне непротиворечивы.
Помимо шкалы Малликена, описанной выше, существует более 20 различных других шкал электроотрицательности (в основу расчёта значений которых положены разные свойства веществ), среди которых шкала Л. Полинга (основана на энергии связи при образовании сложного вещества из простых), шкала Олреда — Рохова (основана на электростатической силе, действующей на внешний электрон), шкала Оганова[4][5][6] и др. Формула, предложенная Огановым в 2021 году, учитывает ионную стабилизацию молекулы как мультипликативную компоненту и позволяет расчет с большей точностью как при маленьких разностях в электроотрицательности, так и при больших[4]. В 2022 году Сяо Дун из Нанькайского университета, Оганов и др. вычислили электроотрицательности для химических элементов при высоких давлениях: 500 тыс. атм, 2 млн атм и 5 млн атм[7].
| Элемент | шкала
Полинга (eV−1/2) |
шкала
Малликена (eV) |
шкала
Аллена (eV) |
шкала
Мартынова и Бацанова (eV−1/2) |
шкала
Оганова (безразмерные значения) |
| H | 2,2[8] | 7,18 | 2,3 | – | 3,04 |
| Li | 0,98 | 3 | 0,912 | 0,95 | 2,17 |
| Na | 0,93 | 2,84 | 0,869 | 0,9 | 2,15 |
| K | 0,82 | 2,42 | 0,734 | 0,8 | 2,07 |
| Rb | 0,82 | 2,33 | 0,706 | 0,8 | 2,07 |
| Cs | 0,79 | 2,18 | 0,659 | 0,75 | 1,97 |
| Fr | 0,7 | 2,21 | 0,67 | 0,7 | 2,01 |
| Be | 1,57 | 4,41 | 1,576 | 1,5 | 2,42 |
| Mg | 1,31 | 3,62 | 1,293 | 1,2 | 2,39 |
| Ca | 1 | 3,07 | 1,034 | 1 | 2,2 |
| Sr | 0,95 | 2,87 | 0,963 | 1 | 2,13 |
| Ba | 0,89 | 2,68 | 0,881 | 0,9 | 2,02 |
| Ra | 0,9 | 2,69 | 0,89 | 0,9 | – |
| Sc | 1,36 | 3,37 | 1,19 | 1,3 | 2,35 |
| Ti | 1,54 | 3,45 | 1,38 | 1,6 | 2,23 |
| V | 1,63 | 3,64 | 1,53 | (II) 1.5 (III) 1.7 (V) 2.00 | 2,08 |
| Cr | 1,66 | 3,72 | 1,65 | (II) 1.6 (III) 1.8 (V) 2.2 | 2,12 |
| Mn | 1,55 | 3,46 | 1,75 | (II) 1.5 (III) 1.8 (IV) 2.0 (VII) 2.3 | 2,2 |
| Fe | 1,83 | 4,03 | 1,8 | (II) 1.8 (III) 1.9 | 2,32 |
| Co | 1,88 | 4,27 | 1,84 | (II) 1.8 (III) 2.0 (IV) 3.1 | 2,34 |
| Ni | 1,91 | 4,4 | 1,88 | (II) 1.9 (III) 2.0 (IV) 3.4 | 2,32 |
| Cu | 1,9 | 4,48 | 1,85 | (I) 1.8) (II) 2.1 | 2,86 |
| Zn | 1,65 | 4,4 | 1,59 | 1,6 | 2,26 |
| Y | 1,22 | 3,26 | 1,12 | 1,25 | 2,52 |
| Zr | 1,33 | 3,53 | 1,32 | 1,5 | 2,05 |
| Nb | 1,6 | 3,84 | 1,41 | (III) 1.6 (V) 1.9 | 2,59 |
| Mo | 2,16 | 3,92 | 1,47 | (IV) 1.8 (VI) 2.2 | 2,47 |
| Tc | 1,9 | 3,91 | 1,51 | (IV) 1.9 | 2,82 |
| Ru | 2,2 | 4,2 | 1,54 | (II) 2.0 (III) 2.0 (IV) 2.1 | 2,68 |
| Rh | 2,28 | 4,3 | 1,56 | (II) 2.1 (III) 2.1 | 2,65 |
| Pd | 2,2 | 4,45 | 1,58 | (II) 2.2 (III) 2.2 (IV) 2.3 | 2,7 |
| Ag | 1,93 | 4,44 | 1,87 | 1,9 | 2,88 |
| Cd | 1,69 | 4,14 | 1,52 | 1,7 | 2,36 |
| Hf | 1,3 | 3,5 | 1,16 | 1,4 | 2,01 |
| Ta | 1,5 | 4,1 | 1,34 | (III) 1.5 (V) 1.8 | 2,32 |
| W | 2,36 | 4,4 | 1,47 | (IV) 1.8 (V) 2.1 | 2,42 |
| Re | 1,9 | 3,97 | 1,6 | (IV) 1.9 | 2,59 |
| Os | 2,2 | 4,89 | 1,65 | (II) 2.0 (III) 2.1 (IV) 2.2 | 2,72 |
| Ir | 2,2 | 5,34 | 1,68 | (II) 2.1 (III) 2.2 | 2,79 |
| Pt | 2,28 | 5,57 | 1,72 | (II) 2.3 (III) 2.3 (IV) 2.4 | 2,98 |
| Au | 2,54 | 5,77 | 1,92 | (I) 2.0 (III) 2.4 | 2,81 |
| Hg | 2 | 4,97 | 1,76 | 1,8 | 2,92 |
| B | 2,04 | 4,29 | 2,05 | 1,9 | 3,04 |
| Al | 1,61 | 3,21 | 1,613 | 1,5 | 2,52 |
| Ga | 1,81 | 3,21 | 1,756 | 1,7 | 2,43 |
| In | 1,78 | 3,09 | 1,656 | 1,8 | 2,29 |
| Tl | 1,62 | 3,24 | 1,789 | (I) 1.4 (III) 1.9 | 2,26 |
| C | 2,55 | 6,26 | 2,544 | 2,5 | 3,15 |
| Si | 1,9 | 4,77 | 1,916 | 1,9 | 2,82 |
| Ge | 2,01 | 4,57 | 1,994 | 2 | 2,79 |
| Sn | 1,96 | 4,23 | 1,824 | (II) 1.8 (IV) 2.0 | 2,68 |
| Pb | 2,33 | 3,89 | 1,854 | (II) 1.9 (IV) 2.1 | 2,62 |
| N | 3,04 | 7,23 | 3,066 | 3 | 3,56 |
| P | 2,19 | 5,62 | 2,253 | 2,1 | 3,16 |
| As | 2,18 | 5,31 | 2,211 | 2 | 3,15 |
| Sb | 2,05 | 4,85 | 1,984 | (III) 1.9 (V) 2.2 | 3,05 |
| Bi | 2,02 | 4,11 | 2,01 | (III) 1.9 (V) 2.2 | – |
| O | 3,44 | 7,54 | 3,61 | 3,55 | 3,78 |
| S | 2,58 | 6,22 | 2,589 | 2,5 | 3,44 |
| Se | 2,55 | 5,89 | 2,424 | 2,4 | 3,37 |
| Te | 2,1 | 5,49 | 2,158 | 2,1 | 3,14 |
| Po | 2 | 4,91 | 2,19 | 2 | – |
| F | 3,98 | 10,41 | 4,193 | 4 | 4 |
| Cl | 3,16 | 8,29 | 2,869 | 3 | 3,56 |
| Br | 2,96 | 7,59 | 2,685 | 2,8 | 3,45 |
| I | 2,66 | 6,76 | 2,359 | 2,5 | 3,2 |
| At | 2,2 | 5,87 | 2,39 | 2,2 | – |
| La | 1,1 | 3,06 | – | 1,2 | 2,49 |
| Ce | 1,12 | 3,05 | – | – | 2,61 |
| Pr | 1,13 | 3,21 | – | – | 2,24 |
| Nd | 1,14 | 3,72 | – | – | 2,11 |
| Pm | 1,13 | 2,86 | – | – | – |
| Sm | 1,17 | 2,9 | – | – | 1,9 |
| Eu | 1,2 | 2,89 | – | – | 1,81 |
| Gd | 1,2 | 3,14 | – | – | 2,4 |
| Tb | 1,1 | 3,51 | – | – | 2,29 |
| Dy | 1,22 | 3,15 | – | – | 2,07 |
| Ho | 1,23 | 3,18 | – | – | 2,12 |
| Er | 1,24 | 3,21 | – | – | 2,02 |
| Tm | 1,25 | 3,61 | – | – | 2,03 |
| Yb | 1,1 | 3,12 | – | – | 1,78 |
| Lu | 1,27 | 2,89 | 1,09 | – | 2,68 |
| Th | 1,3 | 3,63 | – | (IV) 1.3 | 2,62 |
| U | 1,38 | 3,36 | – | (IV) 1.4 (V) 1.6 (VI) 1.8 | 2,45 |
| He | – | 12,29 | 4,16 | – | – |
| Ne | – | 10,78 | 4,787 | – | – |
| Ar | – | 7,88 | 3,242 | – | – |
| Kr | 3,23 | 7 | 2,966 | – | – |
| Xe | 3,02 | 6,07 | 2,582 | – | – |
| Rn | 2,81 | 5,37 | 2,6 | – | – |
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, типа соединения, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, то есть от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности (полярности), силовую постоянную и т. д.
В период бурного развития квантовой химии как средства описания молекулярных образований (середина и вторая половина XX века) плодотворным оказался подход Л. Полинга, который в числе прочих исследований ввёл собственную шкалу электроотрицательностей, в которой из «стандартных» элементов максимальную имеет фтор (


где 
Одним из наиболее развитых в настоящее время подходов является подход Сандерсона. В основу этого подхода легла идея выравнивания электроотрицательностей атомов при образовании химической связи между ними. В многочисленных исследованиях были найдены зависимости между электроотрицательностями Сандерсона и важнейшими физико-химическими свойствами неорганических соединений подавляющего большинства элементов периодической таблицы.[9] Очень плодотворной оказалась и модификация метода Сандерсона, основанная на перераспределении электроотрицательности между атомами молекулы для органических соединений.[10][11][12]
Практическая шкала электроотрицательности атомов[править | править код]
Детальный поиск взаимосвязи между шкалами электроотрицательностей позволил сформировать новый подход к выбору практической шкалы электроотрицательностей атомов. В основу практической шкалы электроотрицательностей атомов взята концепция Луо-Бенсона, использующая понятие ковалентного радиуса r. По физическому смыслу электроотрицательность атома χЛБ — это величина, пропорциональная энергии притяжения валентного электрона, находящегося на расстоянии r от атомного ядра:

Где m и n — число p- и s- электронов в валентной оболочке атома.
Сами Луо и Бенсон рекомендовали для величины χ ЛБ (электроотрицательности атомов) более точное название «ковалентный потенциал». В процессе разработки практической шкалы электроотрицательностей шкала Луо и Бенсона была дополнена электроотрицательностями d- и f-элементов, для которых в расчётное управление введено число внешних электронов, равное двум. Значения электроотрицательностей атомов в практической шкале χ * и их ковалентных радиусов r (Å) приведены в таблице:
Значения электроотрицательностей атомов в практической шкале χ* и их ковалентных радиусов r, (Å).[13]
| Z | Элемент | χ* | r |
|---|---|---|---|
| 1 | H | 2,7 | 0,371 |
| 3 | Li | 0,75 | 1,337 |
| 4 | Be | 2,08 | 0,96 |
| 5 | B | 3,66 | 0,82 |
| 6 | C | 5,19 | 0,771 |
| 7 | N | 6,67 | 0,75 |
| 8 | O | 8,11 | 0,74 |
| 9 | F | 9,915 | 0,706 |
| 11 | Na | 0,65 | 1,539 |
| 12 | Mg | 1,54 | 1,30 |
| 13 | Al | 2,40 | 1,248 |
| 14 | Si | 3,41 | 1,173 |
| 15 | P | 4,55 | 1,10 |
| 16 | S | 5,77 | 1,04 |
| 17 | Cl | 7,04 | 0,994 |
| 19 | K | 0,51 | 1,953 |
| 20 | Ca | 1,15 | 1,74 |
| 21 | Sc | 1,49 | 1,34 |
| 22 | Ti | 1,57 | 1,27 |
| 23 | V | 1,65 | 1,21 |
| 24 | Cr | 1,72 | 1,16 |
| 25 | Mn | 1,71 | 1,17 |
| 26 | Fe | 1,72 | 1,16 |
| 27 | Co | 1,83 | 1,09 |
| 28 | Ni | 1,92 | 1,04 |
| 29 | Cu | 2,30 | 0,87 |
| 30 | Zn | 1,87 | 1,07 |
| 31 | Ga | 2,38 | 1,26 |
| 32 | Ge | 3,24 | 1,223 |
| 33 | As | 4,20 | 1,19 |
| 34 | Se | 5,13 | 1,17 |
| 35 | Br | 6,13 | 1,141 |
| 37 | Rb | 0,48 | 2,087 |
| 38 | Sr | 1,05 | 1,91 |
| 39 | Y | 1,31 | 1,52 |
| 40 | Zr | 1,40 | 1,43 |
| 41 | Nb | 1,43 | 1,40 |
| 42 | Mo | 1,46 | 1,37 |
| 43 | Tc | 1,56 | 1,28 |
| 44 | Ru | 1,65 | 1,21 |
| 45 | Rh | 1,69 | 1,18 |
| 46 | Pd | 1,80 | 1,11 |
| 47 | Ag | 1,79 | 1,12 |
| 48 | Cd | 1,56 | 1,28 |
| 49 | In | 2,00 | 1,497 |
| 50 | Sn | 2,83 | 1,412 |
| 51 | Sb | 3,62 | 1,38 |
| 52 | Te | 4,38 | 1,37 |
| 53 | I | 5,25 | 1,333 |
| 55 | Cs | 0,43 | 2,323 |
| 56 | Ba | 1,01 | 1,98 |
| 57 | La | 1,17 | 1,71 |
| 59 | Pr | 1,20 | 1,66 |
| 61 | Pm | 1,23 | 1,63 |
| 63 | Eu | 1,23 | 1,62 |
| 65 | Tb | 1,28 | 1,56 |
| 67 | Ho | 1,31 | 1,53 |
| 69 | Tm | 1,33 | 1,50 |
| 70 | Yb | 1,34 | 1,49 |
| 71 | Lu | 1,36 | 1,47 |
| 72 | Hf | 1,41 | 1,42 |
| 73 | Ta | 1,44 | 1,39 |
| 74 | W | 1,45 | 1,38 |
| 75 | Re | 1,46 | 1,37 |
| 76 | Os | 1,46 | 1,37 |
| 77 | Ir | 1,46 | 1,37 |
| 78 | Pt | 1,49 | 1,34 |
| 79 | Au | 1,50 | 1,33 |
| 80 | Hg | 1,51 | 1,32 |
| 81 | Tl | 1,91 | 1,57 |
| 82 | Pb | 2,60 | 1,55 |
| 83 | Bi | 3,29 | 1,52 |
| 84 | Po | 4,03 | 1,49 |
| 85 | At | 4,67 | 1,50 |
Приведённая в таблице совокупность значение χ* демонстрирует важную особенность практической шкалы электроотрицательностей: значение электроотрицательности для водорода в этой шкале χ*(H)=2,7 определяет чёткую границу между металлами (М) и неметаллами [Н]: χ*(М) < χ*[Н]. Исключение составляют лишь постпереходные металлы (Sn, Bi, Po), в то время как в других шкалах значения электроотрицательностей, меньшие электроотрицательности водорода, помимо металлов, имеют большинство неметаллов (B, Si, Ge, As, Sb, Te), а в шкале Парра-Пирсона даже углерод, фосфор, сера, селен, иод.[13]
Особое положение водорода в практической шкале даёт основание рассматривать электроотрицательность водорода как «меру» электроотрицательности элементов, которая позволяет осуществить переход к безразмерной практической шкале χ*, определяемой как отношение χ*(X)/ χ*(Н).[13]
Значения относительной электроотрицательности[править | править код]
| Группа | I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A |
| Период | ||||||||||||||||||
| 1 | H 2,20 |
He 4,5 |
||||||||||||||||
| 2 | Li 0,99 |
Be 1,57 |
B 2,04 |
C 2,55 |
N 3,04 |
O 3,44 |
F 3,98 |
Ne 4,4 |
||||||||||
| 3 | Na 0,98 |
Mg 1,31 |
Al 1,61 |
Si 1,90 |
P 2,19 |
S 2,58 |
Cl 3,16 |
Ar 4,3 |
||||||||||
| 4 | K 0,82 |
Ca 1,00 |
Sc 1,36 |
Ti 1,54 |
V 1,63 |
Cr 1,66 |
Mn 1,55 |
Fe 1,83 |
Co 1,88 |
Ni 1,91 |
Cu 1,90 |
Zn 1,65 |
Ga 1,81 |
Ge 2,01 |
As 2,18 |
Se 2,55 |
Br 2,96 |
Kr 3,00 |
| 5 | Rb 0,82 |
Sr 0,95 |
Y 1,22 |
Zr 1,33 |
Nb 1,6 |
Mo 2,16 |
Tc 1,9 |
Ru 2,2 |
Rh 2,28 |
Pd 2,20 |
Ag 1,93 |
Cd 1,69 |
In 1,78 |
Sn 1,96 |
Sb 2,05 |
Te 2,1 |
I 2,66 |
Xe 2,60 |
| 6 | Cs 0,79 |
Ba 0,89 |
* |
Hf 1,3 |
Ta 1,5 |
W 2,36 |
Re 1,9 |
Os 2,2 |
Ir 2,20 |
Pt 2,28 |
Au 2,54 |
Hg 2,00 |
Tl 1,62 |
Pb 2,33 |
Bi 2,02 |
Po 2,0 |
At 2,2 |
Rn 2,2 |
| 7 | Fr
0,7 |
Ra 0,9 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
| Лантаноиды | * |
La 1,1 |
Ce 1,12 |
Pr 1,13 |
Nd 1,14 |
Pm 1,13 |
Sm 1,17 |
Eu 1,2 |
Gd 1,2 |
Tb 1,1 |
Dy 1,22 |
Ho 1,23 |
Er 1,24 |
Tm 1,25 |
Yb 1,1 |
Lu 1,27 |
||
| Актиноиды | ** |
Ac 1,1 |
Th 1,3 |
Pa 1,5 |
U 1,38 |
Np 1,36 |
Pu 1,28 |
Am 1,13 |
Cm 1,28 |
Bk 1,3 |
Cf 1,3 |
Es 1,3 |
Fm 1,3 |
Md 1,3 |
No 1,3 |
Lr 1,291 |
||
Примечания[править | править код]
- ↑ Hydrogen: electronegativity (англ.). Webelements.
- ↑ Mulliken, R. S. (1934). “A New Electroaffinity Scale; Together with Data on Valence States and on Valence Ionization Potentials and Electron Affinities”. Journal of Chemical Physics. 2 (11): 782—793. Bibcode:1934JChPh…2..782M. DOI:10.1063/1.1749394.
- ↑ Mulliken, R. S. (1935). “Electronic Structures of Molecules XI. Electroaffinity, Molecular Orbitals and Dipole Moments”. J. Chem. Phys. 3 (9): 573—585. Bibcode:1935JChPh…3..573M. DOI:10.1063/1.1749731.
- ↑ 1 2 Учредитель: Некоммерческое партнерство «Международное партнерство распространения научных знаний» Адрес: 119234, г Москва, ГСП-1, Ленинские горы, МГУ, Д. 1. В Сколтехе создали новую шкалу электроотрицательности. «Научная Россия» — наука в деталях! (7 апреля 2021). Дата обращения: 10 мая 2021.
- ↑ 1 2 Christian Tantardini, Artem R. Oganov. Thermochemical electronegativities of the elements (англ.) // Nature Communications. — 2021-04-07. — Vol. 12, iss. 1. — P. 2087. — ISSN 2041-1723. — doi:10.1038/s41467-021-22429-0.
- ↑ Максим Абаев Электроны и котики // Наука и жизнь, 2021, № 6. — с. 88—91
- ↑ Xiao Dong, Artem R. Oganov et al. Electronegativity and chemical hardness of elements under pressure (англ.) // PNAS. — 2022. — 1 March (vol. 119, iss. 10).
- ↑ Hydrogen: electronegativity (англ.). webelements.
- ↑ Sanderson R.T. Chemical Bonds and Bond Energy. N.Y.: Acad.Press, 1976.- 218 p.
- ↑ С. С. Бацанов, Структурная химия. Факты и зависимости. — М: Диалог-МГУ, 2000. — 292 с. ISBN 5-89209-597-5
- ↑ Н. С. Зефиров, М. А. Кирпиченок, Ф. Ф. Измайлов, М. И. Трофимов, Докл. АН СССР, 296, 1987, 883.
- ↑ М. И. Трофимов, Е. А. Смоленский, Известия Академии наук. Серия химическая, 2005, 2166—2176.
- ↑ 1 2 3 Филиппов Г.Г., Горбунов А.И. Новый подход к выбору практической шкалы электроотрицательностей атомов.. — Российский химический журнал, 1995. — Т. 39, вып.2. — С. 39—42.
См. также[править | править код]
- Сродство к электрону