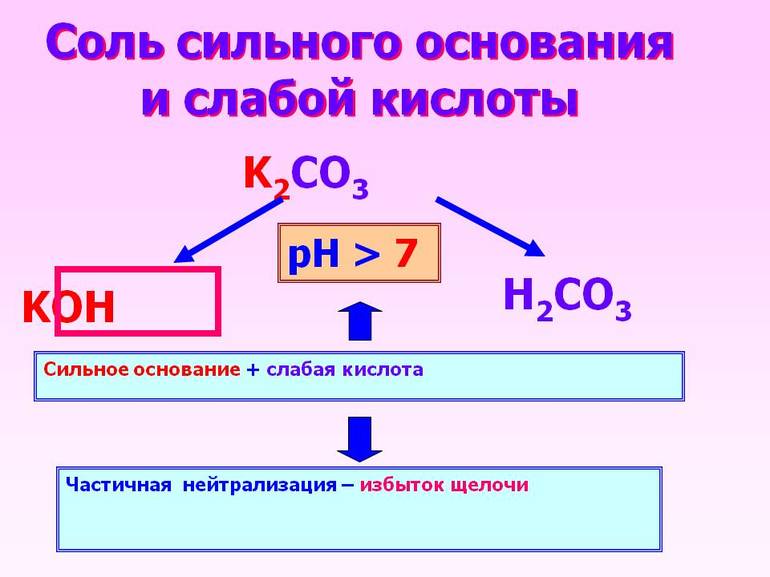
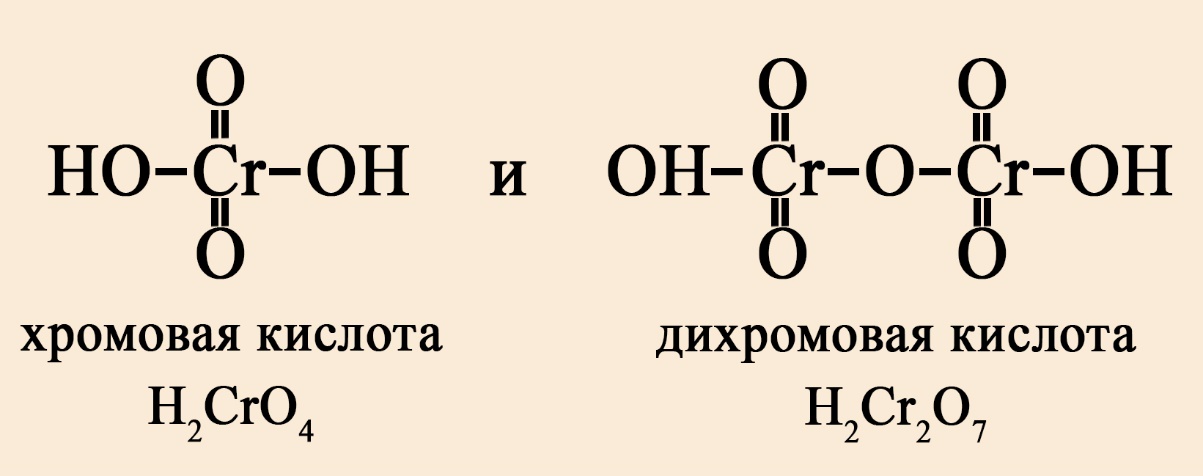Классификация кислот
Материал по химии
- Определение кислот
- Классификация кислот по составу
- Классификация кислот по основности
- Сильные и слабые кислоты
- Тривиальные названия некоторых кислот
- «Протон» или «катион»?
- Кислоты и индикаторы
Определение кислот
Кислоты ‒ это вещества, способные в растворах отдавать катион (протон) водорода.
Примеры диссоциации кислот:
HCl ↔ H+ + Cl‒
H2SO4 ↔ 2H+ + SO42‒
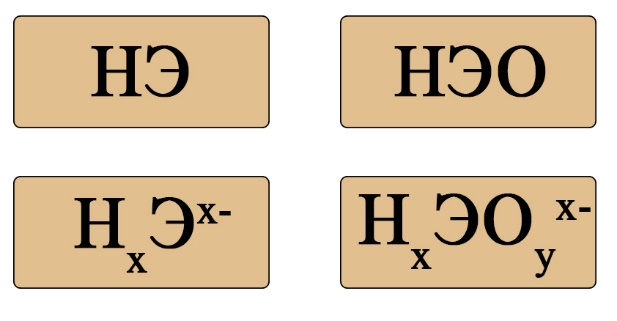
Если пока понятие диссоциации неизвестно, легче ориентироваться по общим формулам кислот:
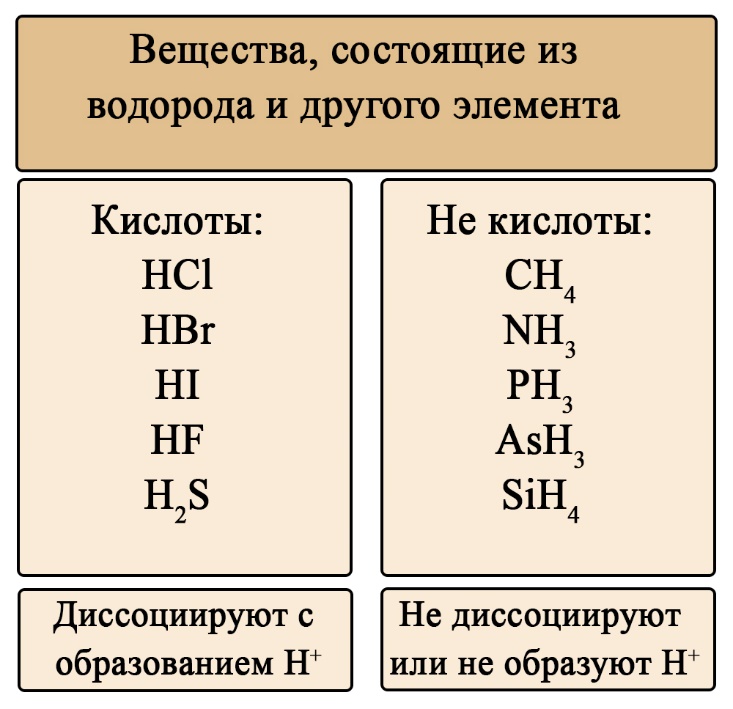
Важен не только состав, но и последовательность. На первом месте должен стоять водород, за ним – элемент, если в составе есть кислород, то он должен стоять последним. Например, HCl – кислота (соответствует формуле HЭ), H2S – тоже кислота (на первом месте водород, на втором – сера), а вот NH3 несмотря на то, что состоит из водорода и элемента, не является кислотой, это легко определить по последовательности: в этой формуле сначала стоит элемент, а за ним – водород (иногда, чтобы запутать сдающего, составитель может написать не NH3, а H3N, Вы должны помнить, что NH3 (аммиак), PH3(фосфин), AsH3 (арсин), CH4 (метан) – не являются кислотами, так как в воде либо не диссоциируют, либо диссоциируют без образования протона водорода. H2SO4 – является кислотой, так как формула имеет порядок элементов «водород → элемент → кислород», а NaOH, тоже состоящая из элемента, кислорода и водорода – кислотой не является, так как тут последовательность будет такова: «элемент → кислород → водород».
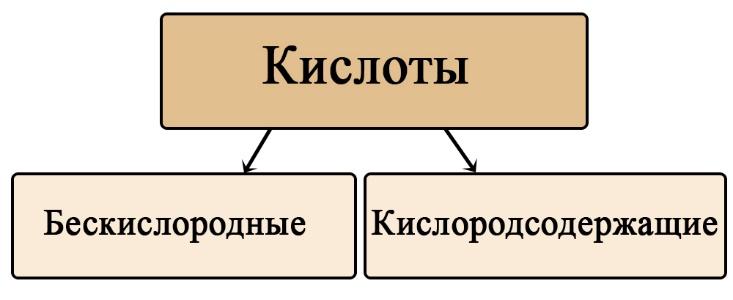
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие – содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
|
Бескислородные |
Кислородсодержащие |
|
HCl |
HClO4 |
|
H2S |
H2SO3 |
|
HBr |
HBrO |
|
HI |
HIO2 |
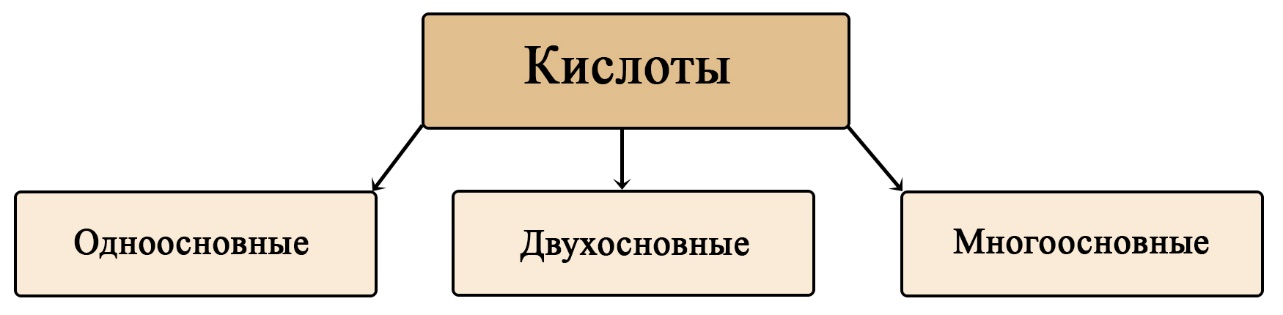
Классификация кислот по основности
Кислоты могут отдать столько водорода, сколько имеется в их составе (в большинстве случаев, есть исключения). Если может отдать максимум один водород – то кислота относится к одноосновным, если может отдать максимум два протона водорода – то двухосновная и так далее.
Например:
HCl ↔ H+ + Cl‒ (одноосновная)
H2SO4 ↔ 2H+ + SO42‒ (двухосновная)
H3PO4 ↔ 3H+ + PO43- (трехосновная/многоосновная)
Таб. Примеры кислот с разной основностью
|
Одноосновные (один водород) |
Двухосновные (два водорода) |
Многоосновные (три и более протона водорода) |
|
HNO3 |
H2S |
H3PO4 |
|
HF |
H2SiO3 |
H3BO3 |
|
HBrO |
H2CO3 |
H4P2O7 |
Сильные и слабые кислоты
От чего зависит сила кислот? В первую очередь от скорости отдачи протона водорода при диссоциации (чем быстрее кислота отдает протон водорода, тем она считается сильнее). Как определить скорость «на глаз», не имея под рукой никаких справочных материалов, кроме таблицы Менделеева?
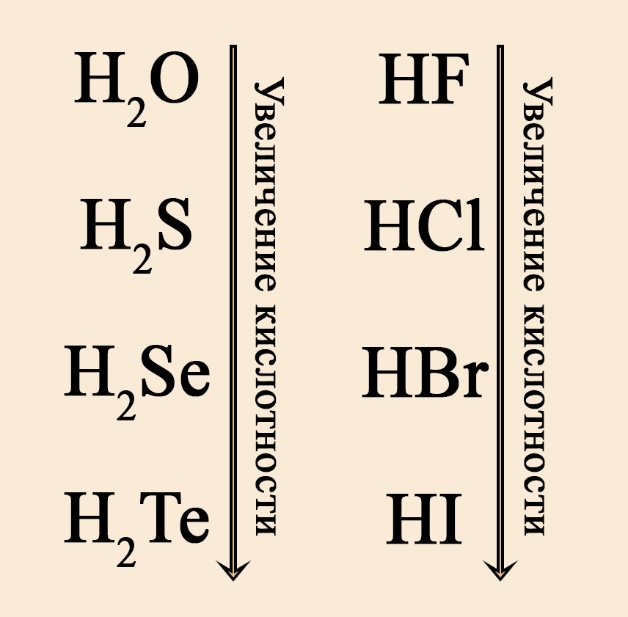
- Если кислота бескислородная, то скорость диссоциации можно определить по радиусу атома, образующего эту кислоту элемента. Напомним, что радиус увеличивается в ПС (периодической системе) сверху-вниз и справа-налево. Так, в ряду кислот HF → HCl → HBr → HI радиус увеличивается от фтора к йоду, так как йод стоит в ПС значительно ниже, чем фтор. Радиус фтора небольшой, поэтому протон водорода прочно связан со фтором, скорость диссоциации будет низкой, значит, кислота слабая. У йода пять электронных оболочек, между йодом и водородом большее расстояние, чем между фтором и водородом, поэтому молекула йодоводорода будет диссоциировать значительно быстрее, значит, кислота сильная. Аналогичную закономерность можно наблюдать в ряду кислот, образованных халькогенами (неметаллами VIА-группы): чем ниже халькоген, тем сильнее образуемая им кислота, поэтому H2S слабее H2Se, а H2Se слабее, чем H2Te.
- Если кислота кислородсодержащая, то её сила зависит от количества кислорода, не входящего в гидроксо-группы. Чем больше кислорода вне -OH группы, тем сильнее кислота. Так, дихромовая кислота сильнее хромовой, потому как дихромовая кислота имеет четыре кислорода вне гидроксо-группы, а хромовая – два кислорода вне гидроксогруппы.
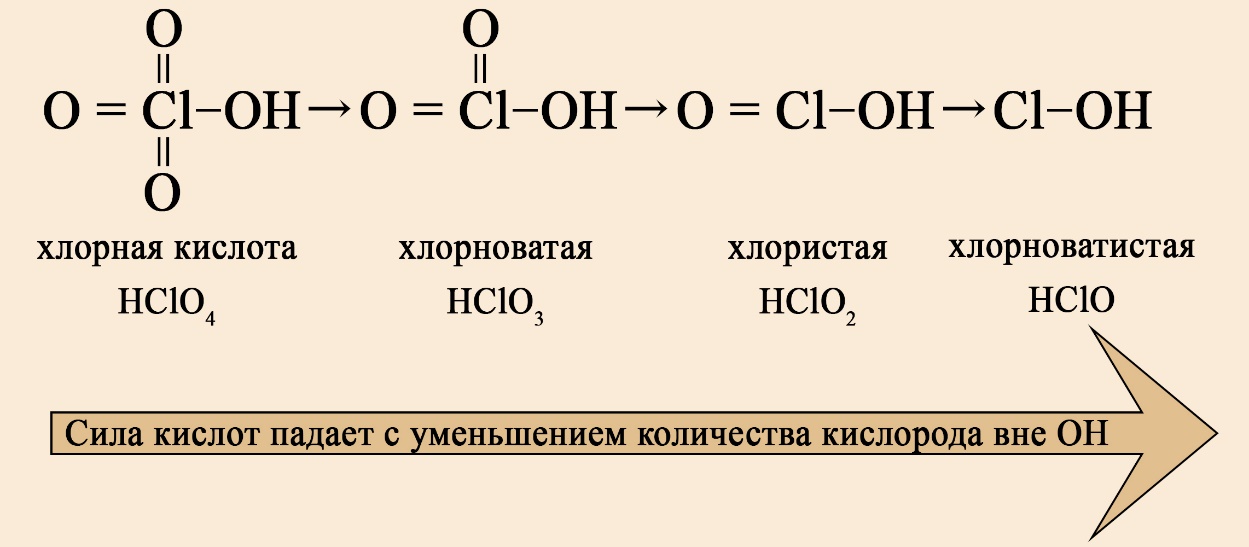
В ряду хлорсодержащих кислот наблюдается такая же закономерность:
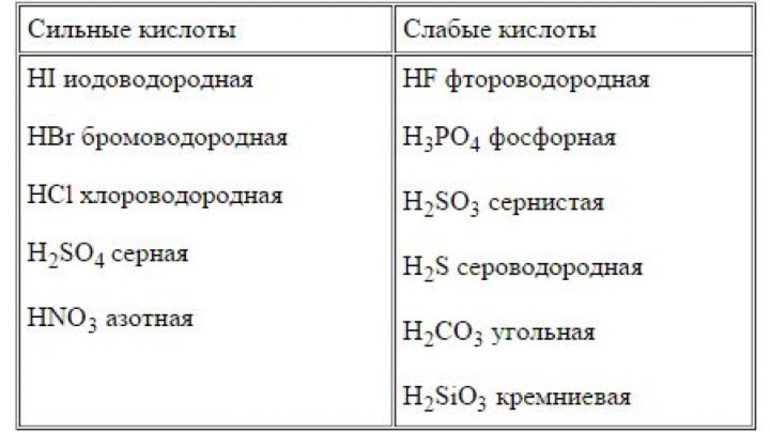
Список сильных кислот: HI, HCl, HBr, HNO3, HClO4, HClO3, HBrO3, H2SO4, HMnO4, H2Cr2O7.
Список слабых кислот: H2S, HF, HNO2, H2SO3, H2CO3, HClO, карбоновые кислоты.
В действительности классификация кислот по их силе несколько богаче, и те кислоты, которые в школе записывают в слабые (например, ортофосфорную и фтороводородную) на самом деле относят к кислотам средней силы. Помимо классификации важно знать и названия кислот, а также их остатки. Остатками кислот называют отрицательно-заряженные ионы (анионы), которые образуются при диссоциации кислоты в воде. То есть остаток кислоты – это частица, которая остаётся, если отнять у кислоты весь водород. Вот несколько таблиц, в которых кислоты сгруппированы по силе, с указанием соответствующих кислотных остатков и примерами солей:
Таб. Самые сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HI |
йодоводородная |
I‒ |
NaI -йодид натрия |
|
HBr |
Бромоводородная |
Br‒ |
KBr – бромид калия |
|
HCl |
Хлороводородная, соляная |
Cl‒ |
CaCl2 – хлорид кальция |
|
HClO4 |
Хлорная |
ClO4‒ |
NaClO4 – перхлорат натрия |
|
H2SO4 |
Серная |
SO42‒ |
K2SO4 – сульфат калия |
|
HMnO4 |
Марганцовая |
MnO4‒ |
NaMnO4 – перманганат натрия |
Таб. Сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HClO3 |
Хлорноватая |
ClO3‒ |
KClO3 – хлорат калия |
|
HBrO3 |
Бромноватая |
BrO3‒ |
Ba(BrO3)2 – бромат бария |
|
H2Cr2O7 |
Дихромовая |
Cr2O72‒ |
(NH4)2Cr2O7 – дихромат аммония |
Таб. Кислоты средней силы и их остатки (в ОГЭ и ЕГЭ считаем слабыми)
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HNO2 |
Азотистая |
NO2‒ |
NaNO2 – нитрит натрия |
|
H3PO4 |
Фосфорная (ортофосфорная) |
PO43‒ |
(NH4)3PO4 – фосфат аммония |
|
HF |
Фтороводородная (плавиковая) |
F‒ |
CaF2 – фторид кальция |
|
HClO2 |
Хлористая |
ClO2‒ |
KClO2 – хлорит калия |
Таб. Слабые кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
H2S |
Сероводородная |
S2‒ |
MgS – сульфид магния |
|
HCN |
Циановодородная |
CN‒ |
KCN – цианид калия |
|
H2CO3 |
Угольная |
CO32‒ |
CaCO3 – карбонат кальция |
|
H2SO3 |
Сернистая |
SO32‒ |
BaSO3 – сульфит бария |
|
HClO |
Хлорноватистая |
ClO‒ |
NaClO – гипохлорит натрия |
|
H2SiO3 |
Кремниевая |
SiO32‒ |
K2SiO3 – силикат калия |
|
CH3COOH |
Уксусная |
CH3COO‒* |
CH3COONa – ацетат натрия |
*В органических кислотах водород пишется не в начале молекулы, а в конце, например:
CH3COOH – уксусная кислота, диссоциирует следующим образом:
CH3COOH ↔ CH3COO‒ + H+
C2H5COOH – пропионовая кислота
CH3CH2COOH ↔ CH3CH2COO‒ + H+
C3H7COOH – масляная кислота.
C3H7COOH ↔ C3H7COO‒ + H+
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- H2SO2
- HCl
- HNO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородная слабая
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HNO2
- HBr
- H3PO4
- одноосновная сильная
- одноосновная слабая
- многоосновная сильная
- многоосновная слабая
Задание по образцу ФИПИ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HF
- H2CO3
- H2SiO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородна слабая
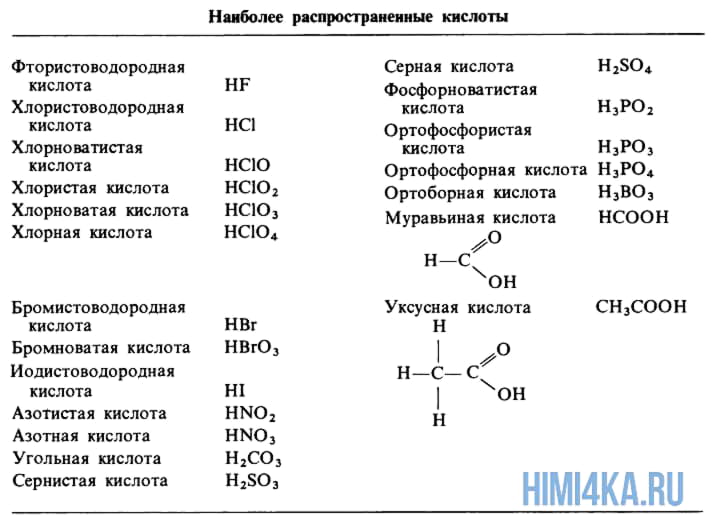
Тривиальные названия некоторых кислот
Многие кислоты имеют альтернативное историческое название, например, хлороводородную кислоту еще называют соляной кислотой, потому что она образует самую популярную соль – NaCl (поваренная соль, используемая в быту). Фтороводородную кислоту называют плавиковой, так как она плавит стекло (поэтому данную кислоту не хранят в стеклянной таре). Муравьиную и щавелевую кислоты назвали так по источнику получения.
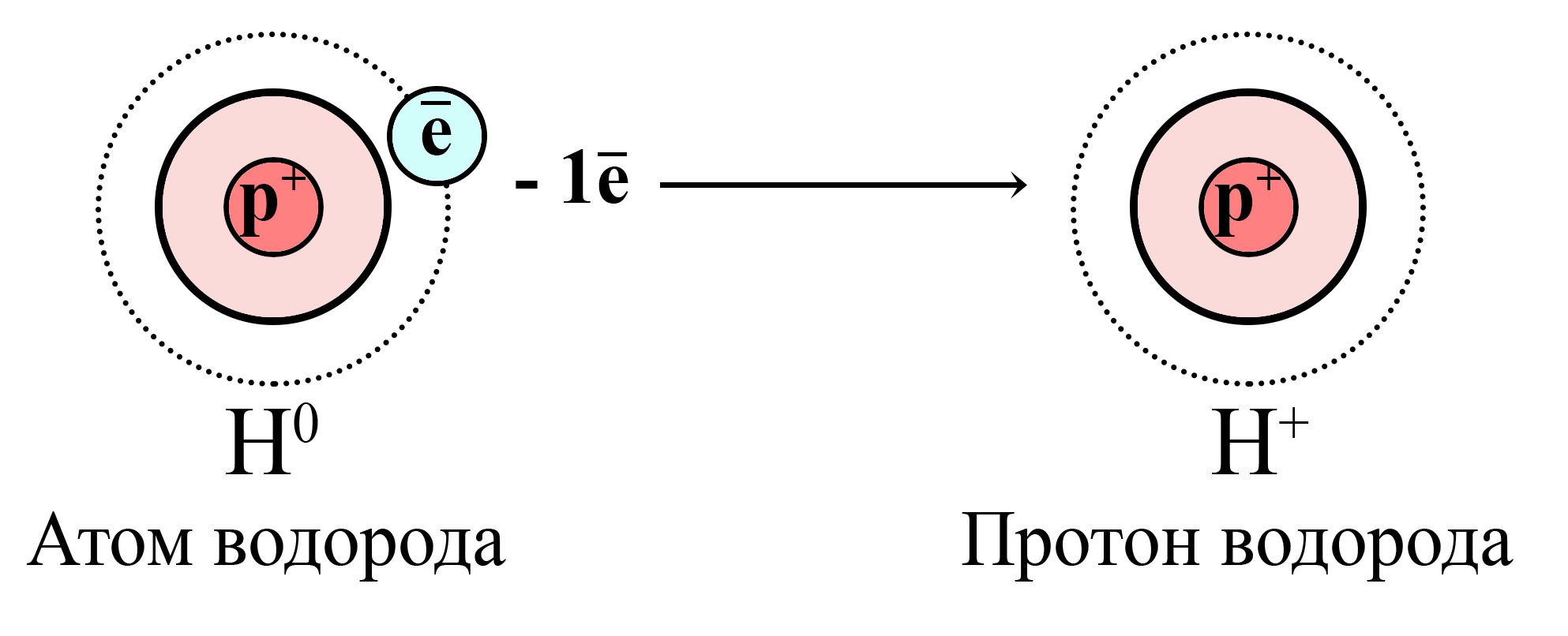
«Протон» или «катион»?
Для всех положительно заряженных частиц характерен термин «катион», однако, по отношению к водороду принято говорить «протон». А дело всё в том, что другие элементы при потере внешних электронов, все равно обладают электронами внутренних слоёв, тогда как водород, содержащий всего один электрон, потеряв его, становится протоном (нейтронов в ядре тоже нет).
Поэтому принято говорить, что кислота отдает не катион водорода, а протон водорода.
Кислоты и индикаторы
Для определения кислот в растворах можно использовать стандартные индикаторы (вещества, меняющие цвет в определенной среде): лакмус и метиловый оранжевый, фенолфталеин кислотами не окрашивается. Лакмус в кислых растворах (рН < 7) становится красным, а метиловый оранжевый – красным или розовым.
Узнать, сильная или слабая кислота можно по константе диссоциации, которая приводится в справочниках по химии, а также на химических сайтах в интернете. Чем ее значение ближе к единице, тем кислота более сильная. Для очень сильных кислот была построена также шкала констант диссоциации выше единицы, но она несколько условна и зависит от методики измерений и расчетов.
Часто, для удобства, приводятся значения показателей константы диссоциации. Это отрицательный десятичный логарифм от значения константы диссоциации. При этом значения имеют более компактную запись.
Следует учесть, что константа диссоциации является константой только в определенном растворителе и при определенной температуре. Обычными условиями для ее выражения являются водные растворы и температура 20-25 С. При изменении растворителя и температуры, константа диссоциации меняется. Обычно она увеличивается при нагревании. Влияние растворителя более сложно, но обычно в кислых растворителях константа диссоциации кислот снижается, а в основных – увеличивается. Для измерения силы сильных кислот, часто используют уксусную кислоту, в которой сильные кислоты становятся более слабыми.
Многие школьники и студенты часто путают силу кислоту (которая количественно выражается константой диссоциации) и коррозионную активность кислоты (способность разрушать материалы, растворять металлы). Эти величины связаны лишь косвенно и для учета коррозионной активности необходимо учитывать еще несколько факторов (электродные реакции, комплексообразование, образование защитных слоев и др.), а не только силу кислоты. Например, фтороводородная кислота – средней силы по константе диссоциации, но растворяет многие материалы за счет сильной сольватирующей и комплексообразующей способности. Причем безводный фтороводород может растворять белки и нуклеиновые кислоты без разрушения, что используется в биохимии.
Как определить силу кислоты
Какая из кислот сильнее? Ответы на этот вопрос не так уж прост, как кажется на первый взгляд. Смотря по каким признакам и в какой среде определять силу кислоты. Не стоит также путать окислительные и кислотные свойства кислоты – иногда они могут не совсем совпадать. Например, смесь соляной и азотной кислоты – «царская водка» – один из самых сильных окислителей. Но соляная и азотная кислоты не самые сильные.

Вам понадобится
- – справочные химические таблицы.
Инструкция
С точки зрения теории электролитической диссоциации кислота – это соединение, которое при диссоциации в воде распадается на положительный ион водорода и отрицательно заряженное основание. Из определения вытекает, что степень диссоциации определяет силу кислоты.
Степень диссоциации зависит от концентрации и задается уравнением: a = Cдис/Собщ, %; где Сдис – молярная концентрация продиссоциировавших молекул, Собщ – общая молярная концентрация вещества, взятого для приготовления раствора. Сильные кислоты диссоциируют практически полностью, кислоты средней силы – от 3 до 30%, слабые – менее 3 %. Как видно из уравнения, чем больше концентрация вещества в растворе, тем меньше величина а. Зная степень диссоциации вы можете судить о силе кислоты.
Силу кислоты также характеризует константа диссоциации или константа кислотности. Она задается выражением: К = [A+]*[B-]/[AB] = const, где [A+], [B-] – равновесные концентрации продиссоциировавших ионов, [AB] – равновесная концентрация непродиссоциировавших молекул. От общей молярной концентрации вещества константа диссоциации не зависит. С повышением температуры степень и константа диссоциации увеличиваются.
Чтобы определить силу кислоты, найдите ее константу диссоциации в справочных таблицах. Чем она больше, тем сильнее кислота. Сильные кислоты имеют константу от 43,6 (HNO3) и выше. К сильным кислотам относится часть минеральных кислот: хлорная, соляная, серная и другие. К слабым кислотам относятся органические кислоты (уксусная, яблочная и др.) и некоторые из минеральных (угольная, цианистая).
Наряду с константой используется показатель кислотности pK, который равный отрицательному десятичному логарифму от константы: pK = – lgK. У сильных кислот он отрицательный.
Но как определить какая из сильных кислот сильнее, если степени их диссоциации в воде стремятся к бесконечности? Такие кислоты называются суперкислотами. Чтобы сравнить между собой, их рассматривают по теории Льюиса как акцепторы электронов. Силу суперкислот измеряют в других средах, имеющих при взаимодействии с ними свойства слабого основания. Эти среды связывают протоны водорода кислоты.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
На сильные и слабые эти субстанции подразделяются в зависимости от возможности отдавать ионы водорода во время взаимодействия с металлами.
Общие свойства
Все кислоты содержат атомы водорода, которые способны вступать в реакцию. Таким образом, кислота представляет собой сложное вещество, молекулы которого состоят из разного количества атомов водорода и кислотного остатка. Эти соединения обладают кислым и зачастую слегка металлическим вкусом. При контакте с ними индикаторы приобретают другой оттенок вплоть до кардинальной смены цвета.
Химические свойства, являющиеся общими для всех кислот:
- Все вещества, содержащие кислород, в процессе разложения образуют воду и кислотный оксид.
- Бескислородные соединения распадаются на простые элементы.
- Окислители вступают в реакцию со всеми расположенными слева от H металлами из ряда активности.
- Кислоты взаимодействуют с солями, образованными более слабым соединением.
Физические свойства веществ могут кардинально отличаться. Например, одни из них имеют запах, у других он отсутствует совершенно.
Кислоты могут быть жидкими, газообразными и твёрдыми. К твёрдым соединениям относятся, например, C2H204 и H3BO3.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические реакции
При соединении сильной кислоты с таким же основанием получится нейтральный раствор. Произошедшая в этом случае химическая реакция называется нейтрализацией. Если же заменить основание на слабое, то полностью диссоциирует только кислое вещество.
Второй компонент не распадается на ионы полностью.
Слабое основание лишь незначительно вступает в реакцию со слабой кислотой.
Когда кислотное соединение реагирует с сильным основанием, то первый реагент проходит частичную диссоциацию, второй же полностью диссоциирует.
Полученный в результате раствор обладает слабыми свойствами основания.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.
При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.
Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ. Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Кривые титрования
Кривые титрования представляют собой график зависимости параметра вещества, который связан с концентрацией реагента, подвергающегося титрованию, титранта или продукта химической реакции, от степени протекания процесса. Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.
Существуют теоретические и экспериментальные кривые. Теоретические используются для того, чтобы обосновать выбор индикатора. Их расчёт осуществляется по уравнению реакции и данным об исходной концентрации соединений, вступающих в реакцию. Экспериментальные кривые позволяют определить точки эквивалентности. Их получают путём измерения одного из свойств системы в процессе титрования.
Протекание и результат химических реакций, в которые вступает любая кислота, напрямую зависят от того, является это вещество сильным или слабым. В специальных химических таблицах приведены наименования самых распространённых соединений, что позволяет безошибочно определить силу реагента.
Содержание материала
- Классификация:
- Водородный показатель
- Способы определения
- Буферный раствор
- Что такое щелочь?
- Основная классификация
- Диссоциация кислот
- Сильные и слабые кислоты и основания
- Сильные кислоты
- Список сильных кислот
- Слабые кислоты
- Список слабых кислот
- Сильные основания
- Список сильных оснований
- Слабые основания
- Список слабых оснований
- Способы определения pH
- Инструментальный метод
- Индикаторы
- Соль
- Показатель кислотности растворов рН, механизм действия
- Работа с кислотами и щёлочами
Классификация:
- Кислоты различают по составу на кислородсодержащие и бескислородные. Примеры кислот приведены ниже в таблице.
Бескислородные кислоты – это растворы галогеноводородов, атомы которых в растворе связаны полярной ковалентной связью. Название кислоты складывается из названия кислотного остатка в первую очередь, а дальше называется катион (водород). Так с хлором и водородом образуется хлороводородная кислота, а с серой – сероводородная.
Кислородосодержащие кислоты, или оксокислоты называют за счёт наличия в них кислорода. Общего принципа построения названия этих кислот нет, так что их названия необходимо запоминать на память.
- Кислоты различают по количеству атомов водорода на одноосновные (один атом водорода), двухосновные (два атома водорода), трёхосновные (три атома водорода).
| Основность кислоты — это число активных атомов водорода в молекуле кислоты | |
| Одноосновные | HClO4, HCl |
| Двухосновные | H2SO4, H2CO3 |
| Трехосновные | H3PO4 |
- Кислоты разделяют на сильные и слабые. К сильным относят галогенводородные и высшие кислородсодержащие кислоты, они растворимы. К слабым относят неустойчивые и нерастворимые в воде кислоты. Чтобы определить силу кислоты, существует правило: из числа атомов кислорода вычесть число атомов водорода, если получаемое число 2 или 3 – кислота сильная, если 1 или 0 – кислота слабая.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.
При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Что такое щелочь?
Щелочь — это те вещества, которые хорошо растворяются в воде. При этом реакция сопровождается с выделением тепла, с увеличением температуры. Если щёлочь сравнивать с кислотой, то на ощупь она намного «мыльнее», то есть скользкая. Вообще, щёлочи не сильно отстают от кислот по разъеданию и по силе. Они также могут с лёгкостью разъесть древесину, пластик, одежду и тому подобное.
Кстати, из щёлочей делают мыло, стекло, бумагу, ткань и это не весь список. Щёлочь можно найти у себя на кухне, ну или в магазине под названием пищевая сода. Кстати, пищевая сода это очень хороший помощник всем домохозяйкам.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Диссоциация кислот
Диссоциация кислот, от HF до HNO3, в водном растворе сопровождается высвобождением одного протона, т.е иона водорода H+.
- HNO3 → H+(водн.) + NO3—(водн.)
В дальнейшем не будем указывать сокращение (водн.), означающее что ион гидратирован, поскольку в водном растворе любой ион гидратирован. Кислоты H2CO3, H2SO3 и H2SO4 диссоциируют в водном растворе с высвобождением двух протонов. Это происходит не в одну, а в две стадии:
- H2CO3 → H+ + HCO3— → 2H+ + CO—
- H2SO3 → H+ + HSO3— → 2H+ + SO—
- H2SO4 → H+ + HSO4— → 2H+ + SO42-
Угольная кислота дает протоны в раствор только частично, так помимо смеси HCO3— и CO— ионов в водном растворе присутствует немного недиссоциированной угольной к-ты. Зато серная кислота полностью высвобождает первый из двух ионов H+, поэтому она считается сильной кислотой. Самые распространенные сильные кислоты — это хлористоводородная и азотная, а распространенная слабая кислота — фосфорная кислота.
Каждая фосфорсодержащая кислота высвобождает в водном растворе три протона, и соответственно осуществляется это в 3 стадии:
- H3PO4 → H+ + H2PO4— → 2H+ + HPO42- → 3H+ + PO43-
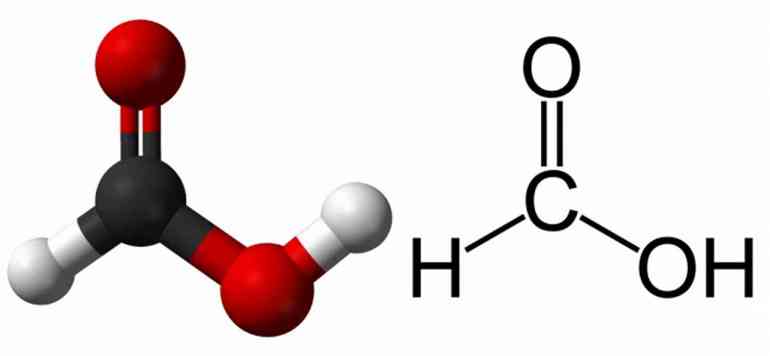
Органические кислоты, такие как уксусная и муравьиная кислота, дают H+ из своих карбоксигрупп –COOH.
- CH3 –COOH → CH3 –COO— + H+
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы. Пример сильной кислоты — соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O+(р-р) + Cl—(р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl — соляная кислота
- HBr — бромоводород
- HI — йодоводород
- HNO3 — азотная кислота
- HClO4 — хлорная кислота
- H2SO4 — серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р) + H2O(ж) → H3O+(р-р) + F—(р-р) — в такой реакции более 90% кислоты не диссоциирует: [H3O+]=[F—] < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов, чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H3PO4 фосфорная
- H2SO3 сернистая
- H2S сероводородная
- H2CO3 угольная
- H2SiO3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH—:
NH3 (р-р) + H2O ↔ NH+4 (р-р) + OH—(р-р)
Большинство слабых оснований — это анионы:
F—(р-р) + H2O ↔ HF(р-р) + OH—(р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр — устройство, трансформирующее концентрацию протонов в растворе в электрический сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль — это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-. В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H+, ни OH— в воде. Например, Cl—, NO—3, SO2-4, Li+, Na+, K+.
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F—, CH3COO—, CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Показатель кислотности растворов рН, механизм действия
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов.
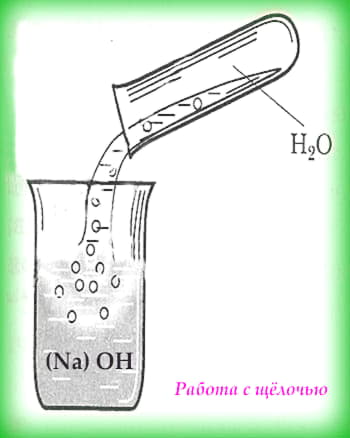
Работа с кислотами и щёлочами
Работа с кислотами и щёлочами требует большой внимательности и осторожности. Ведь при попадании на кожу они вызывают сильные ожоги. Старайтесь работать в проветриваемом помещении. Вдыхать пары щёлочей и кислот также не рекомендуется. Для личной безопасности стоит воспользоваться очками, перчатками и специальной одеждой, чтобы не повредить глаза, руки и любимую одёжку.
При работе с кислотами следует помнить, что сначала вливают кислоту в раствор (воду), а не наоборот. В противном случае произойдёт бурная реакция, которая сопровождается брызгами. А сам процесс добавления кислоты в раствор следует делать очень медленно, при этом контролировать степень нагрева сосуда и обязательно добавлять кислоту по стенкам сосуда.
При работе со щёлочами первым следует добавлять понемногу щёлочь. К тому же запрещено пользоваться стеклянной посудой, рекомендуют фарфоровую или специальную посуду.
При химической обработке металлов (оксидирование, анодирование, травление и др.) погружать в раствор и вынимать из раствора изделие следует с помощью специальных приспособлений или инструментов, но никак не руками, даже если они в резиновых перчатках. Кстати, щёлочь входит в состав некоторых батареек.
Запомните, что при химических ожогах кожи поражённое место нужно промыть сильной струёй проточной воды. И окончательно нейтрализовать: от кислот — 3%-ным раствором питьевой соды, а щёлочь — 1%-ным раствором уксусной кислоты.