Дата публикации 14 ноября 2017Обновлено 2 февраля 2022
Определение болезни. Причины заболевания
Болезнь Паркинсона — это одно из самых распространенных нейродегенеративных заболеваний, поражающее преимущественно дофамин-продуцирующие (дофаминергические) нейроны в определенной области мозга, называемой чёрной субстанцией с накоплением в клетках белка альфа-синуклеина и особых внутриклеточных включений (телец Леви). Это заболевание — самая частая причина синдрома паркинсонизма (80% всех случаев). Распространенность болезни Паркинсона составляет около 140 (120-180) случаев на 100 000 населения.[1] Заболевание чаще всего проявляет себя после 50 лет, однако нередки случаи дебюта болезни и в более раннем возрасте (с 16 лет). Мужчины страдают немного чаще женщин.
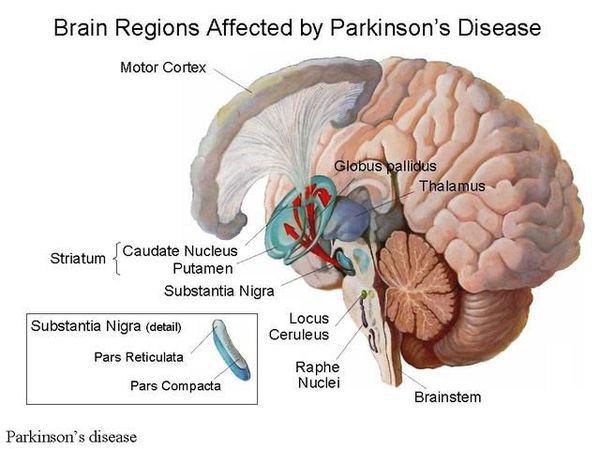
Причина остается в значительной степени неизвестной. Предполагается, что на возникновение заболевания влияют генетические факторы, внешняя среда (возможное воздействие различных токсинов), процессы старения. Генетические факторы имеют доминирующее значение при раннем развитии болезни Паркинсона. Молодые пациенты с этим заболеванием и с семейной историей болезни с большей вероятностью переносят гены, связанные с болезнью Паркинсона, такие, как SNCA, PARK2, PINK1 и LRRK2. В одном из последних исследований показано, что 65% людей с ранним началом болезни Паркинсона в возрасте до 20 лет и 32% людей с началом от 20 до 30 лет имели генетическую мутацию, которая, как полагают, увеличивает риск развития болезни Паркинсона.[2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы болезни Паркинсона
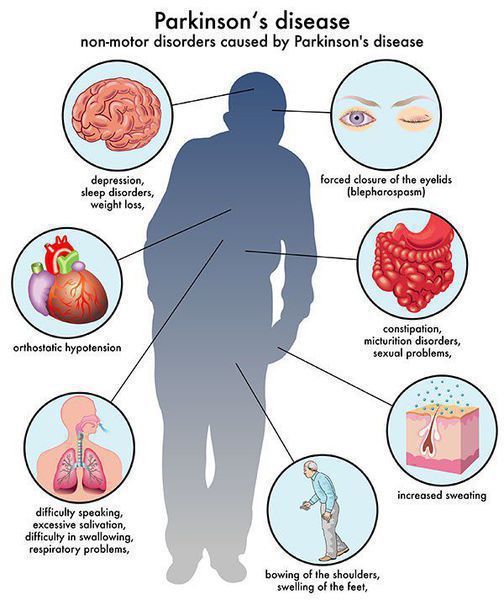
Многие симптомы болезни Паркинсона не связаны с движением. Немоторные («невидимые симптомы») болезни Паркинсона распространены и могут влиять на повседневную жизнь больше, чем более очевидные трудности с движением. Они могут включать:
- нарушение обоняния;
- расстройства сна;
- когнитивные симптомы (снижение памяти, легкомысленность);
- запор;
- расстройства мочеиспускания;
- повышенное потоотделение;
- сексуальную дисфункцию;
- усталость;
- боль (особенно в конечностях);
- покалывание;
- беспокойство и депрессию.[3]
В начале заболевания нередко ставится неверный диагноз — плечелопаточный периартрит, проявляющийся болью и напряжением в мышцах руки и спины.
Синдром паркинсонизма является основным клиническим проявлением болезни Паркинсона, его симптомы:[1]
- замедленность всех движений;
- истощаемость быстрых повторяющихся движений в руках и ногах;
- скованность мышц (мышечная ригидность);
- дрожание рук и ног (но почти никогда — головы), наиболее выражено в покое;
- неустойчивость при ходьбе;
- укорочение длины шага и шарканье при ходьбе, топтание на месте, застывания при ходьбе, отсутствие cодружественных движений руками при ходьбе.
Вначале симптомы возникают только с одной стороны тела, но постепенно приобретают двусторонний характер. Симптомы остаются выраженными на той стороне, где возникли в начале заболевания. Симптомы на другой стороне тела часто не становятся такими же тяжелыми, как симптомы на начальной стороне. Движения становятся все более замедленными (основной симптом паркинсонизма). Симптомы заболевания колеблются в течения дня и зависят от многих факторов.
Патогенез болезни Паркинсона
Болезнь Паркинсона относится к группе синуклеинопатий, так как избыточное накопление в нейронах альфа-синуклеина приводит к их гибели. Повышенный уровень альфа-синуклеина может быть следствием нарушения внутриклеточной системы клиренса белков, осуществляемого лизосомамии и протеосомами. У пациентов обнаружено нарушение функционирования указанной системы, среди причин которого указывают старение, окислительный стресс, действие воспаления, токсины окружающей среды. Клетки гибнут предположительно из-за активации генетически запрограмированного механизма (апоптоза).[4]
Классификация и стадии развития болезни Паркинсона
Болезнь Паркинсона классифицируется по форме, стадии и темпу прогрессирования заболевания.
В зависимости от преобладания в клинической картине того или иного симптома выделяют следующие формы:[1]
1. Смешанная (акинетико-ригидная-дрожательная) форма характеризуется наличием всех трёх основных симптомов в разном соотношении.
2. Акинетико-ригидная форма характеризуется выраженными признаками гипокинезии и ригидности, к которым обычно рано присоединяются нарушения ходьбы и постуральная неустойчивость, при этом тремор покоя отсутствует или выражен минимально.
3. Дрожательная форма характеризуется доминированием в клинической картине тремора покоя, признаки гипокинезии уходят на второй план.

Для характеристики стадий Болезни Паркинсона используется шкала Хен–Яра, 1967:
- на 1-й стадии акинезия, ригидность и тремор выявляются в конечностях с одной стороны (гемипаркинсонизм);
- на 2-й стадии симптоматика становится двусторонней;
- на 3-й стадии присоединяется постуральная неустойчивость, но сохраняется способность к самостоятельному передвижению;
- на 4-й стадии симптомы паркинсонизма резко ограничивают двигательную активность;
- на 5-й стадии в результате дальнейшего прогрессирования заболевания больной оказывается прикованным к постели.
Выделяют три варианта темпа прогрессирования заболевания:
- При быстром смена стадий заболевания от первой к третьей занимает 2 года или менее.
- При умеренном — от 2 до 5 лет.
- При медленном — более 5 лет.
Осложнения болезни Паркинсона
Болезнь Паркинсона — не смертельное заболевание. Человек умирает с ним, а не от него. Однако поскольку симптомы ухудшаются, они могут вызвать инциденты, которые приводят к смерти. Например, в сложных случаях затруднение глотания может привести к тому, что пациенты начнут аспирировать пищу в легкие, что приведет к пневмонии или другим легочным осложнениям. Потеря равновесия может привести к падению, которое, в свою очередь, может привести к серьезным травмам или смерти. Серьезность этих инцидентов во многом зависит от возраста пациента, общего состояния здоровья и стадии заболевания.
На более поздних стадиях заболевания проявляются более выраженные симптомы болезни Паркинсона: дискинезия (непроизвольные движения или подергивание частей тела, которые могут возникнуть в результате длительного использования леводопы, застывания (внезапное отсутствие возможности двигаться) или семенящая походка (короткие, почти бегущие шаги, которые как будто ускоряются сами по себе).
Следует помнить, что болезнь Паркинсона очень индивидуальна по своему течению и у каждого протекает по своему сценарию.
Диагностика болезни Паркинсона
Паркинсонизм относится к числу тех расстройств, которые можно диагностировать на расстоянии, особенно при развёрнутой картине заболевания. Однако диагностировать болезнь Паркинсона на ранней стадии сложно. Ранняя и точная диагностика заболевания очень важна для разработки лучших стратегий лечения и поддержания высокого качества жизни как можно дольше. В практике возможна недооценка или переоценка болезни Паркинсона. Невролог, специализирующийся на расстройствах движения сможет поставить наиболее точный диагноз. Первоначальная оценка проводится на основе анамнеза, неврологического обследования с использованием специальных тестов для оценки симптомов заболевания. Неврологическое обследование включает в себя оценку координации, ходьбы и мелких моторных задач, оценку нейропсихологического статуса.
Практика получения второго мнения в значительной степени зависит от личного выбора пациента. Но имейте в виду, что болезнь Паркинсона часто трудно диагностировать точно, особенно когда симптомы незначительно выражены. Простейшего диагностического теста нет, и примерно 25% диагнозов болезни Паркинсона неверны. Болезнь Паркинсона начинается с мало видимых симптомов, поэтому многие врачи, которые не обучены в сфере двигательных расстройств, не могут поставить точный диагноз. На самом деле даже лучшие неврологи могут ошибаться. Если врач не имеет особого опыта в этой области, то необходимо консультироваться со специалистом по расстройствам движения. Хороший невролог поймет ваше желание подтвердить диагноз. Второе мнение может помочь принять своевременно правильные решения относительно диагноза и терапии.
Лечение болезни Паркинсона
Несмотря на то, что излечения болезни Паркинсона не существует, есть множество методов, которые могут позволить вести полноценную и продуктивную жизнь на многие годы вперед. Многие симптомы могут облегчаться лекарствами, хотя со временем они могут утратить свою эффективность и вызвать нежелательные побочные эффекты (например, непроизвольные движения, известные как дискинезия).
Существует несколько методов лечения, замедляющих появление моторных симптомов и улучшающих двигательные функции. Все эти методы лечения предназначены для увеличения количества дофамина в головном мозге либо путем его замещения, либо продления эффекта дофамина путем ингибирования его распада. Исследования показали, что терапия на ранней стадии может задержать развитие двигательных симптомов, тем самым улучшая качество жизни.[5]
На характер и эффективность лечения влияет ряд факторов:
- выраженность функционального дефицита;
- возраст больного;
- когнитивные и другие немоторные нарушения;
- индивидуальная чувствительность к препаратам;
- фармакоэкономические соображения.
Задача терапии при болезни Паркинсона — восстановить нарушенные двигательные функции и поддержать оптимальную мобильность в течение максимально длительного периода времени, сведя к минимуму риск побочных действий препаратов.[1]
Существуют также хирургические вмешательства, такие, как глубокая стимуляция мозга, подразумевающая имплантацию электродов в мозг. Из-за рисков, присущих этому типу лечения, большинство пациентов исключают данный метод лечения до тех пор, пока лекарства, которые они принимают, больше не дают им значимого облегчения. Обычно этот метод лечения проводится у пациентов с длительностью заболевания от четырех лет, получающих эффект от лекарств, но имеющих моторные осложнения, такие, как: значительное «отключение» (периоды, когда лекарство плохо работает и симптомы возвращаются) и/или дискинезии (неконтролируемые, непроизвольные движения). Глубокая стимуляция мозга лучше всего работает в отношении таких симптомов, как: скованность, медлительность и тремор, не работает с целью коррекции устойчивости, застывания при ходьбе и немоторных симптомах. Данное лечение может даже усугубить проблемы с памятью, поэтому хирургия не рекомендуется для людей с когнитивными расстройствами.[6]
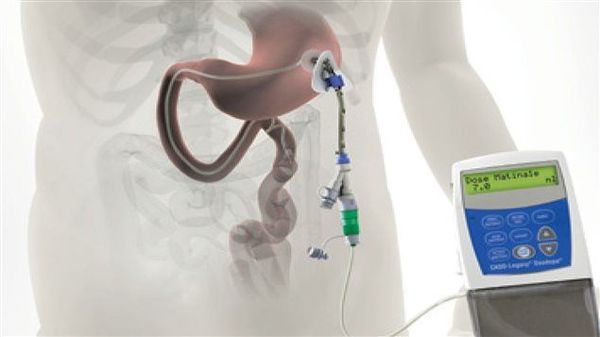
Различные новые способы введения леводопы открывают дополнительные возможности терапии. Сегодня используется интестинальный (кишечный) дуодопа-гель, который уменьшает ежедневные периоды «выключения» и дискинезию у пациентов с прогрессирующей болезнью Паркинсона благодаря постоянному неимпульсному режиму введения препарата.[7]
Исследуется альтернативный подход, использование допаминовых продуцирующих клеток, полученных из стволовых клеток. Хотя терапия стволовыми клетками имеет большой потенциал, требуется больше исследований, прежде чем такие клетки могут стать инструментом в лечении болезни Паркинсона.[8][9]
По мере прогрессирования болезни Паркинсона возможности хранения и буферизации дофамина в мозге становятся все более скомпрометированными, сужая терапевтическое окно для терапии и приводя к колебаниям двигательной системы человека. Апоморфин в виде помпы доставляет подкожную инфузию в течение дня для лечения флуктуаций (феномены «ON-OFF») у пациентов с болезнью Паркинсона, которые недостаточно контролируются пероральным антипаркинсоническими препаратами. Эта система используется постоянно, чтобы обеспечить мозг непрерывной стимуляцией.
При болезни Паркинсона очень полезна физическая нагрузка. Если дважды в неделю по 1–2 часа выполнять упражнения, то можно замедлить развитие заболевания: походка, осанка и когнитивные способности будут ухудшаться гораздо медленнее [12].
Прогноз. Профилактика
Болезнь Паркинсона уникальна для каждого человека, никто не может предсказать, какие симптомы появятся и когда именно. Существуют общее сходство картины прогрессирования болезни, но нет никакой гарантии, что то, что наблюдается у одного, будет у всех с аналогичным диагнозом. Некоторые люди оказываются в инвалидных колясках; другие все еще участвуют в марафонах. Некоторые не могут застегнуть ожерелье, в то время как другие делают ожерелья вручную.
Пациент может сделать всё, чтобы активно повлиять на течение болезни Паркинсона и, по крайней мере, на одну очень вескую причину: ухудшение симптомов часто значительно медленнее у тех, кто проявляет позитивную и активную позицию по отношению к своему состоянию, чем те, кто этого не делает. В первую очередь рекомендуется найти врача, которому доверит пациент, и который будет сотрудничать по развивающемуся плану лечения. Снижение стресса обязательно — стресс ухудшает каждый симптом болезни Паркинсона. Рекомендуются занятия образовательного направления: рисование, пение, чтение стихов, рукоделие, изучение языков, путешествия, работа в коллективе, занятия общественной деятельностью.
К сожалению, даже если адекватно подобрать медикаментозную терапию, это не гарантирует того, что клетки перестанут гибнуть при болезни Паркинсона. Терапия должна быть направлена на создание благоприятных условий для двигательной активности с учётом индивидуальных особенностей клинической картины заболевания. Как показывают результаты многочисленных исследований, профессиональная двигательная реабилитация является необходимым условием для замедления прогрессирования заболевания и улучшения его прогноза. На сегодняшний день по данным клинических исследований показана эффективность реабилитационной программы по протоколам LSVT LOUD, LSVT BIG, теоретическая основа которых сводится к развитию нейропластичности вещества мозга. Она направлена на коррекцию дрожания, ходьбы, постуры, равновесия, мышечного тонуса и речи.[10]
Реабилитационные методики должны быть направленные не только на поддержание сохранившихся двигательных способностей, но и выработку новых навыков, которые бы помогали человеку с болезнью Паркинсона преодолевать ограниченность его физических возможностей, чему способствует программа танцевально-двигательной терапии при болезни Паркинсона, работающая более чем в 100 сообществах по всему миру, включая Россию. Танцевальная терапия позволяет частично решить конкретные проблемы болезни Паркинсона: потеря равновесия, ухудшение координации, шаркающая походка, тремор, застывания, социальная изоляция, депрессия и повышенный уровень тревожности.
Согласно американскому исследованию с участием 52 больных болезнью Паркинсона, регулярная практика аргентинского танца уменьшает симптомы болезни, улучшает баланс и улучшает выполнение сложных движений при болезни Паркинсона.[11]

ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.Болезнь Паркинсона
Содержание статьи
- Как распознать болезнь Паркинсона на ранней стадии
- Как облегчить состояние при Паркинсоне
- Сколько живут с болезнью Паркинсона
- Как вылечить болезнь Паркинсона навсегда
- Краткое содержание
- Источники
- Задайте вопрос эксперту по теме статьи
Согласно оценкам ВОЗ болезнь Паркинсона в 2019 году стала причиной смерти 329 000 человек. Это на 100% больше, чем в 2000 г. По всему миру болезнь Паркинсона опережает неврологические расстройства по степени роста инвалидности. У мужчин болезнь встречается чаще, чем у женщин.
Болезнь Паркинсона (БП) — заболевание головного мозга, ухудшающее его работу. Она проявляется тремором конечностей, замедленностью движений, скованностью и потерей равновесия. А также включает такое осложнения, как снижение когнитивных функций, психические расстройства, нарушение сна.
Рассказываем, что это за болезнь: как ее распознать на ранней стадии, как облегчить состояние, сколько живут с этим диагнозом и можно ли полностью вылечить болезнь.
Как распознать болезнь Паркинсона на ранней стадии
Первые симптомы болезни Паркинсона могут быть замечены в возрасте до 20 лет. Но дебютирует заболевание все же в более зрелом возрасте, в период 50-70 лет. Выявить первые признаки БП можно еще за 5-10 лет до установленного диагноза. Симптомы паркинсонизма при повторяющихся инсультах не будут являться основанием для постановки диагноза БП.
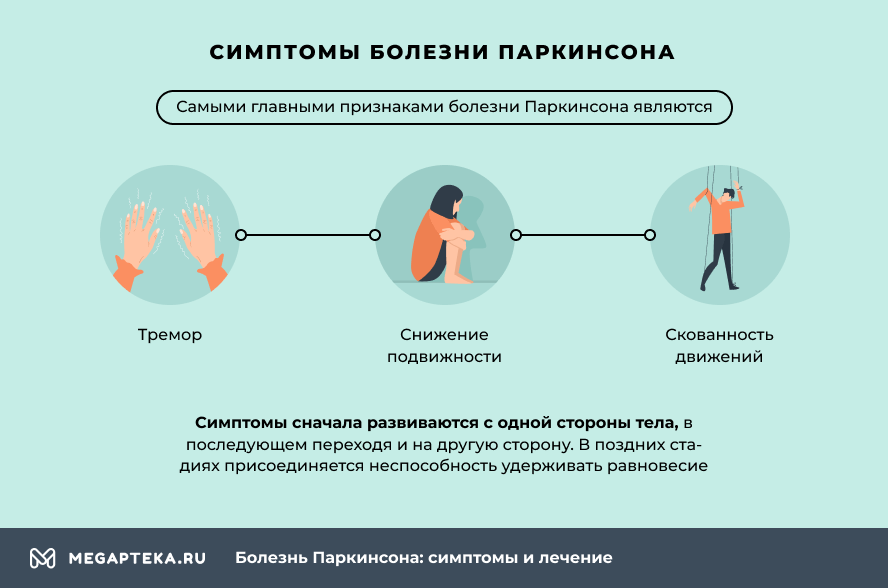
Самые главные признаки болезни Паркинсона:
- тремор,
- снижение подвижности,
- скованность движений.
Симптомы сначала развиваются с одной стороны тела, в последующем переходя и на другую сторону. В поздних стадиях присоединяется неспособность удерживать равновесие.
Болезнь Паркинсона проявляется следующими затруднениями в быту:
- писать
- чистить зубы
- застегивать пуговицы
- слюнотечение из-за невозможности глотания
- снижение мимики и редкое моргание
- замедленная и невнятная речь
Расскажем подробнее о проявлениях болезни Паркинсона.
Тремор рук проявляется в состоянии покоя и уменьшается при активных движениях, при этом усиливается в других конечностях. Например присоединяется тремор головы, нижней челюсти, губ, языка или голосовых связок.
Мышечная ригидность проявляется скованностью и болью в плечевом суставе или в спине и может быть одним из первых проявлений. Такой симптом вызывает наклон головы и туловища вперед, сгибание коленных суставов, при этом может быть наклон туловища в бок по типу «Пизанской башни».
Нарушение ходьбы проявляется уменьшением длины шага, снижением скорости ходьбы, ослаблением движений рук и шарканьем стоп. Для пациентов характерна семенящая походка, застывание при поворотах и непроизвольное ускорение шага.
Нарушение сна проявляется сложностями в засыпании и поддержании ночного сна. Пациенты часто просыпаются или же, наоборот, слишком долго спят. Их мучают ночные кошмары и сонливость днем.
Вегетативная дисфункция наблюдается у 70-100 % пациентов с БП. При развернутой стадии такие заболевания вызывают пневмонию, кишечную непроходимость и даже задержку мочеиспускания, что значительно снижает качество жизни и угрожает летальным исходом.
Депрессия наблюдается еще за несколько лет до проявления БП. Заподозрить ее можно по частому сниженному настроению и невозможностью получать удовольствие.
Когнитивные нарушения проявляются снижением внимания и скоростью реакций, проблемами с пониманием, построением логических схем. Пациентам сложно запоминать новое, копировать рисунки. У них возникают зрительные и слуховые галлюцинации.
От чего бывает болезнь Паркинсона
Причины БП в 5-7% от всех случаев является наследственность. В большинстве случаев болезнь развивается из-за генетической предрасположенности в совокупности с внешними факторами. Психосоматика не является причиной развития БП.
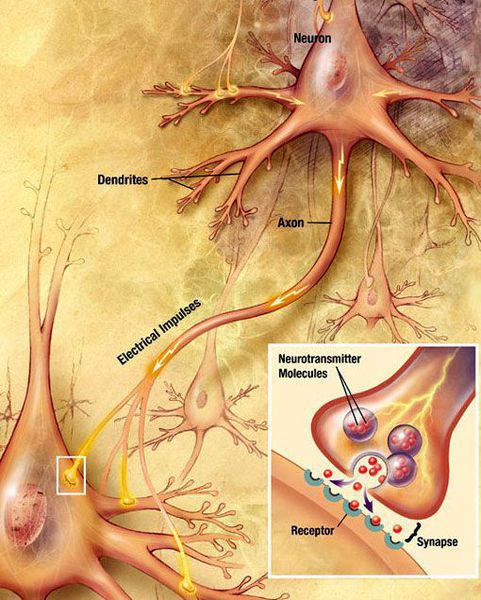
В головном мозге есть нейроны — нервные клетки. Они передают сигналы друг другу и в разные отделы мозга с помощью специальных веществ — медиаторов. Одним из медиаторов является дофамин. При БП снижается количество таких нейронов, концентрация дофамина падает. Это приводит к нарушению работы мозга и возникновению характерных симптомов.
Выделяют три стадии заболевания, в зависимости от которой применяют разное лечение:
- Ранняя: стадия, на которой отмечается «внутренняя дрожь» без внешних проявлений, замедленные психические реакции, снижение внимания и быстроты реакций. Также на ранней стадии наблюдается синдром, когда пациент для удержания равновесия делает несколько шагов назад.
- Развернутая: на этой стадии наблюдается ограничения в повседневной активности. Нарастают периоды «выключения», замедленности и появляются «застывания». Пациенты отмечают в этом периоде увеличение болезненности, тревоги, депрессии и апатии.
- Стадия декомпенсации: резко ухудшаются моторные движения, утрачивается речь, нарушается глотание и теплоотдача. Начинают преобладать спутанность сознания и психические расстройства.
Как облегчить состояние при Паркинсоне
Облегчить состояние возможно выполнением назначений врача, а именно применением лекарственных средств, периодическим наблюдением, и выполнением упражнений.
Лекарства при Паркинсоне
Существуют противопаркинсонические препараты, которые достаточно принимать всего один раз в день. К лекарственным средствам относят препараты, содержащие леводопу, антихолинергические средства и другие. Но не исключается и дополнительная терапия лекарствами, которые необходимо принимать по несколько раз в день.
Для удобства применения всех средств, специалисты рекомендуют приобрести органайзер. С его помощью пациенту не придется каждый раз вспоминать, какое средство он уже выпил, а какое — еще нет. Таблетницу можно сделать своими руками с указанием времени суток или часа, в который необходимо выпить лекарство. Напоминание в телефоне вас предупредит о следующем приеме.
Диспансерное наблюдение
Нужно регулярно посещать врача. Так он своевременно скорректирует лечение и предупредит ухудшение состояния.
Повседневная жизнь
Следует использовать простую одежду из легких тканей. Желательно чтобы были крупные пуговицы или молния. Обувь должна напоминать домашние тапочки на резиновой подошве. Обязательно наличие «пятки». Это поможет надевать обувь и предупредить ее слетание с ноги.
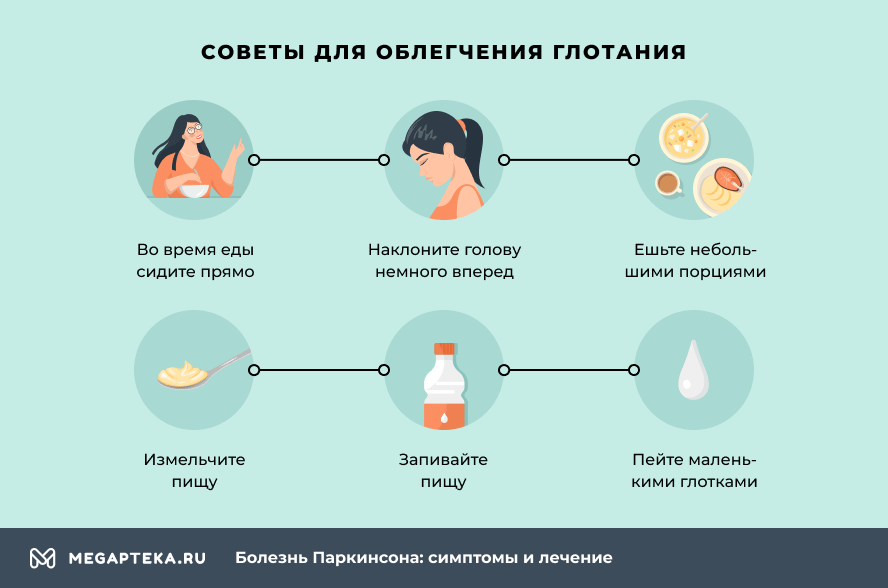
Советы для облегчения глотания
- во время еды сидите прямо
- наклоните голову немного вперед
- ешьте небольшими порциями и не торопитесь со следующей, проглотите до конца предыдущую
- не разговаривайте во время еды
- отведите на прием пищи достаточно времени
- если необходимо, измельчите пищу
- пейте маленькими глотками
- запивайте пищу
- не ложитесь после еды, если у вас наблюдается отрыжка или изжога
Обработка пищи имеет значение — сухие и жареные блюда хуже проглатываются. Отдавайте предпочтение отварным или пюреобразным продуктам. Если во время приема пищи вам мешает дрожание рук, воспользуйтесь специальными средствами: соломинка для питья или «непроливайка», тарелка с креплением к столу. Отдавайте предпочтение ложке, вместо вилки.
Сколько живут с болезнью Паркинсона
Как сообщает журнал Массачусетской больницы общего профиля, пациенты с БП в возрасте около 60 лет живут 10-20 лет после проявления симптомов и постановки диагноза.
Нет времени читать длинные статьи? Подписывайтесь на нас в соцсетях: слушайте фоном видео и читайте короткие заметки о красоте и здоровье.
Мегаптека в соцсетях: ВКонтакте, Telegram, OK, Viber
Как вылечить болезнь Паркинсона навсегда
Лечение пациентов с болезнью Паркинсона ведет врач-невролог. Вылечить болезнь навсегда невозможно, но при комплексном подходе возможно продлить жизнь и повысить ее качество. Лечение подразумевает не только прием лекарств, но и реабилитацию, лечебную физкультуру.
Реабилитация направлена на тренировку ходьбы, удерживание равновесия. Используются силовые упражнения и занятия в бассейне. Рекомендуется выполнять ежедневные домашние упражнения. Такой домашний комплекс разрабатывается специально, учитывая необходимость выполнения бытовых действий:
- вставать и садиться на стул
- ложиться и вставать с кровати
- переворачиваться в кровати
- ходить большими шагами с махами руками с большой амплитудой
- ходьба с препятствиями и их преодоление
- ходьба с резкими остановками и сменой направления ходьбы, в том числе назад
- ходьба и удержание равновесия при выполнении двух задач, например, при разговоре, переноске предмета или повороте головы
- повороты на больших и суженных пространствах
Выполнять комплекс физических упражнений необходимо под контролем врача по медицинской реабилитации.
В качестве дополнительной физической нагрузки, врач назначит тренировку танцами — данстерапия. Данстерапия увеличивает амплитуду движений, облегчает сложные последовательные движения, шаги в разных направления, ходьбу назад, ходьбу в узком пространстве, баланс стоя на одной ноге, смещение веса, контролируемое смещение центра масс. Выбор танца для пациента будет зависеть от индивидуальных особенностей пациента.
Краткое содержание
- Болезнь Паркинсона определяется тремя основными показателями: тремором конечностей, замедленностью движений, скованностью и потерей равновесия.
- При прогрессировании заболевания нарушается походка, становятся невозможны бытовые действия, происходят психические и когнитивные нарушения.
- Болезнь развивается в 3 стадии: ранняя, развернутая и декомпенсация.
- Симптомы начала болезни можно заметить еще за несколько лет до ее полного проявления.
- Облегчить состояние при БП помогает соблюдение всех рекомендаций врача: прием лекарств, регулярное обследования, реабилитация и лечебная физкультура.
- С болезнью Паркинсона после постановки диагноза, ориентировочно в 60 лет, человек может прожить еще 10-20 лет.
- Заболевание не поддается полному излечению, но при регулярных домашних тренировках, проведения реабилитационных мероприятий и даже данстерапии, удается сохранять и стабилизировать прогрессирование болезни.
Источники
- “Клинические рекомендации “Болезнь Паркинсона, вторичный паркинсонизм и другие заболевания, проявляющиеся синдромом паркинсонизма” (утв. Минздравом России)
- ВОЗ: Болезнь Паркинсона
- How Long Can a Person Live With Parkinson’s Disease?
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда


Как диагностировать болезнь Паркинсона: Болезнь Паркинсона — это медленно прогрессирующее хроническое нейродегенеративное неврологическое заболевание, характерное для лиц старшей возрастной группы. Первичная диагностика болезни Паркинсона потребует проведения МРТ головного мозга на томографе 3 Тесла и выше и последующей консультации у невролога. В качестве дополнительного обследования врач может назначить:
- электроэнцефалографию (ЭЭГ),
- реоэнцефалографию.
Какой врач лечит болезнь Паркинсона: При симптомах болезни Паркинсона следует сначала обратиться к врачу неврологу.
Быстрая навигация
Болезнь Паркинсона – это патологическое необратимое состояние, при котором части мозга постепенно повреждаются в течение многих лет.
Причины болезни Паркинсона
Болезнь Паркинсона вызывается потерей нервных клеток в части мозга, называемой черной субстанцией. Нервные клетки в этой части мозга отвечают за производство химического вещества дофамина. Дофамин действует как посредник между частями мозга и нервной системой, которые помогают контролировать и координировать движения тела. Если эти нервные клетки умирают или повреждаются, количество дофамина в головном мозге уменьшается. Это означает, что часть мозга, контролирующая движение, не может работать так же хорошо, как обычно, в результате чего движения больного становятся медленными и неуклюжим. Потеря нервных клеток – медленный процесс. Симптомы болезни Паркинсона обычно начинают развиваться только тогда, когда теряется около 80% нервных клеток в черной субстанции. Пока ученым до конца неизвестно, почему происходит потеря нервных клеток, связанная с болезнью Паркинсона, но в настоящее время считается, что причиной этого заболевания может быть сочетание генетических изменений и факторов окружающей среды.
Было доказано, что ряд генетических факторов увеличивает риск развития болезни Паркинсона, хотя точно неясно, как именно они делают некоторых людей более восприимчивыми к этому состоянию. Паркинсонизм может передаваться в семьях из-за того, что родители передают ребенку дефектные гены, но заболевание таким образом наследуется очень редко.
Некоторые исследователи также считают, что факторы окружающей среды могут увеличить риск развития болезни Паркинсона, например, пестициды и гербициды, химикаты, используемые в сельском хозяйстве, дорожном движении или промышленном загрязнении, могут способствовать этому состоянию. Но доказательства связи факторов окружающей среды с болезнью Паркинсона пока неубедительны.
Другие причины паркинсонизма
«Паркинсонизм» – это общий термин, используемый для описания симптомов тремора, ригидности мышц и замедления движений. Болезнь Паркинсона – наиболее распространенный тип паркинсонизма, но есть и более редкие типы, при которых можно определить конкретную причину. К ним относится паркинсонизм, вызванный:
лекарства (лекарственный паркинсонизм) – симптомы развиваются после приема определенных лекарственных препаратов, таких как некоторые виды антипсихотических средств, и обычно улучшаются после прекращения приема лекарств; другие прогрессирующие заболевания головного мозга, такие как прогрессирующий надъядерный паралич, атрофия множественных систем и кортикобазальная дегенерация; цереброваскулярное заболевание – когда серия небольших инсультов приводит к гибели нескольких частей мозга.
Группы риска болезни Паркинсона
Считается, что около 1 из 500 человек страдает этим недугом. У большинства пациентов с болезнью Паркинсона симптомы начинают проявляться в возрасте старше 50 лет, хотя примерно у 1 из 20 человек с этим заболеванием первые симптомы возникают в возрасте до 40 лет. По статистике мужчины несколько чаще заболевают болезнью Паркинсона, чем женщины.
Что отличает болезнь Паркинсона в молодом возрасте
Возраст постановки диагноза имеет значение по целому ряду критериев, от вероятных причин ранних случаев заболевания до симптомов и лечения:
- генетика. Как и в любом случае болезни Паркинсона, точная причина обычно неизвестна. Тем не менее, «молодые случаи болезни Паркинсона в среднем с большей вероятностью будут семейными или генетическими». У многих пациентов сопутствующая дистония (скованность или судороги в мышцах или конечностях) является ранним симптомом. Больные также чаще сообщают о дискинезии (непроизвольных движениях тела). Они также склонны реже проявлять когнитивные симптомы, такие как слабоумие и проблемы с памятью
- прогресс. У пациентов с болезнью Паркинсона в молодом возрасте болезнь прогрессирует медленнее с течением времени. Симптомы, как правило, имеют более мягкое течение, сохраняя функциональные и когнитивные функции пациента гораздо дольше
- уход. Большинство пациентов с болезнью Паркинсона назначаются специализированные ингибиторы МАО-В, антихолинергические средства и агонисты дофаминовых рецепторов.
Симптомы болезни Паркинсона
Симптомы болезни Паркинсона многочисленны и обычно развиваются постепенно и сначала незначительны. Маловероятно, что пациент испытает все или большинство из них.
Основные симптомы
3 основных симптома болезни Паркинсона влияют на физическое движение:
- тремор – дрожь, которая обычно начинается в руке и чаще возникает, когда конечность расслаблена и находится в состоянии покоя;
- медлительность движений (брадикинезия) – физические движения намного медленнее, чем обычно, что может затруднять повседневные задачи и приводить к характерной медленной, шаркающей походке с очень маленькими шагами;
- ригидность мышц – напряжение и жесткость в мышцах, которые могут затруднить передвижение и выражение лица, а также могут привести к болезненным мышечным спазмам (дистония).
Эти основные симптомы врачи иногда называют паркинсонизмом, поскольку они могут иметь другие причины, кроме болезни Паркинсона. Также болезнь Паркинсона может вызывать ряд других физических и психических симптомов.
Дополнительные симптомы
- проблемы с равновесием – из-за них пациент с этим заболеванием может часто падать и получать травмы;
- потеря обоняния (аносмия) – иногда возникает за несколько лет до развития других симптомов;
- нервная боль – может вызывать неприятные ощущения, такие как жжение, холод или онемение;
- проблемы с мочеиспусканием – например, необходимость часто вставать ночью из-за необходимости мочиться, или непреднамеренное мочеиспускание (недержание мочи);
- запор;
- неспособность получить или поддерживать эрекцию (эректильная дисфункция) у мужчин;
- трудности с сексуальным возбуждением и достижением оргазма (сексуальная дисфункция) у женщин;
- головокружение, помутнение зрения или обморок при переходе из положения сидя или лежа в положение стоя, вызванные внезапным падением артериального давления;
- повышенное потоотделение (гипергидроз);
- трудности с глотанием (дисфагия) – это может привести к недоеданию и обезвоживанию;
- чрезмерное слюноотделение (слюнотечение);
- проблемы со сном (бессонница) – это может привести к чрезмерной сонливости в течение дня депрессия и тревога;
- легкие когнитивные нарушения – небольшие проблемы с памятью и проблемы с деятельностью, требующей планирования и организации;
- деменция – группа симптомов, в том числе более серьезные проблемы с памятью, изменения личности, способность видеть вещи, которых нет (зрительные галлюцинации), и вера в то, что не соответствует действительности (заблуждения).
Симптомы болезни Паркинсона делятся на три категории: первичные двигательные симптомы, вторичные двигательные симптомы и недвигательные симптомы.
Первичные двигательные симптомы болезни Паркинсона
- тремор в состоянии покоя: происходит, когда часть тела на одной стороне тела (обычно рука или нога) слегка дрожит в состоянии покоя без сокращения мышц. Тремор обычно прекращается при легком напряжении мышцы
- брадикинезия: медленные и мелкие движения. Также у пациента возникает ощущение «прилипания» ног к полу при ходьбе. Данное состояние носит временный характер и пропадает после 2-го, 3-го шага
- онемение лица: лицевые мышцы теряют часть своих непроизвольных движений
- ригидность: состояние, при котором мышцы постоянно остаются напряженными, а не сокращаются и расслабляются, как обычно
- постуральная нестабильность/плохой баланс: этот симптом возникает, когда пациенту трудно оставаться в вертикальном положении, возникает чувство отклонения назад.
Недвигательные симптомы болезни Паркинсона
- запор. Если у пациента возникают проблемы с опорожнением кишечника, которые нельзя объяснить другими факторами — диетой с низким содержанием клетчатки или воды, а также приемом определенных лекарств, то это может быть признаком болезни Паркинсона
- гипосомия: это потеря обоняния, что часто встречается при болезни Паркинсона (хотя ее также можно не заметить, как ранний симптом). Данный симптом также может вторично повлиять на чувство вкуса.
- расстройство поведения в фазе быстрого сна: пациент может метаться в постели во сне или упасть с кровати
- расстройства настроения. Психологические проблемы, такие как депрессия и тревога, могут быть ранними признаками болезни Паркинсона и могут возникнуть задолго до того, как появятся двигательные симптомы
- частое мочеиспускание/неотложные позывы: пациенты с болезнью Паркинсона часто чувствуют потребность в более срочном мочеиспускании, даже если их мочевой пузырь не очень наполнен.
Диагностика болезни Паркинсона
Пациенту первично следует обратиться к неврологу, если он обеспокоен тем, что у него могут быть симптомы болезни Паркинсона. На приеме врач расспросит о симптомах, истории болезни и жизни и проведет осмотр, чтобы решить, нужно ли направлять человека к паркинсонологу для дальнейших анализов.
Никакие тесты не могут однозначно показать, есть ли у пациента болезнь Паркинсона. Врач может поставить диагноз на основании клинических симптомов, истории болезни, подробного медицинского осмотра, МРТ головного мозга И однофотонной эмиссионной компьютерной томографии (ОФЭКТ). Также специалист может попросить пациента выполнить некоторые простые умственные или физические задачи, такие как передвижение или ходьба, чтобы помочь с диагностикой. Диагноз болезни Паркинсона вероятен, если у обследуемого есть хотя бы 2 из 3 следующих симптомов:
- дрожь или тремор в части тела, которые обычно возникают только в состоянии покоя; замедленность движений (брадикинезия);
- жесткость мышц (ригидность);
- МРТ снимки имеют характерные изменения в черной субстанции.
Если данные симптомы улучшаются после приема лекарства под названием леводопа, скорее всего, у пациента болезнь Паркинсона.
Лечение болезни Паркинсона
Хотя в настоящее время нет лекарства от болезни Паркинсона, существуют методы лечения, которые помогают уменьшить основные симптомы и как можно дольше поддерживать качество жизни больного. К ним относятся:
поддерживающие процедуры, такие как физиотерапия и трудотерапия; медикаментозное лечение; в некоторых случаях операция на головном мозге.
Большинству пациентов может не понадобиться лечение на ранних стадиях болезни Паркинсона, поскольку симптомы обычно легкие, но им могут потребоваться регулярные медицинские осмотры невролога или паркинсолога и МРТ, чтобы можно было контролировать состояние.
Существует несколько методов лечения, которые могут облегчить жизнь с болезнью Паркинсона и помочь больным справляться с симптомами каждый день:
- Физиотерапия поможет уменьшить ригидность мышц и боль в суставах с помощью движений и упражнений. Метод направлен на то, чтобы облегчить движение, улучшить ходьбу, гибкость, физическую форму и способность управлять вещами самостоятельно.
- Эрготерапевт поможет определить области и действия, с которыми пациент сталкивается в повседневной жизни, например, как одеться или добраться до местных магазинов, и поможет выработать практические решения. Это поможет больному как можно дольше сохранять независимость.
- Многие пациенты с болезнью Паркинсона испытывают трудности с глотанием (дисфагия) и проблемы с речью. Логопед часто может помочь решить эти проблемы, обучая упражнениям на речь и глотание или предоставляя вспомогательные технологии.
Диета при болезни Паркинсона
Некоторым пациентам с болезнью Паркинсона изменение диеты может помочь улучшить некоторые симптомы. Эти изменения могут включать:
- увеличить количество клетчатки в рационе и количество потребляемой жидкости;
- увеличение количества соли в рационе и частое питание небольшими порциями, чтобы избежать проблем с низким артериальным давлением;
- внесение изменений в рацион, чтобы избежать непреднамеренной потери веса.
Медикаментозное лечение
Лекарственные препараты можно использовать для улучшения основных симптомов болезни Паркинсона, таких как тремор и проблемы с движением. Но не все доступные лекарства полезны для всех пациентов, и краткосрочные и долгосрочные эффекты у каждого разные. Обычно используются три основных типа лекарств:
- леводопа;
- агонисты дофамина;
- ингибиторы моноаминоксидазы-B.
Большинству пациентов с болезнью Паркинсона в конечном итоге требуется лекарство под названием леводопа. Леводопа поглощается нервными клетками мозга и превращается в химический дофамин, который используется для передачи сообщений между частями мозга и нервами, контролирующими движение. Повышение уровня дофамина с помощью леводопы обычно улучшает проблемы с движением. Обычно его принимают в виде таблеток или жидкости и часто сочетают с другими лекарствами, такими как бенсеразид или карбидопа. Эти лекарства предотвращают расщепление леводопы в кровотоке до того, как она попадет в мозг. Они также уменьшают побочные эффекты леводопы, в том числе:
- тошнота;
- усталость;
- головокружение.
Если пациенту прописана леводопа, начальная доза обычно очень мала и будет постепенно увеличиваться до тех пор, пока не подействует. Поначалу препарат может вызвать резкое улучшение симптомов, но ее эффекты могут быть менее продолжительными в последующие годы – чем больше нервных клеток в головном мозге теряется, тем меньше из них поглощает лекарство. Это означает, что доза может время от времени увеличиваться. Длительное использование леводопы также связано с такими проблемами, как неконтролируемые судорожные движения мышц (дискинезии) и эффекты «включения-выключения», когда человек быстро переключается между способностью двигаться (включено) и неподвижностью (выключено).
Агонисты дофамина действуют как заменитель дофамина в головном мозге и имеют аналогичный, но более мягкий эффект по сравнению с леводопой, и их можно давать реже, чем леводопу. Агонисты часто принимают в виде таблеток, но также можно приобрести кожный пластырь (ротиготин). Иногда агонисты дофамина принимают одновременно с леводопой, поскольку это позволяет использовать более низкие дозы последней. Возможные побочные эффекты агонистов дофамина включают:
- чувство тошноты;
- усталость и сонливость;
- головокружение.
Агонисты дофамина также могут вызывать галлюцинации и повышенную дезориентацию, поэтому их следует применять с осторожностью, особенно у пожилых пациентов, которые более восприимчивы. У некоторых пациентов прием препарата связан с развитием компульсивного поведения, особенно в высоких дозах, включая азартные игры, компульсивные покупки и чрезмерно повышенный интерес к сексу. Поскольку сам больной может не осознавать проблему, важно, чтобы лица, осуществляющие уход, и члены семьи также отмечали любое ненормальное поведение и обсуждали его с лечащим врачом.
Обычно начальная доза лекарства очень мала, чтобы предотвратить плохое самочувствие и другие побочные эффекты. Дозировка постепенно увеличивается в течение нескольких недель. Потенциально серьезным, но необычным осложнением терапии агонистами дофамина является внезапное засыпание. Обычно это происходит по мере увеличения дозы и имеет тенденцию к стабилизации. В случае возникновения этого осложнения пациентам обычно рекомендуется избегать вождения автомобиля в период увеличения дозы.
Ингибиторы моноаминоксидазы-B (MAO-B), включая селегилин и разагилин, являются еще одной альтернативой леводопе для лечения болезни Паркинсона на ранних стадиях. Они блокируют действие фермента или вещества мозга, которое расщепляет дофамин (моноаминоксидаза-B), повышая уровень дофамина. И селегилин, и разагилин могут улучшить симптомы болезни Паркинсона, хотя их эффекты незначительны по сравнению с леводопой. Их можно использовать вместе с леводопой или агонистами дофамина. Ингибиторы МАО-B обычно очень хорошо переносятся пациентами, но иногда могут вызывать побочные эффекты, в том числе:
- плохое самочувствие;
- головные боли;
- боль в животе;
- повышенное артериальное давление.
Ингибиторы катехол-O-метилтрансферазы (COMT) назначаются пациентам на поздних стадиях болезни Паркинсона. Они предотвращают расщепление леводопы ферментом COMT. Побочные эффекты лекарства включают:
- тошнота;
- понос;
- боль в животе.
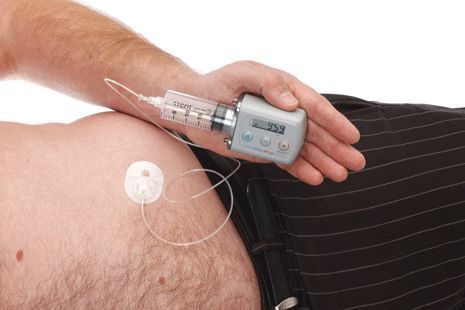
Когда симптомы Паркинсона трудно контролировать с помощью одних таблеток, можно рассмотреть ряд других методов лечения. Агонист дофамина, называемый апоморфином, можно вводить под кожу (подкожно) одним из следующих способов:
- однократная инъекция при необходимости;
- непрерывная инфузия с помощью небольшой помпы, которую можно носить на поясе, под одеждой или в сумке.
Если пациента беспокоят сильные колебания между включением и выключением, можно использовать вид леводопы, называемый дуодопой. Это лекарство представляет собой гель, который непрерывно закачивается в кишечник через трубку, проходящую через брюшную стенку. К концу трубки прикреплен внешний насос, который человек носит с собой.
Хирургическое лечение
Большинство пациентов с болезнью Паркинсона лечатся медикаментами, хотя в некоторых случаях используется тип хирургии, называемый глубокой стимуляцией мозга, которая включает в себя хирургическую имплантацию генератора импульсов, похожего на кардиостимулятор, в грудную стенку. Он подключается к 1 или 2 тонким проводам, помещенным под кожу, и вводится точно в определенные области мозга. Крошечный электрический ток вырабатывается генератором импульсов, который проходит по проводам и стимулирует часть мозга, пораженную болезнью Паркинсона. Хотя операция не излечивает болезнь Паркинсона, у некоторых пациентов она может значительно облегчить симптомы.
Лечение дополнительных симптомов
Помимо основных симптомов двигательных проблем, пациенты с болезнью Паркинсона могут испытывать широкий спектр дополнительных симптомов, которые, возможно, требуют отдельного лечения. К ним относятся:
- депрессия и тревожность – можно вылечить с помощью таких средств ухода за собой, как упражнения, психологическая терапия или лекарства;
- проблемы со сном (бессонница) – можно исправить, изменив привычный распорядок сна;
- эректильная дисфункция – лечится медикаментами; чрезмерное потоотделение (гипергидроз) – можно уменьшить с помощью рецептурного антиперспиранта или хирургического вмешательства в тяжелых случаях;
- трудности с глотанием (дисфагия) – можно улучшить, если есть размягченную пищу или в более тяжелых случаях использовать зонд для кормления;
- чрезмерное слюнотечение – можно улучшить с помощью упражнений на глотание, хирургического вмешательства или приема лекарств в тяжелых случаях;
- недержание мочи – можно лечить упражнениями для укрепления мышц тазового дна, лекарствами или хирургическим вмешательством в тяжелых случаях;
- слабоумие – в некоторых случаях можно лечить с помощью когнитивной терапии и лекарств.
Перспективы болезни Паркинсона
По мере прогрессиа состояния симптомы болезни Паркинсона могут ухудшаться, и пациентам становится все труднее выполнять повседневные дела без посторонней помощи. Многие больные хорошо поддаются лечению и имеют лишь легкую или умеренную инвалидность, тогда как некоторые могут не реагировать на терапию и со временем стать инвалидом в более тяжелой форме. Болезнь Паркинсона не вызывает непосредственной смерти больных, но это заболевание может оказывать большое давление на организм и сделать некоторых людей более уязвимыми для серьезных и опасных для жизни инфекций, однако с развитием лечения большинство пациентов с болезнью Паркинсона теперь имеют нормальную или почти нормальную продолжительность жизни.
В наилучшем положении находятся те пациенты, у кого болезнь Паркинсона начинается в молодом возрасте. Во-первых, такие пациенты являются лучшими кандидатами на хирургические процедуры и медицинские инновации, используемые или разрабатываемые для лечения болезни Паркинсона. С другой стороны, более молодые пациенты с меньшей вероятностью будут подвержены дополнительным сопутствующим проблемам со здоровьем.

Автор: Богатов Никита Дмитриевич
Специализация: Мануальная терапия, Остеопат
Где ведет прием: МРТ центр и клиника РИОРИТ, Клиника Инцентро
Лучшие специалисты в Санкт-Петербурге с рейтингом 4.5+

Волошенко (Кудрявцева) Анна Святославовна
Специализация: Невролог, Вестибулолог, Врач функциональной диагностики
Врачебный стаж: с 2003 года
Где ведет прием: МЦ Согаз

Юзефович Татьяна Сергеевна
Специализация: Невролог, Врач функциональной диагностики, Рефлексотерапевт, Эпилептолог
Врачебный стаж: с 2000 года
Где ведет прием: Инфекционная клиника ID-Clinic

Янишевский Станислав Николаевич
Специализация: Невролог
Врачебный стаж: с 2001 года
Где ведет прием: ЛДЦ Светлана, Клиника Евроонко

Поливянная Юлия Александровна
Специализация: Невролог
Врачебный стаж: с 2010 года
Где ведет прием: ЛДЦ Светлана

Филиппова Мария Владимировна
Специализация: Невролог
Врачебный стаж: с 2015 года
Где ведет прием: МЦ Балтмед Озерки

Альгасова Галина Станиславовна
Специализация: Невролог, Вертебролог
Врачебный стаж: с 1989 года
Где ведет прием: МЦ Балтмед Озерки

Середа Евгения Олеговна
Специализация: Невролог
Врачебный стаж: с 2009 года
Где ведет прием: МЦ Балтмед Озерки

Нестерова Мария Викторовна
Специализация: Невролог
Врачебный стаж: с 2008 года
Где ведет прием: МЦ Балтмед Озерки, МЦ О-Три

Панкова Анна Александровна
Специализация: Невролог
Врачебный стаж: с 2012 года
Где ведет прием: МЦ Балтмед Озерки

Бабенко Игорь Егорович
Специализация: Невролог
Врачебный стаж: с 1983 года
Где ведет прием: МЦ Балтмед Озерки, Поликлиника Городской клинической больницы № 31

Довгополый Денис Григорьевич
Специализация: Терапевт, Невролог, Хирург, Врач общей практики
Врачебный стаж: с 2003 года
Где ведет прием: МЦ Балтмед Озерки

Волгунцева Анна Александровна
Специализация: Невролог
Врачебный стаж: с 2000 года
Где ведет прием: МЦ Балтмед Озерки

Басов Павел Игоревич
Специализация: Невролог, Рефлексотерапевт
Врачебный стаж: с 2005 года
Где ведет прием: МЦ Балтмед Озерки, МЦ Медикал Он Груп Восстания

Белякова Алла Васильевна
Специализация: Невролог, Педиатр, Рефлексотерапевт
Врачебный стаж: с 1983 года
Где ведет прием: МЦ Медицентр, МЦ Профимедика, МЦ Семейный Доктор

Зосина Мария Сергеевна
Специализация: Невролог, Иглорефлексотерапевт
Врачебный стаж: с 2012 года
Где ведет прием: МЦ Медицентр Поликарпова, Городская поликлиника № 86

Топоркова Ольга Александровна
Специализация: Невролог, Врач функциональной диагностики
Врачебный стаж: с 2012 года
Где ведет прием: МЦ Медицентр, Александровская больница

Рогинская Юлия Викторовна
Специализация: Невролог
Врачебный стаж: с 1991 года
Где ведет прием: МЦ Медицентр Поликарпова

Братанова Ирина Валерьевна
Специализация: Невролог, Иглорефлексотерапевт
Врачебный стаж: с 2002 года
Где ведет прием: МЦ Медицентр Поликарпова, МЦ Доктор Борменталь Варшавская

Боброва Ольга Сергеевна
Специализация: Невролог
Врачебный стаж: с 2017 года
Где ведет прием: МЦ Медицентр

Клевакина Елена Евгеньевна
Специализация: Невролог, Иглорефлексотерапевт
Врачебный стаж: с 1978 года
Где ведет прием: МЦ Медицентр

Шикина Екатерина Анатольевна
Специализация: Невролог
Врачебный стаж: с 2018 года
Где ведет прием: МЦ Медпомощь 24 Заневский

Чикова Рима Сахибгареевна
Специализация: Невролог, Иглорефлексотерапевт
Врачебный стаж: с 1989 года
Где ведет прием: МЦ Медпомощь 24 Балканский

Тарасова Росина Васильевна
Специализация: Невролог, Врач УЗИ, Педиатр
Врачебный стаж: с 1990 года
Где ведет прием: МЦ Медпомощь 24 Заневский, Клиника ЧудоДети

Писаренко Елена Георгиевна
Специализация: Невролог
Врачебный стаж: с 1994 года
Где ведет прием: МЦ Медпомощь 24 Заневский, Городская поликлиника № 40 для творческих работников, Хеликс Дунайский, Максимилиановская поликлиника

Мирзалиев Магомедали Ибрагимович
Специализация: Невролог
Врачебный стаж: с 2017 года
Где ведет прием: МЦ Медпомощь 24 Заневский

Марченков Михаил Владимирович
Специализация: Невролог
Врачебный стаж: с 2010 года
Где ведет прием: МЦ Медпомощь 24 Балканский

Герасименко Ольга Геннадьевна
Специализация: Невролог
Врачебный стаж: с 2005 года
Где ведет прием: МЦ Медпомощь 24 Балканский, МЦ Балтмед Озерки

Синельников Константин Андреевич
Специализация: Невролог, Вестибулолог, Вертебролог
Врачебный стаж: с 2010 года
Где ведет прием: МЦ Март

Латышева Марина Игоревна
Специализация: Невролог
Врачебный стаж: с 1991 года
Где ведет прием: МЦ Энерго Киевская

Пачулия Этери Борисовна
Специализация: Невролог, Вертебролог
Врачебный стаж: с 1999 года
Где ведет прием: МЦ Энерго Киевская, Кардиоклиника

Грачев Юрий Сергеевич
Специализация: Невролог, Вертебролог
Врачебный стаж: с 2003 года
Где ведет прием: Клиника Скандинавия на Московском

Бабинцева Елена Юрьевна
Специализация: Невролог, Иглорефлексотерапевт
Врачебный стаж: с 1993 года
Где ведет прием: МЦ Риорит

Данеева Надежда Андреевна
Специализация: Невролог
Врачебный стаж: с 2009 года
Где ведет прием: Доступная медицина Восстания

Готовчиков Андрей Александрович
Специализация: Невролог
Врачебный стаж: с 1998 года
Где ведет прием: МЦ Энергия Здоровья, Клиника неврологии Первого Меда

Климкин Андрей Васильевич
Специализация: Невролог, Врач УЗИ
Врачебный стаж: с 2010 года
Где ведет прием: МЦ Энергия Здоровья, НИИ Детских Инфекций (НИИДИ СПб)

Мурзина Елена Геннадьевна
Специализация: Невролог, Мануальная терапия, Остеопат
Врачебный стаж: с 2010 года
Где ведет прием: МЦ Энергия Здоровья, Центр семейной медицины на Манежной

Иванова Мария Александровна
Специализация: Невролог, Остеопат
Врачебный стаж: с 2005 года
Где ведет прием: МЦ Лонга Вита, Гайде на Лиговском

Асадуллаева Патимат Мурадовна
Специализация: Невролог
Врачебный стаж: с 2007 года
Где ведет прием: МЦ Лонга Вита, МЦ Атлант

Калачев Павел Алексеевич
Специализация: Невролог, Мануальная терапия, Вертебролог
Врачебный стаж: с 2009 года
Где ведет прием: МЦ Лонга Вита

Трубников Илья Игоревич
Специализация: Невролог, Мануальная терапия, Остеопат
Врачебный стаж: с 2015 года
Где ведет прием: МЦ Лонга Вита, МЦ РИН-Мед, Клиника Медпомощь 24 на Заневском

Алмазов Кирилл Сергеевич
Специализация: Невролог, Вертебролог
Врачебный стаж: с 2012 года
Где ведет прием: СМ-Клиника на Малой Балканской

Архипенко Елена Юрьевна
Специализация: Невролог
Врачебный стаж: с 2012 года
Где ведет прием: СМ-Клиника на Малой Балканской

Боровикова Ольга Александровна
Специализация: Невролог
Врачебный стаж: с 2013 года
Где ведет прием: СМ-Клиника на Выборгском, Елизаветинская больница

Зимакова Татьяна Викторовна
Специализация: Невролог, Мануальная терапия, Остеопат
Врачебный стаж: с 2002 года
Где ведет прием: СМ-Клиника на Ударников

Кабанов Алексей Юрьевич
Специализация: Невролог, Вертебролог, Сомнолог
Врачебный стаж: с 2013 года
Где ведет прием: СМ-Клиника на Дунайском

Овчинников Михаил Александрович
Специализация: Невролог, Мануальная терапия, Вертебролог, Остеопат
Врачебный стаж: с 2008 года
Где ведет прием: СМ-Клиника на Выборгском

Паско Надежда Анатольевна
Специализация: Невролог
Врачебный стаж: с 2009 года
Где ведет прием: СМ-Клиника на Выборгском

Пицуха Светлана Анатольевна
Специализация: Невролог
Врачебный стаж: с 1997 года
Где ведет прием: СМ-Клиника на Ударников

Суркин Кямиль Митхатьевич
Специализация: Невролог
Врачебный стаж: с 1987 года
Где ведет прием: СМ-Клиника на Дунайском, Клиника Международная академия здоровья

Алешина Вера Валерьевна
Специализация: Невролог
Врачебный стаж: с 2009 года
Где ведет прием: СМ-Клиника на Ударников

Грибов Геннадий Вячеславович
Специализация: Невролог, Нейрохирург, Хирург
Врачебный стаж: с 2010 года
Где ведет прием: СМ-Клиника на Дунайском, Всеволожская ЦРБ

Здор Александр Анатольевич
Специализация: Невролог
Врачебный стаж: с 1984 года
Где ведет прием: СМ-Клиника на Маршала Захарова, ЛИЦ на Московском, Клиника Дезир на Московском

Иванова Галина Юрьевна
Специализация: Невролог
Врачебный стаж: с 1988 года
Где ведет прием: СМ-Клиника на Ударников

Ковалёва Наталья Александровна
Специализация: Невролог
Врачебный стаж: с 2008 года
Где ведет прием: СМ-Клиника на Дунайском

Курбанбаев Нурали Бахтиярович
Специализация: Невролог
Врачебный стаж: с 2016 года
Где ведет прием: СМ-Клиника на Маршала Захарова, СМ-Клиника на Малой Балканской

Репин Павел Николаевич
Специализация: Невролог
Врачебный стаж: с 2016 года
Где ведет прием: СМ-Клиника на Маршала Захарова, СМ-Клиника на Дунайском

Скрипник Татьяна Анатольевна
Специализация: Невролог
Врачебный стаж: с 1997 года
Где ведет прием: СМ-Клиника на Ударников

Шеняк Татьяна Михайловна
Специализация: Невролог
Врачебный стаж: с 1981 года
Где ведет прием: СМ-Клиника на Ударников

Степашин Максим Николаевич
Специализация: Невролог, Мануальная терапия, Остеопат
Врачебный стаж: с 2005 года
Где ведет прием: СМ-Клиника на Малой Балканской, Центр здоровой спины

Шогенов Рамиш Курбанович
Специализация: Невролог, Вестибулолог, Вестибулолог
Врачебный стаж: с 2008 года
Где ведет прием: МЦ Риорит

Левина Екатерина Олеговна
Специализация: Невролог
Врачебный стаж: с 1998 года
Где ведет прием: Клиника доктор Пеля

Обухов Андрей Васильевич
Специализация: Невролог, Мануальная терапия, Остеопат
Врачебный стаж: с 1995 года
Где ведет прием: Клиника доктора Пеля, Медицинский центр Экспресс

Ревтович Антон Аркадьевич
Специализация: Невролог
Врачебный стаж: с 2010 года
Где ведет прием: Клиника доктора Пеля, Клиника биоакустической коррекции на Московской
Литература
- Артемьев Д.В. Нарушения высших психических функций при болезни Паркинсона / Д.В. Артемьев, Ж.М. Глозман // Достижения в нейрогериартрии. -М., 1995. – С. 46-60.
- Вейн A.M. Паркинсонизм / A.M. Вейн, B.JI. Голубев, Ю.Э. Берзиныш. -Р. : Зинатне, 1981.-328 с.
- Левин О.С. Сравнительное исследование болезни Паркинсона и деменции с тельцами Леви /О.С. Левин, H.A. Амосова, Т. В. Найму шина и др. // Журн. неврологии и психиатрии. 2004. – № 1. – С. 17-23.
- Хомская Е.Д. Нейропсихология / Е.Д. Хомская. 4-е изд. – СПб. : Питер, 2005. – 496 с.
- Яхно H.H. Сравнительная оценка различных форм паркинсонизма у больных пожилого и старческого возраста / H.H. Яхно, И.В. Дамулин, O.A. Гончаров // Журн. неврологии и психиатрии. 1992. — Т. 92, № 1.-С. 67-72.
Последние статьи о диагностике

Что показывает МРТ головного мозга
На сегодня в медицинских клиниках СПб МРТ головного мозга – это всеми признанный золотой стандарт в исследовании разных заболеваний структур головы. Показаниями для исследования мозга будут:
Что лучше – МРТ или КТ головного мозга
МРТ и КТ – это два томографических метода, которые позволяют визуализировать структуры головы, но каждый из этих видов сканирования лучше покажет те или иные ткани и органы. МРТ лучше, чем КТ, отображает органы, в которых много молекул воды.
Эта статья — о заболевании. О синдроме см. Паркинсонизм.
| Болезнь Паркинсона | |
|---|---|
 Пациент с болезнью Паркинсона. Рисунок из руководства 1886 года Уильяма Говерса |
|
| МКБ-11 | 8A00.0 |
| МКБ-10 | G20 |
| МКБ-10-КМ | G20 и F02.3 |
| МКБ-9 | 332 |
| МКБ-9-КМ | 332.0[1][2] и 332[1][2] |
| OMIM | 168600 |
| DiseasesDB | 9651 |
| MedlinePlus | 000755 |
| eMedicine | neuro/304 |
| MeSH | D010300 |
Боле́знь Паркинсо́на (синонимы: идиопатический синдром паркинсонизма, дрожательный паралич) — медленно прогрессирующее хроническое нейродегенеративное неврологическое заболевание, характерное для лиц старшей возрастной группы[3]. Относится к дегенеративным заболеваниям экстрапирамидной моторной системы. Вызвано прогрессирующим разрушением и гибелью нейронов, вырабатывающих нейромедиатор дофамин[4], — прежде всего в чёрной субстанции, а также и в других отделах центральной нервной системы. Недостаточная выработка дофамина ведёт к тормозному[5] влиянию базальных ганглиев на кору головного мозга. Ведущими (основными, или кардинальными) симптомами являются:
- мышечная ригидность;
- гипокинезия;
- тремор;
- постуральная неустойчивость.
Современная медицина пока не может излечить это заболевание, однако существующие методы консервативного и оперативного лечения позволяют значительно улучшить качество жизни больных и замедлить прогрессирование болезни[6].
Термин «паркинсонизм» является общим понятием для ряда заболеваний и состояний с вышеназванными ведущими симптомами. Однако наиболее значимой из форм паркинсонизма является болезнь Паркинсона — идиопатическое заболевание (что означает болезнь самостоятельную, не вызванную генетическими нарушениями или другими заболеваниями).
Своим названием болезнь Паркинсона обязана французскому неврологу Жану Шарко. Он предложил назвать её в честь британского врача и автора «Эссе о дрожательном параличе» Джеймса Паркинсона, чей труд не был должным образом оценён при жизни[7].
История изучения[править | править код]

Первая страница «Эссе о дрожательном параличе» Джеймса Паркинсона

Жан Шарко — французский невролог, предложивший называть заболевание болезнью Паркинсона

Рисунок человека с болезнью Паркинсона, сделанный Жаном Шарко
Проявления болезни Паркинсона были описаны за несколько тысячелетий до опубликования в 1817 году Джеймсом Паркинсоном «Эссе о дрожательном параличе» (англ. An Essay on the Shaking Palsy).
В египетском папирусе XII столетия до н. э. у одного из фараонов отмечены характерные для заболевания симптомы. В Библии описаны люди с тремором[7][8]. В текстах Аюрведы заболевание, проявляющееся тремором, ограничением движений, слюнотечением и другими характерными симптомами, рекомендовано лечить некоторыми видами бобовых. Знаменитый древнеримский врач Гален, по всей видимости, ещё во II столетии н. э. описал болезнь Паркинсона, указав на её симптомы — тремор покоя (дрожь покоящихся частей тела), постуральную неустойчивость и мышечную ригидность[8][9].
После Галена симптомы паркинсонизма вновь были описаны лишь в XVII столетии[8]. Голландский врач и анатом Франциск Сильвий отметил отличие тремора покоя от других видов дрожания, немец Иероним Гобий[en] выделил симптомы характерной для паркинсонизма походки[8][9][10]. Знаменитый шотландский хирург Джон Хантер дал подробное описание больного паркинсонизмом[8][11].
В 1817 году английский врач Джеймс Паркинсон опубликовал «Эссе о дрожательном параличе»[7]. В нём он описал шестерых больных людей, подробно остановившись на таких характерных симптомах заболевания, как тремор покоя, патологическая походка и постуральная неустойчивость, мышечная ригидность и другие. Также он оценил их динамику при прогрессировании заболевания[7][12]. Работа оставалась незамеченной в течение 40 лет после опубликования[12]. Классические исследования неврологов У. Говерса, С. Вильсона, В. Эрба и Ж. Шарко в 1868—1881 годах позволили выделить болезнь Паркинсона как самостоятельное заболевание. По предложению знаменитого французского невролога Шарко заболевание получило имя британского врача Паркинсона, чей труд не был должным образом оценён при жизни[7].
После определения болезни Паркинсона как самостоятельного заболевания возник вопрос о том, поражение каких структур приводит к его симптомам. Французский невролог Эдуард Бриссо в конце XIX столетия предположил, что за развитие заболевания ответственны субталамическое ядро и ножки мозга (отдел среднего мозга)[7]. В 1912 году Фредерик Леви обнаружил специфические клеточные включения в клетках ствола мозга, характерные для болезни Паркинсона, впоследствии названные тельцами Леви[7]. В 1919 году русский невролог К. Н. Третьяков определил, что основные патологические изменения при заболевании возникают в чёрной субстанции[13]. Предположения К. Н. Третьякова не признавались медицинским сообществом до их подтверждения немецким патологоанатомом Рольфом Хасслером[en] в 1948 году[7][14].
Биохимические изменения, которые лежат в основе заболевания, стали изучать в 1950-х годах. За исследования нейротрансмиттера дофамина, играющего важную роль в развитии заболевания, шведский фармаколог Арвид Карлссон получил Нобелевскую премию по физиологии и медицине[15] в 2000 году. Состав телец Леви был расшифрован в 1997 году[16].
Вместе с исследованиями природы заболевания развивались методы его лечения. Неврологи конца XIX — начала XX столетий отмечали положительный эффект алкалоидов группы атропина белладонны. В 1939 году была предпринята попытка хирургического лечения — деструкция базальных ганглиев. Эти методики были усовершенствованы за последующие 20 лет[9]. До внедрения в клиническую практику леводопы антихолинергические препараты и хирургическое разрушение базальных ядер оставались основными методами лечения болезни Паркинсона[15][17]. В конце 1980-х годов стимуляция глубинных структур мозга электрическими импульсами была признана возможным методом лечения заболевания[18].
Эпидемиология[править | править код]
Болезнь Паркинсона составляет 70—80 % случаев синдрома паркинсонизма. Она является наиболее частым нейродегенеративным заболеванием после болезни Альцгеймера[19][20]. Заболевание встречается повсеместно. Его частота колеблется от 60 до 140 человек на 100 тысяч населения, число больных значительно увеличивается среди представителей старшей возрастной группы. Удельный вес людей с болезнью Паркинсона в возрастной группе старше 60 лет составляет 1 %[3], а старше 85 лет — от 2,6 %[4] до 4 %[19]. Чаще всего первые симптомы заболевания появляются в 55—60 лет. Однако в ряде случаев болезнь может развиться и в возрасте до 40 лет (болезнь Паркинсона с ранним началом) или до 20 лет (ювенильная форма заболевания)[4].
Мужчины болеют несколько чаще, чем женщины. Существенных расовых различий в структуре заболеваемости не выявлено[4].
Этиология[править | править код]
Этиология болезни Паркинсона на вторую половину 2011 года окончательно не выяснена. Этиологическими факторами риска считаются старение, генетическая предрасположенность, воздействие факторов окружающей среды[4][21][22]. Патоморфологически нормальное старение сопровождается уменьшением числа нейронов чёрной субстанции и наличием в них телец Леви. Старению также сопутствуют нейрохимические изменения в стриатуме — снижение содержания дофамина и фермента тирозингидроксилазы, а также уменьшение числа дофаминовых рецепторов. С помощью позитронно-эмиссионной томографии доказано, что темпы дегенерации нейронов чёрной субстанции при болезни Паркинсона намного выше, чем при нормальном старении[4].
Около 15 % людей с болезнью Паркинсона имеют семейный анамнез данного заболевания. Однако гены, ответственные за развитие болезни Паркинсона, не идентифицированы[4].
Причинами паркинсоноподобных проявлений также могут быть воздействие факторов окружающей среды (пестициды, гербициды, соли тяжёлых металлов)[23], хроническая цереброваскулярная недостаточность или употребление лекарств, вызывающих экстрапирамидные побочные эффекты[24].
Экологические факторы[править | править код]
Установлено, что после инъекции вещества 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП) развивается паркинсонизм[4]. МФТП проникает через ГЭБ и под действием МАО-B окисляется до 1-метил-4-фенилпиридина (МФП+). МФП+ проникает в митохондрии и ингибирует комплекс I дыхательной цепи. Сходство химического строения МФТП и некоторых пестицидов (например, ротенон, паракват) и гербицидов (например, Агент Оранж) позволило предположить, что МФТП-подобные токсины окружающей среды способствуют развитию болезни Паркинсона[25][26][27]. К факторам риска относят также проживание в сельской местности и близость промышленных предприятий и карьеров[27].
Риск развития болезни Паркинсона у курильщиков в 3 раза ниже, чем у некурильщиков[25]. Предполагают, что это связано с дофамин-стимулирующим эффектом никотина[25]. Кроме того, это можно объяснить наличием в дыме табака соединений, действие которых подобно ингибиторам МАО[28]. От развития болезни Паркинсона защищает также употребление кофеина[29].
Окислительная гипотеза[править | править код]
Окислительная гипотеза предполагает, что свободные радикалы, образующиеся при окислительном метаболизме дофамина, играют важную роль в развитии и прогрессировании болезни Паркинсона. Содержание веществ, которые могут служить донором электронов, в чёрном веществе увеличивается, что способствует образованию свободных радикалов[4].
Кроме того, при окислении дофамина под действием МАО образуется пероксид водорода. Если пероксид водорода не связывается с глутатионом, то происходит накопление весьма реактивных гидроксильных радикалов, которые вступают в реакцию с липидами клеточных мембран, вызывая перекисное окисление липидов и гибель клеток.
Патогенез[править | править код]
Патологическая анатомия[править | править код]


При болезни Паркинсона поражаются структуры экстрапирамидной системы — базальные ядра и чёрное вещество, голубое пятно и другие[30]. Наиболее выраженные изменения отмечают в передних отделах чёрной субстанции. Характерные для болезни Паркинсона симптомы возникают при гибели 60—80 % нейронов этого анатомического образования[22][31].
Макроскопические изменения характеризуются депигментацией содержащих меланин областей чёрного вещества и голубого пятна[19][32]. При микроскопическом исследовании поражённых областей выявляют уменьшение числа нервных клеток. В них определяется наличие телец Леви. Также происходит гибель астроцитов (разновидности глиальных клеток) и активация микроглии. Тельца Леви образуются вследствие скопления в цитоплазме белка α-синуклеина[en][22]. Наличие телец Леви — один из признаков болезни Паркинсона[32].
Тельца Леви обнаруживают также и при других нейродегенеративных заболеваниях. В связи с этим они не считаются специфическим маркером болезни Паркинсона. Кроме того, при данном заболевании в чёрной субстанции и голубом пятне обнаружены «бледные тельца» — внутриклеточные гранулярные включения, которые замещают распадающийся меланин[33].
Согласно предложенной Брааком и соавторами классификации, в асимптоматической стадии болезни Паркинсона тельца Леви появляются в нервных клетках обонятельной луковицы, продолговатого мозга и варолиевого моста. С прогрессированием заболевания наличие данных патологических телец отмечается в нейронах чёрной субстанции, среднего мозга, базальных ганглиев и на конечных этапах в клетках коры головного мозга[31].
Патологическая физиология[править | править код]
Тесная взаимосвязь между составляющими экстрапирамидной системы — паллидумом и стриатумом — обеспечивается многочисленными пучками нервных волокон. Благодаря связям между таламусом и стриопаллидарной системой образуются рефлекторные дуги, обеспечивающие выполнение многочисленных стереотипных и автоматизированных движений (например, ходьба, бег, плаванье, езда на велосипеде и др.). Тесная связь стриопаллидарной системы с ядрами гипоталамуса определяет её роль в механизмах эмоциональных реакций[34].
В норме экстрапирамидная система посылает импульсы к периферическим двигательным нейронам. Эти сигналы играют важную роль в обеспечении миостатики путём готовности мышц к произвольным движениям. От деятельности данного отдела центральной нервной системы зависит способность человека принимать оптимальную для намеченного действия позу, достигается необходимое соотношение тонуса мышц-агонистов и мышц-антагонистов, а также плавность и соразмерность произвольных движений во времени и пространстве[34].
Характер клинических проявлений болезни зависит от того, какая часть стриопаллидарной системы поражена — стриатум или паллидум. Если чрезмерно тормозящее влияние стриатума, возникает гипокинезия — бедность движений, амимия. Гипофункция стриатума приводит к возникновению избыточных непроизвольных движений — гиперкинезов[34]. Паллидум оказывает тормозящее воздействие на структуры стриатума. Для болезни Паркинсона характерно снижение тормозящего влияния паллидума на стриатум. Повреждение паллидума приводит к «торможению торможения» периферических двигательных нейронов[35].
Открытие роли нейромедиаторов позволило объяснить функции экстрапирамидной системы, а также причины возникновения клинических проявлений болезни Паркинсона и паркинсонизма. В мозге существует несколько дофаминергических систем. Одна из них начинается в нейронах чёрной субстанции, аксоны которых через ножку мозга, внутреннюю капсулу, бледный шар доходят до полосатого тела (лат. corpus striatum). Терминальные отделы этих аксонов содержат большое количество дофамина и его производных. Дегенерация данного нигростриарного дофаминергического пути является основным причинным фактором развития болезни Паркинсона. Вторая восходящая дофаминергическая система — мезолимбический путь. Он начинается от клеток интерпедункулярного ядра среднего мозга и заканчивается в гипоталамусе и лобных долях головного мозга. Этот путь принимает участие в контроле настроения, поведении и контролирует начало двигательного акта и движений аффективной реакции (движений, которые сопровождают эмоции)[35].
Основу всех форм паркинсонизма составляет резкое уменьшение количества дофамина в чёрной субстанции и полосатом теле[4] и соответственно нарушение функционирования дофаминергических проводящих путей головного мозга.
Симптоматика[править | править код]
Для болезни Паркинсона характерны 4 двигательных нарушения: тремор, гипокинезия, мышечная ригидность, постуральная неустойчивость, — а также вегетативные и психические расстройства[21].
Тремор (дрожание) — наиболее очевидный и легко выявляемый симптом[36]. Для паркинсонизма характерен тремор, возникающий в покое, хотя редко возможны и другие типы (постуральный, интенционный)[21]. Его частота 4—6 Гц (движений в секунду). Он обычно начинается в дистальном отделе одной руки, при прогрессировании заболевания распространяясь на противоположную руку и на ноги[4]. Разнонаправленные движения большого и других пальцев внешне напоминают счёт монет или скатывание пилюль (схожесть с ручной техникой создания пилюль в фармацевтике)[37][38]. Иногда также отмечается дрожание головы по типу «да-да» или «нет-нет», дрожание век, языка, нижней челюсти. В редких случаях оно охватывает всё тело. Тремор усиливается при волнении и стихает во время сна и произвольных движений[39]. В отличие от мозжечкового тремора, который появляется при движении и отсутствует в покое, при болезни Паркинсона типично его наличие в покое и уменьшение или исчезновение при движениях[40].

Почерк при болезни Паркинсона. На рисунке (масштаб не соблюдён) видны рваные движения там, где предполагаются плавные линии
Гипокинезия — снижение спонтанной двигательной активности. Больной может застывать, часами сохраняя неподвижность. Характерна общая скованность. Активные движения возникают после некоторого промедления, темп их замедлен — брадикинезия[40]. Больной ходит мелкими шагами, ступни при этом располагаются параллельно друг другу — кукольная походка[39]. Лицо маскообразное (амимия), взгляд застывший, мигания редкие. Улыбка, гримаса плача возникают с запозданием и так же медленно исчезают[40].

«Поза манекена», характерная для болезни Паркинсона
Речь лишена выразительности, монотонна и имеет тенденцию к затуханию. В результате характерного для болезни Паркинсона уменьшения амплитуды движений почерк становится мелким — микрография[38][39].
Одним из проявлений олигокинезии (уменьшение количества движений) является отсутствие физиологических синкинезий (содружественных движений). При ходьбе руки не совершают обычных размашистых движений, они остаются прижатыми к туловищу (ахейрокинез). При взгляде вверх не отмечается наморщивания лба. Сжатие пальцев в кулак не сопровождается разгибанием кисти. Больной не может выполнять несколько целенаправленных движений одновременно. Все действия напоминают автоматические[38][39][40].
Мышечная ригидность — равномерное повышение тонуса мышц по пластическому типу. Конечности при их сгибании и разгибании застывают в приданном им положении. Такая форма повышения мышечного тонуса называется «пластической восковой гибкостью». Преобладание ригидности в определённых группах мышц приводит к формированию характерной позы просителя[38] (также называют «поза манекена»[39][40]): больной сутулится, голова наклонена вперёд, полусогнутые в локтевых суставах руки прижаты к телу, ноги также слегка согнуты в тазобедренных и коленных суставах. При пассивном сгибании-разгибании предплечья, головы, круговых движениях в лучезапястном суставе можно ощутить своеобразную прерывистость, ступенчатость напряжения мышц — «симптом зубчатого колеса»[38][40].
Изменения мышечного тонуса ведут к нарушению тенденции конечности к возвращению в исходную позицию после совершённого движения. Например, после резкого пассивного тыльного сгибания стопы она некоторое время сохраняет приданную ей позицию — феномен Вестфаля[39].
Постуральная неустойчивость развивается на поздних стадиях заболевания[4]. У больного отмечаются затрудения преодоления как инерции покоя, так и инерции движения. Больному сложно начать движение, а начав его, трудно остановиться. Возникают явления пропульсии (лат. propulsio — проталкивание вперёд), латеропульсии и ретропульсии. Они выражаются в том, что, начав движение вперёд, в сторону или назад, туловище обычно как бы опережает ноги, в результате чего нарушается положение центра тяжести. Человек теряет устойчивость и падает[39]. Иногда у больных определяют «парадоксальные кинезии», когда вследствие эмоциональных переживаний, после сна либо вследствие других факторов человек начинает свободно передвигаться, пропадают характерные для заболевания симптомы. Через несколько часов симптоматика возвращается[38].
Вегетативные и психические расстройства. Кроме нарушений двигательной сферы, при болезни Паркинсона отмечаются вегетативные расстройства, а также нарушения обмена веществ. Следствием может быть либо истощение (кахексия), либо ожирение. Секреторные расстройства проявляются сальностью кожных покровов, особенно лица, повышенным слюноотделением, избыточной потливостью[38][39].
Психические расстройства при болезни Паркинсона могут быть обусловлены как самим заболеванием, так и антипаркинсоническими препаратами. Начальные признаки психоза (страх, растерянность, бессонница, галлюцинаторно-параноидное состояние с нарушением ориентировки) отмечают у 20 % амбулаторных и двух третей больных с тяжёлой формой паркинсонизма. Слабоумие выражено слабее, чем при сенильной деменции. У 47 % наблюдают депрессии, у 40 % — расстройства сна и патологическую утомляемость[41]. Больные безынициативны, вялы, а также назойливы, склонны к повторению одних и тех же вопросов[38][39].
Различают несколько клинических форм заболевания — ригидно-брадикинетическую, дрожательно-ригидную и дрожательную[42]:
- Ригидно-брадикинетическая форма характеризуется повышением тонуса мышц по пластическому типу, прогрессирующим замедлением активных движений вплоть до обездвиженности. Появляются мышечные контрактуры. Характерна «поза манекена» («поза просителя»).
- Дрожательно-ригидная форма характеризуется тремором конечностей, преимущественно их дистальных отделов, к которому присоединяется скованность произвольных движений.
- Для дрожательной формы характерно наличие постоянного или почти постоянного средне- и крупноамплитудного тремора конечностей, языка, головы, нижней челюсти. Тонус мышц нормальный или несколько повышен. Темп произвольных движений сохранён.
Диагностика и дифференциальный диагноз. Другие виды паркинсонизма[править | править код]

Томография мозга мужчины (56 лет) с диагнозом Паркинсона
Диагностика болезни Паркинсона в большинстве случаев не вызывает затруднений — достаточно наличия у пациента гипокинезии и одного из симптомов: тремора покоя, ригидности, постуральных нарушений в сочетании с положительным эффектом от приёма леводопы[36]. На начальных этапах заболевания, когда проявления заболевания не выражены либо выражены слабо, правильной диагностике может способствовать выявление постуральных рефлексов (рефлексов положения). К ним относится описанный выше феномен Вестфаля, а также феномен Фуа—Тевенара (либо феномен голени). Данные рефлексы возникают вследствие повышения пластического тонуса мышц. Феномен голени проявляется тем, что максимально согнутая в коленном суставе нога больного, который лежит на животе, опускается медленно и обычно разгибается не полностью[39].
Дифференциальный диагноз болезни Паркинсона с другими патологиями проходит в два этапа. Следует исключить состояния и процессы, при которых имеются схожие с паркинсонизмом симптомы. При наличии у больного паркинсонизма необходимо учитывать, что данный синдром характерен для ряда заболеваний.
Патогномоничные для паркинсонизма симптомы наблюдаются при следующих расстройствах[4]:
- психомоторная заторможенность — депрессия, кататонический ступор, истерия, гиперсомния
- мышечный гипертонус — нейромиотония, синдром «ригидного человека»
- апраксия ходьбы — нормотензивная гидроцефалия, опухоли мозга и др.
- тремор — поражение мозжечка
Паркинсонизм также может быть вызван целым рядом заболеваний. В большинстве случаев (~80 %) он вызван поражением нигростриарной системы вследствие болезни Паркинсона. При поражениях соответствующих отделов центральной нервной системы другой этиологии будут возникать токсический, лекарственный, постэнцефалитический, сосудистый, посттравматический и другие паркинсонизмы[4].
При многих заболеваниях развивается синдром паркинсонизма в сочетании с симптомами поражения других отделов центральной нервной системы. Для обозначения данной группы заболеваний используют термин «паркинсон-плюс»[4].
В 2022 году исследователи из Университета Кобе и Университета Хиросимы нашли новый биомаркер, позволяющий с помощью теста выявлять болезнь Паркинсона на ранних стадиях с точностью до 85-88%[43].
Классификация паркинсонизма и частота встречаемости его отдельных форм*[20]
| Тип | Форма | Частота, % |
|---|---|---|
| Первичный (идиопатический) паркинсонизм | Болезнь Паркинсона | 80,2 |
| Ювенильный паркинсонизм | * | |
| Вторичный паркинсонизм | Постэнцефалитический | 0,5 |
| Лекарственный | 3,9 | |
| Сосудистый | 2,1 | |
| Токсический | * | |
| Травматический | * | |
| Паркинсонизм, связанный с тиреоидными нарушениями, гипотиреоидизмом, гепатоцеребральной дегенерацией, опухолью мозга, гидроцефалией, сирингомезенцефалией | * | |
| Паркинсонический синдром при мультисистемной дегенерации — «паркинсонизм-плюс» |
Прогрессирующий супрануклеарный паралич (синдром Стила—Ричардсона) | 7,4 |
| Синдром Шая—Драйжера | 1,7 | |
| Стриато-нигральная дегенерация | 0,4 | |
| Комплекс паркинсонизм—деменция—боковой амиотрофический склероз | 0,2 | |
| Кортико-базальная дегенерация | 0,5 | |
| Болезнь диффузных телец Леви | 1,2 | |
| Болезнь Галлервордена—Шпатца | 0,3 | |
| Оливо-понто-церебральная дегенерация | * |
* Формы паркинсонизма, частота встречаемости которых не указана, диагностируют редко, и в сумме они составляют 2,2 %.
В соответствии с последними соглашениями Европейской ассоциации болезни Паркинсона[44] синдром паркинсонизма подразделяется на четыре группы:
- идиопатический паркинсонизм
- генетические формы паркинсонизма, семейный синдром паркинсонизма — наследственная форма, обозначается локализацией гена (например, PARK1)
- паркинсонизм в рамках других нейродегенеративных заболеваний (атипичные формы паркинсонизма, иногда называемые благодаря дополнительным симптомам «синдром паркинсонизм плюс»)
- симптоматические синдромы Паркинсона — например, как следствие некоторых медикаментов, амфетаминов, травм, опухолей, действия токсических веществ, эндокринно-метаболических нарушений, воспалительно-инфекционных заболеваний
Идиопатический и атипичный паркинсонизм могут в качестве проявлений нейродегенеративных заболеваний классифицироваться как синуклеинопатии (англ.) (рус. (идиопатический паркинсонизм, мультисистемная атрофия, деменция с тельцами леви) или таупатии (прогрессирующий супрануклеарный парез взора, кортико-базальная деменция).
В 1992 году британский врач Хьюз предложил критерии диагностики болезни Паркинсона, позволяющие установить диагноз с точностью до 93 % (согласно данным аутопсий)[45]:
- Наличие гипокинезии и как минимум одного из следующих симптомов: ригидность, тремор покоя 4—6 Гц, постуральные нарушения.
- Асимметричный дебют заболевания (стадия гемипаркинсонизма).
- Прогрессирующее течение.
- Отсутствие в анамнезе возможных этиологических факторов вторичного паркинсонизма (приём нейролептиков, достоверно перенесённый энцефалит, острые нарушения мозгового кровообращения, повторные или тяжёлые черепно-мозговые травмы).
- Отсутствие следующих симптомов:
- a) на всех стадиях заболевания
-
- отчётливой мозжечковой и/или пирамидной симптоматики
- надъядерного паралича взора
- окулогирных кризов
-
- b) на ранних стадиях заболевания
-
- грубых постуральных расстройств
- грубой прогрессирующей вегетативной недостаточности
- грубой деменции
-
Эти критерии должны соблюдаться лишь при отборе больных для научных исследований. Для предварительного диагноза достаточно выполнение лишь первых двух пунктов[36].
Стадии паркинсонизма по Хён и Яру (Hoehn, Yahr, 1967)[править | править код]
Наиболее часто применяемой в медицине является классификация стадий паркинсонизма по Хён и Яру[46]
[47]. Впервые она была опубликована в 1967 году в журнале Neurology Маргарет Хён (англ. Hoehn) и Мелвином Яром (англ. Yahr). Изначально она описывала 5 стадий прогрессирования болезни Паркинсона (1 — 5)[48]. Впоследствии шкалу модифицировали, дополнив её стадиями 0, 1,5 и 2,5[49].
- Стадия 0 — нет признаков заболевания.
- Стадия 1 — симптомы проявляются на одной из конечностей.
- Стадия 1,5 — симптоматика проявляется на одной из конечностей и туловище.
- Стадия 2 — двусторонние проявления без постуральной неустойчивости.
- Стадия 2,5 — двусторонние проявления с постуральной неустойчивостью. Больной способен преодолевать инерцию движения, вызванную толчком.
- Стадия 3 — двусторонние проявления. Постуральная неустойчивость. Больной способен к самообслуживанию.
- Стадия 4 — обездвиженность, потребность в посторонней помощи. При этом больной способен ходить и/или стоять без поддержки.
- Стадия 5 — больной прикован к креслу или кровати. Тяжёлая инвалидизация.
Лечение[править | править код]

Молекула дофамина, недостаток которого вызывает болезнь Паркинсона
Консервативное лечение[править | править код]
В настоящее время болезнь Паркинсона является неизлечимой, все существующие методы лечения направлены на облегчение её симптомов (симптоматическое лечение). Основные препараты, устраняющие двигательные нарушения: леводопа (чаще в комбинации с периферическими ингибиторами ДОФА-декарбоксилазы или реже с ингибиторами КОМТ), агонисты дофаминовых рецепторов[en] и ингибиторы МАО-Б[6].
Дофаминергические препараты[править | править код]
Диоксифенилаланин (сокращённо допа, или дофа) — биогенное вещество, которое образуется в организме из тирозина и является предшественником дофамина, в свою очередь являющегося предшественником норадреналина. В связи с тем, что при болезни Паркинсона содержание дофамина в головном мозге значительно снижено, для лечения заболевания целесообразно применение веществ, повышающих его содержание в ЦНС. Сам дофамин не может быть использован для этой цели, так как он плохо проникает через гемато-энцефалический барьер[50].
Леводопа[править | править код]
В качестве лекарственного препарата широко применяют синтетический левовращающий изомер диоксифенилаланина (сокращённо L-дофа), который значительно активнее правовращающего. Леводопа хорошо всасывается при приёме внутрь. Бо́льшая часть препарата попадает в печень и превращается в дофамин, который не проникает через гемато-энцефалический барьер. Для уменьшения декарбоксилирования препарат рекомендуют применять с ингибиторами дофа-декарбоксилазы (бенсеразидом, карбидопой)[50].
Препарат эффективен при болезни Паркинсона и паркинсонизме. Он уменьшает гипокинезию и ригидность. При треморе, дисфагии и слюнотечении лечебный эффект достигается у 50—60 %[50].
Препарат можно назначать с центральными холиноблокаторами и не следует применять с необратимыми ингибиторами моноаминоксидазы (МАО)[50].
При применении возможны побочные эффекты: диспепсические явления (тошнота, рвота, потеря аппетита), гипотензия, аритмии, гиперкинезы и др.[50]
У пациентов младше 60—70 лет назначение леводопы из-за развития побочных явлений и снижения эффективности при длительной терапии стараются отложить и применяют другие лекарственные средства[51]. Лечение пациентов старше 70 лет даже в начальных стадиях рекомендуют начинать с леводопы, что объясняют меньшей эффективностью препаратов других групп и более частыми соматическими и психическими побочными эффектами в этом возрасте[4].
Агонисты дофамина[править | править код]
В качестве основного лечения также используются агонисты дофаминовых рецепторов (бромокриптин, перголид[en], прамипексол[en], ропинирол[en], каберголин[en], апоморфин, лизурид[en]). Препараты данной группы являются специфическими центральными агонистами дофаминовых рецепторов. Имитируя действие дофамина, они вызывают те же фармакологические эффекты, что и леводопа[52].
По сравнению с леводопой они реже вызывают дискинезии и другие двигательные расстройства, но чаще оказывают иные побочные эффекты: отёки, сонливость, запоры, головокружение, галлюцинации, тошноту[53].
Ингибиторы МАО типа Б и катехол-О-метилтрансферазы[править | править код]
Данная группа препаратов избирательно подавляет активность ферментов, которые расщепляют дофамин: моноаминоксидаза (МАО типа Б) и катехол-О-метилтрансфераза (КОМТ). ингибиторы МАО-Б (например, селегилин, разагилин] и ингибиторы КОМТ (например, энтакапон[en] и толкапон[en]) замедляют неуклонное прогрессирование болезни Паркинсона. Фармакологические эффекты аналогичны леводопе, хотя их выраженность значительно меньше. Они позволяют усилить эффекты леводопы, не повышая и даже снижая её суммарную дозу[22][54].
Ингибиторы обратного нейронального захвата дофамина[править | править код]

Непрямые дофаминомиметики (амантадин) повышают чувствительность рецепторов к соответствующему медиатору. Данные препараты усиливают выделение дофамина из пресинаптических окончаний и тормозят его обратный нейрональный захват. Лекарственные средства данной группы вызывают те же фармакологические эффекты, что и леводопа, то есть они преимущественно подавляют гипокинезию и мышечную ригидность, значительно меньше влияя на тремор[52].
Центральные холиноблокаторы[править | править код]
Тригексифенидил — основной препарат группы центральных холиноблокаторов, применяемых для лечения болезни Паркинсона
Для лечения паркинсонизма применяют антихолинергические средства. Знаменитый французский врач Жан Шарко ещё в 1874 году использовал белладонну для уменьшения наблюдаемой при заболевании усиленной саливации. Им также было отмечено уменьшение тремора при её приёме. В дальнейшем для лечения стали использовать не только препараты белладонны, но и другие холиноблокаторы — атропин и скополамин. После появления синтетических холинолинолитиков стали применяться тригексифенидил (циклодол), трипериден, бипериден[en], тропацин, этпенал, дидепил и динезин[55].
Применение холиноблокаторов патогенетически обосновано. Поражения чёрной субстанции и других нервных образований приводит к существенным сдвигам в холин- и дофаминергических процессах, а именно повышению холинергической активности и снижению дофаминергической. Таким образом, центральные холиноблокаторы «выравнивают» нейромедиаторные взаимодействия[55].
Применяемые ранее препараты белладонны действуют преимущественно на периферические ацетилхолиновые рецепторы и меньше — на холинорецепторы мозга. В связи с этим терапевтическое действие данных препаратов относительно невелико. Вместе с этим они вызывают ряд побочных явлений: сухость во рту, нарушение аккомодации, задержку мочи, общую слабость, головокружение и др.[55]
Современные синтетические противопаркинсонические центральные холиноблокаторы характеризуются более избирательным действием. Они широко применяются при лечении экстрапирамидных заболеваний, а также неврологических осложнений, вызываемых нейролептиками[55].
Отличительным свойством центральных холиноблокаторов является то, что они в большей степени воздействуют на тремор; в меньшей мере влияют на ригидность и брадикинезию. В связи с периферическим действием уменьшается слюнотечение, в меньшей степени потоотделение и сальность кожи[55].
Хирургическое лечение[править | править код]
Хирургические методы лечения можно разделить на два типа: деструктивные операции и стимуляцию глубинных мозговых структур.
Деструктивные операции[править | править код]
К деструктивным операциям, применяемым при болезни Паркинсона, относятся таламо- и паллидотомия.
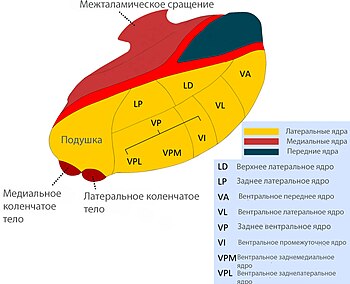
Схема таламуса. VI (в центре снизу) обозначено вентральное промежуточное ядро, разрушение которого приводит к снижению тремора у больных с болезнью Паркинсона
Таламотомия показана лишь в тех случаях, когда основным симптомом заболевания является тремор[56]. Для получения положительного результата от операции больные должны соответствовать нескольким критериям: болезнь Паркинсона проявляется односторонним тремором, консервативное лечение неэффективно[57][58]. Показано, что разрушение вентрального промежуточного ядра таламуса (лат. nucleus ventralis intramedius) приводит к снижению тремора у больных паркинсонизмом[59][60]. Согласно литературным данным[57][61], эффективность операции по устранению тремора при болезни Паркинсона достигает 96 %. При этом те же авторы отмечают высокий риск осложнений (13 % стойких[61] и 56 % преходящих[57]). К осложнениям, возникающим после таламотомии, относят дизартрию, абулию, дисфазию, диспраксию.
Паллидотомия может быть показана больным с преобладанием двигательных расстройств, для которых консервативное лечение неэффективно. Процедура заключается во введении иглы в бледный шар (лат. globus pallidus) с последующим его частичным разрушением.
Паллидотомия является относительно безопасной процедурой. При анализе 85 статей, посвящённых паллидотомии, и соответственно результатов лечения 1510 больных выделены такие осложнения данной операции[62]:
| Осложнение | К-во больных | Уровень (%) |
|---|---|---|
| Внутричерепное кровоизлияние | 26 | 1,7 % |
| Постоперационный психоз | 8 | 0,5 % |
| Гиперсаливация | 9 | 0,6 % |
| Судорожные приступы | 8 | 0,5 % |
| Нарушение фонации | 20 | 1,3 % |
| Нарушение полей зрения | 30 | 2,0 % |
| Депрессия | 13 | 0,9 % |
| Нарушение функции лицевого нерва | 56 | 3,7 % |
| Дизартрия | 18 | 1,2 % |
| Нарушение памяти | 19 | 1,3 % |
| Слабость в одной из конечностей | 24 | 1,6 % |
| Другие осложнения | 30 | 2,0 % |
Эффективность паллидотомии при болезни Паркинсона достаточно высока. Гипокинезия в противоположных стороне операции конечностях снижается в 82 % случаев[63].
С развитием радиохирургии появилась новая возможность производить разрушение соответствующих нервных структур без травматизации окружающих структур и тканей[64][65][66][67][68].
Нейростимуляция[править | править код]

Стереотаксическая рамка при операциях стимуляции глубинных нервных структур
Нейростимуляция является современным методом лечения, который представляет собой малоинвазивную нейрохирургическую операцию.
Данный метод применяется в следующих случаях[69]:
- Несмотря на правильно подобранную лекарственную терапию, у пациента не удаётся добиться значительного уменьшения симптомов.
- Прогрессирование заболевания приводит к необходимости увеличивать дозы лекарственных препаратов, при этом побочные эффекты лекарств становятся непереносимыми.
- Пациент социально активен и боится потерять работу из-за заболевания.
- Пациент теряет способность к самообслуживанию и становится зависимым от своей семьи в выполнении повседневных действий.
Суть метода: лечебный эффект достигается за счёт стимуляции точно рассчитанным небольшим по амплитуде электрическим током определённых структур головного мозга, ответственных за контроль над движениями тела. Для этого пациенту вводятся в головной мозг тонкие электроды, которые соединяются с нейростимулятором (похож на кардиостимулятор), имплантирующимся подкожно в области груди под ключицей[70].
Сама операция обычно проводится в два этапа. На первом этапе под местным обезболиванием с помощью магнитно-резонансной томографии и стереотаксической нейронавигации электроды вводятся в глубинные структуры головного мозга, ответственные за контроль над движениями, — в область субталамического ядра (STN). Затем осуществляется тестовая стимуляция, в ходе которой пациент сообщает о соматосенсорных ощущениях, возникающих при различных параметрах стимуляции. При положительном результате проводится второй этап: пациенту имплантируются подкожные части системы — коннекторы и генератор импульсов (нейростимулятор). Обычно второй этап проводится под наркозом. В послеоперационном периоде производится программирование нейростимулятора и обучение пациента. Пациент имеет возможность сам корректировать настройки стимуляции (в пределах, заданных врачом) в зависимости от собственного самочувствия и особенностей выполняемой деятельности[70].
Результаты операции[71][72]:
- Увеличивается период эффективного контроля над симптомами болезни.
- Значительно снижается необходимость в антипаркинсонических лекарствах.
- Позволяет неинвазивно корректировать настройки стимуляции при прогрессировании заболевания.
- В отличие от палидотомии и таламотомии, является обратимой.
- Может быть билатеральной (то есть эффективна и при симптомах с обеих сторон тела).
- Легко переносится и является безопасным методом
Недостатки нейростимуляции:
- Относительно высокая стоимость.
- Вероятность смещения электродов или поломки; в этих случаях (15 %) нужна повторная операция
- Необходимость замены генератора (через 3-7 лет)
- Некоторый риск инфекционных осложнений (3-5 %)
Лечение с применением стволовых клеток. Генная терапия[править | править код]
Результаты первых испытаний по применению стволовых клеток при болезни Паркинсона были опубликованы в 2009 году. Согласно полученным данным, через 36 месяцев после введения стволовых клеток положительный эффект отмечен у 80 % больных[73]. Лечение заключается в трансплантации нейронов, полученных в результате дифференцировки стволовых клеток, в головной мозг. Теоретически они должны заменить погибшие дофаминсекретирующие клетки[74]. Метод на вторую половину 2011 года исследован недостаточно и не имеет широкого клинического применения[75][76].
Новый метод лечения, направленный на остановку болезни Паркинсона — пересадка пациенту собственных стволовых клеток (перепрограммированных его клеток кожи), дифференцированных в предшественники дофаминергических нейронов. В США с 2017 года первый пациент начал получать такую терапию (бывший врач Джордж Лопес, финансирующий эти исследования). В результате лечения на 2020 год нейродегенерация в его мозге приостановилась, а работоспособность улучшилась, субъективно улучшилось качество жизни. Пока что такая терапия остаётся единичной, из-за этических вопросов каждый раз необходимо получать разрешение регулирующего органа (FDA)[77][78].
В 2003 году впервые человеку с болезнью Паркинсона в субталамическое ядро были введены генетические векторы, содержащие ген, ответственный за синтез глутаматдекарбоксилазы. Данный фермент снижает активность субталамического ядра. Вследствие этого он оказывает положительное терапевтическое воздействие. Несмотря на полученные хорошие результаты лечения, на первую половину 2011 года методика практически не применяется и находится в стадии клинических исследований[79][80][81].
Перспективы растворения телец Леви[править | править код]
Многими исследователями считается, что тельца Леви являются не просто маркером болезни Паркинсона, но и одним из патогенетических звеньев, то есть усугубляют симптомы.[82]
В исследованиях Assia Shisheva 2015 года показано, что агрегацию α-синуклеина с образованием телец Леви предотвращает комплекс белков ArPIKfyve и Sac3.[83], который даже может способствовать расплавлению этих патологических включений. На основе указанного механизма появляется перспектива создания лекарства, способного растворять тельца Леви и лечить ассоциированные с ними деменции.
Исследования на животных[править | править код]
Для изучения этиологии и патогенеза болезни Паркинсона, а также для разработки новых методов лечения широко используются «модели» данной болезни, вызываемой у животных. В качестве модельных животных обычно используются генетически модифицированные линии мышей [1][84] и обезьяны — макаки-резусы [2][85] и мармозетки[86].
У обезьян симптомы болезни обычно вызывают с помощью 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (MPTP) или 6-гидроксидопамина (6-OHDA). Были также получены трансгенные обезьяны с избирательной сверхэкспресией в мозге α-синуклеина, что вызывало развитие симптомов болезни Паркинсона.
В 2020 году проведено успешное устранение симптомов болезни Паркинсона у модельных мышей путём блокировки синтеза полипиримидин-связывающего белка (PTB1) в астроцитах, в результате чего делящиеся астроциты были перепрограммированы в нейроны. Сможет ли такое репрограммирование остановить развитие болезни Паркинсона у людей, неизвестно[87]. Есть также данные о том, что устранить симптомы болезни Паркинсона у модельных мышей позволяет лечение фарнезолом[88].
Клинические испытания[править | править код]
С 2011 года проводится серия клинических испытаний вакцины PD01. Предполагается, что PD01 блокирует выработку α-синуклеина за счёт выработки специфичных антител. У всех добровольцев первой группы получавших препарат, удалось добиться стабилизации состояния. У 50 % испытуемых обнаружены антитела к α-синуклеину. Клинические испытания должны закончиться в 2016—2017 годах.[89]
Кетогенная диета обладает потенциальным терапевтическим эффектом благодаря своим нейрозащитным и противовоспалительным свойствам[90]. В пилотном исследовании 2019 года значительные когнитивные улучшения у пациентов были обнаружены уже после 8 недель на диете.[91]
В январе 2019 года пресс-служба университета Мельбурна сообщила о результатах испытания препарата для лечения болезни Паркинсона, БАС и старческой деменции, разработка которого велась на протяжении 15 лет. Сообщается, что у 70 % пациентов, прошедших экспериментальное лечение препаратом CuATSM, отмечалось стойкое и существенное замедление развития заболевания двигательных нейронов и улучшение когнитивных и клинических симптомов. Второй этап клинических испытаний назначен на 2019 год[92][93].
В феврале 2019 года был опубликован отчёт[94] о завершившихся клинических испытаниях проводившихся при участии Бристольского университета в Великобритании[95]. 41 доброволец принимал участие в двойном слепом рандомизированном плацебо-контролируемом исследовании 2-й фазы. Испытуемым вводили препарат нейротрофина — глия-производного нейротрофического фактора[en] (GDNF) — под напором непосредственно в обе половины стриатума головного мозга с помощью четырёх ультратонких катетеров. Эксперимент проводился в течение 18 месяцев. В первые 9 месяцев испытуемые случайным образом были разделены на две группы: одна группа получала инъекции GDNF, а вторая — плацебо. Во второй части эксперимента все испытуемые получали препарат. Несмотря на то, что состояние большинства участников улучшилось, в ходе первой части эксперимента не удалось достичь у первой группы требуемого 20 % порога улучшения по сравнению с группой получавшей плацебо (по неизвестной причине в случае болезни Паркинсона применение плацебо даёт существенный положительный эффект[96]). Тем не менее, результаты МРТ продемонстрировали заметное восстановление количества нейронов в указанной области головного мозга испытуемых. Таким образом, отмечали авторы эксперимента, улучшение «выходит далеко за пределы всего когда-либо виденного в ходе исследований, посвящённых лечению болезни Паркинсона с помощью факторов роста, доставляемых хирургическим путём». Дальнейшие исследования показали, что увеличенные дозы препарата, а также увеличенное время наблюдения могут дать более чёткие результаты в зависимости от стадии болезни пациентов.[97][98][99][100]
Прогноз[править | править код]

Годы жизни, скорректированные по нетрудоспособности при болезни Паркинсона на 100 тысяч населения в 2004 году
нет данных ≤ 5 5–12,5 12,5–20 20–27,5 27,5–35 35–42,5 42,5–50 50–57,5 57,5–65 65–72,5 72,5–80 ≥ 80
Прогноз условно неблагоприятный — болезнь Паркинсона неуклонно прогрессирует. Симптомы нарушения движений развиваются наиболее быстро. Больные, не получающие лечения, в среднем теряют возможность обслуживать себя самостоятельно через 8 лет от начала заболевания, а через 10 лет становятся прикованными к постели[101]. На вторую половину 2011 года подавляющее большинство пациентов получает соответствующее лечение. Прогноз в данной группе лучше, по сравнению с больными, не получающими адекватной терапии. Лица, принимающие леводопу, становятся зависимыми от обслуживающих их лиц в среднем через 15 лет[101]. Тем не менее, в каждом конкретном случае скорость прогрессирования заболевания различна[101]. Отмечено, что при относительно раннем развитии болезни Паркинсона быстрее всего прогрессируют симптомы нарушения двигательной активности, а при появлении первых симптомов заболевания у лиц 70 лет и старше на первый план выходят психические расстройства[102].
Адекватная терапия замедляет развитие ряда симптомов, ведущих к потере трудоспособности больных (мышечной ригидности, гипокинезии, постуральной неустойчивости и др.). Однако через 10 лет с момента начала заболевания трудоспособность большинства больных значительно снижена[30][102][101].
Продолжительность жизни больных снижена[101]. Трудоспособность у данных больных стойко и необратимо утрачивается, в зависимости от выраженности неврологических нарушений больным назначается группа инвалидности.
Известные люди, ставшие жертвами болезни Паркинсона[править | править код]
Болезнь поражает людей самых разнообразных социальных групп и профессий. Развиваясь постепенно, она приводит к снижению трудоспособности больного человека.
Данное заболевание было диагностировано у некоторых знаменитых политиков, государственных и церковных деятелей. Диагноз болезни Паркинсона был поставлен папе римскому Иоанну Павлу II в 1993 году[103]. Официально Ватиканом болезнь понтифика признана в 2003[104]. Таким образом Иоанн Павел II последние 12 лет жизни страдал от симптомов и проявлений паркинсонизма. В последние годы жизни китайский государственный деятель Мао Цзэдун отошёл от политической деятельности в связи с развившимся у него недугом[105][106]. У палестинского лидера Ясира Арафата болезнь Паркинсона официально признана не была. Однако наличие у него выраженного тремора в последние годы жизни дало основание предполагать данное заболевание[107][108]. Болезнь Паркинсона диктатора Франсиско Франко в значительной степени повлияла на историю Испании. По воспоминаниям короля Хуана Карлоса «Франко был человеком, созданным чтобы прожить 100 лет. Не курил, не пил и не был большим гурманом. Вёл совершенно размеренную жизнь и проводил много времени на воздухе, охотясь или ловя рыбу с борта „Асор“». Болезнь стала для него большой неожиданностью. Франко дал поручение подготовить декрет о передаче власти и в 1973 году ушёл с поста председателя правительства[109].

Папа римский Иоанн Павел II, 2004 год. Болезнь понтифика официально подтверждена Ватиканом в 2003 году[104]. На фотографии видны характерные для болезни Паркинсона симптомы — «поза манекена», амимия
Среди представителей искусства и научного мира болезнь Паркинсона была диагностирована у Сальвадора Дали, знаменитого итальянского и советского физика Бруно Понтекорво[110], математика Андрея Колмогорова[111], британского писателя Артура Кёстлера, советского и российского поэта Андрея Вознесенского, британских рок-музыкантов Гленна Типтона и Оззи Осборна[112], R&B музыканта, создателя группы Earth, Wind & Fire Мориса Уайта. Испанскому живописцу и скульптору Сальвадору Дали диагноз был поставлен за 8 лет до смерти, в 1981 году[113]. У британского писателя Артура Кёстлера симптомы болезни появились в 1976 году. Несмотря на то, что сильный тремор в руках мешал ему писать[114][115], он ещё создал несколько произведений. Поэт-шестидесятник Андрей Вознесенский после 15 лет заболевания умер от его осложнений[116]. В возрасте 101 год умер от осложнений болезни Паркинсона Жак Фреско[117][118], американский производственный инженер, промышленный дизайнер и футуролог.
Заболеванию также подвержены спортсмены. Развитие болезни Паркинсона приводит к их уходу из профессионального спорта. В неполные 40 лет у американского боксёра Мохаммеда Али диагностировали болезнь Паркинсона. Многократный чемпион был вынужден завершить свою спортивную карьеру[119][120]. Боролся с болезнью 35 лет, в возрасте 74 лет умер. К другим знаменитым спортсменам-паркинсоникам можно отнести американского автогонщика Фила Хилла[121] и баскетболиста Брайана Гранта[122].
Среди знаменитых киноактёров болезнь Паркинсона была диагностирована у Майкла Джей Фокса, Деборы Керр[123], Винсента Прайса[124][125] и Робина Уильямса[126]. Советский и российский актёр Михаил Ульянов страдал заболеванием последние 15 лет жизни[127]. У американо-канадского актёра Майкла Джей Фокса болезнь была диагностирована в 1991 году. Ему на тот момент было всего 30 лет. Впоследствии он создал общественную организацию «Фонд Майкла Джей Фокса[en]» по исследованию болезни Паркинсона, которая помогает паркинсоникам и спонсирует исследования по изучению проблемы[128]. Самому Фоксу была проведена таламотомия[129][130][131].
В 2016 году болезнь Паркинсона была выявлена у знаменитого российского модельера Вячеслава Зайцева[132].
Высказывалось предположение, что болезнью Паркинсона страдает президент Российской Федерации Владимир Путин[133][134].
См. также[править | править код]
- Нейролептический паркинсонизм
Примечания[править | править код]
- ↑ 1 2 Disease Ontology (англ.) — 2016.
- ↑ 1 2 Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ 1 2 Samii A., Nutt J. G., Ransom B. R. Parkinson’s disease (англ.) // The Lancet. — Elsevier, 2004. — Vol. 363. — P. 1783—1793. — PMID 15172778.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Яхно Н. Н., Штульман Д. Р. Болезни нервной системы. — М.: Медицина, 2001. — Т. 2. — С. 76—95. — 744 с. — ISBN 5-225-04540-5.
- ↑ Atsushi Nambu. Seven problems on the basal ganglia (англ.) // Current Opinion in Neurobiology. — 2008-12. — Vol. 18, iss. 6. — P. 595–604. — doi:10.1016/j.conb.2008.11.001. Архивировано 27 января 2021 года.
- ↑ 1 2 Symptomatic pharmacological therapy in Parkinson’s disease // Parkinson’s Disease (англ.) / The National Collaborating Centre for Chronic Conditions. — London: Royal College of Physicians, 2006. — P. 59—100. — ISBN 1-86016-283-5. Архивная копия от 24 сентября 2010 на Wayback Machine
- ↑ 1 2 3 4 5 6 7 8 Lees A. J. Unresolved issues relating to the shaking palsy on the celebration of James Parkinson’s 250th birthday (англ.) // Mov Disord. — 2007. — Vol. 22, no. Suppl 17. — P. S327—334. — PMID 18175393.
- ↑ 1 2 3 4 5 García Ruiz PJ. [Prehistory of Parkinson’s disease] (исп.) // Neurologia. — 2004. — V. 19. — P. 735—737. — PMID 15568171.
- ↑ 1 2 3 Lanska D. J. Chapter 33: the history of movement disorders (англ.) // Handb Clin Neurol. — 2010. — Vol. 95. — P. 501—546. — PMID 19892136.
- ↑ Koehler P. J., Keyser A. Tremor in Latin texts of Dutch physicians: 16th-18th centuries (англ.) // Mov Disord. — 1997. — Vol. 12. — P. 798—806. — PMID 9380070.
- ↑ Currier R. D. Did John Hunter give James Parkinson an idea? (англ.) // Arch Neurol. — 1996. — Vol. 53. — P. 377—378. — PMID 8929162.
- ↑ 1 2 Louis ED. The shaking palsy, the first forty-five years: a journey through the British literature (англ.) // Mov Disord. — 1997. — Vol. 12. — P. 1068—1072. — PMID 9399240.
- ↑ Lees A. J., Selikhova M., Andrade L. A., Duyckaerts C. The black stuff and Konstantin Nikolaevich Tretiakoff (англ.) // Mov Disord. — 2008. — Vol. 23. — P. 777—783. — PMID 18383531.
- ↑ Parent M., Parent A. Substantia nigra and Parkinson’s disease: a brief history of their long and intimate relationship (англ.) // Can J Neurol Sci. — 2010. — Vol. 37. — P. 313—319. — PMID 20481265.
- ↑ 1 2 Fahn S. The history of dopamine and levodopa in the treatment of Parkinson’s disease (англ.) // Mov Disord. — 2008. — Vol. 23, no. Suppl 3. — P. S497—508. — PMID 18781671.
- ↑ Schulz-Schaeffer WJ. The synaptic pathology of alpha-synuclein aggregation in dementia with Lewy bodies, Parkinson’s disease and Parkinson’s disease dementia (англ.) // Acta Neuropathol. — 2010. — Vol. 23. — P. 131—143. — PMID 20563819.
- ↑ Hornykiewicz O. L-DOPA: from a biologically inactive amino acid to a successful therapeutic agent (англ.) // Amino Acids. — 2002. — Vol. 23. — P. 65—70. — PMID 12373520.
- ↑ Coffey R. J. Deep brain stimulation devices: a brief technical history and review (англ.) // Artif Organs. — 2009. — Vol. 33. — P. 208—220. — PMID 18684199.
- ↑ 1 2 3 de Lau L. M., Breteler M. M. Epidemiology of Parkinson’s disease (англ.) // The Lancet. — Elsevier, 2006. — Vol. 5. — P. 525—535. — PMID 16713924.
- ↑ 1 2 [www.nbuv.gov.ua/portal/chem_biol/umch/2001_2/pdf/944_rus.pdf Паркопан — антихолинергический препарат для лечения экстрапирамидных двигательных нарушений] // Український медичний часопис. — 2001. — Т. 2, № 22. — С. 49—52.
- ↑ 1 2 3 Гусев Е. И., Коновалов А. Н. и др. Неврология. Национальное руководство. — М.: ГЭОТАР-Медиа, 2009. — 2116 с. — ISBN 978-5-9704-0665-6. Архивная копия от 6 декабря 2010 на Wayback Machine
- ↑ 1 2 3 4 Robert A. Hauser. Parkinson’s disease Patophysiology (англ.). Medscape (20 июня 2011). Дата обращения: 5 июля 2011. Архивировано 24 августа 2011 года.
- ↑ «Ф.Хоффманн-Ля Рош Лтд.» (Базель, Швейцария). «Morbus Parkinson и её лечение», Москва, 2000.
- ↑ Tysnes O.B., Vilming ST. Atypical parkinsonism. — PMID 18846125.
- ↑ 1 2 3 de Lau L. M., Breteler M. M. Epidemiology of Parkinson’s disease (англ.) // The Lancet. — Elsevier, 2006. — June (vol. 5, no. 6). — P. 525—535. — doi:10.1016/S1474-4422(06)70471-9. — PMID 16713924.
- ↑ Tanner C. M., Kamel F., Ross G. W. et al. Rotenone, Paraquat and Parkinson’s Disease. — Environ. Health Perspect, 2011. — Январь. — doi:10.1289/ehp.1002839. — PMID 21269927.
- ↑ 1 2 Neurologic disorders // Veterans and Agent Orange: Update 2008 (нид.) / IOM (Institute of Medicine). — Washington D.C.: The National Academies press, 2009. — С. 510—545. — ISBN 0-309-13884-1. Архивная копия от 28 сентября 2011 на Wayback Machine
- ↑ Castagnoli K., Murugesan T. Tobacco leaf, smoke and smoking, MAO inhibitors, Parkinson’s disease and neuroprotection; are there links? (англ.) : journal. — Neurotoxicology, 2004. — January (vol. 25, no. 1—2). — P. 279—291. — doi:10.1016/S0161-813X(03)00107-4. — PMID 14697903.
- ↑ Costa J., Lunet N., Santos C., Santos J., Vaz-Carneiro A. Caffeine exposure and the risk of Parkinson’s disease: a systematic review and meta-analysis of observational studies (англ.) // Journal of Alzheimer’s Disease (англ.) (рус. : journal. — 2010. — Vol. Suppl 1. — P. S221—38. — doi:10.3233/JAD-2010-091525. — PMID 20182023.
- ↑ 1 2 Obeso J. A., Rodríguez-Oroz M. C., Benitez-Temino B., Blesa F. J., Guridi J., Marin C., Rodriguez M. Functional organization of the basal ganglia: therapeutic implications for Parkinson’s disease // Mov. Disord. — 2008. — Т. 23, № Suppl 3. — С. S548—59. — PMID 18781672.
- ↑ 1 2 Davie C. A. A review of Parkinson’s disease // Br Med Bull. — 2008. — Т. 86. — С. 109—127. — PMID 18398010.
- ↑ 1 2 Tolosa E., Jankovic JJ. Parkinson’s disease and movement disorders // Neuropathology of movement disorders / Dickson D. V.. — Lippincott Williams & Wilkins. — 2007. — С. 271—283. — ISBN 0-7817-7881-6.
- ↑ Артемьев Д. В., Голубев В. Л., Яхно Н. Н. Болезнь Паркинсона // Нервные болезни / Под редакцией Н. Н. Яхно, Д. Р. Штульмана. — М.:: Медицина, 2003. — Т. 2. — С. 76—96. — 512 с. — 5000 экз. — ISBN 5-225-04663-0.
- ↑ 1 2 3 Пулатов А. М., Никифоров А. С. Бледный шар и полосатое тело как основные отделы экстрапирамидной системы. Их строение, связи и функция // Пропедевтика нервных болезней. — 2-е изд. — Ташкент: Медицина, 1979. — С. 97—100. — 368 с. — 20 000 экз.
- ↑ 1 2 Дубенко Є. Г. укр. Екстрапірамідна система (Экстрапирамидная система) // укр. Нервові хвороби (Нервные болезни) / Под редакцией С. М. Виничука, Е. Г. Дубенко. — К.:: Здоров’я, 2001. — С. 61—65. — 696 с. — 3000 экз. — ISBN 5-311-01224-2.
- ↑ 1 2 3 Jankovic J. Parkinson’s disease: clinical features and diagnosis (англ.) // Journal of Neurology, Neurosurgery and Psychiatry (англ.) (рус. : journal. — 2008. — April (vol. 79, no. 4). — P. 368—376. — doi:10.1136/jnnp.2007.131045. — PMID 18344392. Архивировано 19 августа 2015 года.
- ↑ Cooper G., Eichhorn G., Rodnitzky R. L. Parkinson’s disease // Neuroscience in medicine / Conn P. M.. — Totowa, NJ: Humana Press (англ.) (рус., 2008. — С. 508—512. — ISBN 978-1-60327-454-8.
- ↑ 1 2 3 4 5 6 7 8 Дубенко Є. Г. укр. Розділ 23. Хвороба Паркінсона Раздел 23. (Болезнь Паркинсона) // укр. Нервові хвороби (Нервные болезни) / Под редакцией С. М. Виничука, Е. Г. Дубенко. — К.:: Здоров’я, 2001. — С. 465—469. — 696 с. — 3000 экз. — ISBN 5-311-01224-2.
- ↑ 1 2 3 4 5 6 7 8 9 10 Пулатов А. М., Никифоров А. С. Клинические проявления поражения стриопаллидарной системы // Пропедевтика нервных болезней. — 2-е изд. — Ташкент: Медицина, 1979. — С. 100—105. — 368 с. — 20 000 экз.
- ↑ 1 2 3 4 5 6 Триумфов А. В. Паркинсонизм // Топическая диагностика заболеваний нервной системы. — М.:: ООО “МЕДпресс”, 1998. — С. 194—195. — 304 с. — 5000 экз. — ISBN 5-900990-04-4.
- ↑ Доброхотова Т. А., Засорина М. А. Паркинсонизм // Нейропсихиатрия / Доброхотова Т. А.. — М.:: Издательство БИНОМ, 2006. — С. 223—226. — 304 с. — 2000 экз. — ISBN 5-9518-0151-6.
- ↑ Гусев Е. И., Коновалов А. Н., Бурд Г. С. Болезнь Паркинсона // Неврология и нейрохирургия. — М.:: Медицина, 2000. — С. 586—591. — 656 с. — 20 000 экз. — ISBN 5-225-00969-7.
- ↑ Биохимики нашли новый биомаркер болезни Паркинсона. gazeta.ru. — новость. Дата обращения: 28 мая 2022. Архивировано 31 мая 2022 года.
- ↑ Guidelines Архивная копия от 3 декабря 2013 на Wayback Machine
- ↑ Hughes A. J. et al. UK Parkinson’s Disease Society Brain Bank Clinical Diagnostic Criteria // J Neurol Neurosurg Psychiatry. — 1992. — Т. 55. — С. 181—184. Архивировано 13 сентября 2011 года.
- ↑ [parkinsons.about.com/od/glossary/g/Hoehn_and_yahr.htm Hoehn and Yahr Stages] (англ.). сайт parkinsons.about.com. Дата обращения: 12 сентября 2011. Архивировано 22 января 2012 года.
- ↑ Progression of Parkinson`s disease (англ.). сайт parkinsons.bsd.uchicago.edu. Дата обращения: 12 сентября 2011. Архивировано 22 января 2012 года.
- ↑ Hoehn M. M., Yahr M. D. Parkinsonism: onset, progression and mortality (англ.) // Neurology (англ.) (рус.. — Wolters Kluwer (англ.) (рус., 1967. — Vol. 17. — P. 427—442. — PMID 6067254.
- ↑ Goetz CG, Poewe W, Rascol O, Sampaio C, Stebbins GT, Counsell C, Giladi N, Holloway RG, Moore CG, Wenning GK, Yahr MD, Seidl L. Movement Disorder Society Task Force report on the Hoehn and Yahr staging scale: status and recommendations // Mov Disord. — 2004. — Т. 19. — С. 1020—1028. — PMID 15372591.
- ↑ 1 2 3 4 5 Машковский М. Д. Противопаркинсонические дофаминергические препараты // Лекарственные средства. — 14-е изд., перераб., испр. и доп. — М.:: ООО “Издательство Новая Волна”, 2002. — Т. 1. — С. 140—144. — 540 с. — ISBN 5-7864-0128-6.
- ↑ Rowland, Lewis P. Rowland, Timothy A. Pedley. Merritt’s Neurology. — Lippincott Williams & Wilkins, 2009. — 1216 с. — ISBN 9780781791861.
- ↑ 1 2 Михайлов Н. Б. 16.5.2 Средства, стимулирующие дофаминовые рецепторы на нейронах стриарной системы // Настольная книга врача по клинической фармакологии. — Руководство для врачей. — СПб.:: Фолиант, 2001. — С. 470—471. — 736 с. — 3000 экз. — ISBN 5-93929-025-6.
- ↑ Stowe R.L., Ives N.J., Clarke C., van Hilten J., Ferreira J., Hawker R.J., Shah L., Wheatley K., Gray R. Dopamine agonist therapy in early Parkinson’s disease (англ.) : journal. — PMID 18425954.
- ↑ Михайлов Н. Б. 16.5.3 Ингибиторы ферментов (МАО-Б и КОМТ), разрушающих эндогенный дофамин и дофаминомиметики // Настольная книга врача по клинической фармакологии. — Руководство для врачей. — СПб.:: “Фолиант”, 2001. — С. 471—472. — 736 с. — 3000 экз. — ISBN 5-93929-025-6.
- ↑ 1 2 3 4 5 Машковский М. Д. Противопаркинсонические антихолинергические препараты // Лекарственные средства. — 14-е изд., перераб., испр. и доп. — М.:: ООО “Издательство Новая Волна”, 2002. — Т. 1. — С. 137—140. — 540 с. — ISBN 5-7864-0128-6.
- ↑ Hua S. E., Garonzik I. M., Lee J.-I., Lenz F. A. Chapter 170 Thalamotomy for Tremor. (Tremor of Parkinson’s Disease) // Youmans Neurological Surgery / H. R. Winn. — 5th. — Philadelphia: SAUNDERS, 2004. — P. 2774—2776. — ISBN 0-7216-8291-x.
- ↑ 1 2 3 Jankovic J., Cardoso F., Grossman R. G., Hamilton W. J. Outcome after stereotactic thalamotomy for parkinsonian, essential, and other types of tremor // Neurosurgery. — 1995. — Т. 37. — С. 680—686. — PMID 8559296.
- ↑ Hallett M., Litvan I. Evaluation of surgery for Parkinson’s disease: a report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. The Task Force on Surgery for Parkinson’s Disease (англ.) // Neurology (англ.) (рус.. — Wolters Kluwer (англ.) (рус., 1999. — Vol. 53. — P. 1910—1921. — PMID 10599758.
- ↑ Zirh TA, Lenz FA, Reich SG, Dougherty PM. Patterns of bursting occurring in thalamic cells during parkinsonian tremor (англ.) // Neuroscience (англ.) (рус.. — Elsevier, 1998. — Vol. 83. — P. 107—121. — PMID 9466402.
- ↑ Lenz F. A., Vitek J. L., DeLong M. R. Role of the thalamus in parkinsonian tremor: evidence from studies in patients and primate models // Stereotact Funct Neurosurg. — 1993. — Т. 60. — С. 94—103. — PMID 8511438.
- ↑ 1 2 Fox M. W., Ahlskog J. E., Kelly P. J. Stereotactic ventrolateralis thalamotomy for medically refractory tremor in post-levodopa era Parkinson’s disease patients // J Neurosurg. — 1991. — Т. 75. — С. 723—730. — PMID 1919694.
- ↑ Lozano A. M., Alkhani A. Chapter 171. Pallidotomy for Parkinson`s Disease // Youmans Neurological Surgery / H. R. Winn. — 5th. — Philadelphia: SAUNDERS, 2004. — P. 2785—2801. — ISBN 0-7216-8291-x.
- ↑ Lang A. E., Lozano A. M., Montgomery E., Duff J., Tasker R., Hutchinson W. Posteroventral medial pallidotomy in advanced Parkinson’s disease // N Engl J Med. — 1997. — Т. 337. — С. 1036—1042. — PMID 9321531.
- ↑ Hirai T., Ryu H., Nagaseki Y., Gaur M. S., Fujii M., Takizawa T. Image-guided electrophysiologically controlled posteroventral pallidotomy for the treatment of Parkinson’s disease: a 28-case analysis // Adv Neurol. — 1999. — Т. 80. — С. 585—591. — PMID 10410775.
- ↑ Friedman D. P., Goldman H. W., Flanders A. E., Gollomp S. M., Curran W. J. Jr. Stereotactic radiosurgical pallidotomy and thalamotomy with the gamma knife: MR imaging findings with clinical correlation–preliminary experience // Radiology. — 1999. — Т. 212. — С. 143—150. — PMID 10405733.
- ↑ Young R. F., Vermeulen S., Posewitz A., Shumway-Cook A. Pallidotomy with the gamma knife: a positive experience // Stereotact Funct Neurosurg. — 1998. — Т. 70. — С. Suppl 1:218—228. — PMID 9782254.
- ↑ Young R. F. Gamma knife radiosurgery as an alternative form of therapy for movement disorders // Arch Neurol. — 2002. — Т. 59. — С. 1660—1662. — PMID 12374507.
- ↑ Young R. F., Shumway-Cook A., Vermeulen S. S., Grimm P., Blasko J., Posewitz A., Burkhart W. A., Goiney R. C. Gamma knife radiosurgery as a lesioning technique in movement disorder surgery // J Neurosurg. — 1998. — Т. 89. — С. 182—193. — PMID 9688111.
- ↑ Шабалов В. А., Томский А. А. Паркинсонизм. www.gofn.ru. Дата обращения: 20 июля 2011. Архивировано 24 августа 2011 года.
- ↑ 1 2 Raoul S., N’Guyen J.-P. Surgery for Parkinson’s disease // Essential Practice of Neurosurgery / Editor in Chief Kazadi Kalangu; Deputy editors Yoko Kato&Gilbert Dechambenoit. — Nagoya, Japan: Yamagiku Printing Co., Ltd., 2009. — P. 1077—1084. — 1496 p. — ISBN 978-4-904992-01-2.
- ↑ About Medtronic Deep Brain Stimulation Therapy (англ.). www.medtronicdbs.com. Дата обращения: 10 июля 2011. Архивировано 24 августа 2011 года.
- ↑ F. J. G. Vingerhoets, MD, J.-G. Villemure, MD FRCSC, P. Temperli, MD, C. Pollo, MD, E. Pralong, MD PhD and J. Ghika, MD. Subthalamic DBS replaces levodopa in Parkinson’s disease. Two-year follow-up (англ.) // Neurology (англ.) (рус.. — Wolters Kluwer (англ.) (рус., 2002. — Vol. 58. — P. 396—401.
- ↑ Steven Ertelt. Adult Stem Cell Research Reverses Effects of Parkinson’s Disease in Human Trial (англ.). LifeNews.com (2009—2002). Дата обращения: 21 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Stem Cell Research Aims to Tackle Parkinson’s Disease (англ.). ScienceDaily (2008—2001). Дата обращения: 21 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Breakthrough produces Parkinson’s patient-specific stem cells free of harmful reprogramming genes (англ.) (3 мая 2008). Дата обращения: 21 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Borthwick L. Stem cells improve Parkinson’s disease symptoms (англ.). www.nature.com. Дата обращения: 10 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Лосева П. Инъекция стволовых клеток в мозг затормозила болезнь Паркинсона : [арх. 4 июля 2020] / Полина Лосева // N+1. — 2020. — 14 мая.
- ↑ Schweitzer, Jeffrey S. Personalized iPSC-Derived Dopamine Progenitor Cells for Parkinson’s Disease : [англ.] / Jeffrey S. Schweitzer, Bin Song, Todd M. Herrington … [] // The New englang Journal of Medicine. — 2020. — Vol. 382. — P. 1926–1932. — doi:10.1056/NEJMoa1915872. — PMID 32402162. — PMC 7288982.
- ↑ Einat Rotman. Gene Therapy Improves Parkinson’s Symptoms (англ.). The Future of Things (28 января 2008). Дата обращения: 27 августа 2011. Архивировано 22 января 2012 года.
- ↑ 55-летний Натан Кляйн (Nathan Klein) — первый в мире пациент, прооперированный по методу генной терапии от болезни Паркинсона (недоступная ссылка — история). www.fotobank.com. Дата обращения: 27 августа 2011. Архивировано 22 января 2012 года.
- ↑ Gene therapy offers hope for easing Parkinson’s (англ.). MSN. Дата обращения: 27 августа 2011. Архивировано 22 января 2012 года.
- ↑ Catharine Paddock PhD. Mechanism that ‘melts’ protein clumps may lead to new Parkinson’s treatments (англ.) (19 октября 2015). Дата обращения: 11 декабря 2015. Архивировано 22 декабря 2015 года.
- ↑ Ikonomov O. C. et al. The Protein Complex of Neurodegeneration-related Phosphoinositide Phosphatase Sac3 and ArPIKfyve Binds the Lewy Body-associated Synphilin-1, Preventing Its Aggregation //Journal of Biological Chemistry. — 2015. — Т. 290. — №. 47. — С. 28515-28529.
- ↑ Ted M. Dawsonsend, Han Seok Ko, Valina L. Dawson. Genetic Animal Models of Parkinson’s Disease. Neuron, Volume 66, Issue 5, 646—661, 10 June 2010
- ↑ Jeffrey H. Kordower, Marina E. Emborg, Jocelyne Bloch, Shuang Y. Ma, Yaping Chu, Liza Leventhal,1 Jodi McBride,1 Er-Yun Chen,1 Stéphane Palfi,1 Ben Zion Roitberg,1 W. Douglas Brown, James E. Holden, Robert Pyzalski, Michael D. Taylor, Paul Carvey, ZaoDung Ling, Didier Trono, Philippe Hantraye, Nicole Déglon, and Patrick Aebischer. Neurodegeneration Prevented by Lentiviral Vector Delivery of GDNF in Primate Models of Parkinson’s Disease. Science, Vol. 290, pp. 767—773 (October 27, 2000).
- ↑ Eslamboli A. Marmoset monkey models of Parkinson’s disease: which model, when and why? Brain Res Bull. 2005 Dec 30;68(3):140-9. Epub 2005 Sep 7.
- ↑ Лосева П. Репрограммирование клеток в мозге живой мыши сняло симптомы болезни Паркинсона : [арх. 3 июля 2020] / Полина Лосева // N+1. — 2020. — 25 июня.
- ↑ Parkinson’s Disease Reversed by Farnesol in Mice Архивная копия от 20 августа 2021 на Wayback Machine. Genetic Engineering & Biotechnology News (GEN)
- ↑ Разработка вакцины против болезни Паркинсона выглядит многообещающе (6 августа 2014). Архивировано 25 сентября 2015 года. Дата обращения: 24 сентября 2015.
- ↑ Charlotte Veyrat-Durebex, Pascal Reynier, Vincent Procaccio, Rudolf Hergesheimer, Philippe Corcia. How Can a Ketogenic Diet Improve Motor Function? (англ.) // Frontiers in Molecular Neuroscience. — 2018. — Vol. 11. — ISSN 1662-5099. — doi:10.3389/fnmol.2018.00015. Архивировано 9 мая 2018 года.
- ↑ Robert Krikorian, Marcelle D. Shidler, Suzanne S. Summer, Patrick G. Sullivan, Andrew P. Duker. Nutritional ketosis for mild cognitive impairment in Parkinson’s disease: A controlled pilot trial // Clinical Parkinsonism & Related Disorders. — 2019-08-06. — ISSN 2590-1125. — doi:10.1016/j.prdoa.2019.07.006. Архивировано 1 декабря 2020 года.
- ↑ Австралийские ученые создали препарат для лечения болезни Паркинсона. ТАСС. Дата обращения: 15 января 2019. Архивировано 15 января 2019 года.
- ↑ SCIMEX. Patient trial shows impressive clinical results for motor neurone disease (англ.). Scimex (10 января 2019). Дата обращения: 15 января 2019. Архивировано 15 января 2019 года.
- ↑ Alan Whone Matthias Luz Mihaela Boca Max Woolley Lucy Mooney Sonali Dharia Jack Broadfoot David Cronin Christian Schroers Neil U Barua Lara Longpre C Lynn Barclay Chris Boiko Greg A Johnson H Christian Fibiger Rob Harrison Owen Lewis Gemma Pritchard Mike Howell Charlie Irving David Johnson Suk Kinch Christopher Marshall Andrew D Lawrence Stephan Blinder Vesna Sossi A Jon Stoessl Paul Skinner Erich Mohr Steven S Gill. Randomized trial of intermittent intraputamenal glial cell line-derived neurotrophic factor in Parkinson’s disease. Brain. Oxford University Press (26 февраля 2019). Дата обращения: 27 марта 2019. Архивировано 27 марта 2019 года.
- ↑ Pioneering trial offers hope for restoring brain cells damaged in Parkinson’s. University of Bristol (27 февраля 2019). Дата обращения: 27 марта 2019. Архивировано 27 марта 2019 года.
- ↑ Brian Vastag Biotechnology: Crossing the barrier. Nature. Springer Nature (18 августа 2010). Дата обращения: 27 марта 2019. Архивировано 27 марта 2019 года.
- ↑ New Treatment Offers Potentially Promising Results for the Possibility of Slowing, Stopping, or Even Reversing Parkinson’s Disease. Journal of Parkinson’s Disease (27 февраля 2019). Дата обращения: 27 марта 2019. Архивировано 27 марта 2019 года.
- ↑ В Великобритании испытали внутричерепные импланты для лечения болезни Паркинсона. ТАСС (27 февраля 2019). Дата обращения: 27 марта 2019. Архивировано 27 марта 2019 года.
- ↑ Антон Цыбко. Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля? Биомолекула (21 ноября 2018). Дата обращения: 27 марта 2019. Архивировано 27 марта 2019 года.
- ↑ The Parkinson’s Drug Trial: A Miracle Cure?. BBC. (2019). Архивная копия от 27 марта 2019 на Wayback Machine
- ↑ 1 2 3 4 5 Poewe W. The natural history of Parkinson’s disease // J Neurol. — 2006. — Т. 253. — С. 7:VII2—6. — PMID 17131223.
- ↑ 1 2 Obeso J. A., Rodriguez-Oroz M. C., Goetz C. G., Marin C., Kordower J. H., Rodriguez M., Hirsch E. C., Farrer M., Schapira A. H., Halliday G. Missing pieces in the Parkinson’s disease puzzle // Nat Med. — 2010. — Т. 16. — С. 653—661. — PMID 20495568.
- ↑ [parkinsons.about.com/od/livingwithpd/p/Pope_John_Paul_II.htm Pope John Paul II and Parkinson’s Disease] (англ.). parkinsons.about.com (2005). Дата обращения: 8 августа 2011. Архивировано 24 августа 2011 года.
- ↑ 1 2 Иоанн Павел II страдает от болезни Паркинсона. newsinfo.ru. Дата обращения: 22 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Мао Цзэдун. vseportrety.ru. Дата обращения: 22 июля 2011. Архивировано 4 марта 2016 года.
- ↑ Mao Zedong Biography (англ.). Encyclopedia of World Biography. Дата обращения: 10 августа 2011. Архивировано 18 июля 2011 года.
- ↑ Ясир Арафат улетел в Париж на лечение. Возможно, у него болезнь Паркинсона. newsru.com (29 октября 2011). Дата обращения: 10 июля 2011. Архивировано 12 ноября 2011 года.
- ↑ Leaders in emergency meeting as Arafat ‘in coma’ (англ.). Daily Mail. Дата обращения: 8 августа 2011. Архивировано 24 августа 2011 года.
- ↑ Пожарская С. П. Франсиско Франко и его время. — М.:: ОЛМА Медиа Групп, 2007. — С. 339—340. — 410 с. — ISBN 978-5-373-00591-3.
- ↑ Герштейн С. С. Воспоминания и размышления о Бруно Понтекорво. Vivos Voco. Дата обращения: 12 августа 2011. Архивировано 12 ноября 2011 года.
- ↑ Успенский В. А. Колмогоров, каким я его помню // В сб.: Колмогоров в воспоминаниях учеников, 2-е издание. — Москва: МЦНМО, 2006. — С. 274. — ISBN 5-94057-198-0. Архивировано 24 августа 2014 года.
- ↑ Страдающий болезнью Паркинсона Оззи Осборн изменился до неузнаваемости. Lenta.ru (1 сентября 2020). Дата обращения: 2020-9-1. Архивировано 1 сентября 2020 года.
- ↑ Salvador Dali (англ.). famouspainter.com. Дата обращения: 11 августа 2011. Архивировано из оригинала 14 сентября 2011 года.
- ↑ Arthur Koestler. NNDB.com. Дата обращения: 22 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Cesarani, David. Arthur Koestler: The Homeless Mind. — William Heinemann, 1998. — P. 535. — ISBN 0434113050.
- ↑ Писательница Зоя Богуславская, вдова Вознесенского: Андрей умер от болезни Паркинсона, а не от инфаркта или инсульта. nnov.kp.ru. Дата обращения: 22 июля 2011. Архивировано 10 марта 2013 года.
- ↑ RIP Jacque Fresco, the mind died but the idea lives on. (англ.). Indestructible Ideas (22 мая 2017). Дата обращения: 27 июля 2017. Архивировано 8 октября 2017 года.
- ↑ Sandomir, Richard. Jacque Fresco, Futurist Who Envisioned a Society Without Money, Dies at 101 (англ.), The New York Times (24 May 2017). Архивировано 30 декабря 2019 года. Дата обращения: 9 июля 2017.
- ↑ Мохаммед Али. superboxing.net. Дата обращения: 8 августа 2011. Архивировано 13 октября 2011 года.
- ↑ The world’s champion (англ.). vitapro.com. Дата обращения: 10 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Phil Hill (1927–2008). f1ronspeak.wordpress.com. Дата обращения: 22 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Grant takes charge of Parkinson’s battle. sports.espn.go.com. Дата обращения: 10 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Дебора Керр. kinofilms.com.ua. Дата обращения: 22 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Винсент Прайсс. horror-movies.ru. Дата обращения: 22 июля 2011. Архивировано из оригинала 11 октября 2011 года.
- ↑ Vincent Price. Find a Grave. Дата обращения: 12 августа 2011. Архивировано 22 января 2012 года.
- ↑ Робин Уильямс страдал от болезни Паркинсона, сообщила его жена. РИА Новости (14 августа 2014). Дата обращения: 15 августа 2014. Архивировано 15 августа 2014 года.
- ↑ Виталий Бродзкий. Елена Ульянова: «Дома отец был страшно мягким». WomanHit (22 ноября 2012). Дата обращения: 2013-6-9. Архивировано 2 ноября 2014 года.
- ↑ Фонд Майкла Джея Фокса выделяет 1,5 млн евро фармакологическому предприятию из Турку. yle.fi. Служба новостей Yle (2014-7-8). Дата обращения: 2014-7-8.
- ↑ Anne Harding. Brain implant better than meds for Parkinson’s disease (англ.). CNN (6 января 2009). Дата обращения: 8 августа 2011. Архивировано 24 августа 2011 года.
- ↑ The Michael J. Fox Foundation for Parkinson’s Research (англ.). michaeljfox.org. Дата обращения: 22 июля 2011. Архивировано 24 августа 2011 года.
- ↑ Fox Quits Spin City (англ.). BBC News (19 января 2000). Дата обращения: 8 августа 2011. Архивировано 24 августа 2011 года.
- ↑ Страдающий болезнью Паркинсона Вячеслав Зайцев потерял способность самостоятельно передвигаться по дому. Вокруг ТВ (28 июля 2020). Дата обращения: 26 июня 2021. Архивировано 26 июня 2021 года.
- ↑ «Здоровье отменное». Кремль прокомментировал публикации о болезни Путина Архивная копия от 24 апреля 2022 на Wayback Machine // BBC News, 6 ноября 2020.
- ↑ William M. Arkin. Exclusive: Putin treated for cancer in April, U.S. intelligence report says (англ.). Newsweek (2 июня 2022). Дата обращения: 4 июня 2022. Архивировано 4 июня 2022 года.
Литература[править | править код]
- Болезнь Паркинсона // Нейродегенеративные заболевания: учеб. пособие / Сост.: Р.В. Магжанов, К.З. Бахтиярова, Е.В. Первушина. — Уфа: ФГБОУ ВО БГМУ Минздрава России, 2018. — С. 31-50. — 96 с.
Ссылки[править | править код]
- Национальное общество по изучению болезни Паркинсона и расстройств движений
- European Parkinson’s Disease Association (EPDA) guidelines
- Болезнь Паркинсона
- Определён ген, вызывающий заболевание Паркинсона.
- Здоровая тема.ru — болезнь Паркинсона на сайте медицинского справочника «Здоровая тема».
- The Parkinson’s Disease Forum (англ.).
- Санкт-Петербургская общественная организация инвалидов, больных болезнью Паркинсона.
- Болезнь Паркинсона, запись с медицинского канала MDTV, c переводом на русский.
- Болезнь Паркинсона — болезнь Паркинсона на сайте о нейродегенеративных заболеваниях «Деменция.com».
- Экологические факторы риска при болезни Паркинсона (на английском языке с Google-переводом)
- Луцкий И. С., Евтушенко С. К., Симонян В. А. Симпозиум «Болезнь Паркинсона (клиника, диагностика, принципы терапии)» // Последипломное образование. — 2011. — № 5 (43).
|
|
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Болезнь Паркинсона: причины появления, симптомы, диагностика и способы лечения.
Определение
Болезнь Паркинсона – хроническое прогрессирующее заболевание головного мозга, при котором в нервных клетках определенных его участков накапливается патологический белок α-синуклеин и образуются особые внутриклеточные включения – тельца Леви, что вызывает гибель пораженных нервных клеток. Основная функция этих нейронов – производство дофамина, который участвует в контроле двигательной активности, тонуса мышц, мыслительных процессов. Предполагается, что образование телец Леви начинает происходить за 15-20 лет до появления у пациента первых симптомов болезни. Таким образом, клинические проявления возникают, когда уже разрушено большое количество нейронов.
Заболевание дает о себе знать, как правило, после 60 лет, причем мужчины болеют чаще, чем женщины.
Причины появления болезни Паркинсона
На сегодняшний день нет единого мнения относительно причин появления у человека болезни Паркинсона. Возможно, имеют значение генетические факторы (определенные мутации генов).
Кроме истинной болезни Паркинсона (первичного паркинсонизма) существует так называемый вторичный паркинсонизм. Они не различаются по клиническим проявлениям, но причины последнего известны – черепно-мозговые травмы, мозговые инсульты (нарушение мозгового кровообращения), опухоли головного мозга, различные интоксикации и др.
Классификация заболевания
Болезнь Паркинсона классифицируют по клинической форме, стадии и скорости прогрессирования заболевания.
В зависимости от преобладания в клинической картине того или иного симптома выделяют три клинических формы:
- акинетико-ригидно-дрожательную, или смешанную (60-70%);
- акинетико-ригидную (15-20%), когда преобладают мышечная скованность и замедленность, бедность движений;
- дрожательную (5-10%) с преобладанием дрожания конечностей и головы (тремор).
В зависимости от стадии (степени тяжести) заболевания выделяют:
0-я стадия – двигательные проявления заболевания отсутствуют;
1-я стадия – односторонние проявления заболевания;
2-я стадия – двусторонние проявления заболевания без постуральной неустойчивости;
3-я стадия – умеренно выраженная постуральная неустойчивость (нарушение баланса, невозможность удерживать равновесие при изменении положения тела или во время ходьбы, что может приводить к падениям), самостоятельное передвижение возможно;
4-я стадия – значительная утрата двигательной активности, но пациент еще в состоянии передвигаться;
5-я стадия – при отсутствии посторонней помощи пациент прикован к постели или инвалидному креслу.
По скорости прогрессирования:
- быстрое прогрессирование – смена стадий заболевания происходит в течение 2 и менее лет;
- умеренное прогрессирование – смена стадий происходит в течение 2-5 лет;
- медленное прогрессирование – смена стадий происходит более чем через 5 лет.
Симптомы болезни Паркинсона
Болезнь Паркинсона обычно начинается постепенно, поэтому сначала пациент и его родственники не обращаются за медицинской помощью, связывая быструю утомляемость, повышенную тревожность, легкие нарушения координации, боль в шее и плечах с возрастом, остеохондрозом, усталостью, снижением настроения.
По мере прогрессирования заболевания у пациента наблюдается дрожание (тремор) конечностей и головы.
Обычно он возникает в покое и уменьшается при попытке совершить движение конечностями. Больного беспокоит скованность мышц, которая усиливается при повторных движениях (каждое последующее движение выполнять все сложнее). Нередко одностороннее двигательное поражение в дебюте заболевания со временем переходит на другую сторону.
Для пациентов с болезнью Паркинсона характерны замедленность движений и нарушение походки (ходьба мелкими шаркающими шажками, туловище излишне наклонено вперед, при ходьбе ослаблены содружественные движения рук, что чревато падениями). Больному сложно начать движение, а начав, сложно остановиться.
Окружающие обращают внимание на бедность мимики (лицо пациента практически не выражает эмоций), тихий голос, медленную и монотонную речь.
Возникают когнитивные расстройства, включающие ухудшение памяти, нарушение внимания, мышления; часто отмечаются эмоциональные нарушения – подавленное настроение, повышенная тревожность, ворчливость. Нарушается сон.
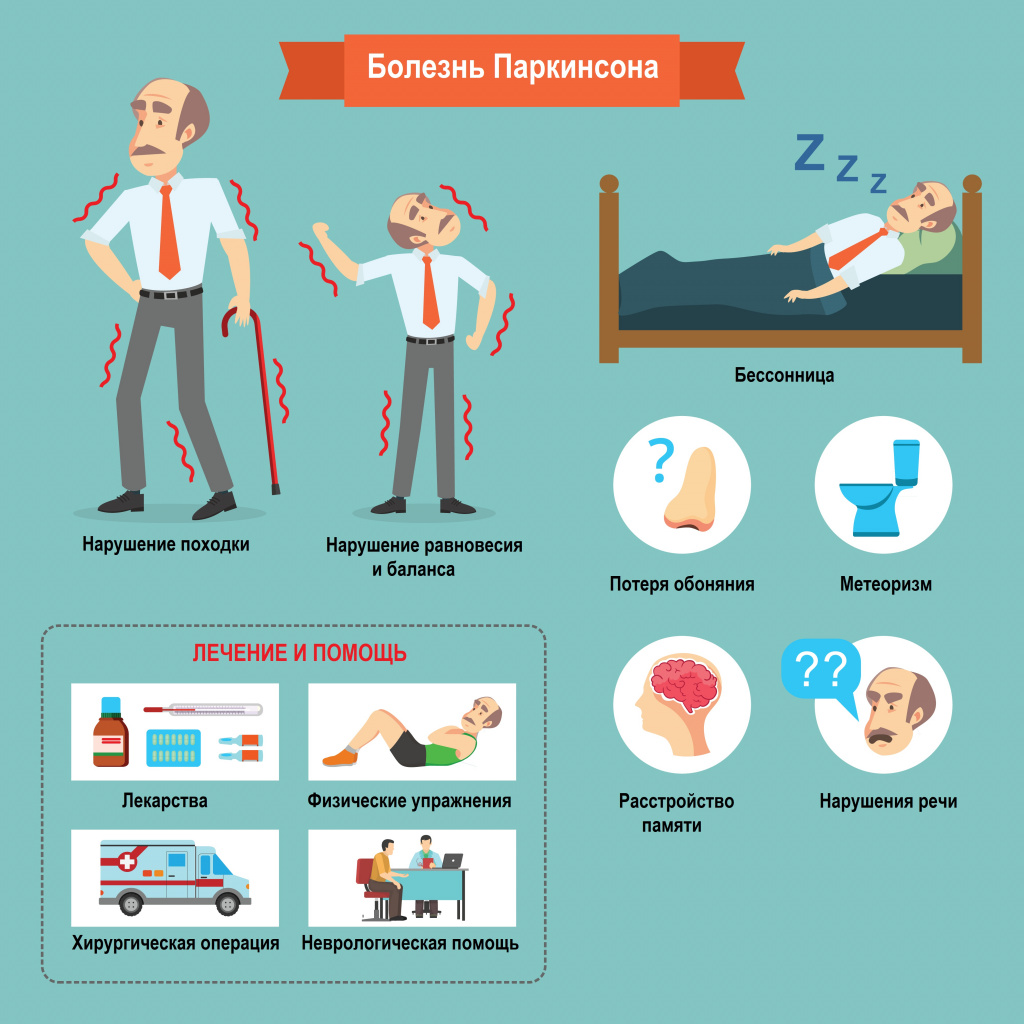 Диагностика болезни Паркинсона
Диагностика болезни Паркинсона
Основа диагностики заболевания – сбор жалоб и анамнеза, качественный неврологический осмотр. Важно наблюдение пациента в динамике, оценка состояния на фоне проводимой терапии. Для этого используют специфические опросники (шкалы), где фиксируется информация о двигательной активности, эмоциональном состоянии пациента, возможности обходиться без посторонней помощи и др.
Инструментальные методы исследования включают магнитно-резонансную томографию (МРТ) головного мозга, позитронно-эмиссионную томографию (ПЭТ), транскраниальное ультразвуковое сканирование головного мозга.
МРТ головного мозга
Безопасное и информативное сканирование структур головного мозга для диагностики его патологий.
Выявляемые изменения неспецифичны (встречаются и при иных заболеваниях), но исследования проводятся для исключения других неврологических расстройств, как причины имеющихся жалоб.
Специфических лабораторных маркеров болезни Паркинсона нет. Однако врач может назначить клинический анализ крови , анализ мочи общий, биохимический анализ крови – АЛТ (аланинаминотрансфераза), АСТ (аспартатаминотрансфераза), креатинин, мочевина, натрий и калий, креатинкиназа (креатинфосфокизаза, КФК). Результаты анализов позволяют оценить общее состояние пациента, исключить сопутствующую патологию, в том числе со стороны печени и почек, чтобы подтвердить безопасность назначаемого лечения.
Креатинин (в крови) (Creatinine)
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat.
Краткая характеристика определя�…
Мочевина (в крови) (Urea)
Синонимы: Диамид угольной кислоты; Карбамид; Мочевина в крови; Азот мочевины.
Urea nitrogen; Urea; Blood Urea Nitrogen (BUN); Urea; Plasma Urea.
Краткая характеристика аналита Мочевина
Моче�…
Калий, натрий, хлор в сыворотке крови (К+, Potassium, Na+, Sodium, Сl-, Chloride, Serum)
Синонимы: Анализ крови на электролиты; Электролиты в сыворотке крови. Electrolyte Panel; Serum electrolyte test; Sodium, Potassium, Chloride; Na/K/Cl.
Краткая характеристика определяемых �…
Поскольку гибель нейронов начинается задолго до появления специфических симптомов, усилия ученых направлены на поиск ранних маркеров, которые могли бы указывать на начало болезни Паркинсона. Возможно, раньше начатое лечение могло бы улучшить прогноз заболевания.
При наследственной форме заболевания (наличии близкого родственника с болезнью Паркинсона), его ранней манифестации, сниженном ответе на терапию, а также при наличии нехарактерной симптоматики и быстрой прогрессии заболевания назначают комплексную диагностику.
К каким врачам обращаться
Заподозрить болезнь Паркинсона может врач любой специальности. Подтверждает диагноз, назначает терапию и наблюдает больных невролог. В процессе лечения могут понадобиться консультации психиатра, нейрохирурга, логопеда, реабилитолога.
Лечение болезни Паркинсона
В настоящий момент методы предотвращения образования телец Леви неизвестны, поэтому лечение направлено на замедление прогрессирования двигательных расстройств, поддержание активности с целью улучшения качества жизни пациента. Многие симптомы уменьшаются на фоне лечения, хотя со временем лекарственные препараты могут снижать свою эффективность и вызывать нежелательные побочные эффекты.
Основа терапии – увеличение количества дофамина в головном мозге путем его замещения или продления эффекта за счет замедления его распада.
Большое внимание уделяется физической и социально-психологической реабилитации больных. Для замедления прогрессирования болезни важно не только поддерживать сохранившиеся двигательные способности, но и формировать новые навыки. В частности, занятия танцами при болезни Паркинсона позволяют улучшить координацию движений. Кроме того, пациент не ощущает социальной изоляции, снижается тревожность.
Во время подбора терапии неврологический осмотр пациента проводится не реже 1 раза в месяц, а после стабилизации состояния – 1 раз в 3 месяца.
При недостаточной эффективности лекарственной терапии, пациентам со значимыми двигательными расстройствами без выраженных когнитивных нарушений может быть рекомендовано хирургическое вмешательство – имплантация электродов в головной мозг для его глубокой стимуляции.
 Осложнения
Осложнения
В связи с потерей равновесия есть риск падений, которые могут сопровождаться различными травмами.
Профилактика болезни Паркинсона
На сегодняшний день профилактических мероприятий не существует.
Источники:
- Н.В. Федорова. Болезнь Паркинсона: диагностика и лечение. Современная терапия в психиатрии и невроллогии, журнал. № 1, 2016. С. 13-17.
- probolezny.ru/bolezn-parkinsona
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы – 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
6042
14 Мая
-
6049
14 Мая
-
6016
14 Мая
Похожие статьи
Стенокардия
Стенокардия: причины появления, симптомы, диагностика и способы лечения.

