Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
- Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные), таблицу Менделеева, манометр, термометр.
Инструкция
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С), определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту), выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром), то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
Видео по теме
Обратите внимание
Как найти количество атомов в веществе. Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023. Вам понадобится.
Полезный совет
Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Зная это число, можно различными способами, которые и были испробованы в 1908-1910 гг., найти число N. Можно собрать α-частицы в цилиндре Фарадея, измерить их заряд и, разделив его на число частиц, получить заряд каждой из них; половина его дает нам элементарный заряд, по которому уже определяется число N…
Источники:
- как определить количество атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
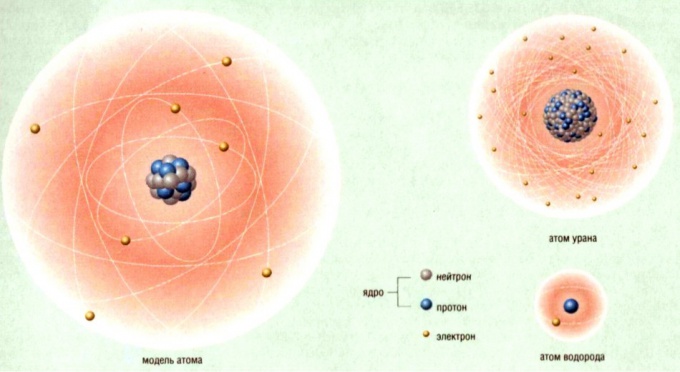
An atom is an element. The two words are synonymous, so if you’re looking for the number of atoms in an element, the answer is always one, and only one. Scientists know of 118 different elements, which they categorize in the periodic table, a diagram that arranges them in increasing order according to the number of protons in their nuclei. This arrangement allows you to answer a significant question at a glance: “What is the number of protons in a particular element?” To answer that, you simply need to look at the place the element occupies in the chart. The place number corresponds to the number of protons.
TL;DR (Too Long; Didn’t Read)
If you have a sample that contains atoms of a single element, you can find the number of atoms by weighing it.
Elements That Form Diatomic Molecules
Some atoms can form covalent bonds with other atoms of the same element to form diatomic molecules. The best known is oxygen (O). A single oxygen atom is highly reactive, but when it forms a bond with another oxygen atom to form O2, the combination is more stable. This is the form in which oxygen exists in the earth’s atmosphere. Four other elements can combine in this way at standard temperature and pressure. They include nitrogen (N), which is the most abundant element in the atmosphere, hydrogen (H), chlorine (Cl) and fluorine (F). Two other elements, bromine (Br) and iodine (I), can form diatomic molecules at higher temperatures. All diatomic molecules contain two atoms.
Noble Gases and Metals
Some atoms, such as sodium and phosphorous, are so reactive that they are never found free in nature. However, two groups of elements, the noble gases and noble metals, are stable and can exist in samples that contain only non-bound atoms of that element. For example, a container full of argon gas (Ar) contains only argon atoms, and a bar of pure gold contains only gold (Au) atoms. If you have a large sample of a noble gas or metal, you can calculate how many atoms it contains by weighing it.
In addition to these gases and metals, carbon (C) can also exist in the free state. Diamond and graphite are the two most common forms. Among non-metals, carbon is unique in its ability to exist in this way.
Counting Atoms
To calculate the number of atoms in a sample, you need to find how many moles of the element the sample contains. A mole is a unit chemists use. It’s equal to Avogadro’s number (6.02 X 1023) of atoms. By definition, the weight of one mole of an element (its molar mass) is equal to its atomic weight in grams. The atomic weight for each element is on the periodic table right under the element’s symbol. The atomic weight of carbon is 12 atomic mass units (amu), so the weight of one mole is 12 grams.
If you have a sample that contains only atoms of a particular element, weigh the sample in grams and divide by the atomic weight of the element. The quotient tells you the number of moles. Multiply that by Avogadro’s number, and you’ll find out how many atoms the sample contains.
Examples
1. How many atoms are there in one ounce of pure gold?
An ounce is 28 grams, and the atomic weight of gold is 197. The sample contains 28 ÷ 197 = 0.14 moles. Multiplying this by Avogadro’s number tells you the number of atoms in the sample = 8.43 x 1022 atoms.
2. How many oxygen atoms are there in a gas sample that weighs 20 grams?
The same procedure applies to finding the number of atoms in a diatomic gas, even though the atoms have combined to form molecules. The atomic weight of oxygen is 16, so one mole weighs 16 grams. The sample weighs 20 grams, which is equal to 1.25 moles. Therefore, the number of atoms is 7.53 x 1023.
Введение
Одним из
специфических методов обучения химии является решение химических задач. В
процессе решения задач определяется степень усвоения материала, умение
использовать полученные знания.
Различают качественные, расчетные и комбинированные задачи. Расчетные
задачи подразделяют, в свою очередь, на три группы:
1.
Задачи, решаемые с
использованием химической формулы вещества или на вывод формулы.
2.
Задачи, для решения
которых используют управления химической реакций.
3.
Задачи, связанные с
растворами веществ.
Каждая из групп содержит различные виды задач.
Программой по химии предусмотрены следующие виды
расчетных задач:
1.
Вычисление относительной молекулярной массы веществ
по химическим формулам.
2.
Вычисления по химическим
уравнениям количества вещества, участвующего в реакции, по известному
количеству вещества, принимающего участие в химической реакции.
3.
Вычисления по химическим
уравнениям объема газов по известному количеству вещества одного из вступающих
в реакцию веществ или получающихся в результате ее.
4.
Вычисление массовой доли и
массы вещества в растворе.
5.
Вычисление по химическим
уравнениям массы по известному количеству вещества одного из вступающих или
получающихся в реакции веществ.
Основным требованием к отбору задач
является их химическое содержание. Условия задачи должны соответствовать целям
урока, должны быть доступны по содержанию и нести сведения практического
характера.
Расчетные задачи можно применять при объяснении нового материала,
при закреплении знаний, для домашнего задания, при текущем учете знаний, при
повторении материала и итоговом зачете, при выполнении самостоятельных и
контрольных работ, на факультативных или кружковых занятиях.
При решении задач необходимо правильно применять общепризнанные
буквенные обозначения физических величин и их единиц измерения в системе СИ
(см. таблицу 1 в Приложении) и использовать единый стиль оформления задач.
Последовательность действий учителя и ученика при решении задач
следующая:
1.
Понимание сущности задачи.
2.
Выполнение химической
части решения задачи (запись условия, уравнений реакций, постановка вопроса).
3.
Выбор наиболее
рационального способа решения.
4.
Расчет
5.
Запись ответа.
Существует несколько способов решения задач.
Наиболее распространенными являются:
1. Соотношение масс веществ.
2. Использование величины “количество
вещества”.
3. Составление пропорций.
Эти способы решения будут использованы в данном пособии.
- Вычисление относительных атомных и молекулярных
масс.
Относительная атомная масса(Аr)-это
отношение массы атома элемента к 1/12 массы атома углерода:
Аr(Э)=![]() =m(Э)
=m(Э)![]() 1аем. (1)
1аем. (1)
ma(Э)-масса атома элемента;
ma(Э)-масса атома углерода;
1/12 ma(c)=1,66![]() 10-24г – одна атомная единица массы (а.е.м).
10-24г – одна атомная единица массы (а.е.м).
Задача 1. Найдите
относительную атомную массу натрия, если масса атома натрия 38 ![]() 10-24 г, а масса атома углерода
10-24 г, а масса атома углерода
20 ![]() 10-24 г.
10-24 г.
Ход рассуждений. Запишем кратко условие
задачи. Вспомним определение Аr и формулу для ее вычисления. Подставим
числовые данные. Сделаем расчет.
![]() Дано: Решение:
Дано: Решение:
ma(Na)=38![]() 10-24г Ar(Na)=
10-24г Ar(Na)=![]()
![]() ma(с)=20
ma(с)=20![]() 10-24г Ar(Na)=
10-24г Ar(Na)=![]()
Аr(Na)-? Ответ: Аr(Na)=23
Относительная молекулярная масса (Мr)-это отношение массы молекулы вещества к 1/12
массы атома углерода:
Mr=![]() (а.е.м) (2)
(а.е.м) (2)
Mm
– масса молекулы вещества.
Задача 2. Определите относительную молекулярную массу Fe2O3, если известно, что масса молекулы оксида
железа (III) 2,6![]()
Ход рассуждений. Запишем кратко условие задачи. Вспомним определение Мr.
Поскольку для вычисление Мr через массу молекулы необходимо знать массу
атома углерода, подставим ее значение в условие задачи. Запишем формулы(2).
Подставим числовые данные в формулу. Сделаем расчет.
![]() mM(Fe2O3)=2.6
mM(Fe2O3)=2.6![]()
![]() Mr
Mr
(Fe2O3)=![]()
ma(С)=20![]() Mr (Fe2O3)=
Mr (Fe2O3)=![]()
![]() Мr(Fe2O3)-? Ответ: Mr (Fe2O3)=160
Мr(Fe2O3)-? Ответ: Mr (Fe2O3)=160
2.
Определение относительной молекулярной массы и массы молекулы
Относительную молекулярную массу (Mr)
можно вычислить по относительной атомной массе элементов, входящих в эту
молекулу. Для этого нужно знать формулу вещества, т.е. какие элементы входят и
каково число атомов каждого элемента в молекуле:
Mr = Аr(Э1) * n1+
Аr(Э2) * n2
+ … (3)
Аr(Э1) – относительная атомная масса
первого элемента;
n1 – число атомов первого элемента в молекуле;
Аr(Э2) – относительная атомная масса
второго элемента
n2 – число атомов второго элемента в молекуле;
Задача 3. Определите относительную молекулярную массу
углекислого газа СO2, зная относительные массы углерода и кислорода.
Ход рассуждений. Запишем кратко
условие задачи. Определим формулу для вычисления (Mr),
если известны относительные атомные массы (Аr) кислорода и углерода. Подставим числовые
данные в формулу (3).Сделаем расчет.
![]() Дано: Мr (СО2)
Дано: Мr (СО2)
= Аr(С) * nс+ Аr(О) * nо
Мr (СО2) =12*1+16*2=44
Аr (С)=12
![]() Аr (О)=16
Аr (О)=16
Мr (СО2) – ? Ответ: Мr (СО2)
= 44
3. Нахождение массовой доли элемента в веществе
Нахождение массовой доли элемента в
веществе – центральная задача среди расчетов по формуле вещества. Рекомендуются
упражнения этого вида выполнить в таком количестве, чтобы учащиеся приобрели
навык расчета массовой доли элемента в веществе.
Массовая доля элемента в веществе (W) показывает, какую часть
составляет масса атомов элемента от массы молекулы вещества. Для чистого
вещества с постоянным составом массовая доля элемента в веществе постоянна. В
любой массе массовая доля элемента такая, как в истинной или условной молекуле.
Для нахождения W (Э) необходимо
относительную атомную массу Аrвсех атомов данного элемента (n) отнести к относительной
молекулярной массе вещества (Мr) :
 (4)
(4)
Массовую долю элемента в веществе можно
выражать в долях или процентах. Во втором случае полученный по формуле (4)
результат умножают на 100%:

Задача 4. Определить массовую долю элемента кислорода в
320 г серной кислоты.
![]() Дано: Решение:
Дано: Решение:
![]() m(H2SO4)=320г W(O) = Ar (O) *n
m(H2SO4)=320г W(O) = Ar (O) *n
Аr (О)=16 Mr (H2SO4)
Аr (S)=32
Аr (H)=1 Mr
(H2SO4) = 1*2+32*1+16*4=98
![]()
![]() W (O) -? W(O) = 16*4 = 0,65 или 65 %
W (O) -? W(O) = 16*4 = 0,65 или 65 %
98
4. Вычисления с использованием понятия
«Количество вещества», «Число Авогадро»
Количество вещества – (υ) – это физическая величина, определяемая числом
структурных единиц (атомов, молекул, ионов, электронов) и других частиц). Единица
измерения количества вещества –МОЛЬ. Моль равна количеству вещества системы,
которая содержит столько же структурных частиц, сколько содержится атомов в
углероде – 12 массой 0,012 кг (12г), 1 моль вещества содержит 6*1023
структурных частиц. Является величиной постоянной и называется числом Авогадро
(NA).
NA ![]()

Используя понятие «моль» необходимо указывать, о каких структурных
частицах говорится. Если число структурных частиц, содержащихся в системе (N)
разделить на число структурных частиц, составляющих 1 моль (NA), можно определить число молей.
![]()
![]() υ = N (5)
υ = N (5)
NA
Задача 5. Какое
количество вещества содержит 18*1023 молекул Н2S?
Дано: Решение:
![]()
![]() N(Н2S) =
N(Н2S) =
18*1023 υ = N = 18*1023 = 3 моль Н2S
![]() υ (Н2S) –? NA 60*1023
υ (Н2S) –? NA 60*1023
Задача 6. Какое
число атомов соответствует 0,25 моль железа?
![]() Дано: Решение:
Дано: Решение:
![]() υ
υ
(Fe) = 0,25моль
N (Fe) -? N = υ *
NA
N (Fe)
=0,25 моль * 6*1023 = 1,5*1023 атомов
Ответ:
N (Fe) = 1,5*1023 атомов
Количество вещества
(υ) взаимно связано с массой вещества (m):
m = υ *
М (6)
Где М – молярная масса.
Нужно различать понятия «масса», «относительная молекулярная масса» и
«молярная масса». Первые два понятия уже описаны выше. Молярная масса –это
масса 1 моль вещества или масса 6*1023 структурных частиц. Единица
измерения моляронй массы – г/моль. Связь с относительной молекулярной (Mr)
М=Mr * 1 г/моль
Mr (NaOH) =40
M (NaOH) =
40г/моль
Задача 7.
Определите массу 0,3 моль оксида алюминия.
![]() Дано: Решение:
Дано: Решение:
υ (Al2O3) = 0,3моль M (Al2O3)=27*2+16*3=102г/моль
M (Al2O3)=102г/моль m (Al2O3)=0,3 моль*102г/моль= 30,6 г
![]() m (Al2O3) -? Ответ: m (Al2O3)= 30,6 г
m (Al2O3) -? Ответ: m (Al2O3)= 30,6 г
Задача 8. Сколько моль вещества составляет 12 г
гидроксида калия?
![]() Дано: Решение:
Дано: Решение:
m(KOH) = 12 г Преобразуем формулу (6)
M (KOH)=56г/моль υ =![]()
υ ![]() (KOH) -? υ (КОН)
(KOH) -? υ (КОН)
= 12г = 0,2 моль
![]() 56
56
г/моль
Ответ:
υ (КОН) = 0,2 моль.
6. Вычисление массовой доли и массы вещества в растворе.
Массовая доля растворенного вещества определяется как отношение
массы растворенного вещества к массе раствора:

W – массовая доля
растворенного вещества;
mр.в.– масса растворенного вещества, г;
mр-ра.– масса раствора, г;
Массовую долю можно
выражать в долях (умножение на 100% в этом случае опускается ) или в процентах.
Расчеты по химическим формулам.
Алгоритмы.
1.
Записать химическую
формулу вещества.
2.
Установить определяемый
элемент.
3.
Рассчитать массу вещества
и массу определяемого элемента. Составить пропорцию и рассчитать Х.
Задача.
Вычислить массу меди,
содержащуюся в 320 г. оксида меди (II).
