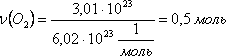Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
- Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные), таблицу Менделеева, манометр, термометр.
Инструкция
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С), определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту), выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром), то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
Видео по теме
Обратите внимание
Как найти количество атомов в веществе. Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023. Вам понадобится.
Полезный совет
Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Зная это число, можно различными способами, которые и были испробованы в 1908-1910 гг., найти число N. Можно собрать α-частицы в цилиндре Фарадея, измерить их заряд и, разделив его на число частиц, получить заряд каждой из них; половина его дает нам элементарный заряд, по которому уже определяется число N…
Источники:
- как определить количество атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
найди число атомов каждого элемента в молекуле оксида углерода, если массовая доля углерода в нём равна (42,86) %, а массовая доля кислорода — (57,14) %.
1. Примем массу оксида равной (100) г. Масса углерода в такой порции равна (42,86) г, а масса кислорода — (57,14) г.
2. Находим относительные атомные массы элементов в Периодической таблице:
3. Обозначаем число атомов углерода как (x), а число атомов кислорода — (y), и записываем отношение масс:
.
4. Получаем выражение:
5. Находим отношение (x : y):
.
В молекуле оксида углерода на (1) атом углерода приходится (1) атом кислорода.
Для
определения числа атомов (молекул) в
определенном количестве вещества
необходимо воспользоваться следующей
формулой: N = ν · NA,
где
N – число частиц (атомов или молекул).
Например,
определим количество атомов алюминия,
содержащиеся в 2 моль вещества алюминия:
N (Al) = ν (Al) · NA.
N
(Al) = 2 моль · 6,02 · 1023
= 12,04 · 1023
(атомов).
Кроме того, можно определить
количество вещества по известным числом
атомов (молекул):
.
Например,
определим количество вещества
молекулярного кислорода, которая
содержит 3,01 · 1023
молекул кислорода:.
.
.
Количество вещества определяется числом
структурных единиц (атомов, молекул,
ионов или других частиц) этого вещества.
Количество вещества обозначается
буквой.
9.
Уравнение Менделеева- Клайперона.
PV=(m/M)RT,
где R-
универсальная газовая постоянная,
равная 8,31 Дж/(К*моль)
10.
Эквивалент. Закон эквивалентов.
Эквивалент-
часть вещества, реагирующая без остатка
с одним эквивалентом водорода или вообще
с одним эквивалентом любого другого
вещества.
Закон
эквивалентов: «Вещества
взаимодействуют друг с другом в
эквивалентных количествах» , или «массы
реагирующих веществ пропорциональны
их эквивалентам либо эквивалентным
массам (объемам): m1/m2=
Э1/Э2».
11.
Значения эквивалентов водорода и
кислорода.
Эm(Н2)=1
г/экв
Эm(О2)=
8 г/экв
12.
Молярная масса эквивалента, молярный
объем эквивалента.
Молярная
масса эквивалента элемента в соединении
не является величиной постоянной,
зависит от валентности элемента в данном
соединении и выражается уравнением:

где
М – молярная масса элемента, г/моль; Z –
валентность элемента в данном соединении;
1/z – фактор эквивалентности
Эквивалентный
объем или объем моля эквивалента Vэ(X)
– это объем, который занимает один моль
эквивалентов газообразного вещества
при нормальных условиях (н.у.).
13.
Эквивалент кислоты, основания, соли.
Кислоты:
определяется отношением Mr
основания к числу атомов водорода в
формуле кислоты, способных заместиться
на металл (основность кислоты). Например
эквивалент серной кислоты Н2SO4=
98/2= 49 (1/2*М)
Основания:
определяется отношением Mr
основания к числу гидроксильтных групп
ОН в формуле основания, способных
заместиться на кислотный остаток
(кислотность основания). Например,
эквивалент едкого натра равен ЭNaOH=
40/1= 40, т.е. у этого вещества значения
эквивалента и молекулярной массы
совпадают. (1/3*М)
Соли:
определяется как частное от деления Mr
соли на суммарный заряд катионов. Так,
эквивалент сульфата аллюминия ЭAl2SO4=
342/6= 57. (М/ сумм. Заряд)
Оксида:
равен сумме эквивалентов кислорода и
элемента, образующего данный оксид.
Например, эквивалент оксида аллюминия
равен: Al2O3=
ЭAl+
ЭО. Поскольку алюминий трехвалентен,
то ЭAl=
ArAl/B=
27/3=9, следовательно, ЭAl2O3=
9+8=17. Тоже получим, разделив Mr
оксида на суммарный заряд катионов
металла: 102/6=17.
14.
Закон Авогадро. Следствия из закона
Авогадро.
Закон:
«В равных объемах любых газов при
одинаковых условиях содержится одинаковое
число молекул» .
Следствия:
–
одинаковое число молекул различных
газов при одинаковых условиях ( давлении
и температуре) занимает одинаковый
объем.
–
один моль любого газа при определенных
условиях занимает постоянный объем.
15.
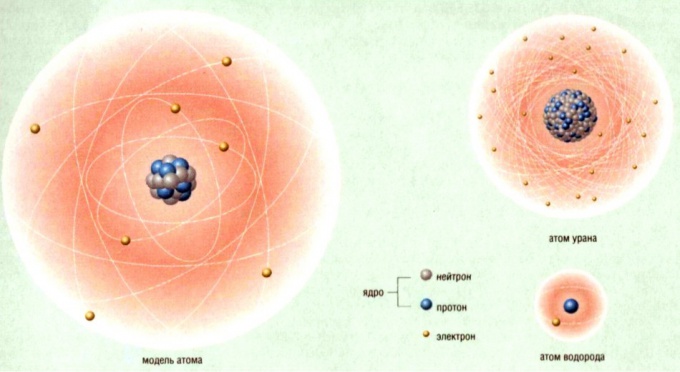
Строение атома: модель Томпсона.
В
атоме Томсона положительное электричество
«размазано» по сфере, в которую вкраплены,
как изюм в пудинг, электроны. В простейшем
атоме водорода электрон находится в
центре положительно заряженной сферы.
При смещении из центра на электрон
действует квазиупругая сила
электростатического притяжения, под
действием которой электрон совершает
колебания. Частота этих колебаний
определяется радиусом сферы, зарядом
и массой электрона, и если радиус сферы
имеет порядок радиуса атома, частота
этих колебаний совпадает с частотой
колебания спектральной линии атома. В
многоэлектронных атомах электроны
располагаются по устойчивым конфигурациям,
рассчитанным Томсоном. Томсон считал
каждую такую конфигурацию определяющей
химические свойства атомов. Он предпринял
попытку теоретически объяснить
периодическую систему элементов Д. И.
Менделеева. Эту попытку Бор позднее
назвал «знаменитой» и указал, что со
времени этой попытки «идея о разделении
электронов в атоме на группы сделалась
исходным пунктом и более новых воззрений».
Отметив, что теория Томсона оказалась
несовместимой с опытными фактами, Бор
тем не менее считал, что эта теория
«содержит много оригинальных мыслей и
оказала большое влияние на развитие
атомной теории».
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
An atom is an element. The two words are synonymous, so if you’re looking for the number of atoms in an element, the answer is always one, and only one. Scientists know of 118 different elements, which they categorize in the periodic table, a diagram that arranges them in increasing order according to the number of protons in their nuclei. This arrangement allows you to answer a significant question at a glance: “What is the number of protons in a particular element?” To answer that, you simply need to look at the place the element occupies in the chart. The place number corresponds to the number of protons.
TL;DR (Too Long; Didn’t Read)
If you have a sample that contains atoms of a single element, you can find the number of atoms by weighing it.
Elements That Form Diatomic Molecules
Some atoms can form covalent bonds with other atoms of the same element to form diatomic molecules. The best known is oxygen (O). A single oxygen atom is highly reactive, but when it forms a bond with another oxygen atom to form O2, the combination is more stable. This is the form in which oxygen exists in the earth’s atmosphere. Four other elements can combine in this way at standard temperature and pressure. They include nitrogen (N), which is the most abundant element in the atmosphere, hydrogen (H), chlorine (Cl) and fluorine (F). Two other elements, bromine (Br) and iodine (I), can form diatomic molecules at higher temperatures. All diatomic molecules contain two atoms.
Noble Gases and Metals
Some atoms, such as sodium and phosphorous, are so reactive that they are never found free in nature. However, two groups of elements, the noble gases and noble metals, are stable and can exist in samples that contain only non-bound atoms of that element. For example, a container full of argon gas (Ar) contains only argon atoms, and a bar of pure gold contains only gold (Au) atoms. If you have a large sample of a noble gas or metal, you can calculate how many atoms it contains by weighing it.
In addition to these gases and metals, carbon (C) can also exist in the free state. Diamond and graphite are the two most common forms. Among non-metals, carbon is unique in its ability to exist in this way.
Counting Atoms
To calculate the number of atoms in a sample, you need to find how many moles of the element the sample contains. A mole is a unit chemists use. It’s equal to Avogadro’s number (6.02 X 1023) of atoms. By definition, the weight of one mole of an element (its molar mass) is equal to its atomic weight in grams. The atomic weight for each element is on the periodic table right under the element’s symbol. The atomic weight of carbon is 12 atomic mass units (amu), so the weight of one mole is 12 grams.
If you have a sample that contains only atoms of a particular element, weigh the sample in grams and divide by the atomic weight of the element. The quotient tells you the number of moles. Multiply that by Avogadro’s number, and you’ll find out how many atoms the sample contains.
Examples
1. How many atoms are there in one ounce of pure gold?
An ounce is 28 grams, and the atomic weight of gold is 197. The sample contains 28 ÷ 197 = 0.14 moles. Multiplying this by Avogadro’s number tells you the number of atoms in the sample = 8.43 x 1022 atoms.
2. How many oxygen atoms are there in a gas sample that weighs 20 grams?
The same procedure applies to finding the number of atoms in a diatomic gas, even though the atoms have combined to form molecules. The atomic weight of oxygen is 16, so one mole weighs 16 grams. The sample weighs 20 grams, which is equal to 1.25 moles. Therefore, the number of atoms is 7.53 x 1023.