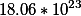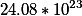milanasport8
+10
Решено
2 года назад
Химия
5 – 9 классы
решите пожалуйста❤По формуле❤
Сколько атомов в 3 молях воды H20?
Смотреть ответ
1
Ответ проверен экспертом
5
(2 оценки)
1
nikitabogoslov7
2 года назад
Светило науки – 307 ответов – 0 раз оказано помощи
Ответ:
В трёх молях воды содержится 6 моль атомов. Число атомов найдем по формуле N=n*Na, где Na=6*10^23, N=6*6*10^23= 36*10^23
(2 оценки)
https://vashotvet.com/task/12308949
Найдите правильный ответ на вопрос ✅ «Вычислите количество атомов в 3-х молях Ca? …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Вычислите количество атомов в 3-х молях Ca?
Предмет: Химия,
автор: etozhesonyaaa
Ответы
Автор ответа: svyazistka2010
1
Ответ:
Объяснение:
1 моль содержит
атомов (или молекул) вещества. Это число называется числом Авогадро. Соответственно, 3 моля вещества содержат в 3 раза больше атомов (или молекул):
Предыдущий вопрос
Следующий вопрос
Интересные вопросы
Предмет: Українська мова,
автор: anastasiakasuk47
6 клас. Твір-опис приміщення.
Бажано щоб описати клас у якому є гірлянди і ялинка у куточку.
Будь ласка.
Потрібно на завтра
ЗНАЙДІТЬСЯ ТІ ЯКІ МОЖУТЬ ЗАРАЗ НАПИСАТИ…
3 года назад
Предмет: Английский язык,
автор: KolettFall3
3 и 4 задание. К 4 есть фото.
3 года назад
Предмет: Информатика,
автор: vika19923211
Вправа 2 Програма ” куб”
Дано довжину ребра куба знайти його об’ем та площу всієї поверхні
Об’ єм куба дорівнює кубу довжини його ребра площа сторони дорівнює квадратну довжини ребра
3 года назад
Предмет: Литература,
автор: катя4079
краткая биография А.Прокофьева
6 лет назад
Предмет: Математика,
автор: Андрей58645
Помогите!!!!!
(5х-3)^2+(2х-3)(2х+3)=2
6 лет назад
Как определить количество атомов в молекуле?
Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Задачи на атомистику
Задачи на атомистику — это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Ниже я выкладываю задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года.
Для решения задач на атомистику используются довольно простые идеи. Во-первых, понятие массовой доли. Во-вторых, умение выражать число атомов через число молекул или других структурных единиц.
Например , в молекуле триоксида серы SO3 на 1 молекулу приходится один атом серы и три атома кислорода:
1 молекула SO3 — 1 атом серы, 3 атома кислорода
Несложно пропорцией определить, что на две молекулы триоксида серы будет приходиться два атома серы и шесть атомов кислорода:
2 молекулы SO3 — 2 атома S, 6 атомов О
На 20 молекул триоксида:
20 молекул SO3 — 20 атомов S, 60 атомов О
А вот сколько атомов приходится на х молекуле триоксида? Это также легко определить через пропорцию:
х молекул SO3 — х атомов S, 3х атомов О
Иначе говоря, количество атомов кислорода в молекуле SO3 в три раза больше, чем количество молекул. А количество атомов серы равно количеству молекул триоксида серы. Это простая, но не всегда очевидная идея. То есть индексы в формуле вещества показывают не только, как соотносится количество атомов между собой, но и какое число атомов приходится на 1 молекулу или другую структурную единицу вещества.
Если так соотносится число атомов и молекул, то также будет соотноситься и количество вещества атомов и молекул, выраженное в молях. Потому что 1 моль — это не что иное, как порция, состоящая из одинакового числа данных частиц.
То есть на х моль триоксида серы приходится:
х моль SO3 — х моль атомов S, 3х моль атомов О
Представьте себе, что атомы — это элементы изделия, а молекула состоит из некоторого числа таких деталей. Таким образом, число деталей разного типа всегда больше или равно числа изделий. Получается, в молекуле число атомов всегда больше или равно, чем количество молекул.
И наоборот, число молекуле триоксида серы в 3 раза меньше, чем число атомов кислорода в составе SO3. И число молекул равно количеству атомов серы.
Например , на х моль атомов серы приходится х моль молекул SO3.
Еще одно понятие, которое пригодится при решении задач на атомистику — молярное соотношение веществ .
Молярное соотношение — это отношение количества одного вещества к количеству другого вещества.
Например , молярное соотношение хлорида натрия и воды в растворе составляет 1 к 20, или 0,05:
n(NaCl)/ n(H2O) = 1/20 = 0,5
Молярное соотношение можно задавать отдельным числом, а можно соотношением:
n(NaCl) : n(H2O) = 1:20
А вот выражать молярное соотношение через проценты нельзя. Это безразмерная величина.
Научиться решать задачи на атомистику не очень сложно. В ЕГЭ по химии атомистика станет, скорее всего, лишь частью более сложной комплексной задачи 34. Но я бы рекомендовал не пытаться сразу решать задачи на атомистику уровня ЕГЭ по химии. Занимаясь в спортзале, вы же не пытаетесь на первой тренировке поднять сразу тяжелую штангу. Точнее, попытаться вы можете, но последствия будут плачевными.
Для начала сделайте разминку возьмите простые задачи, чтобы освоить основные приемы и понять логику решения таких заданий. А после легких задач можно постепенно перейти к более сложным. Именно в таком порядке и расположены задачи в данной подборке «Атомистика», которые позволяют понять, как именно удобно работать с такими заданиями.
Публикую подборку задач, в которых используются идеи атомистики. Все задачи взяты из сборника С.А. Пузакова, В.А. Попкова «Пособие по химии. Вопросы. Упражнения. Задачи». В скобках я привожу нумерацию этих задач в задачнике.
1. (66) В смеси оксида меди (I) и оксида меди (II) на 4 атома меди приходится 3 атома кислорода. Вычислите массовые доли веществ в такой смеси.
Пусть n (количество вещества) (Cu2O) = х моль, n(CuO) = y моль, тогда:
количество вещества атомов меди в первом оксиде n1(Cu) = 2х моль, во втором оксиде: n2(Cu) = у моль
количество вещества атомов кислорода в первом оксиде n1(О) = х моль, во втором оксиде: n2(О) = у моль
общее количество вещества атомов меди: n(Cu) = (2x + y) моль, атомов кислорода: n(O) = (x + y) моль.
По условию задачи их отношение равно как 4 : 3, т. е. (2x + y) / (x + y) = 4 / 3.
Преобразуем приведённое выше равенство, получаем y = 2x.
Выразим через х массы соединений:
m(CuO) = n(CuO) * M(CuO) = 80 * у = 80 * 2x = (160x) г
Масса смеси двух оксидов будет равна:
m(смеси) = (144x + 160x) г = (304x) г
Теперь рассчитываем массовую долю оксидов в смеси:
ω(Cu2O) = m(Cu2O) / m(смеси) = 144x / 304x = 0.4737 (47.37%)
ω(CuO) = m(CuO) / m(смеси) = 160x / 304x = 0.5263 (52.63%)
Ответ: ω(CuO) = 52,6%, ω(Cu2O) = 47,4%
2. (67) В смеси двух хлоридов железа на 5 атомов железа приходится 13 атомов хлора. Вычислите массовые доли веществ в такой смеси.
Железо образует два устойчивых хлорида: FeCl2 и FeCl3.
Пусть n(FeCl2) = х моль, n(FeCl3) = y моль, тогда:
количество вещества атомов железа в первом хлориде n1(Fe) = х моль, во втором хлориде: n2(Fe) = у моль,
количество вещества атомов хлора в первом хлориде n1(Cl) = 2х моль, во втором хлориде: n2(Сl) = 3у моль,
общее количество вещества атомов железа: n(Fe) = (x + y) моль, атомов хлора: n(Cl) = (2x + 3y) моль.
По условию задачи их отношение равно как 5 : 13, т. е. (x + y) / (2x + 3y) = 5 / 13.
Преобразуя приведённое выше равенство, получаем y = 1,5x.
Выразим через х массы соединений:
m(FeCl3) = n(FeCl3) * M(FeCl3) = 162,5 * у = 162,5 * 1,5x = (243,75x) г
Масса смеси двух хлоридов будет равна:
m(смеси) = (127x + 243,75x) г = (370,75x) г
Теперь рассчитываем массовую долю хлоридов в смеси:
ω(FeCl2) = m(FeCl2) / m(смеси) = 127x / 370,75x = 0,343 (34,3%)
ω(FeCl3) = m(FeCl3) / m(смеси) = 243,75x / 370,75x = 0,657 (65,7%)
Ответ: ω(FeCl2) = 34,3%, ω(FeCl3) = 65,7%
3. (70) В каком молярном соотношении были смешаны карбид кальция и карбонат кальция, если массовая доля углерода в полученной смеси равна 25%?
Формулы карбида и карбоната кальция: CaC2 и CaCO3.
Пусть n(CaC2) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов углерода в карбиде кальция n1(С) = 2х моль, в карбонате: n2(С) = у моль,
общее количество вещества атомов углерода: n(С) = (2x + y) моль.
масса атомов углерода: m(С) = 12(2x + y) г.
Выразим через х массы соединений:
m(CaCO3) = n(CaCO3) * M(CaCO3) = 100у г
Масса смеси двух веществ будет равна:
m(смеси) = (64x + 100у) г
Теперь записываем выражение для массовой доли атомов углерода в смеси:
ω(C) = m(C) / m(смеси)
0,25 = 12(2x + y) / (64x + 100у)
Преобразуем выражение, выражаем х через у:
Это и есть искомое молярное соотношение карбида кальция и карбоната кальция:
n(CaC2)/ n(CaCO3) = х/у = 1,625
Ответ: n(CaC2)/ n(CaCO3) = 1,625
4. (71) В каком молярном соотношении были смешаны гидросульфит натрия и гидросульфид натрия, если массовая доля серы в полученной смеси равна 45%?
Ответ: n(NaHS)/ n(NaHSO3) = 2,18
5. (72) Какую массу сульфата калия следует добавить к 5,5г сульфида калия, чтобы в полученной смеси массовая доля серы стала равной 20%?
Ответ: 31,3 г
6. (73) В смеси нитрата аммония и нитрата свинца (II) массовая доля азота равна 25%. Вычислите массовую долю свинца в этой смеси.
Ответ: 23,6%
7. (74) В смеси нитрата аммония и нитрата бария массовая доля азота равна 30%. Вычислите массовую долю нитрат-ионов в смеси.
Ответ: 71,3%
8. (75) В смеси двух оксидов углерода на 5 атомов углерода приходится 7 атомов кислорода. Вычислите объемную долю более тяжелого оксида в этой смеси
Ответ: φ(СO2) = 40%
9. (619) Через 13,1 г смеси бромида калия и йодида калия, в которой массовая доля брома равна 24,5%, пропустили смесь хлора и брома, в результате чего получилась смесь двух солей, в которой массовая доля брома равна 57%. Вычислите массу смеси галогенов, вступившую в реакцию.
Масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 13,1·0,245 = 3,21 г
Количество вещества атомов брома:
n(Br) = m/M = 3,21 г/80 г/моль = 0,04 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,04 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0.04 моль·119 г/моль = 4,77 г
Масса йодида калия:
m(KI) = m(смеси) — m(KBr) =13,1 — 4,77 = 8,33 г
Количество вещества йодида калия:
n(KI) = m/M = 8,33 г/166 г/моль = 0,05 моль
По условию задачи, смесь йодида калия и бромида калия вступила в реакцию не полностью, но в конечной смеси осталось только две соли. При этом йодид калия, скорее всего, вступил в реакцию полностью, так как иначе конечная смесь будет содержать более двух солей.
Предположим, что сначала прореагируют наиболее активные окислитель и восстановитель — йодид калия и хлор:
2KI + Cl2 = 2KCl + I2
Если весь йодид калия вступил в эту реакцию, то в конечной смеси присутствуют только исходный бромид калия и образовавшийся хлорид калия. Количество хлорида калия:
n(KCl) = n(KI) = 0,05 моль
m(KCl) = n·M = 0,05 моль·74,5 г/моль = 37,25 г
Массовая доля брома в такой смеси:
ω(Br) = m(Br) / m(смеси) = 3,21 г / (3,725 г + 4,77) = 0,378 или 37,8%, что не соответствует условию задачи.
Следовательно, йодид калия реагирует не только с хлором, но и с бромом:
2KI + Cl2 = 2KCl + I2
2KI + Br2 = 2KBr + I2
Пусть с хлором прореагировало х моль йодида калия, тогда с бромом 0,05-х моль
Тогда образуется х моль хлорида калия и 0,05-х моль бромида калия.
Масса образовавшегося хлорида калия:
m(KCl) = n·M = x моль·74,5 г/моль = 74,5x г
m2(KBr) = n·M = (0,05-х) моль·119 г/моль = (5,95 — 119x) г
Масса конечной смеси солей:
mсмеси = mисх(KBr) + m2(KBr) + m(KCl) = 4,77 г + (5,95 — 119x) г + 74.5х = (10,72 — 44,5х) г
Количество атомов брома в конечной смеси:
n(Br) = 0,04 моль + (0,05 — х) моль = (0,09 — х) моль
Масса атомов брома:
m(Br) = n·M = (0,09 — х) моль·80 г/моль = (7,2 — 80х) г
Массовая доля брома в конечной смеси:
ω(Br) = (7,2 — 80х) / (10,72 — 44,5х) = 0,57
Решаем полученное уравнение, находим х:
Количество вещества и масса хлора, который вступил в первую реакцию:
n(Cl2) = 0,5х = 0,5·0,02 = 0,01 моль
m(Cl2) = n·M = 0,01·71 г/моль = 0,71 г
Количество вещества брома, который вступил во вторую реакцию:
n(Br2) = n·M = 0,5(0,05 — 0,02) моль = 0,015 моль
m(Br2) = n·M =0,015 моль·160 г/моль = 2,4 г
Масса смеси галогенов, которые прореагировали с йодидом калия:
m(смеси) = m(Cl2) + m(Br2) = 0,71 г + 2,4 г = 3,11 г
Ответ: 3,11 г
10. (620) Через смесь натрия и бромида калия, в которой массовая доля брома равна 60%, пропустили хлор, в результате чего масса брома в смеси солей оказалась в 2 раза меньше, чем в исходной смеси. Вычислите массовую долю брома в полученной смеси солей.
Примем массу исходной смеси за 100 г, тогда масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 100·0,6 = 60 г
Количество вещества атомов брома:
n(Br) = m/M = 60 г/80 г/моль = 0,75 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,75 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0,75 моль·119 г/моль = 89,25 г
m(Na) = m(смеси) — m(KBr) =100 — 89,25 = 10,75 г
Количество вещества натрия:
n(Na) = m/M = 10,75 г/23 г/моль = 0,467 моль
Поскольку масса брома в смеси уменьшилась в два раза, в реакцию вступила половина исходного бромида калия, то есть 0,375 моль KBr. При этом натрий прореагировал полностью, так как, по условию, образовалась смесь солей:
2Na + Cl2 = 2NaCl
2KBr + Cl2 = 2KCl + Br2
В первой реакции образовался хлорид натрия:
n(NaCl) = n(Na) = 0,467 моль
m(NaCl) = n·M = 0,467 моль ·58,5 г/моль = 27,32 г
Во второй образовался хлорид калия:
n(KCl) = 0,5·n(KBr) = 0,375 моль
m(KCl) = n·M = 0,375 моль ·74,5 г/моль = 27,94 г
И остался бромид калия:
mост(KBr) = n·M = 0,375 моль ·74,5 г/моль = 44,625 г
В конечной смеси масса брома равна:
mост(Br) = n·M = 0,375 моль ·80 г/моль = 30 г
Масса конечной смеси:
mсм = mост(KBr) + m(KCl) + m(NaCl) = 44,625 г + 27,94 г + 27,32 г = 99,89 г
Массовая доля брома в конечной смеси солей:
ω(Br) = mост(Br)=/mсм = 30 г/99,89 г = 0,30 или 30%
Ответ: ω(Br) = 30%
11. (621) К смеси калия и иодида натрия, в которой массовая доля калия равна 40%, добавили бром, в результате чего масса йода в полученной смеси солей уменьшилась в 5 раз по сравнению с исходной. Вычислите массовую долю йода в полученной смеси солей.
Ответ: 6,08%
12. (827) Аммиак, образовавшийся при гидролизе смеси нитрида кальция и нитрида лития, в которой массовая доля азота равнялась 30%, пропустили через 80 мл бромоводородной кислоты. В результате реакции молярная концентрация кислоты уменьшилась с 2,8 до 1,2 моль/л (изменением объема раствора за счет поглощения газа пренебречь). Вычислите массу исходного образца смеси нитридов.
Ответ: 5,97 г.
13. (828) К 1,59%-му раствору карбоната натрия добавили по каплям 40 г 3,78%-го раствора азотной кислоты; в результате в образовавшемся растворе число атомов азота оказалось в 2 раза больше числа атомов углерода. Вычислите массовые доли веществ в получившемся растворе.
Ответ: 1,28% NaNO3, 0,631 NaHCO3.
14. (855)Через 15 г 9,45%-го раствора азотной кислоты пропустили аммиак; в результате в образовавшемся растворе массовая доля азота оказалась равной 3,5%. Вычислите массовые доли веществ в образовавшемся растворе.
15. (951) К смеси фосфата натрия, дигидрофосфата натрия и гидрофосфата натрия общей массой 15 г (молярное соотношение солей в порядке перечисления 3:2:1) добавили 100 г 4%-го раствора гидроксида натрия. Установите количественный состав раствора (в массовых долях).
Ответ: w(Na3PO4) = 14,7%, w(NaOH) = 34,3%.
16. (952) К 2 г смеси гидрофосфата калия и дигидрофосфата калия, в которой массовая доля фосфора равна 20%, добавили 20 г 2%-го раствора фосфорной кислоты. Вычислите массовые доли всех веществ в получившемся растворе.
17. (992) В смеси карбида алюминия и карбида кальция число атомов алюминия равно числу атомов кальция. При гидролизе этой смеси выделяется 1,12 л (н.у.) смеси газов. Вычислите массу исходной смеси карбидов.
Ответ: 2,86 г
18. (1007) Смесь карбоната стронция и гидрокарбоната аммония общей массой 12 г, в которой масса атомов углерода в 12 раз больше массы атомов водорода, добавили к избытку 10%-го раствора серной кислоты. Вычислите массу выпавшего осадка и объем выделившегося газа (н.у.)
Ответ: 2 л, 13,2 г
19. (1009) Какой объем газа (н.у.) выделится при добавлении к 20 г 20%-го раствора серной кислоты 20 г смеси карбоната калия и гидрокарбоната натрия с одинаковым числом атомов калия и водорода?
Ответ: 0,914 л.
20. (1021) В смеси сульфита кальция и гидрокарбоната кальция число атомов кальция в 6 раз больше числа атомов серы. Вычислите плотность по воздуху газовой смеси, образующейся при обработке этой смеси избытком разбавленного раствора серной кислоты.
Ответ: 1,58
21. (1059) Массовая доля калия в растворе, содержащем силикат калия и сульфат калия, равна 0,909%, а масса серы равна массе кремния. К этому раствору добавили в 4 раза меньшую массу соляной кислоты с массовой долей хлороводорода 1,46%. Вычислите, во сколько раз масса серы оказалась больше массы кремния в образовавшемся растворе.
22. (1162) Смесь натрия с другим щелочным металлом поместили в воду. По окончании реакции воду полностью испарили. Массовая доля кислорода в полученной смеси веществ оказалась равной 50%. Вычислите массовые доли веществ в полученной смеси.
Ответ: w(NaOH) =62,5%, w(LiOH) = 37,5%
23. (1215) В смеси оксида ванадия (V) и оксида ванадия (III) массовая доля кислорода равна 40%. Какое количество вещества алюминия понадобится для полного восстановления ванадия из 100 г этой смеси?
Ответ: 1,67 моль
Задача на атомистику, которую составители ЕГЭ по химии рекомендовали к прорешиванию:
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
Ответ: n(O)/n(Р) = 104
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
Ответ: n(O)/n(Р) = 104
Задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года
1. В смеси оксида магния и фосфида магния массовая доля атомов магния равна 54,4%. Они полностью прореагировала с соляной кислотой массой 365 г 34-% раствора. К полученному раствору добавили раствор фторида калия массой 232 грамма 30-% раствора. Найти массовую долю хлорида калия в конечном растворе.
2. Взяли смесь оксида кальция и карбоната кальция. Массовая доля кальция в смеси 50%. Смесь растворили в 300 г раствора избытка соляной кислоты. Выделившийся газ полностью прореагировал с раствором гидроксида натрия массой 200г и массовой долей 8%. Вычислите массовую долю образовавшейся соли.
3. Взяли смесь Cu и CuO . Массовая доля меди в смеси 96%. Полученную смесь растворили в концентрированной серной кислоте массой 496 г, взятой в избытке. Полученный газ растворили в необходимом количестве раствора гидроксида натрия массой 200 г и массовой долей 10%. Найдите массовую долю соли в растворе после растворения.
4. Смесь из оксида и сульфида алюминия, где массовая доля алюминия 50%, залили 700 г, раствора соляной кислоты, взятой в избытке. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди. Вычислите концентрацию соли после того, как залили соляную кислоту.
5. Смесь оксида кальция и карбоната кальция с массовой долей кальция 62,5% растворили в 300 г раствора соляной кислоты. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
Пусть n(CaO) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов кальция в оксида n1(Ca) = х моль, в карбонате: n2(Са) = у моль,
общее количество вещества атомов кальция: n(Са) = (x + y) моль.
Масса атомов кальция: m(Ca) = n(Са)·M(Ca) = 40(x + y) г.
Масса оксида кальция: m(CaО) = n(СаО)·M(CaО) = 56x г.
Масса карбоната кальция: m(CaCO3) = n(CaCO3)·M(CaCO3) = 100у г.
Масса смеси: mсм = m(CaО) + m(CaCO3) = (56х + 100у) г
40(x + y)/(56х + 100у) = 0,625
Преобразуя приведённое выше равенство, получаем х = 4,5у.
Далее протекают реакции:
CaO + 2HCl = CaCl2 + H2O
Количество образовавшегося углекислого газа n(CO2) = y моль, масса m(CO2) = 44y г.
Запишем уравнение материального баланса для конечного раствора:
361,6 = 56х + 100у + 300 — 44у
у = 0,2 моль, х = 0,9 моль.
Количество углекислого газа: n(CO2) = 0,2 моль, масса m(CO2) = 44·0,2 = 8,8 г.
При взаимодействии углекислого газа с гидроксидом натрия возможно образование средней или кислой соли:
NaOH + CO2 = NaHCO3 (2)
Какие продукты образуются, определяется соотношением количества вещества реагентов.
Масса щелочи: m(NaOH) = mр-ра(NaOH) · ω(NaOH) = 80 · 0,1 = 8 г
Количество вещества: n(NaOH) = m(NaOH) / M(NaOH) = 8/40 = 0,2 моль
Соотношение количества вещества реагентов n(NaOH):n(CO2) = 0,2:0,2 = 1:1
Следовательно, протекает только вторая реакция с образованием кислой соли — гидрокарбоната натрия.
n(NaHCO3) = n(CO2) = 0,2 моль
m(NaHCO3) = n(NaHCO3)·M(NaHCO3) = 0,2·84 = 16,8 г
Масса конечного раствора гидрокарбоната:
mр-ра = m(CO2) + mр-ра(NaOH) = 8,8 + 80 = 88,8 г
Массовая доля гидрокарбоната натрия в конечном растворе:
ω(NaHCO3) = m(NaHCO3)/mр-ра = 16,8/88,8 = 0,1892 или 18,92%
Ответ: ω(NaHCO3) = 18,92%
6. Смесь оксида и пероксида натрия, в которой соотношение атомов натрия к атомам кислорода равно 3:2, нагрели с избытком углекислого газа. Полученное вещество растворили в воде. В результате образовалось 600 г раствора. К полученному раствору добавили 229,6 г раствора хлорида железа(III).Найдите массовую долю оксида натрия в исходной смеси, если масса конечного раствора 795 г и массовая доля карбоната натрия в этом растворе 4%.
7. Смесь карбида алюминия и карбида кальция, в которой массовая доля углерода равна 30%, полностью растворили в 547.5 г соляной кислоте. При этом кислота прореагировала без остатка. К образовавшемуся раствору добавили 1260г 8% раствора гидрокарбоната натрия. Найдите массовую долю кислоты в растворе, в котором растворили исходную смесь.
8. В смесь железной окалины и оксида железа(III) добавили 500 г раствора конц. азотной кислоты, причём соотношение атомов железа к атомам кислорода в смеси равно 7:10. Чтобы полностью поглотить выделившийся газ использовали 20 г раствора NaOH с массовой долей 20%.. Найдите массу соли, образовавшейся при добавлении кислоты в смесь.
9. Дана смесь оксида и пероксида бария, в которой число атомов бария относится к числу атомов кислорода как 5:9. Добавили 490 г 20% холодной серной кислоты при этом смесь прореагировала полностью и раствор стал нейтральным. Определить массовую долю воды в полученном растворе.
10. Смесь из оксида лития и нитрида лития с массовой долей атомов лития 56%, смешали с 265 г раствора соляной кислоты с массовой долей 20%. (все вещества полностью прореагировали). После к образовавшемуся раствору добавили 410г 20%- ного фосфата натрия. Найдите массовую долю образовавшегося хлорида натрия.
11. Дан холодный раствор серной кислоты. К нему добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
Холодный раствор серной кислоты реагирует с пероксидом бария без ОВР:
При этом в растворе присутствует пероксид водорода, а сульфат бария выпадает в осадок.
Пусть n(H2O2) = х моль, n(H2O) = y моль, тогда:
количество вещества атомов водорода в пероксиде n1(H) = 2х моль, в воде: n2(Н) = 2у моль,
количество вещества атомов кислорода в пероксиде n1(О) = 2х моль, в воде: n2(О) = у моль,
общее количество вещества атомов водорода: n(Н) = (2x + 2y) моль,
общее количество вещества атомов кислорода: n(О) = (2x + y) моль.
(2x + 2y)/(2x + y) = 9/5
у = 8х
При добавлении каталитического количества оксида марганца (IV) пероксид водорода разлагается:
Пусть весь пероксид водорода разложился, тогда изменение массы раствора равно массе выделившегося газа, то есть массе кислорода:
m(O2) = 6,4 г
n(O2) = m(O2)/M(O2) = 6,4 / 32 = 0,2 моль
Отсюда количество вещества серной кислоты с исходном растворе:
Количество и масса воды не изменялись:
m(H2O) = n(H2O)·M(H2O) = 3,2·18 = 57,6 г
Массовая доля серной кислоты в исходном растворе:
Задачи на «атомистику» из реального ЕГЭ по химии-2020
- Дан раствор массой 200 г, содержащий хлорид железа(II) и хлорид железа(III). В этом растворе соотношение числа атомов железа к числу атомов хлора равно 3 : 8. Через него пропустили хлор до прекращения реакции. К образовавшемуся раствору добавили раствор гидроксида натрия также до полного завершения реакции. При этом образовалось 526,5 г 20%-ного раствора хлорида натрия. Вычислите массовую долю гидроксида натрия в использованном растворе.
Ответ: w(NaOH) = 18,8%
- Смесь цинка и карбоната цинка, в которой соотношение числа атомов цинка к числу атомов кислорода равно 5 : 6, растворили в 500 г разбавленного раствора серной кислоты. При этом все исходные вещества прореагировали полностью, и выделилось 22,4 л смеси газов (н.у.). К этому раствору добавили 500 г 40%-ного раствора гидроксида натрия. Вычислите массовую долю сульфата натрия в конечном растворе.
- Смесь пероксида и оксида бария, в которой соотношение числа атомов бария к числу атомов кислорода равно 5 : 9 растворили в 490 г холодного 20%-ного раствора серной кислоты. При этом соединения бария прореагировали полностью и образовался нейтральный раствор. Вычислите массовую долю воды в образовавшемся растворе.
- Смесь оксида и пероксида натрия, в которой соотношение числа атомов натрия к числу атомов кислорода равно 3 : 2, нагрели в избытке углекислого газа. Продукт реакции растворили в воде и получили 600 г раствора. К этому раствору добавили 229,6 г раствора хлорида железа(III). После завершения реакции масса раствора составила 795 г, а массовая доля карбоната натрия в нём – 4%. Вычислите массу оксида натрия в исходной смеси.
- Смесь железной окалины и оксида железа(III), в которой соотношение числа атомов железа к числу атомов кислорода равно 7 : 10, растворили в 500 г концентрированной азотной кислоты, взятой в избытке. Для полного поглощения выделившегося при этом газа потребовалось 20 г 20%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, образовавшемся после растворения оксидов в кислоте.
- Смесь карбида алюминия и карбида кальция, в которой массовая доля атомов углерода равна 30%, полностью растворили в 547,5 г соляной кислоты. При этом соляная кислота прореагировала без остатка. К образовавшемуся раствору добавили 1260 г 8%-ного раствора гидрокарбоната натрия до полного завершения реакции. Вычислите массовую долю кислоты в растворе, в котором растворили исходную смесь.
- Смесь меди и оксида меди(II), в которой массовая доля атомов меди равна 96%, растворили в 472 г концентрированной серной кислоты, взятой в избытке. Минимальная масса 10%-ного раствора гидроксида натрия, который может прореагировать с выделившимся при этом газом, составляет 200 г. Вычислите массовую долю соли в растворе, образовавшемся после растворения исходной смеси в кислоте.
- Смесь сульфида и оксида алюминия, в которой массовая доля атомов алюминия равна 50%, растворили в 700 г соляной кислоты, взятой в избытке. Для полного поглощения выделившегося при этом газа потребовалось 240 г 20%-ного раствора сульфата меди(II). Вычислите массовую долю соли в растворе, образовавшемся после растворения сульфида и оксида алюминия в кислоте.
- Смесь карбоната кальция и оксида кальция, в которой массовая доля атомов кальция равна 62,5%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 361,6 г. Выделившийся в результате реакции газ полностью поглотился 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, получившемся в результате реакции.
- Смесь кальция и карбоната кальция, в которой массовая доля атомов кальция равна 50%, растворили в 300 г соляной кислоты, взятой в избытке. При этом образовался раствор массой 330 г. Один из выделившихся в результате реакции газов полностью поглотился 200 г 8%-ного раствора гидроксида натрия. Вычислите массовую долю соли в растворе, получившемся в результате реакции.
- Смесь оксида магния и фосфида магния, в которой массовая доля атомов магния равна 54,4%, растворили в 365 г 34%-ной соляной кислоты. При этом реагирующие вещества вступили в реакцию полностью. К полученному раствору добавили 232 г 30%-ного раствора фторида калия. Вычислите массовую долю хлорида калия в конечном растворе.
Ответ: w(KCl) = 14,9%
- Смесь оксида лития и нитрида лития, в которой массовая доля атомов лития равна 56%, растворили в 365 г 20%-ной соляной кислоты. При этом реагирующие вещества вступили в реакцию полностью. К полученному раствору добавили 410 г 20%-ного раствора фосфата натрия. Вычислите массовую долю хлорида натрия в конечном растворе.
Ответ: w(NaCl) = 11,9%
- В колбу с холодным раствором серной кислоты внесли пероксид бария, при этом оба вещества между собой прореагировали полностью. В образовавшемся растворе соотношение числа атомов водорода и атомов кислорода составило 9 : 5. Затем в колбу добавили каталитическое количество оксида марганца(IV). При этом произошла реакция, в результате которой масса раствора в колбе уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты, которая содержалась в исходном растворе.
- Железную пластинку полностью растворили в 500 г раствора кислоты. Объем выделившейся смеси оксида азота(II) и оксида азота(IV) составляет 20,16 л (н.у.). В этой смеси соотношение числа атомов кислорода к числу атомов азота равно 5 : 3. Вычислите массовую долю соли в полученном растворе.
- Смесь сульфата железа(II) и сульфата железа(III), в которой соотношение числа атомов железа к числу атомов серы равно 3 : 4, поместили в 126,4 г раствора перманганата калия, подкисленного серной кислотой, с массовой долей перманганата калия 5%. Все вещества, участвующие в окислительно-восстановительной реакции, прореагировали полностью. Вычислите массу 20%-ного раствора гидроксида натрия, который требуется добавить к полученному раствору для полного завершения всех реакций.
Как решать задачи по химии. Расчет по уравнениям химических реакций.
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_<2>SO_ <4>+ NaOH → Na_<2>SO_ <4>+ H_<2>O
H_<2>SO_ <4>+ 2NaOH → Na_<2>SO_ <4>+ 2H_<2>O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅10 23 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅10 23 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅10 23 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
beginH_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end
Следом запишем молярные массы для этих веществ
begin H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin49 : г & & X : г & & & & \ H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin49 : г & & X : г & & & & \ H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
[spoiler title=”источники:”]
http://chemege.ru/zadachi-na-atomistiku/
http://in-chemistry.ru/kak-reshat-zadachi-po-himii-raschet-po-uravneniyam-himicheskih-reaktsij
[/spoiler]
Мольные доли вещества и количество атомов
| Формула химического вещества(Добавьте ! если используете для школьных расчетов) |
| Масса указанного вещества в граммах |
| Заданная формула |
| Количество вещества в указанной массе |
| Мольные доли (сумма равна единице) |
| В одном моль вещества находятся(поэлементно) |
| Количество атомов в веществе(поэлементно) |
| Масса каждого из элемента в указанном веществе |
Мольная доля химического элемента в веществе помогает узнать, сколько моль содержится в том или ином веществе.
Просьба не путать это с массовой долей химического вещества. Это совершенно разные сущности.
Покажем, как вычисляется мольная доля на примере аммоний азотнокислого.
В одном 1 моль вещества содержится
Кислорода 3 моль ( 
Азота 2 моль
Водорода 4 моль ( 
Соответственно мольные доли равны
Кислорода 3/(3+2+4)=0.33333
Азота 2/(3+2+4)=0.22222
Водорода 4/(3+2+4)=0.4444444
В 1 моль любого химического вещества содержится постоянное количество атомов/молекул равное
Таким образом
Количество атомов кислорода
Количество атомов азота
Количество атомов водорода
У некоторых читателей может возникнуть недопонимание, как так в 1 моль вещества находится 2 моль азота + 4 моль водорода+3 моль кислорода.
Да и с количеством атомов, тоже получается путаница.
Объясняем на примере воды…
В одном моль воды 
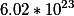
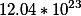
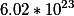
Калькулятор который представлен на сайте, может решать следующие задачи
– Расчет мольных долей химических элементов, входящих в формулу
– Расчет количества каждого из химического элемента
– Число атомов химического элемента в 1 моль заданного вещества
– При вводе массы вещества, расчет количества этого вещества (в моль)
Рассмотрим несколько примеров.
1. Чему равна мольная доля кислорода в нитрат калия?
Пишем формулу. Получаем результат
| Заданная формула |
 |
| Количество вещества в указанной массе |
|
0.9700333916236084 моль |
| Мольные доли (сумма равна единице) |
|
N=0.2 |
Ответ 0.6
2. Сколько атомов серы и кислорода находится в 10 граммах серной кислоты?
Формула серной кислоты 
| Количество атомов в веществе(поэлементно) |
|
H=1.2276509409067566*10^²³ |
3. Сколько молей азота и водорода находится в 5 моль аммония сульфат?
Пишем формулу и смотрим
| Заданная формула |
2SO_{4}}$) |
| Количество вещества в указанной массе |
|
0.07568045049847685 моль |
| Мольные доли (сумма равна единице) |
|
H=0.53333333333333 |
| В одном моль вещества находятся(поэлементно) |
|
H=8 моль |
В одном моль вещества находится 2 моль азота и 8 моль водорода. Значит в 5 моль вещества будет…
2*5 моль азота =10 и 8*5 моль водорода=40. Это наш ответ.
4. Рассчитать количество вещества 20 грамм оксида железа и массу железа в этом веществе.
Пишем формулу и массу. Получаем
| Заданная формула |
 |
| Количество вещества в указанной массе |
|
0.27837163727062175 моль |
| Мольные доли (сумма равна единице) |
|
Fe=0.5 |
| В одном моль вещества находятся(поэлементно) |
|
Fe=1 моль |
| Количество атомов в веществе(поэлементно) |
|
Fe=1.6757972563691428*10^²³ |
| Масса каждого из элемента в указанном веществе |
|
Fe=15.546220826 грамм |
Наш ответ: количество вещества 0.27837163727062175 моль
масса железа в 20 граммах оксида железа Fe=15.546220826 грамм
И последняя 5 задача
5.Сколько молекул вещества в 100 граммах Na2SO4?
Вводим формулу, вводим массу и думаем.
В этой задаче не надо складывать количество атомов каждого из химического элемента, входящих в формулу. Этот ответ будет неправильный.
Нам надо узнать количество молекул(!) вещества. Поэтому просто узнаем количество моль этого вещества и умножаем на постоянную Авогадро (6.02*10^²³ )
 |
| Количество вещества в указанной массе |
|
0.704225352112676 моль |
поэтому число молекул в ста граммах равно 6.02*0.704*10^²³=4.24*10^²³
Удачных расчетов!