Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
- Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные), таблицу Менделеева, манометр, термометр.
Инструкция
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С), определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту), выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром), то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
Видео по теме
Обратите внимание
Как найти количество атомов в веществе. Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023. Вам понадобится.
Полезный совет
Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Зная это число, можно различными способами, которые и были испробованы в 1908-1910 гг., найти число N. Можно собрать α-частицы в цилиндре Фарадея, измерить их заряд и, разделив его на число частиц, получить заряд каждой из них; половина его дает нам элементарный заряд, по которому уже определяется число N…
Источники:
- как определить количество атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Для
определения числа атомов (молекул) в
определенном количестве вещества
необходимо воспользоваться следующей
формулой: N = ν · NA,
где
N – число частиц (атомов или молекул).
Например,
определим количество атомов алюминия,
содержащиеся в 2 моль вещества алюминия:
N (Al) = ν (Al) · NA.
N
(Al) = 2 моль · 6,02 · 1023
![]()
= 12,04 · 1023
(атомов).
Кроме того, можно определить
количество вещества по известным числом
атомов (молекул):
![]() .
.
Например,
определим количество вещества
молекулярного кислорода, которая
содержит 3,01 · 1023
молекул кислорода:.
![]()
.
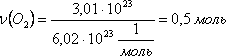
.
Количество вещества определяется числом
структурных единиц (атомов, молекул,
ионов или других частиц) этого вещества.
Количество вещества обозначается
буквой.
9.
Уравнение Менделеева- Клайперона.
PV=(m/M)RT,
где R-
универсальная газовая постоянная,
равная 8,31 Дж/(К*моль)
10.
Эквивалент. Закон эквивалентов.
Эквивалент-
часть вещества, реагирующая без остатка
с одним эквивалентом водорода или вообще
с одним эквивалентом любого другого
вещества.
Закон
эквивалентов: «Вещества
взаимодействуют друг с другом в
эквивалентных количествах» , или «массы
реагирующих веществ пропорциональны
их эквивалентам либо эквивалентным
массам (объемам): m1/m2=
Э1/Э2».
11.
Значения эквивалентов водорода и
кислорода.
Эm(Н2)=1
г/экв
Эm(О2)=
8 г/экв
12.
Молярная масса эквивалента, молярный
объем эквивалента.
Молярная
масса эквивалента элемента в соединении
не является величиной постоянной,
зависит от валентности элемента в данном
соединении и выражается уравнением:
 ,
,
где
М – молярная масса элемента, г/моль; Z –
валентность элемента в данном соединении;
1/z – фактор эквивалентности
Эквивалентный
объем или объем моля эквивалента Vэ(X)
– это объем, который занимает один моль
эквивалентов газообразного вещества
при нормальных условиях (н.у.).
13.
Эквивалент кислоты, основания, соли.
Кислоты:
определяется отношением Mr
основания к числу атомов водорода в
формуле кислоты, способных заместиться
на металл (основность кислоты). Например
эквивалент серной кислоты Н2SO4=
98/2= 49 (1/2*М)
Основания:
определяется отношением Mr
основания к числу гидроксильтных групп
ОН в формуле основания, способных
заместиться на кислотный остаток
(кислотность основания). Например,
эквивалент едкого натра равен ЭNaOH=
40/1= 40, т.е. у этого вещества значения
эквивалента и молекулярной массы
совпадают. (1/3*М)
Соли:
определяется как частное от деления Mr
соли на суммарный заряд катионов. Так,
эквивалент сульфата аллюминия ЭAl2SO4=
342/6= 57. (М/ сумм. Заряд)
Оксида:
равен сумме эквивалентов кислорода и
элемента, образующего данный оксид.
Например, эквивалент оксида аллюминия
равен: Al2O3=
ЭAl+
ЭО. Поскольку алюминий трехвалентен,
то ЭAl=
ArAl/B=
27/3=9, следовательно, ЭAl2O3=
9+8=17. Тоже получим, разделив Mr
оксида на суммарный заряд катионов
металла: 102/6=17.
14.
Закон Авогадро. Следствия из закона
Авогадро.
Закон:
«В равных объемах любых газов при
одинаковых условиях содержится одинаковое
число молекул» .
Следствия:
–
одинаковое число молекул различных
газов при одинаковых условиях ( давлении
и температуре) занимает одинаковый
объем.
–
один моль любого газа при определенных
условиях занимает постоянный объем.
15.
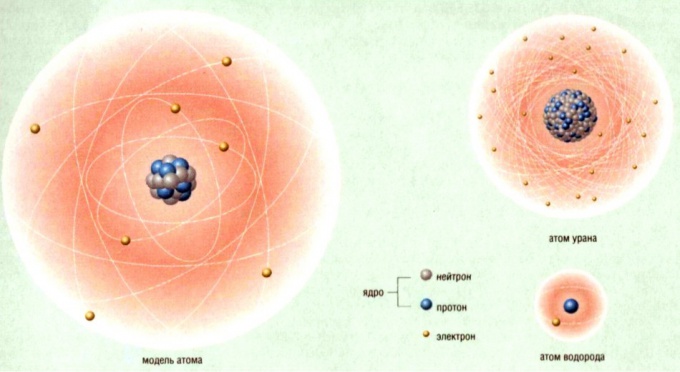
Строение атома: модель Томпсона.
В
атоме Томсона положительное электричество
«размазано» по сфере, в которую вкраплены,
как изюм в пудинг, электроны. В простейшем
атоме водорода электрон находится в
центре положительно заряженной сферы.
При смещении из центра на электрон
действует квазиупругая сила
электростатического притяжения, под
действием которой электрон совершает
колебания. Частота этих колебаний
определяется радиусом сферы, зарядом
и массой электрона, и если радиус сферы
имеет порядок радиуса атома, частота
этих колебаний совпадает с частотой
колебания спектральной линии атома. В
многоэлектронных атомах электроны
располагаются по устойчивым конфигурациям,
рассчитанным Томсоном. Томсон считал
каждую такую конфигурацию определяющей
химические свойства атомов. Он предпринял
попытку теоретически объяснить
периодическую систему элементов Д. И.
Менделеева. Эту попытку Бор позднее
назвал «знаменитой» и указал, что со
времени этой попытки «идея о разделении
электронов в атоме на группы сделалась
исходным пунктом и более новых воззрений».
Отметив, что теория Томсона оказалась
несовместимой с опытными фактами, Бор
тем не менее считал, что эта теория
«содержит много оригинальных мыслей и
оказала большое влияние на развитие
атомной теории».
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Содержание:
Составление химических формул по валентности:
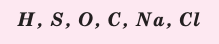
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
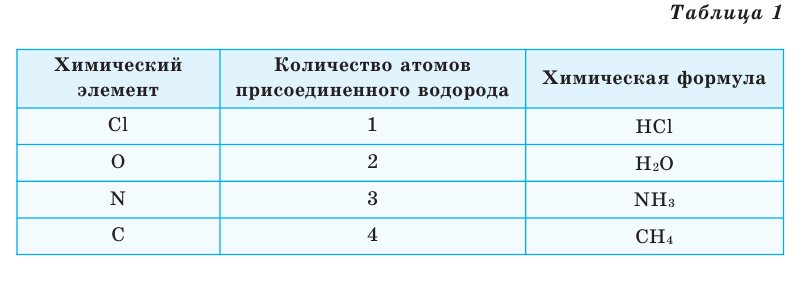
Из таблицы становится ясно, что атом хлора присоединяется с 1, атом кислорода – с 2, атом азота – с 3, а атом углерода – с 4 атомами водорода. Следовательно, химические элементы обладают разной способностью присоединять к себе атомы водорода. Для объяснения этого пользуются понятием «валентности». Свойство атомов химических элементов присоединять к себе определенное число атомов других химических элементов называют валентностью. Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.

Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Кислород в угарном газе в ионе гидроксония 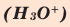 является I I I – валентным. А углерод бывает I I I – валентным только в угарном газе
является I I I – валентным. А углерод бывает I I I – валентным только в угарном газе 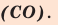
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
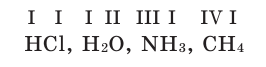
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
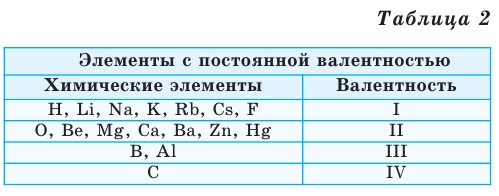
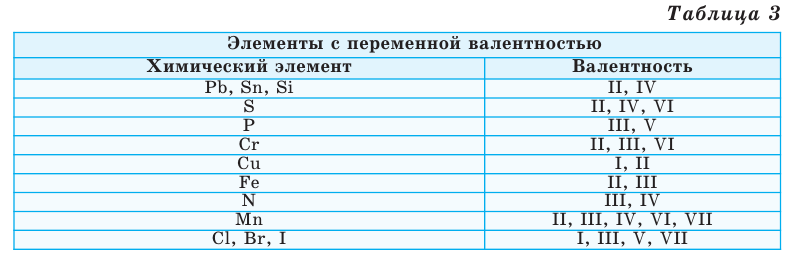
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении 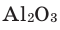 (оксид алюминия).
(оксид алюминия).
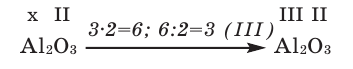
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
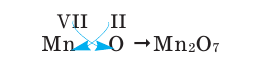
3) Если при составлении формулы по валентности полученные индексы сократить до минимальных целых чисел, в таком случае можно, проведя эту операцию, получить простую формулу вещества (поделив VI и II на самый большой делитель – 2, можно получить формулу).
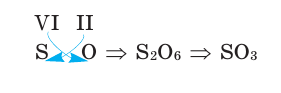
Химическая формула

Заполните таблицу. Как произносится химическая формула вещества?
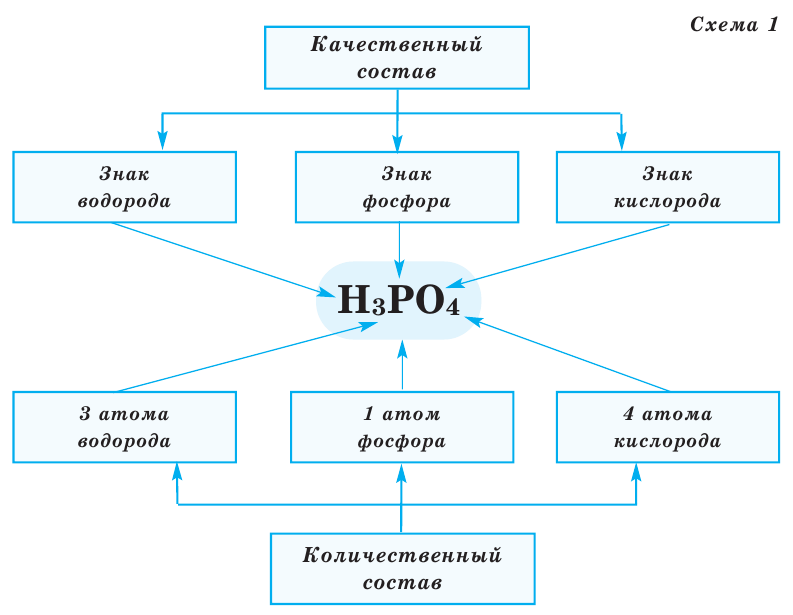
Все вещества имеют химическую формулу. Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав – число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
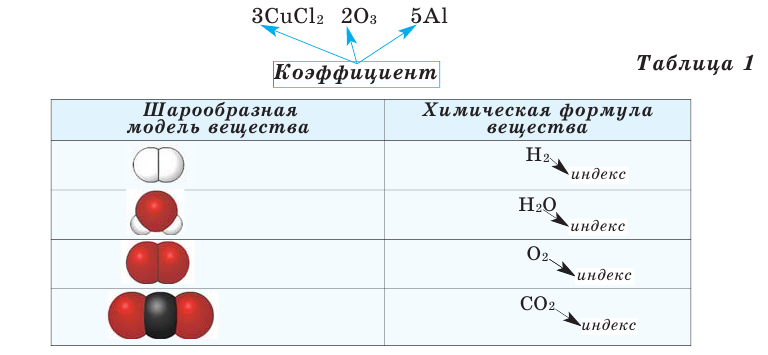
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе (таблица 2).

Пользуясь краткими названиями химических элементов, можно прочитать формулы:

Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).
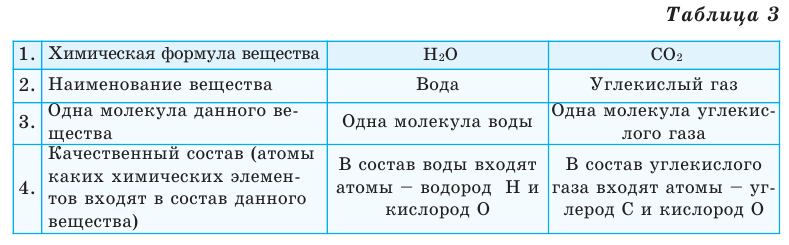

Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два раза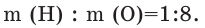 Т.е. при распаде 9 г воды будут получены 1 г водорода и 8 г кислорода. При сопоставлении данных чисел с относительными атомными массами элементов можно прийти к выводу, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Состав воды и других химических соединений, независимо от способа их получения и места нахождения, всегда остается постоянным. Основываясь на этом, в 1799 году французским химиком Ж.Л.Прустом был открыт «Закон постоянства состава веществ». В настоящее время закон постоянства состава веществ выражается следующим образом: Независимо от способа получения, состав и свойства химических соединений молекулярного строения всегда постоянны.
Т.е. при распаде 9 г воды будут получены 1 г водорода и 8 г кислорода. При сопоставлении данных чисел с относительными атомными массами элементов можно прийти к выводу, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Состав воды и других химических соединений, независимо от способа их получения и места нахождения, всегда остается постоянным. Основываясь на этом, в 1799 году французским химиком Ж.Л.Прустом был открыт «Закон постоянства состава веществ». В настоящее время закон постоянства состава веществ выражается следующим образом: Независимо от способа получения, состав и свойства химических соединений молекулярного строения всегда постоянны.

Французский химик. В период с 1799 по 1806 гг. исследовал составы различных оксидов, сульфидов и других веществ. В итоге им был открыт закон постоянства состава химических соединений.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ имеет немолекулярное строение. Как же составляются химические формулы этих веществ? Химические формулы веществ с немолекулярным строением составляются на основе количественного соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения. В результате таких исследований стало известно, что в кварце количественное соотношение между атомами кремния (Si) и кислорода (О) составляет 1:2. Значит, его формулу можно представить в виде: 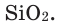 В хлориде алюминия же соотношение между ионами алюминия
В хлориде алюминия же соотношение между ионами алюминия 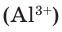 и хлора
и хлора  Следовательно, его формула –
Следовательно, его формула – 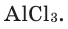
Начальные химические понятия и законы
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово “атом” в переводе с древнегреческого языка означает ~ “неделимый”.
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами. Например, Н (аш) — химический символ водорода, от латинского слова Hydrogenium (“образующий воду”).
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674•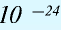 г. Абсолютная масса атома углерода — 19,993•
г. Абсолютная масса атома углерода — 19,993•  г.
г.
Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше 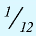 массы атома — изотопа
массы атома — изотопа 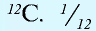 массы атома — изотопа
массы атома — изотопа 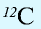 равна 1,66057•
равна 1,66057•  — 1 а.е.м.
— 1 а.е.м.
Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02• частиц (атомов, молекул, ионов). Число 6,02•
частиц (атомов, молекул, ионов). Число 6,02•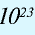 называется постоянной Авогадро.
называется постоянной Авогадро.
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, 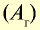 |
Число атомов в 1 моле |
| Водород | Н | 1,674•  |
1,008 | 6,02• |
| Кислород | О | 26,567• |
15,999 | 6,02• |
| Углерод | С |
19,993• |
12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667• г. Определите его относительную атомную массу.
г. Определите его относительную атомную массу.
Решение. Единица массы 1 атома равна 1,66057• г.
г.
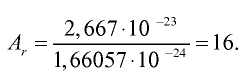
Ответ: 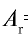 =16.
=16.
Пример №2
Какой будет масса (г) 0,301 •  атомов кислорода?
атомов кислорода?
Решение. 6,02 • атомов кислорода составляют 1 моль и равны 16 г.
атомов кислорода составляют 1 моль и равны 16 г.
Тогда, если 6,02 •  атомов кислорода —16 г, то 0,301•
атомов кислорода —16 г, то 0,301• атомов кислорода — х.
атомов кислорода — х.
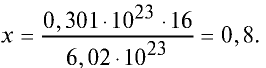
Ответ: 0,8 г.
Определение химической формулы
- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например: 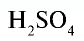 — серная кислота. Химическая формула
— серная кислота. Химическая формула 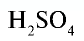 показывает, что это — одна молекула серной кислоты, в которой содержатся 2 атома водорода, 1 атом серы и 4 атома кислорода, или 1 моль вещества.
показывает, что это — одна молекула серной кислоты, в которой содержатся 2 атома водорода, 1 атом серы и 4 атома кислорода, или 1 моль вещества.
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (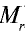 ) и количество молей вещества:
) и количество молей вещества:
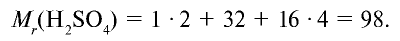
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (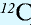 ).
).
В 12 г углерода содержится 6,02• атомов.
атомов.
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 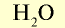 |
18 | 1 | 6,02• |
| Углекислый газ | 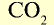 |
44 | 1 | 6,02• |
| Серная кислота | 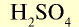 |
98 | 1 | 6,02• |
Валентность
1. Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность: 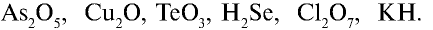
Решение.
1) 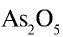 — валентность кислорода равна двум. Число атомов кислорода — пять, валентность каждого — два, общая валентность атомов кислорода (2•5=10) равна 10. Общая валентность мышьяка также должна быть равна десяти. Число атомов мышьяка в соединении — два: 10: 2 = 5. Следовательно, каждому атому мышьяка соответствуют 5 единиц. Валентность мышьяка в соединении — 5;
— валентность кислорода равна двум. Число атомов кислорода — пять, валентность каждого — два, общая валентность атомов кислорода (2•5=10) равна 10. Общая валентность мышьяка также должна быть равна десяти. Число атомов мышьяка в соединении — два: 10: 2 = 5. Следовательно, каждому атому мышьяка соответствуют 5 единиц. Валентность мышьяка в соединении — 5;
2) 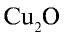 — 21•2, 2:2=1. Медь одновалентна;
— 21•2, 2:2=1. Медь одновалентна;
3) 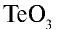 — 2•3 = 6, 6:1=6. Теллур шестивалентен;
— 2•3 = 6, 6:1=6. Теллур шестивалентен;
4) 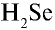 — 1•2 = 2, 2:1 = 2. Селен двухвалентен;
— 1•2 = 2, 2:1 = 2. Селен двухвалентен;
5) 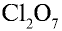 — 2 • 7 = 14, 14 : 2 = 7. Хлор семивалентен;
— 2 • 7 = 14, 14 : 2 = 7. Хлор семивалентен;
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — 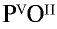 ;
;
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
5) запишем найденные числа атомов в индексе химических символов – 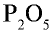 .
.
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
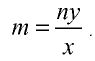
Например, валентность углерода в 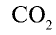 , равна
, равна 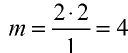 ; валентность кислорода —n = 2, число атомов кислорода — у = 2, число атомов углерода — х = 1.
; валентность кислорода —n = 2, число атомов кислорода — у = 2, число атомов углерода — х = 1.
Количество вещества
Определение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) 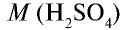 = 98 г/моль;
= 98 г/моль;
2) вычислим количество вещества n по формуле
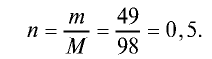
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
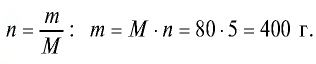
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). 1 моль вещества в газообразном или парообразном состоянии при н.у. занимает объем 22,4 л, который называется молярным объемом (табл. 3).
Таблица 3
Молярные объемы некоторых газообразных веществ
| Вещество | 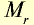 |
Молярная масса, г/моль | Молярный объем, л | Число молекул |
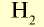 |
2 | 2 | 22,4 | 6,02• |
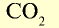 |
44 | 44 | 22,4 | 6,02• |
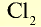 |
71 | 71 | 22,4 | 6,02• |
Плотность газа определятся по формуле 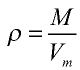 , а относительная плотность газа — по формуле
, а относительная плотность газа — по формуле 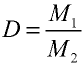 .
.
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) 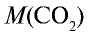 – 44 г/моль;
– 44 г/моль;
2) вычислим объем 22 г  с помощью пропорции: 44 г
с помощью пропорции: 44 г 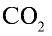 занимают объем 22,4 л, 22 г
занимают объем 22,4 л, 22 г 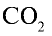 — займут х л объема,
— займут х л объема,
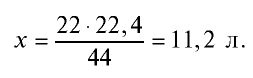
Ответ: 22 г 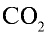 занимают объем 11,2 л.
занимают объем 11,2 л.
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
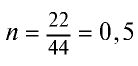 моля.
моля.
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Каким будет объем 90 г воды, переведенной в газообразное (пар) состояние при 20°С ?
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М(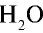 ) = 18 г/моль;
) = 18 г/моль;
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г 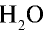 (пар) занимают объем 22,4 л,
(пар) занимают объем 22,4 л,
90г 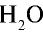 (пар) — х л объема,
(пар) — х л объема,
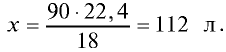
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
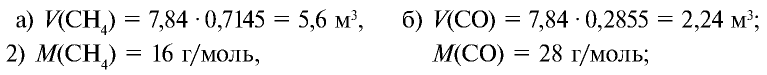
3)найдем массу 5,6 м3 СН4 с помощью пропорции: 22,4 м3 СН4 – 16 кг,
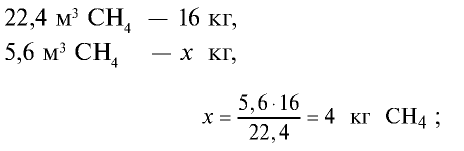
4) найдем массу 2,24 м3 СО с помощью пропорции: 22,4 м3 СО – 28 кг,
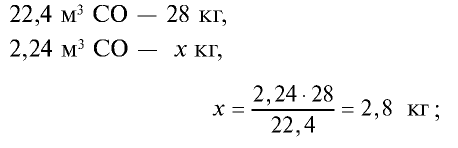
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Рассчитайте количество вещества и число молекул в 1 л воды при 20°С .
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т{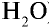 ) = 1000 см3 • 1 г/см3 = 1000 г;
) = 1000 см3 • 1 г/см3 = 1000 г;
2) вычислим количество вещества в 1000 г воды:
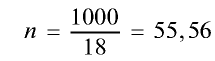 моль.
моль.
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02• молекул, в 55,56 молях воды — х молекул,
молекул, в 55,56 молях воды — х молекул,
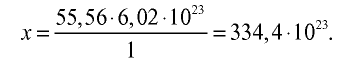
Ответ: в 1 л воды содержится 55,56 моля, 334,4 •  или 3,344 •
или 3,344 • 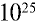 молекул.
молекул.
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г  :
:
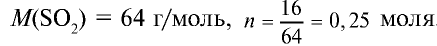 .
.
2) вычислим, какой объем займут 16 г (или 0,25 моля)  с помощью пропорции:
с помощью пропорции:
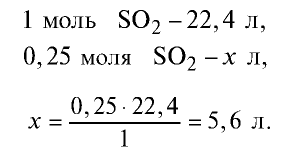
Ответ: 16 г  займут 5,6 л объема.
займут 5,6 л объема.
Вычисление плотности газов
Плотность газов определяется путем деления их молярной массы на молярный объем:
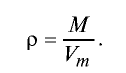
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
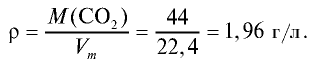
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Из формулы
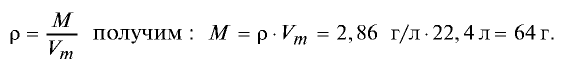
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газов
Пример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
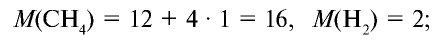
2) определим плотность метана относительно водорода:
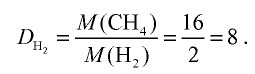
Ответ: плотность метана относительно водорода равна 8, или метан тяжелее водорода в 8 раз.
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
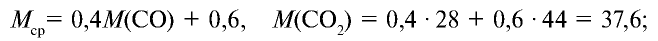
2) вычислим плотность газовой смеси относительно водорода:
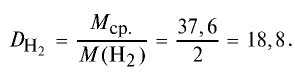
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении “Азот” в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M(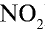 ) = 46 г/моль.
) = 46 г/моль.
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
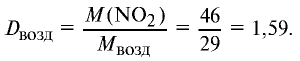
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
Из формулы
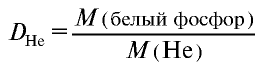
следует, что М(белый фосфор) = 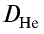 • М (Не) = 31•4 = 124 г/моль.
• М (Не) = 31•4 = 124 г/моль.
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента: 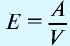
Эквивалентность оксида выражается формулой: 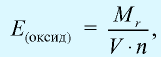 где
где  — молекулярная масса оксида; V — валентность элемента, образующего оксид; n — число атомов элемента, образующего данный оксид.
— молекулярная масса оксида; V — валентность элемента, образующего оксид; n — число атомов элемента, образующего данный оксид.
Эквивалентность оснований выражается формулой: 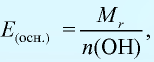
где  — молекулярная масса основания; n(ОН) — число гидроксильных групп в основании.
— молекулярная масса основания; n(ОН) — число гидроксильных групп в основании.
Эквивалентность кислот выражается формулой: 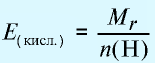 где
где  — молекулярная масса кислоты;
— молекулярная масса кислоты;
n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: 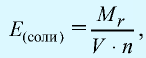 где
где  — молекулярная масса соли; V — валентность металла, образующего соль; n — число атомов металла, образующего соль.
— молекулярная масса соли; V — валентность металла, образующего соль; n — число атомов металла, образующего соль.
Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
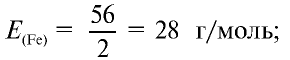
2) найдем эквивалентность железа в трехвалентных соединениях:
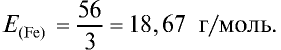
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
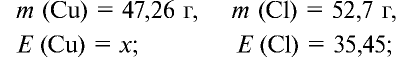
2) определим эквивалентность меди, пользуясь формулой 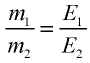
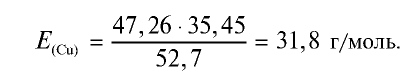
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: 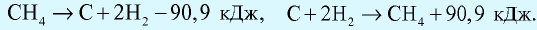 Тепловой эффект реакций обусловлен природой исходных веществ и образовавшихся продуктов и не имеет отношения к промежуточным этапам реакции (закон Гесса).
Тепловой эффект реакций обусловлен природой исходных веществ и образовавшихся продуктов и не имеет отношения к промежуточным этапам реакции (закон Гесса).
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
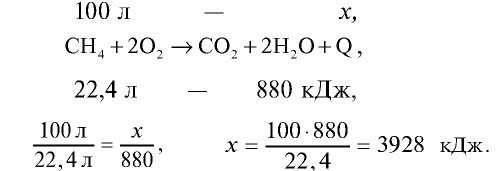
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования  — 46,2 кДж/моль.
— 46,2 кДж/моль.
Решение.
Запишем реакцию горения аммиака:
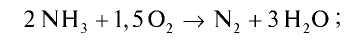
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
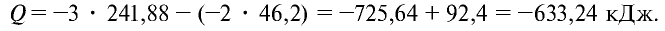
Ответ: 633,24 кДж.
- Относительная атомная и относительная молекулярная масса
- Молярная масса в химии
- Физические и химические явления
- Растворы в химии
- Вещества и их свойства в химии
- Чистые вещества и смеси в химии
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
Какая ж тут формула может быть? Пишем молекулярную формулу и подсчитываем сумму индексов.
H2O = 2 + 1 = 3
CO2 = 1 + 2 = 3
CO = 1 + 1 = 2
Или нарисовать молекулу и собственным корявым пальцем пересчитать атомы.
Похоже Вы не так поняли. Афтор спрашивает “в веществе”, а не в молекуле.
По формуле N=NAm/M, где NA – пост.Авогадро, M – молярная масса и, собственно, N – количество молекул в образце массой m. Далее N умножить на количество атомов в одной молекуле.
