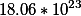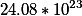Виктория
Ученик
(215),
закрыт
10 лет назад
Вячек
Высший разум
(391245)
11 лет назад
Стоит (на будущее) твёрдо запомнить – в 1 моле любого вещества содержится 6,02*10 в 23-ей степени частиц (молекул, атомов, ионов и т. д.) . Это число Авогадро.
Стало быть в любом случае нужно вычислить количество вещества в молях, а затем уж число атомов или молекул
Как найти количество атомов
Иногда перед исследователями встает такая задача: как определить количество атомов того или иного вещества? Первоначально она может показаться исключительно сложной, ведь количество атомов даже в крохотном образце какого-либо вещества просто грандиозное. Как же их подсчитать?

Инструкция
Предположим, вам надо подсчитать количество атомов в куске чистого металла – например, железа, меди или даже золота. Да, представьте себя на месте великого ученого Архимеда, которому царь Гиерон дал совсем другое поручение, сказав: «Знаешь, Архимед, напрасно я подозревал своего ювелира в мошенничестве, корона-то оказалась из чистого золота! Нашему царскому величеству теперь угодно знать, сколько в ней золотых атомов».
Настоящего Архимеда задача, естественно, ввергла бы в ступор, хоть он и был гением. Ну а вы справились бы с нею в два счета. Сначала надо точно взвесить корону. Предположим, она весила бы ровно 2 кг, то есть 2000 граммов. Потом по таблице Менделеева установите молярную массу золота (примерно 197 грамм/моль.) Для упрощения расчетов чуть-чуть округлите в большую сторону – пусть будет 200 грамм/моль. Следовательно, в злополучной короне ровно 10 молей золота. Ну а потом возьмите универсальное число Авогадро (6,022х1023), умножьте на 10 и с торжеством отнесите результат царю Гиерону.
Ну а если надо подсчитать количество атомов газа? Задача чуть сложнее, но тоже легкорешаемая. Надо только с достаточной точностью измерить температуру, объем и давление газа.
А потом воспользуйтесь хорошо знакомым уравнением Менделеева–Клапейрона: PV = MRT/m. Обратите внимание, что M/m является ничем иным, как количеством молей данного газа, поскольку M – его фактическая масса, а m – молярная.
Подставьте известные вам величины в дробь PV/RT, найденный результат умножьте на универсальное число Авогадро (6,022*1023) и получите количество атомов газа при заданном объеме, давлении и температуре.
А если требуется подсчитать количество атомов в образце сложного вещества? И тут нет ничего особо трудного. Взвесьте образец, потом напишите его точную химическую формулу, с помощью Таблицы Менделеева уточните молярную массу каждого компонента и вычислите точную молярную массу этого сложного вещества (учтя при необходимости индексы элементов).
Ну а потом узнайте количество молей в исследуемом образце (поделив массу образца на молярную массу) и умножьте полученный результат на величину числа Авогадро.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
An atom is an element. The two words are synonymous, so if you’re looking for the number of atoms in an element, the answer is always one, and only one. Scientists know of 118 different elements, which they categorize in the periodic table, a diagram that arranges them in increasing order according to the number of protons in their nuclei. This arrangement allows you to answer a significant question at a glance: “What is the number of protons in a particular element?” To answer that, you simply need to look at the place the element occupies in the chart. The place number corresponds to the number of protons.
TL;DR (Too Long; Didn’t Read)
If you have a sample that contains atoms of a single element, you can find the number of atoms by weighing it.
Elements That Form Diatomic Molecules
Some atoms can form covalent bonds with other atoms of the same element to form diatomic molecules. The best known is oxygen (O). A single oxygen atom is highly reactive, but when it forms a bond with another oxygen atom to form O2, the combination is more stable. This is the form in which oxygen exists in the earth’s atmosphere. Four other elements can combine in this way at standard temperature and pressure. They include nitrogen (N), which is the most abundant element in the atmosphere, hydrogen (H), chlorine (Cl) and fluorine (F). Two other elements, bromine (Br) and iodine (I), can form diatomic molecules at higher temperatures. All diatomic molecules contain two atoms.
Noble Gases and Metals
Some atoms, such as sodium and phosphorous, are so reactive that they are never found free in nature. However, two groups of elements, the noble gases and noble metals, are stable and can exist in samples that contain only non-bound atoms of that element. For example, a container full of argon gas (Ar) contains only argon atoms, and a bar of pure gold contains only gold (Au) atoms. If you have a large sample of a noble gas or metal, you can calculate how many atoms it contains by weighing it.
In addition to these gases and metals, carbon (C) can also exist in the free state. Diamond and graphite are the two most common forms. Among non-metals, carbon is unique in its ability to exist in this way.
Counting Atoms
To calculate the number of atoms in a sample, you need to find how many moles of the element the sample contains. A mole is a unit chemists use. It’s equal to Avogadro’s number (6.02 X 1023) of atoms. By definition, the weight of one mole of an element (its molar mass) is equal to its atomic weight in grams. The atomic weight for each element is on the periodic table right under the element’s symbol. The atomic weight of carbon is 12 atomic mass units (amu), so the weight of one mole is 12 grams.
If you have a sample that contains only atoms of a particular element, weigh the sample in grams and divide by the atomic weight of the element. The quotient tells you the number of moles. Multiply that by Avogadro’s number, and you’ll find out how many atoms the sample contains.
Examples
1. How many atoms are there in one ounce of pure gold?
An ounce is 28 grams, and the atomic weight of gold is 197. The sample contains 28 ÷ 197 = 0.14 moles. Multiplying this by Avogadro’s number tells you the number of atoms in the sample = 8.43 x 1022 atoms.
2. How many oxygen atoms are there in a gas sample that weighs 20 grams?
The same procedure applies to finding the number of atoms in a diatomic gas, even though the atoms have combined to form molecules. The atomic weight of oxygen is 16, so one mole weighs 16 grams. The sample weighs 20 grams, which is equal to 1.25 moles. Therefore, the number of atoms is 7.53 x 1023.
Металлы
имеют относительно сложные типы
кубических решеток – объемно
центрированная (ОЦК) и гранецентрированная
(ГЦК) кубические решетки.
Основу
ОЦК-решетки составляет элементарная
кубическая ячейка (рис. 1.2,б), в которой
положительно заряженные ионы металла
находятся в вершинах куба, и еще один
атом в центре его объема, т. е. на
пересечении его диагоналей. Такой тип
решетки в определенных диапазонах
температур имеют железо, хром, ванадий,
вольфрам, молибден и др. металлы.
У
ГЦК-решетки (рис. 1.2, в) элементарной
ячейкой служит куб с центрированными
гранями. Подобную решетку имеют железо,
алюминий, медь, никель, свинец и др.
металлы.
Третьей
распространенной разновидностью
плотноупакованных решеток является
гексагональная плотноупакованная (ГПУ,
рис. 1.2, г). ГПУ-ячейка состоит из отстоящих
друг от друга на параметр с параллельных
центрированных гексагональных
оснований. Три иона (атома) находятся
на средней плоскости между основаниями.
У
гексагональных решеток отношение
параметра с/а всегда
больше единицы. Такую решетку имеют
магний, цинк, кадмий, берилий, титан
и др.
объемно-центрированная
кубическая (ОЦК)
(2
атома на ячейку)
гранецентрированная
кубическая (ГЦК)
(4
атома на ячейку)
гексагональная
плотноупакованная (ГП)
(6
атомов на ячейку)
2)Дана эвтектическая система, нарисовать изменение электросопротивления
Электропроводность
металла всегда снижается при растворении
в металле второго компонента из-за
рассеения электронов проводимости на
искажениях кристаллической решетки.
Зависимость строится согласно правилу
аддитивности. Минимумы электросопротивления
(максимумы электропроводности) в чистых
компонентах
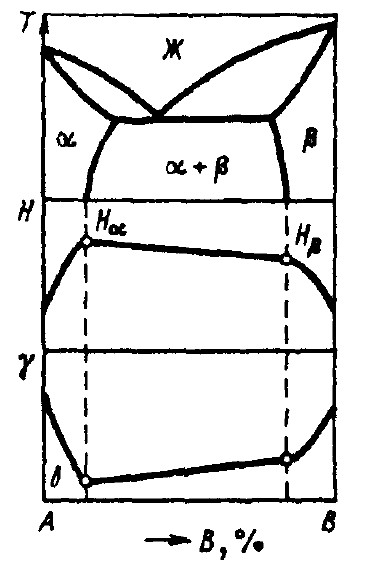
зависимости
Твердости (H)
и
электропроводности (γ)
3)Описать стадии выделения при старении, на какой стадии максимальная прочность
старение
— термическая обработка, при которой
в сплаве, подвергнутом закалке без
полиморфных превращений, главным
процессом является выделение из
пересыщенного твердого раствора.
Старение
в общем случае протекает в несколько
стадий:
-
Выделяются
участки пересыщенного твердого раствора
размером 1…10 нм. Так называемые зоны
Генье-Престона. -
Выделение
из зон ГП (Генье-Престона) метастабильной
β’-фазы,
структура которой промежуточная между
матричным α-раствором
и сиабильной β-фазой. Метастабильная
β’-фаза
выделяется быстрее чем стабильная. -
Выделение
стабильной β-фазы
В
общем случае наблюдается такая
последовательность выделения α
![]() ГП
ГП![]() β’
β’![]()
β
Образование
выделений стабильной β-фазы
сопровождается растворением метстабильной
β’-фазы
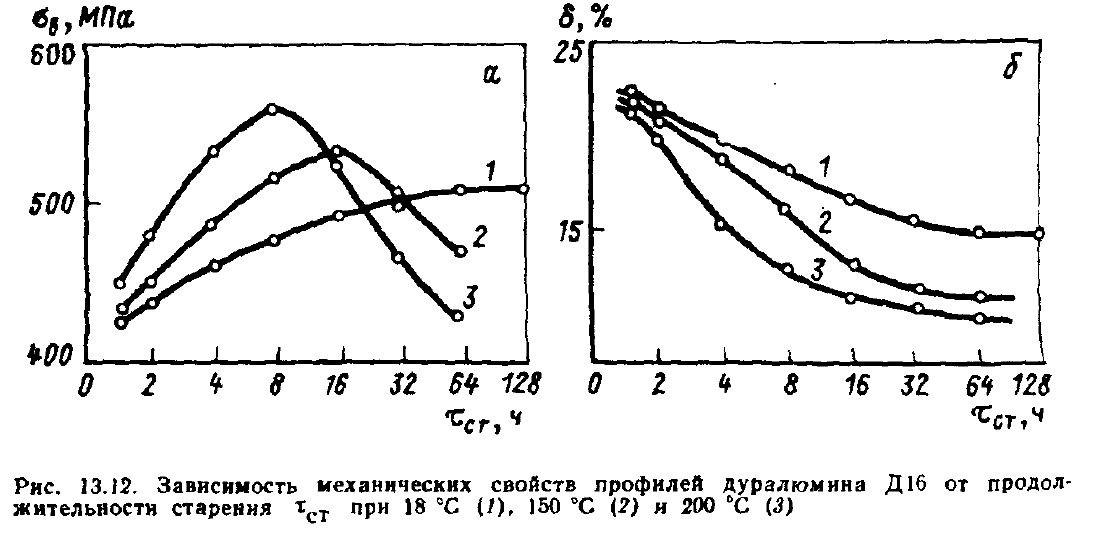
При
увелечении продолжительности старения
прочность сначала возрастает, а потом
снижается.
Упрочнение
возникает на стадии образования зон ГП
и метастабильной β’-фазы.
Чем
больше зон ГП и частиц β’-фазы
и меньше расстояние между ними — тем
более затруднено скольжение дислокаций.
Такое
упрочнение называется дисперсионным
твердением.
Разупрочнение
при дальнейшем увеличении времени
старения называется перестариванием.
Происходит коагуляция дисперсных
выделений метастабильной
β’-фазы,
при этом увеличивается расстояние между
выделениями. Соответственно уменьшается
торможение дислокаций. Также выделения
метастабильной β’-фазы
постепенно заменяются выделениями
стабильной β-фазы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Мольные доли вещества и количество атомов
| Формула химического вещества(Добавьте ! если используете для школьных расчетов) |
| Масса указанного вещества в граммах |
| Заданная формула |
| Количество вещества в указанной массе |
| Мольные доли (сумма равна единице) |
| В одном моль вещества находятся(поэлементно) |
| Количество атомов в веществе(поэлементно) |
| Масса каждого из элемента в указанном веществе |
Мольная доля химического элемента в веществе помогает узнать, сколько моль содержится в том или ином веществе.
Просьба не путать это с массовой долей химического вещества. Это совершенно разные сущности.
Покажем, как вычисляется мольная доля на примере аммоний азотнокислого.
В одном 1 моль вещества содержится
Кислорода 3 моль ( 
Азота 2 моль
Водорода 4 моль ( 
Соответственно мольные доли равны
Кислорода 3/(3+2+4)=0.33333
Азота 2/(3+2+4)=0.22222
Водорода 4/(3+2+4)=0.4444444
В 1 моль любого химического вещества содержится постоянное количество атомов/молекул равное
Таким образом
Количество атомов кислорода
Количество атомов азота
Количество атомов водорода
У некоторых читателей может возникнуть недопонимание, как так в 1 моль вещества находится 2 моль азота + 4 моль водорода+3 моль кислорода.
Да и с количеством атомов, тоже получается путаница.
Объясняем на примере воды…
В одном моль воды 
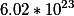
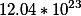
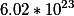
Калькулятор который представлен на сайте, может решать следующие задачи
– Расчет мольных долей химических элементов, входящих в формулу
– Расчет количества каждого из химического элемента
– Число атомов химического элемента в 1 моль заданного вещества
– При вводе массы вещества, расчет количества этого вещества (в моль)
Рассмотрим несколько примеров.
1. Чему равна мольная доля кислорода в нитрат калия?
Пишем формулу. Получаем результат
| Заданная формула |
 |
| Количество вещества в указанной массе |
|
0.9700333916236084 моль |
| Мольные доли (сумма равна единице) |
|
N=0.2 |
Ответ 0.6
2. Сколько атомов серы и кислорода находится в 10 граммах серной кислоты?
Формула серной кислоты 
| Количество атомов в веществе(поэлементно) |
|
H=1.2276509409067566*10^²³ |
3. Сколько молей азота и водорода находится в 5 моль аммония сульфат?
Пишем формулу и смотрим
| Заданная формула |
2SO_{4}}$) |
| Количество вещества в указанной массе |
|
0.07568045049847685 моль |
| Мольные доли (сумма равна единице) |
|
H=0.53333333333333 |
| В одном моль вещества находятся(поэлементно) |
|
H=8 моль |
В одном моль вещества находится 2 моль азота и 8 моль водорода. Значит в 5 моль вещества будет…
2*5 моль азота =10 и 8*5 моль водорода=40. Это наш ответ.
4. Рассчитать количество вещества 20 грамм оксида железа и массу железа в этом веществе.
Пишем формулу и массу. Получаем
| Заданная формула |
 |
| Количество вещества в указанной массе |
|
0.27837163727062175 моль |
| Мольные доли (сумма равна единице) |
|
Fe=0.5 |
| В одном моль вещества находятся(поэлементно) |
|
Fe=1 моль |
| Количество атомов в веществе(поэлементно) |
|
Fe=1.6757972563691428*10^²³ |
| Масса каждого из элемента в указанном веществе |
|
Fe=15.546220826 грамм |
Наш ответ: количество вещества 0.27837163727062175 моль
масса железа в 20 граммах оксида железа Fe=15.546220826 грамм
И последняя 5 задача
5.Сколько молекул вещества в 100 граммах Na2SO4?
Вводим формулу, вводим массу и думаем.
В этой задаче не надо складывать количество атомов каждого из химического элемента, входящих в формулу. Этот ответ будет неправильный.
Нам надо узнать количество молекул(!) вещества. Поэтому просто узнаем количество моль этого вещества и умножаем на постоянную Авогадро (6.02*10^²³ )
 |
| Количество вещества в указанной массе |
|
0.704225352112676 моль |
поэтому число молекул в ста граммах равно 6.02*0.704*10^²³=4.24*10^²³
Удачных расчетов!