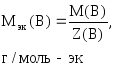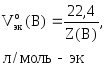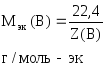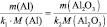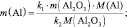Обозначение
nэк(В),
единицы измерения моль-эк.
Если известна масса вещества и молярная
масса эквивалентов, то количество
вещества эквивалентов рассчитывают по
формуле:
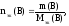 (21)
(21)
где
m(В)
– масса вещества, г;
Мэк(В)
– молярная масса эквивалентов вещества,
г/моль-эк.
Для
газообразных веществ можно рассчитать
nэк(В),
зная объем газа, который он имеет при
н.у.:
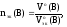 (22)
(22)
где
Vo(В)
– объем газа при н.у., л;
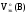 –молярный
–молярный
объем эквивалентов газа при н.у., л/моль-эк
Между
количеством вещества эквивалентов
nэк(В)
и количеством вещества n(В)
существует простая зависимость :
nэк(В)
= n(В)
· Z(В)
(23)
Пример.
Рассчитать Z(В),
Мэк(В) всех веществ, принимающих участие
в реакциях а) и б), а так же
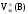 газообразных веществ в реакции а).
газообразных веществ в реакции а).
а)
Fe2O3
(т)
+ 3CO(г)
= 2Fe(т)
+ 3CO2(г)
б)
Al2(SO4)3
+ 6NaOH = 2Al(OH)3
+ 3Na2SO4
Решение.
Прежде всего необходимо определить к
какому типу реакций (обменная или
окислительно – восстановительная)
относится данная реакция, для чего
рассчитывают степени окисления атомов
или групп атомов в формульных единицах
всех веществ.
Реакция
а)
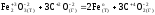
является
окислительно-восстановительной.
Находим
атомы, которые изменяют степени окисления,
и выписываем их, с учетом числа в составе
одной формульной единицы и числа отданных
и принятых электронов:
а)
для реагентов

б)
для продуктов
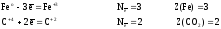
Расчеты
всех величин приведены в таблице 5.
Таблица
5
|
ФЕ |
|
Z(B) |
M(B), |
|
|
|
Fe2O3 |
6 |
6 |
160,0 |
26,7 |
– |
|
CO |
2 |
2 |
28,0 |
14,0 |
11,2 |
|
Fe |
3 |
3 |
56,0 |
18,7 |
– |
|
CO2 |
2 |
2 |
44,0 |
22,0 |
11,2 |
Реакция
б)
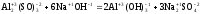
является
обменной, т.к. степени окисления атомов
и групп атомов в ходе реакции не
изменяются. Далее необходимо выбрать
те части формульных единиц (положительно
или отрицательно заряженных) по которым
будет производится расчет суммарного
заряда замещающихся ионов, а далее –
Z(B)
и Мэк(В). Расчеты приведены в таблице 6.
Таблица
6.
|
ФЕ |
Замещаю- щиеся ионы |
qi |
Ni |
Z(В)= |
М(В), г/моль |
|
|
Al2(SO4)3 |
SO4–2 |
–2 |
3 |
3·2=6 |
342,0 |
57,0 |
|
NaOH |
Na+ |
+1 |
1 |
1·1=1 |
40,0 |
40,0 |
|
Al(OH)3 |
OH– |
–1 |
3 |
3·1=3 |
78,0 |
26,0 |
|
Na2SO4 |
Na+ |
+1 |
2 |
2·1=2 |
142,0 |
71,0 |
6. Закон эквивалентов.
Согласно
закону эквивалентов все
вещества реагируют и образуются в
эквивалентных количествах.
Например,
для реакции
2CO
+ O2
= 2CO2
(24)
nэк(CO)
= nэк(O2)=nэк(CO2)
(25)
Для
реакции в общем виде:
nAA
+ nBB
= nCC
+ nDD
, (26)
где
A,B
– реагенты;
C,D
– продукты реакции;
nA,nB,nC,nD
– стехиометрические коэффициенты,
закон
эквивалентов
имеет вид:
nэк(A)
= nэк(B)
= nэк(C)
= nэк(D)
(27)
Т.е.
количество вещества эквивалентов всех
участвующих в реакции (26) веществ
(реагентов А и В и образовавшихся
продуктов C
и D)
одинаковы. Поэтому, если количество
вещества эквивалентов одного из веществ
(реагента или продукта) известно по
условию задачи, то определены и nэк
всех остальных веществ, участвующих в
реакции, и необходимость их расчета
отпадает. В этом состоит преимущество
проведения расчетов по закону эквивалентов.
Для
любой химической реакции (см. уравнение
реакции в общем виде (26)) соблюдается
условие (27), которое также может быть
представлено следующим образом:
n(А)
· Z(A)=
n(В)
· Z(B)=
n(С)
· Z(C)=
n(D)
· Z(D)
(28)
Условие
(28) упрощает определение эквивалентного
числа в сложных реакциях.
Пример.
Определить Z(Cr2(SO4)3)
в обменной реакции, выраженной уравнением
Cr2(SO4)3
+ 12KOH = 2K3[Cr(OH)6]
+ 3K2SO4
Решение.
Для приведенной реакции запишем условие
(28):
n(
Cr2(SO4)3)
· Z(Cr2(SO4)3)=
n(
KOH) · Z(KOH)
Из
уравнения реакции:
n(
Cr2(SO4)3)
= 1 n(KOH)
= 12
Поскольку
Z(KOH)
= 1 (не может быть другим, см. табл. 2), то
![]()
![]()
Если
известны массы веществ, участвующих в
реакции, то используя уравнения (21) и
(27) можно записать:
![]() (29)
(29)
или
![]() (30)
(30)
Уравнение
(30) является математическим выражением
закона эквивалентов.
Если
одно из веществ уравнения (26), например
B,
находится в газообразном состоянии и
известен его объем при н.у., то количество
вещества эквивалентов этого газа можно
рассчитать по уравнению (22), а математическая
запись закона эквивалентов для веществ
A
и B
будет иметь вид:
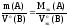 (31)
(31)
Пример.
Рассчитать массу алюминия, вступившего
в реакцию с разбавленной серной кислотой,
если в результате реакции образуется
10,2 л водорода (н.у.).
Решение.
Запишем уравнение реакции и укажем
степени окисления атомов и заряды ионов:
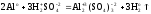
Реакция
окислительно-восстановительная. Находим
атомы, которые изменяют степени окисления,
и выписываем их, с учетом числа в составе
одной формульной единицы и числа отданных
и принятых электронов:
Alo
–
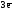 =
=
Al+3 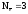 Z(Al) = 3
Z(Al) = 3
H2o
–
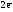 =
=
2H+1 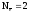 Z(H2)
Z(H2)
= 2
Согласно
закону эквивалентов:
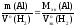 .
.
Отсюда
выражаем массу алюмиия:
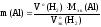
Рассчитаем
Мэк(Al)
и
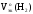 :
:
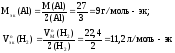
Подставив
полученные значения Мэк(Al)
и
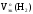 ,
,
а так жеVo(H2),
рассчитаем массу алюминия:
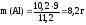
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
§ 2.1.3. Закон эквивалентов. Закон приведённого количества вещества
Закон эквивалентов гласит:
Вещества взаимодействуют друг с другом равными количествами молярных масс эквивалентов:
nЭ1 = nЭ2,
где nЭ1 – количество молярных масс эквивалента одного вещества; nЭ2 – количество молярных масс эквивалента другого вещества, взаимодействующего с первым. Действительно, если рассчитать количества молярных масс эквивалентов взаимодействующих веществ для любой из рассмотренных выше реакций, то они окажутся равными.
Последнее равенство можно представить иначе:
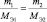
или 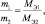
где m1 и m2 – массы реагирующих веществ; МЭ1 и МЭ2 – молярные массы их эквивалентов.
Все три последние равенства являются математическими формами записи закона эквивалентов.
Согласно закону эквивалентов для реакции:
k1А + k2B = k3C + k4D
должно выполняться
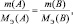
где m(A) и m(B) массы веществ А и В соответственно, МЭ(А) и МЭ(B) – молярные массы их эквивалентов. Или в соответствии с (2):
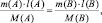
где M(A) и M(B) молярные массы веществ А и В, l(A) и l(B) количества активных связей в молекулах А и В соответственно.
После простейшего преобразования можно легко получить:
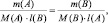
поскольку, в данном случае l(B) = k1; l(A) = k2, то:
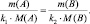 (2.3)
(2.3)
Так как последнее равенство справедливо для любой пары участвующих в реакции веществ (исходных и продуктов), то можно утверждать, что
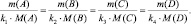
То есть, в пределах любой одной и той же химической реакции
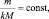 (2.4)
(2.4)
где 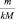 – приведённое количество вещества.
– приведённое количество вещества.
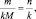
где n – количество вещества.
Приведённым количеством вещества называется отношение количества вещества к его стехиометрическому коэффициенту.
Равенства (2.3) и (2.4) представляют собой математические формы записи закона приведённого количества вещества, согласно которому
приведённые количества веществ участвующих в реакции (исходных и продуктов) равны между собой.
Закон приведённого количества вещества вытекает также из простого анализа привычных пропорций:
k1А + k2B = k3C + k4D;
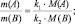
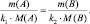
В общем случае
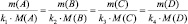
или 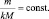
Согласно следствию закона приведённого количества вещества
приведённые количества элементов одного и того же сложного вещества равны между собой
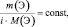
где m(Э) – масса или процентное содержание одного из элементов в данной навеске вещества; М(Э) – молярная масса этого элемента; i – индекс этого элемента в данном веществе, величина 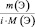 – приведённое количество элемента.
– приведённое количество элемента.
Иногда, в одной и той же реакции вещество может проявлять различные молярные массы эквивалента, что может некорректно восприниматься как нарушение закона эквивалентов. Например, при реакции разбавленной азотной кислоты с медью:
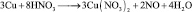 (2.5)
(2.5)
из восьми молекул азотной кислоты 2 молекулы являются окислителями, превращаясь в NO, а 6 молекул участвуют в процессе, не сопровождающемся изменением степени окисления. То есть, вся реакция делится на два взаимодействия:
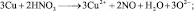

Хотя, реально частица O2– не существует, однако, из приведённой схемы видно, что в первом взаимодействии.
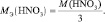
А во втором взаимодействии
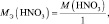
при этом, в обоих случаях закон эквивалентов выполняется – количества молярных масс эквивалентов всех взаимодействующих веществ и частиц равны шести.
При составлении уравнений окислительно-восстановительных реакций, стехиометрические коэффициенты перед восстановителем (kв), отдающим nв электронов, и перед окислителем (kо), принимающим nо электронов, можно рассчитывать с помощью следующих формул:
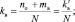 (2.6)
(2.6)
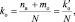 (2.7)
(2.7)
где mв – количество молекул восстановителя, не участвующих в восстановлении; mo – количество молекул окислителя, не принимающих участия в окислении; N – максимальное число, которому кратны все коэффициенты уравнения. Например, для реакции (2.5)
nо = 3; nв = 2; mo = 6; mв = 0; N = 1,
поэтому
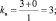
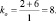
Примеры решения задач
1. Пользуясь, следствиями закона эквивалентов, определить массу алюминия, израсходованного на получение 5,1 г оксида алюминия, если молярная масса алюминия 27 г/моль, молярная масса оксида алюминия 102 г/моль.
Прежде, чем приступить к решению подобной задачи целесообразно записать уравнение реакции
4Al + 3O2 = 2Al2O3.
|
Дано: m(Al2O3) = 5,1 г M(Al) = 27 г/моль М(Al2O3) = 102 г/моль k1 = 4 моль k2 = 2 моль |
Решение: Согласно следствию закона эквивалентов:
или |
|
m(Al) – ? |
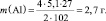
Ответ: m(Al) = 2,7 г.
2. Пользуясь равенствами 2.6 и 2.7 расставить коэффициенты в схеме реакции взаимодействия цинка с очень разбавленной азотной кислотой:
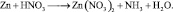
Решение
В данной реакции окислителем является азотная кислота, в которой атом азота принимает 8 электронов, то есть nо = 8. Поскольку mв = 0, то 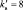 . Окисленной формы цинка в правой части уравнения также должно быть 8 атомов.
. Окисленной формы цинка в правой части уравнения также должно быть 8 атомов.
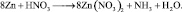
Из последней схемы видно, что mo = 16; nв = 2. Следовательно 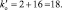 Восстановленной формы азота в правой части уравнения должно быть только два атома
Восстановленной формы азота в правой части уравнения должно быть только два атома
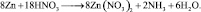
Все коэффициенты можно сократить на 2, то есть в данном случае N = 2. Поэтому, окончательно kв = 4; kо = 9
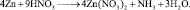
Задачи для самостоятельного решения
1. Пользуясь законом приведённого количества вещества, определить массу сульфита натрия, необходимую для полного превращения 0,2 моль перманганата калия в сульфат марганца по реакции:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O. (2.8)
Сколько грамм воды выделится в результате этой реакции?
2. Определить массу бихромата калия, необходимую для полного превращения 49,8 г. иодида калия в йод по реакции:
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O. (2.9)
Сколько грамм йода образуется в результате этой реакции?
Решить задачу двумя способами – пользуясь пропорциями и пользуясь законом приведёного количества вещества.
3. Пользуясь законом приведённого количества вещества, определить химическую формулу оксида меди, если в нём содержится 89 массовых процента меди, и 11 массовых процента кислорода.
4. Пользуясь равенствами (2.6) и (2.7) расставить коэффициенты в схеме реакции:
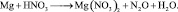
1. Сформулируйте закон эквивалентов и закон приведённого количества вещества.
2. Что такое приведённое количество вещества?
3. Выведите закон приведённого количества вещества из закона эквивалентов.
Как определить эквивалент вещества?
Ученик
(45),
закрыт
11 лет назад
NN
Мастер
(1513)
12 лет назад
Эквивалентная масса (молярная масса эквивалента вещества) mэкв также является одной из важнейших характеристик вещества. По определению эквивалент вещества – это такое количество химического вещества, которая реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений. Величина mэкв определяется или экспериментально, или, чаще всего, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений (мы будем рассматривать только неорганические соединения)
mэкв (оксида) = Моксида/(число атомов кислорода·2);
mэкв (основания) = Моснования/кислотность основания;
mэкв (кислоты) = Мкислоты/основность кислоты;
mэкв (соли) = Мсоли/(число атомов металла·валентность металла) .
Можно отметить, что в большинстве случаев кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты.
Например: mэкв (Fe2O3) = М (Fe2O3)/(3·2) = 160/6 = 26,7 г/моль;
mэкв (H2SO4) = M(H2SO4)/2 = 98/2 = 49 г/моль;
mэкв (Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль;
mэкв (Al2(SO4)3) = M(Al2(SO4)3) = 342/2 = 171 г/моль;
Эквивалентные массы веществ используют для количественных расчетов при химических взаимодействиях между веществами. Огромным преимуществом при этом является то, что для этого не нужно использовать уравнение химической реакции (которое во многих случаях написать затруднительно) , нужно только знать, что данные химические вещества взаимодействуют между собой или вещество является продуктом химической реакции.
Для количественных расчетов используется закон эквивалентов: массы реагирующих и образующихся веществ относятся друг к другу, как их эквивалентные массы.
Математическое выражение закона эквивалентов имеет следующий вид:
m1/m2 = mэкв (1)/mэкв (2)(1.2)
где: m 1 и m 2 – массы реагирующих или образующихся веществ,
mэкв (1) и mэкв (2) – эквивалентные массы этих веществ.
Пример: определить массу соды (карбоната натрия) Na2CO3, необходимую для полной нейтрализации 1,96 кг серной кислоты H2SO4.
Решение:
Воспользуемся законом эквивалентов
m(Na2CO3)/m(H2SO4) = mэкв (Na2CO3)/mэкв ( H2SO4)
Определяем эквивалентные массы веществ, исходя из их химических формул:
m (Na2CO3) = 106 /(2·1) = 53 г/моль;
mэкв (H2SO4) = 98/2·1 = 49 г/моль.
Тогда:
Х / 1,96кг = 53 г/моль / 49 г/моль
Х = 2,12 кг.
Ирина Миняшина
Мудрец
(12270)
12 лет назад
Для щёлочи молярная масса поделить на количество ОН, для кислоты – она же на количество Н, для соли – она же делить на произведение кол-ва атомов металла и валентоности этого металла.
Эквивале́нт вещества́ или просто эквивале́нт — безразмерная величина, равная количеству одного вещества, реагирующему в конкретной реакции с произвольным (часто – равным 1 моль) количеством другого вещества; общее формальное определение выглядит так:
-
- для реакции аА + bВ –> …
- эквивалент вещества В по веществу А есть отношение а/b (читается: “одна частица В эквивалентна а/b частиц А” или (что то же самое, см. ниже) “одна порция вещества В эквивалентна а/b порций вещества А”)
- (где а и b – коэффициенты перед этими веществами в уравнении реакции, а их отношение – называется также “мольное соотношение” или “мольное отношение”, или “число эквивалентности”;
- отношение b/а (то есть обратное) называется “фактор эквивалентности вещества В по веществу А”, см. ниже; также, b/а – является коэффициентом перед веществом В в приведённом по веществу А уравнении той же самой реакции). Иногда эквивалентном вещества называют непосредственно фактор эквивалентности этого вещества, не проводя между ними различий. [1]
Эквивалент – архаичная величина, которая использовалась в химии и биологии с начала ХIХ до середины ХХ веков (см. ниже раздел “история”). Говорить об эквиваленте вещества имеет смысл только относительно конкретной реакции. Само по себе понятие эквивалента используется редко; чаще встречаются обороты речи “эквивалентное соотношение веществ” и величины: “фактор эквивалентности”, “молярная масса эквивалента”, “эквивалентная масса”, “эквивалентная концентрация” (синоним: “нормальная концентрация”, устаревший синоним: “нормальность”), “количество вещества эквивалентна”.
Более частными определениями являются такие:
1) в окислительно-восстановительной реакции (по определению: в реакции, в которой происходит изменение степеней окисления атомов, то есть происходит обмен электронами) – величина мольного отношения вещества к отдаваемым или принимаемым им в данной реакции электронов (если рассматривать атомы окислителя или восстановителя – то величина изменения степени окисления такого атома в данной реакции); то есть в определении выше, А = 
2) в кислотно-основной реакции (по определению: в реакции, в которой не происходит изменения степеней окисления атомов, то есть обмениваются частицы, отличные от электронов) – величина мольного отношения вещества к отдаваемым или принимаемым им в данной реакции протонам, или гидроксил-ионам; то есть в определении выше, А = 
Фактор эквивалентности был определён выше[1]:
для реакции аА + bВ –> …
-
- фактор эквивалентности f(вещества В по веществу А) = b/а
- f = 1/Z, где Z – число эквивалентности (то есть эквивалент; число, обратное f), изменение степени окисления (количество отданных или принятых электронов), количество протонов или гидроксил-ионов в данной реакции.
Все остальные перечисленные выше “эквивалентные” величины получаются[1] умножением соответствующих не-эквивалентных величин на фактор эквивалентности f:
-
- молярная масса эквивалента вещества = молярная масса вещества * f = молярная масса вещества / Z
-
- нормальная концентрация = молярная концентрация * f
-
- количество вещества эквивалента = количество вещества * f
Кроме указанных выше, встречаются также определения фактора эквивалентности, основанные на отношении молярных масс (и до 1870 года – основанные на “эквивалентных весах элементов”), например:
“Эквивалентный вес кислоты или основания для реакций нейтрализации или любого другого соединения, которое действует путем двойного разложения, представляет собой массу соединения, которое будет давать или вступать в реакцию с 1,008 г иона водорода или 17,0074 г иона гидроксида, например, соляная кислота (HCl), 36,461 г; серная кислота (H2SO4), 98,078 г; гидроксид натрия (NaOH), 40 г; или карбонат натрия (Na2CO3), 105,9892 г.”
Также встречаются устаревшие определения фактора эквивалентности на основе понятия валентности (которое фактически не используется в химии примерно с середина ХХ века).
Также встречаются определения эквивалента с использованием понятия “мнимых” частиц и с использованием (принципиально ложной, физически противоречивой) предпосылки, что уравнение химической реакции описывает поведение неких отдельных частиц вещества, а не порций порядка молей веществ[1]:
“Эквивалентном называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равносильна) в данной реакции одному иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях)”
Примеры использования:
В реакции 
-
- вещество
эквивалентно 1
-иону (число эквивалентности Z = 1), фактор эквивалентности фосфорной кислоты = 1/1; f(NaOH) = 1.
- вещество
В реакции 
-
- вещество
эквивалентно 2
-ионам (Z = 2), фактор эквивалентности фосфорной кислоты = 1/2: f(NaOH) = 1.
- вещество
В реакции 
-
- вещество
эквивалентно 3
-ионам (Z = 3), фактор эквивалентности фосфорной кислоты = 1/3; f(NaOH) = 1.
- вещество
В реакции 
-
- 1 условная единица вещества
эквивалентна 5 электронам (Z = 5, f(перманганата) = 0,2) и 8 порциям HCl (f(перманганата) = 1/8)
- 1 условная единица вещества
В реакции 
-
- f(перманганата по электронам) = 1; f(перманганата по гидроксиду бария) = 0,25.
В реакции 
-
- f(перманганата по электронам) = 1/3; f(перманганата по сероводороду) = 2/3; f(сероводорода по электронам) = 0,5; f(сероводорода по перманганату) = 1,5
История понятия “эквивалентов”[править | править код]
История предпосылок, понятия эквивалентов, эквивалентных масс и смены этих понятий на последующие, более обоснованные физически, сводиться к попыткам химиков ответить на вопрос: “в каком соотношении реагируют вещества?” (актуальный ответ, который мы знаем теперь, но который разработчики понятий эквивалентна не знали: в мольном соотношении; то есть в соотношении количеств частиц (атомов, молекул, электронов, ионов; количество выражается в молях), равным отношению коэффициентов перед веществами в уравнении реакции, так называемый “основной закон химической стехиометрии”[2]) и установить строение веществ, которые реагировали.
Первые эквивалентные массы кислот и оснований были опубликованы Карлом Фридрихом Венцелем в 1777 году [3][4], он же ввёл понятие “эквивалентных количеств веществ” и “эквивалента вещества” (трактат “Учение о химическом сродстве тел”). В результате экспериментов в обменными реакциями солей, Карл Венцель пришёл к выводу, что для нейтрализации одного и того же количества кислоты или основания требуются различные количества других кислот или оснований. Он предложил “закон нейтральности”:
- “Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух или большего числа оснований, то количества последних эквивалентны и нейтрализуются одним и тем же количеством другой кислоты”
Более крупный набор таблиц был подготовлен, с опорой на работу Венцеля, немецким химиком Иеремией Бенджамином Рихтером. Основные выводы и эксперименты он опубликовал в своей книге 1972 г “Стехиометрия, или искусство измерения химических элементов”, и его “закон эквивалентов” является развитием “закона нейтральности” Венцеля.
Рихтер сформилировал закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2 = m2Э1
Под Э подразумевается элемент или вещество; под m – масса.
Оба автора – Венцель и Рихтер – не признавали атомную теорию, и не смогли развить концепцию стехиометрии дальше. Их концепции для современников прошли незамеченными и далее не были развиты во что-либо; хотя их таблицы соотношений нейтрализации были перепечатаны несколькими известными химиками того времени.
Тем не менее, многие химики сочли эквивалентные веса полезным инструментом, независимо от того, придерживались ли эти химики атомной теории. Эквивалентные веса были полезным обобщением “закона определенных пропорций” (он же – “закон постоянства состава”) Джозефа Пруста (1794 г.), который позволил химии стать количественной наукой. Он развил идею о постоянстве состава веществ и о постоянстве количественных отношений, в которых вещества могут соединяться. Французский химик Жан-Батист Дюма (1800–1884 гг.) стал одним из наиболее влиятельных противников атомной теории после того, как принял ее в начале своей карьеры, но был стойким сторонником эквивалентных весов. Далее Дальтон развил идею, сформулировав”закон кратных отношений”. Дальше понятие о постоянных соотношениях реагентов получило в работах Луи Гей-Люссака и в молекулярной теории А.Авогадро.
Последним смертельным ударом по использованию эквивалентных весов элементов стало представление Дмитрием Менделеевым его периодической таблицы в 1869 году, в которой он связал химические свойства элементов с приблизительным порядком их атомных весов. Однако эквивалентные веса продолжали использоваться для многих соединений еще сто лет, особенно в аналитической химии. Эквивалентные массы обычных реагентов можно было заносить в таблицы, что упрощало аналитические расчеты до того, как электронные калькуляторы стали широко доступны: такие таблицы были обычным явлением в учебниках аналитической химии. После разработки теории строения атомов и молекул, в химии окончательно утвердилось понятие о мольном соотношении.
По состоянию на 2023 год, понятие “фактор эквивалентности” всё ещё печатается в учебниках по общей химии для ВУЗов, а также используется в аналитической химии (в титриметрическом анализе).
См. также[править | править код]
- Электрохимический эквивалент
Примечания[править | править код]
- ↑ 1 2 3 4 Васильев В.П. – “Аналитическая химия”, в 2 томах. – том 1, стр 181-182. – М.: Высшая школа, 1989
- ↑ В.В.Ерёмин, А.Я.Борщевский – “Основы общей и физической химии”. – Долгопрудный: Интеллект, 2012. – стр.28
- ↑ Фигуровский Н.А. “История химии: учебное пособие для студентов пед. ин-тов по хим. и биол. специальностям”. – М.: Просвещение, 1979. – стр. 70-76
- ↑ М.Джуа – “История химии”. – М.: МИР, 1975. – стр.163-218
ЭКВИВАЛЕНТ.
ЗАКОН ЭКВИВАЛЕНТОВ.
РАСЧЕТЫ В ОБЪЕМНОМ (ТИТРИМЕТРИЧЕСКОМ) АНАЛИЗЕ.
Введение.
Как показывает опыт участия в муниципальном и региональном этапах ВОШ по химии в Московской области, задания практической части представляют собой элементы объемного (титриметрического) количественного анализа. В основе практической части лежат методы кислотно-основного (методы нейтрализации – алкалиметрия и ацидиметрия) и окислительно-восстановительного (редоксиметрия) титрования. При пояснении расчетов практической части, составители демонстрируют решение с использованием понятий «моль», «молярная масса» и традиционных подходов при количественных вычислениях по уравнению химической реакции.
Как известно, расчеты в объемном анализе опираются на понятия «эквивалент», «эквивалентная масса» и закон эквивалентов, которые в общеобразовательной школе не рассматриваются. Понятия «эквивалент», «эквивалентная масса», «количество вещества эквивалента» не абстрактны. Они вводятся для того, чтобы упростить расчеты по уравнениям химической реакции. В любой последовательности реакций из эквивалента одного вещества образуется один эквивалент любого другого вещества. Поэтому для определения выхода продукта реакции нет необходимости записывать уравнение реакции, устанавливать стехиометрические коэффициенты, проводить расчет для каждой реакции отдельно, так как число молей эквивалентов всех веществ одно и то же (закон эквивалентов).
В связи с вышесказанным представилось целесообразным научить школьников, участвующих в олимпиадах по химии, использовать данные понятия и законы при выполнении расчетов, связанных с титрованием. Учащиеся, хорошо усвоившие данный материал, могут успешно его применять при решении сложных химических задач.
Эквиваленты простых и сложных веществ. Закон эквивалентов.
Эквивалентом вещества (Э) называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. В общем случае, под эквивалентом понимают реальную или условную единицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна 1 молю атомов (ионов водорода) в реакциях ионного обмена или одному электрону в окислительно-восстановительных реакциях.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ).
Эквивалент (фактор эквивалентности) химического элемента несложно определить, исходя из химической формулы его водородного соединения. Так, например, атомы элементов VII-A группы (галогены) образуют водородные соединения общей формулы HR. Как видно из формулы, на 1 моль атомов водорода приходится 1 моль атомов галогена, из чего можно сделать вывод, что эквивалент галогена равен 1 молю. Аналогично определяем эквиваленты химических элементов остальных групп ПСХЭ:
VI-A группа (O, S, Se, Te) – Н2R → Э = ½ (fЭ = ½)
V-A группа (N, P, As, Sb) – RH3 → Э = 1/3 (fЭ = 1/3)
IV-A группа (C, Si, Ge, Sn) – RH4 → Э = 1/4 (fЭ = ¼)
Следует знать, что эквивалент водорода принят равным 1 молю.
Что касается металлов, то для ЩМ и ЩЗМ известны ионные соединения с водородом – гидриды, общей формулы МеН и МеН2 соответственно, из чего следует, что Э (ЩМ) = 1 моль и Э (ЩЗМ) = ½ моль. Для остальных металлов эквивалент не является постоянной величиной и определяется косвенно по уравнению реакции с веществом, эквивалент которого точно известен. Из всего вышесказанного можно сделать вывод, что эквивалент элемента есть величина, обратная его валентности в данном соединении:
Э = 1/В или fЭ = Э = 1/В.
Для определения эквивалента элемента необязательно исходить из его соединения с водородом. Эквивалент можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен (далее мы рассмотрим пример решения подобной задачи).
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает:
-
H3PO4 + KOH = KH2PO4 + H2O; fЭ = Э(H3PO4) = 1
-
H3PO4 + 2KOH = K2HPO4+ 2H2O; fЭ = Э(H3PO4) = 2
-
H3PO4 + 3KOH = K3PO4+ 3H2O; fЭ = Э(H3PO4) = 3
Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Расчет фактора эквивалентности
|
Частица |
Эквивалент (фактор эквивалентности) |
Примеры |
|
Элемент Простое вещество Оксид Кислота Основание Соль Окислитель (восстановитель) Ион |
fЭ = 1/В(Э), где В(Э) – валентность элемента fЭ = 1/n(Э)хВ(Э), где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента fЭ = 1/n(Э)хВ(Э), где n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента fЭ = 1/n(Н+), n(Н+) – число отданных в ходе реакции ионов водорода (основность кислоты) fЭ = 1/n(ОН–), n(ОН–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания) fЭ = 1/n(Ме)хВ(Ме)=1/n(А)хВ(А), где n(Ме) – число атомов Ме (индекс в химической формуле соли), В(Ме) – валентность Ме; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка. fЭ = 1/nе, где nе – число электронов, участвующих в процессе окисления или восстановления fЭ = 1/│z│, где z – заряд иона |
fЭ(Cr)в Сr2O3= 1/3 fЭ(Cr)в H2CrO4= 1/6 fЭ(H2)= ½ fЭ(O2)= ¼ fЭ(Cl2)= ½ fЭ(Сr2O3)= 1/(2×3)=1/6 fЭ(СrO)= 1/(1×2)=1/2 fЭ(P2O5)= 1/(2×5)=1/10 fЭ(H2SO4)= 1/1=1 (основность=1); fЭ(H2SO4)= 1/2 (основность=2) fЭ(Сг(OH)3)= 1/2(кислотность=2); fЭ(Сг(OH)3)= 1/3(кислотность=3); fЭ(Сг2(SO4)3)= 1/(2×3)=1/6 (расчет по Ме); fЭ(Сг2(SO4)3)= 1/(3×2) =1/6 (расчет по кислотному остатку) MnO4 –+ 8H+ + 5e–→ Mn+2 + H2O, fЭ(MnO4–)=1/ 5 fЭ(SO42-)= ½ |
Пример. Определите фактор эквивалентности и эквивалент солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4.
Решение:
а) fЭ(ZnCl2) = 1/ n(Zn)хВ(Zn) = 1/(1×2) = ½ или
fЭ(ZnCl2) = 1/ n(Cl)хВ(Cl) = 1/(2×1) = ½;
б) fЭ(KHCO3) = 1/ n(K)хВ(K) = 1/(1×1) = 1 или
fЭ(KHCO3) = 1/n(HCO3)хВ(HCO3) = 1/(1×1) = 1
в) ) fЭ(MgOH)2SO4) = 1/ n(MgOH)хВ(MgOH) = 1/(2×1) = ½ или
fЭ(MgOH)2SO4) = 1/ n(SO4)хВ(SO4) = 1/(1×2) = ½
Эквивалентной массой или молярной массой эквивалента(МЭ) называется масса одного моль эквивалента и рассчитывается по формуле:
МЭ = Э×М = fЭ×M (г/моль)
где Э – эквивалент элемента (fЭ – фактор эквивалентности), М – молярная масса. Так, зная эквиваленты элементов, несложно рассчитать их эквивалентные массы:
МЭ (Br) = 1×80 = 80 г/моль; МЭ (О) = 1/2×16 = 8 г/моль; МЭ (N) = 1/3×14 = 4,67 г/моль и т.д.
Следует отметить, что наибольшее практическое значение имеет именно эквивалентная масса, а не сам эквивалент. Эквивалентные массы сложных веществ, участвующих в реакциях, протекающих без изменения степени окисления элементов, рассчитываются по следующим формулам:
Эоксида = Моксида/ (число атомов элемента × валентность элемента)
Экислоты = Мкислоты/основность кислоты
Эоснования = Моснования/кислотность основания
Эсоли = Мсоли/ (число атомов Ме × валентность Ме) (если расчет фактора эквивалентности соли по Ме)
Под основностью кислоты и кислотностью основания в данном случае подразумевается число нейтрализованных ионов Н+ в молекуле кислоты и
Н3РО4 + КОН = КН2РО4 + Н2О
основность ортофосфорной кислоты равна 1, следовательно Э(Н3РО4) = М/1 = 98 г/моль;
б) в реакции
Н3РО4 + 2КОН = K2HPO4+ 2Н2О
основность ортофосфорной кислоты равна 2, следовательно Э(Н3РО4) = М/2 = 49 г/моль;
в) в реакции
Al(OH)3 + 2HCl = AlOHCl2 + 2H2O
Кислотность Al(OH)3 = 2, следовательно Э(Al(OH)3) = М/2 = 78/2 = 39 г/моль.
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей:
МЭ(оксида) = МЭ(элемента) + МЭ(O) = МЭ(элемента) + 8
МЭ(кислоты) = МЭ(H) + МЭ(An) = 1 + МЭ(An)
МЭ(основания) = МЭ(Ме) + МЭ(OН) = МЭ(Ме) + 17
МЭ(cоли) = МЭ(Ме) + МЭ(An)
Если речь идет о газообразных веществах, целесообразно пользоваться при стехиометрических расчетах значением эквивалентного объема (VЭ).
Эквивалентным объемом (VЭ) газообразного вещества называется объем, занимаемый при данных условиях одним моль эквивалента вещества:
VЭ = (Vm × Э)/n или VЭ = fЭ х Vm = fЭ х 22,4
где Vm = 22,4 л/моль (молярный объем газа); Э – эквивалент элемента, образующего простое газообразное вещество; n – число атомов элемента в молекуле простого вещества.
Например, VЭ (Н2) = (22,4×1)/2 = 11,2 л/моль; VЭ (О2) = (22,4×0,5)/2 = 5,6 л/моль; VЭ (N2) = (22,4×1)/(2×3) = 3,73 л/моль.
Эквивалентные объемы газообразных сложных веществ определяются по их эквивалентам, определяемым косвенно в соответствии с химическим уравнением реакции. Например, при определении эквивалентного объема аммиака исходят из его кислотно-основных свойств. Аммиак, являясь основанием, реагирует с кислотами. Причем, в реакциях с кислотой аммиак присоединяет 1 моль ионов Н+:
NH3 + H+ = NH4+.
Откуда следует, что Э(NH3) = 1 и VЭ(NH3) = Э(NH3)×Vm = 1×22,4 = 22,4 л/моль. Аналогично эквивалентный объем определяется для фосфина – РН3, арсина – AsH3.
Эквиваленты летучих газообразных соединений IVA-группы (СН4, SiH4) зависят от конкретной реакции. Например, СН4 + Cl2 → CH3Cl + HCl, эквивалент метана равен 1 молю, так как замещает в реакции 1 моль атомов водорода. Следовательно, VЭ(СН4) = 22,4 л/моль. Как видно из данного примера, эквивалент не является постоянной величиной, а зависит от конкретной химической реакции.
Закон эквивалентов(И.Рихтер, 1792 г.): вещества реагируют и образуются согласно их эквивалентам.
Из закона эквивалентов следует, что массы (объемы) веществ, участвующих в химической реакции, пропорциональны их эквивалентным массам (эквивалентным объемам).
Другими словами, число молей эквивалентов (nЭКВ) всех веществ в реакции равны между собой. Число молей эквивалентов можно рассчитать по следующим формулам:
nЭКВ = m/MЭ,
где m – масса вещества (г), МЭ – эквивалентная масса вещества (г/моль);
nЭКВ = V/VЭ,
где V – объем газообразного вещества (н.у., л), VЭ – эквивалентный объем газа (л/моль).
Пример 1. При сжигании 2,28 г металла было получено 3,78 г его оксида. Определить эквивалентную массу металла.
Решение. Сначала находим массу кислорода, пошедшего на окисление металла: 3,78 г – 2,28 г = 1,5 г.
Далее по закону эквивалентов находим эквивалентную массу металла:
m(Me)/m(O) = MЭ(Me)/MЭ(O), следовательно MЭ(Me) = m(Me)×MЭ(О)/m(O) = 2,28 × 8/1,5 = 12,16 г/моль.
Для веществ, реагирующих между собой в растворе, число эквивалентов рассчитывается по формуле:
nЭКВ = Nр-ра × Vр-ра,
где Nр-ра – нормальность раствора (нормальная концентрация или молярная концентрация эквивалента): показывает число молей эквивалентов растворенного вещества, содержащееся в 1 л раствора (моль/л). Другими словами, нормальность раствора показывает сколько эквивалентных масс вещества содержится в 1 л раствора.
Vр-ра – объем раствора в литрах.
Пример 2. Рассчитать нормальную концентрацию раствора, в 250 мл которого содержится 10 г гидроксида кальция.
Решение:
-
Найдем сначала сколько граммов вещества будет содержаться в 1 л (100 мл) данного раствора
10 г ——————————- 250 мл
х ———————————- 1000 мл
х = 1000×10/250 = 40 (г/л)
-
Затем рассчитаем число моль эквивалентов, заключенное в 40 г
Ca(OH)2. Для этого для начала необходимо рассчитать МЭ(Ca(OH)2):
МЭ(Ca(OH)2) = 74/2 = 37 г/моль;
nЭКВ = m/МЭ = 40/37 = 1,08 моль
Следовательно, N (Ca(OH)2) = 1,08 моль/л.
Расчеты в объемном (титриметрическом) анализе.
Титриметрический анализ является методом количественного анализа, в котором измеряют количество реактива, затраченного в ходе химической реакции. При этом используют точное измерение объемов реагирующих веществ: заставляют реагировать два раствора, и, как можно точнее, определяют момент завершения реакции между обоими веществами. Зная точную концентрацию одного вещества, можно установить и точную концентрацию другого, опираясь на закон эквивалентов для двух взаимодействующих растворов веществ:
N1×V1 = N2×V2,
где N1 и N2 – нормальности растворов веществ, V1 и V2 – объемы растворов веществ (л).
Раствор вещества, концентрация которого точно известна, называется стандартным раствором. Концентрация стандартного раствора, приготовленного по точной навеске, взятой на аналитических весах с точностью до 4-го знака после запятой, рассчитывается следующим образом:
-
Сначала рассчитываем так называемый титр раствора (Т, г/мл) или простой титр, который показывает число граммов вещества, содержащегося в 1 мл раствора, по формуле
Т = mнавески/ Vколбы (г/мл)
-
Затем рассчитываем нормальность раствора по формуле:
N = T×1000/МЭ
Стандартный раствор можно приготовить также из фиксанала.
Раствор, концентрация которого подвергается стандартизации, называется рабочим раствором или титрантом. Стандартизация рабочего раствора осуществляется в процессе титрования. Иногда рабочим раствором служит раствор с известной концентрацией (стандартизованный раствор), при помощи которого определяется количество реагента в титруемом растворе.
Титрование – постепенное приливание рабочего раствора к стандартному до момента достижения точки эквивалентности. Точка эквивалентности (Т.Э.) – момент достижения полного взаимодействия двух веществ. Раствор, которым титруют (рабочий раствор), помещают в бюретку. Титруемый раствор находится в специальной конической колбе для титрования.
Среди известных методов титриметрического анализа следует выделить метод нейтрализации (кислотно-основного титрования), а также метод окислительно-восстановительного титрования (редоксиметрия) – именно данные методы предлагаются в качестве заданий практической части олимпиады.
В основе метода нейтрализации лежит одноименная реакция, краткое ионное уравнение которой: Н+ + ОН– = Н2О. В зависимости от того, раствор какого вещества (кислоты или щелочи) является стандартизованным и служит рабочим раствором при титровании, различают методы алкалиметрии и ацидиметрии.
Ацидиметрия – количественное определение щелочей при помощи титрованного раствора кислоты. Рабочий раствор – раствор кислоты, титруемый раствор – раствор щелочи.
Алкалиметрия – количественное определение кислот при помощи титрованного раствора щелочи. Рабочий раствор – раствор щелочи, титруемый раствор – раствор кислоты.
Поскольку реакция нейтрализации не сопровождается видимыми изменениями, для фиксирования Т.Э. к титруемому раствору прибавляют индикатор. Индикаторами в методе нейтрализации служат органические вещества, окраска которых меняется в зависимости от изменения величины рН: кислотно-основные индикаторы (метиловый оранжевый, фенолфталеин и др.). Резкое необратимое изменение окраски индикатора в Т.Э. указывает на то, что к титруемому веществу добавлено эквивалентное количество титранта (рабочего раствора).
Так, например, при титровании раствора щелочи раствором кислоты, в колбу для титрования помещают раствор щелочи и 2-3 капли раствора метилоранжа. Индикатор приобретает в щелочной среде желтую окраску, но по мере добавления раствора кислоты окраска раствора изменяется и в Т.Э. резко переходит из желтой в оранжевую. Изменение окраски указывает на то, что было добавлено ровно столько кислоты, сколько требуется для полной нейтрализации того количества щелочи, которое было в колбе для титрования. Иными словами, в момент изменения окраски индикатора число эквивалентов кислоты становится равным числу эквивалентов щелочи (закон эквивалентов).
В основе окислительно-восстановительного титрования лежит ОВР. Обычно восстановитель титруют окислителем. В отдельных случаях применяют обратное титрование. Методы в редоксиметрии классифицируют в соответствии с тем, какое вещество используется в качестве окислителя и, соответственно, присутствует в рабочем растворе:
– перманганатометрия (окислитель – раствор КMnO4);
– хроматометрия ( окислитель – растворы K2Cr2O7 или К2CrO4);
– броматометрия (окислитель – раствор KBrO3);
– йодометрия (окислитель – раствор I2) и т.д.
В редоксиметрии возможно как индикаторное титрование, так и безындикаторное. Титрование в отсутствии индикатора проводится всеми окрашенными окислителями (растворы перманганата, бихромата, йода и т.д.), меняющими окраску при переходе из окисленной в восстановленную форму, т.е. при достижении Т.Э. при титровании. Индикаторное титрование имеет ряд недостатков: зависимость изменения окраски среды от рН раствора, медленное изменение окраски, образование промежуточных соединений.
Так, например, в методе перманганатометрии раствором KMnO4 титруют раствор восстановителя (Na2SO3, NaNO2, Na2S и т.д.), обычно в кислой среде. Конец реакции легко определяется по изменению окраски от одной избыточной капли перманганата. В кислой среде титруемый раствор окрашивается в розовый цвет за счет избыточных MnO4– – ионов.
Эквивалентные массы окислителя и восстановителя рассчитываются по формуле:
MЭ = М/n,
где М – молярная масса вещества (г/моль), n – количество принятых или отданных электронов соответственно.
Например, для реакции
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + K2SO4 + 5Fe2(SO4)3 + 8H2O
MnO4– + 8H+ + 5e– → Mn+2 + 4H2O | 2
2Fe+2 – 2e– → 2Fe+3 | 5
МЭ(KMnO4) = М/5 = 158/5 = 31,6 г/моль; МЭ(Fe+2) = M/1 = 56/1 = 56 г/моль (в пересчете на один моль Fe+2).
Пример 3. На титрование 10 мл раствора КОН пошло 12 мл 0,1 н. раствора НСl. Определить N(KOH).
Решение:
Уравнение реакции: КОН + НСl = КСl + Н2О
По закону эквивалентов: NКОН × VKOH = NHCl × VHCl
Нормальность раствора КОН: NКОН = NHCl × VHCl/ VKOH = 12×0,1/10 = 0,12 н.
Ответ: NKOH = 0,12 н.
Пример 4. Определить, сколько граммов железа содержится в растворе, если на титрование этого раствора потребовалось 20 мл 0,05234 н. раствора KMnO4.
Решение:
Уравнение реакции (см. выше)
Для решения воспользуемся формулой сложного титра:
ТА/В = NA× ЭВ/1000 (г/мл),
где NA – нормальность раствора вещества А, ЭВ – эквивалентная масса вещества В. Сложный титр показывает какая масса вещества В реагирует с 1 мл раствора вещества А.
-
Определяем сложный титр перманганата калия по железу
Т(KMnO4/Fe) = N(KMnO4)×ЭFe/1000 = 0,05234×56/1000 = 0,002931 г/мл
-
1 мл KMnO4 восстанавливает из раствора 0,002931 г железа, а 20 мл – 0,002931 × 20 = 0,6058 г.
Ответ: масса железа – 0,6058 г.
Пример 5. Определить формулу соединения, если известно, что оно содержит 28% металла, 24% серы и 48% кислорода по массе.
Решение:
-
Исходя из элементного состава неизвестного вещества, можно предположить, что это – соль. Выразим состав соли формулой MexSyOz. Далее определим состав кислотного остатка (SyOz)n- через так называемый атомный фактор:
y : z = m(S)/Ar(S) : m(O)/Ar(O) = 24/32 : 48/16 = 0,75 : 3 = 1 : 4.
Из чего следует, что формула кислотного остатка соответствует сульфат-иону – SO42-.
-
Определяемое соединение – соль – сульфат неизвестного металла состава Ме2(SO4)х. Так как известен состав и валентность кислотного остатка (В = II), можно определить его эквивалентную массу*:
Э (SO42-) = М(SO42-)/В(SO42-) = 96/2 = 48 г/моль.
Эквивалентную массу металла рассчитаем, опираясь на уравнение реакции:
2Me + xH2SO4 = Me2(SO4)x + xH2,
n (Н2SO4) = n(SO4)в соли = (24 + 48)/96 = 72/96 = 0,75 моль. Следовательно, m(Н2SO4) = 0,75×98 = 73,5 г.
Согласно закону эквивалентов,
m(Me)/ m(Н2SO4) = Э(Ме)/Э(Н2SO4),
из чего следует: Э(Ме) = m(Me) × Э(Н2SO4)/ m(Н2SO4) = 28×49/73,5 = 18,7 г/моль.
-
Так же по закону эквивалентов число эквивалентов металла равно числу эквивалентов сульфат-ионов, из чего следует
m(Me)/Э(Me)= m(SO42-)/ Э(SO42-), т.е.
28/18,7 = 72/48, или
1,5 = 1,5.
Так как число эквивалентов составных частей формульной единицы соли Ме2(SO4)x не могут быть дробными, то
nЭКВ(Me) : nЭКВ(SO42-) = 3 : 3,
следовательно Ar(Me) = nЭКВ(Ме) × Э(Ме) = 3 × 18,7 = 56 (это железо).
-
Найдем валентность железа в данном соединении по формуле
В = Ar/Э = 56/18,7 = 3.
Следовательно, формула соли – Fe2(SO4)3
*Для простоты эквивалентные массы (Мэ) обозначили буквой «Э».