Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-

1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-

2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-

3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-

4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-

5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-

6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-

1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-

2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-

3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 952 233 раза.
Была ли эта статья полезной?
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра и вращающихся вокруг него электронов. Ядро также имеет сложное строение и состоит из нейтронов и электронов.
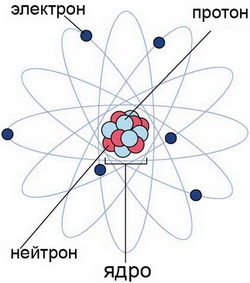
Число электронов равно числу протонов в атоме и определяется порядковым номером. В связи с этим атом в целом электронейтрален, так как электроны заряжены отрицательно, а протоны положительно. Заряд ядра также равен порядковому номеру. Число нейтронов рассчитывается по формуле N = A – Z, где N — общее число нейтронов, А — массовое число, Z — заряд ядра. Число энергетических уровней в атоме определяется номером периода. Число электронов на последнем внешнем уровне равно номеру группы.
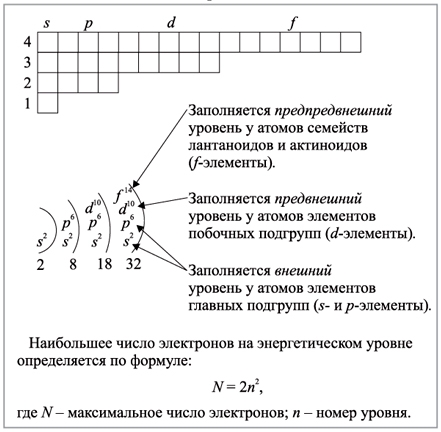
Максимальное число электронов на энергетическом уровне определяется формулой N = 2 * n^2 , где N — общее число электронов на энергетическом уровне, n – номер уровня.
В связи с этим максимальное число электронов на первом (n = 1) уровне равно 2 (так как N = 2 * 1^2), на втором (n = 2) уровне — 8 (так как N = 2 * 2^2), на третьем (n = 3) уровне — 18 (так как N = 2 * 3^2) и т.д.
Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень — s. На втором уровне два подуровня — s и p. на третьем — s, p и d. На четвертом — s, p, d и f.
Максимальное число электронов на подуровнях
- 2 — максимальное число электронов на s-подуровне.
- 6 — максимальное число электронов на p-подуровне.
- 10 — максимальное число электронов на d-подуровне.
- 14 — максимальное число электронов на f-подуровне.
Максимальное число электронов на подуровне не зависит от номера уровня.
Заполнение энергетических уровней
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
Геометрия орбиталей
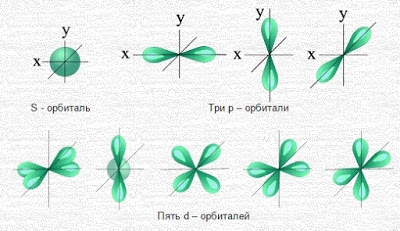
Примеры
Полезные ссылки
Источник материала
Электронная оболочка атома (видео)
Строение атома (Часть 1) (видео)
Строение атома (Часть 2) (видео)
Строение атома. Ядерные силы (видео)
Дополнительные материалы
Модели строения атома (видео)
Строение атома: Атомное ядро (видео)
Химия. Строение атома: Строение электронных оболочек (видео)
Строение атома (видео)

Вам понадобится.

- – бумага;
- – ручка;
- – периодическая система Менделеева.
ИнструкцияЧтобы определить количество электронов, воспользуйтесь периодической системой Д.И. Менделеева. В этой таблице элементы расположены в определенной последовательности, которая тесно связана с их атомным строением. Зная, что положительный зарядатома всегда равен порядковому номеру элемента, вы легко найдете количество отрицательных частиц. Ведь известно – атом в целом нейтрален, а значит, число электронов будет равно числу протонов и номеру элемента в таблице. Например, порядковый номералюминия равен 13. Следовательно, количество электронов у него будет 13, у натрия – 11, у железа – 26 и т.д.
Если вам необходимо найти количество электронов на энергетических уровнях, сначала повторите принцип Пауля и правило Хунда. Потом распределите отрицательные частицы по уровням и подуровням с помощью все той же периодической системы, а точнее ее периодов и групп. Так номер горизонтального ряда (периода) указывает на количество энергетических слоев, а вертикального (группы) – на число электронов на внешнем уровне.
Не забывайте о том, что количество внешних электронов равно номеру группы только у элементов, которые находятся в главных подгруппах. У элементов побочных подгрупп количество отрицательно заряженных частиц на последнем энергетическом уровне не может быть больше двух. Например, у скандия (Sc), находящегося в 4 периоде, в 3 группе, побочной подгруппе, их 2. В то время как у галия (Ga), который находится в том же периоде и той же группе, но в главной подгруппе, внешних электронов 3.
При подсчете электронов в атоме, учтите, что последние образуют молекулы. При этом атомы могут принимать, отдавать отрицательно заряженные частицы или образовывать общую пару. Например, в молекуле водорода (H2) общая пара электронов. Другой случай: в молекуле фторида натрия (NaF) общая сумма электронов будет равна 20. Но в ходе химической реакции атом натрия отдает свой электрон и у него остается 10, а фтор принимает – получается тоже 10.
None Источники:
- a так как атом то номер элемента
Вам понадобится.

- Периодическая система химических элементов Д.И. Менделеева.
ИнструкцияБлагодаря умению правильно вычислять количество
протоновнейтронов
или электронов, можно определить валентность химического элемента, а также составить электронную формулу. Для этого потребуется только периодическая система химических элементов Д.И. Менделеева, которая является обязательным справочным материалом.
Таблица Д. И. Менделеева разделена на группы (располагаются вертикально), которых всего восемь, а также на периоды, расположенные горизонтально.

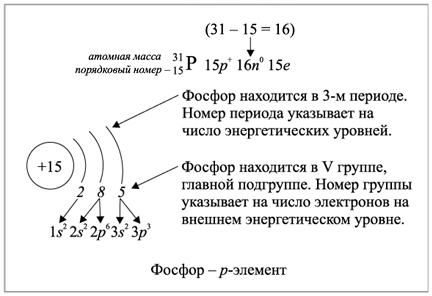
Каждый химический элемент имеет свой порядковый номер и относительную атомную массу, что указано в каждой клетке периодической таблицы. Количество протонов (р) и электронов (ē) численно совпадает с порядковым номером элемента. Для определения числа нейтронов (n) необходимо из относительной атомной массы (Ar) вычесть номер химического элемента.
Пример № 1. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 7. Химический элемент № 7 – это азот (N).
Сначала определите количество протонов (р). Если порядковый номер 7, значит, будет 7 протонов. Учитывая, что это число совпадает с количеством отрицательно заряженных частиц, электронов (ē) тоже будет 7.
Для определения числа нейтронов (n) из относительной атомной массы (Ar (N) = 14) вычтите порядковый номер азота (№ 7). Следовательно, 14 – 7 = 7. В общем виде вся информация выглядит таким образом:р = +7;ē = -7;n = 14-7 = 7.
Пример № 2. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 20. Химический элемент № 20 – это кальций (Са).
Сначала определите количество протонов (р). Если порядковый номер 20, следовательно, будет 20 протонов. Зная, что это число совпадает с количеством отрицательно заряженных частиц, значит электронов (ē) тоже будет 20.
Для определения числа нейтронов (n) из относительной атомной массы (Ar (Са) = 40) вычтите порядковый номер кальция (№ 20). Следовательно, 40 – 20 = 20. В общем виде вся информация выглядит таким образом:р = +20;ē = -20;n = 40-20 = 20.
Пример № 3. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 33. Химический элемент № 33 – это мышьяк (As).
Сначала определите количество протонов (р). Если порядковый номер 33, значит, будет 33 протона. Учитывая, что это число совпадает с количеством отрицательно заряженных частиц, электронов (ē) тоже будет 33.

Для определения числа нейтронов (n) из относительной атомной массы (Ar (As) = 75) вычтите порядковый номер азота (№ 33). Следовательно, 75 – 33 = 42. В общем виде вся информация выглядит таким образом:р = +33;ē = -33;n = 75 -33 = 42.
None Источники:
- протон и нейтроны составляют ответ
Данное количество вычисляется по формуле:

Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия. -Мультиплетность максимальна -При совпадении мультиплетностей суммарный орбитальный момент L максимален.

Разберём это правило на примере заполнения орбиталей p-подуровня p-элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками — электроны, причём направление стрелки обозначает ориентацию спина):
Как видно, сначала появляется один электрон на 2px-орбитали, затем один электрон на 2py-орбитали, после этого один электрон на 2pz-орбитали, затем появляются парные электроны на 2px-, 2py– и 2pz-орбиталях.
21. Тормозное и характеристическое рентгеновское излучение. Закон Мозли.
Когда энергия бомбардирующих анод электронов становится достаточной для вырывания электронов из внутренних оболочек атома, на фоне тормозного излучения появляются резкие линии характеристического излучения. Частоты этих линий зависят от природы вещества анода, поэтому их и назвали характеристическими.
Состояние атома с вакансией во внутренней оболочке неустойчиво. Электрон одной из внешних оболочек может заполнить эту вакансию, и атом при этом испускает избыток энергии в виде фотона характеристического излучения: Все переходы на k-оболочку образуют K-серию, соответственно, на l- и m-оболочки – L- и M-серии (рис. 2.8). Английский физик Генри Мозли в 1913 году установил закон, названный его именем, связывающий частоты линий рентгеновского спектра с атомным номером испускающего их элемента Z:
Здесь , постоянная Ридберга; σ – постоянная, учитывающая экранирующую роль окружающих ядро электронов. Чем дальше электрон от ядра, тем σ больше.
На рис. 2.9 показана графическая зависимость закона.
Закон Мозли позволил по измерению длин волн λ рентгеновских лучей точно установить атомный номер элемента. Он сыграл большую роль при размещение элементов в таблице Менделеева.
22. Физические особенности в молекулярных спектрах. Энергия и спектр двухатомной молекулы. PQ– и R-ветви.
Молекула — частица, образованная двумя или большим количеством атомов, характеризующаяся определённым количеством входящих в неё атомных ядер и электронов, а также определённой структурой.
Энергия свободной молекулы состоит из энергии поступательного движения молекулы как единого целого, энергии колебания атомов внутри молекулы, энергии вращения целой молекулы и ее частей относительно друг друга, энергии электронного возбуждения молекулы (энергия движения электронов в молекуле) и внутриядерной энергии:
Е=Епост +Евр+Екол +Еэл +Еяд.
Молекулярные спектры – спектры испускания и поглощения электромагнитного излучения и комбинацию рассеяния света, принадлежащие свободным или слабо связанным молекулам. Имеют вид совокупности полос (линий) в рентгеновской, УФ – видимой, ИК и радиоволновой областях спектра. Положение полос (линий) в спектрах испускания и поглощения характеризуется частотами v и волновыми числами υ; оно определяется разностью энергий Е’ и Е: тех состояний молекулы, между которыми происходит квантовый переход: 23. Одномерный кристалл Кронига-Пенни. Понятие о зонной теории твердых тел. Фермионы и бозоны.
КРОНИГА – ПЕННИ МОДЕЛЬ – одномерная, точно решаемая модель движения электронов в периодич. поле, иллюстрирующая природу возникновения энергетич. зон в кристалле (см. Зонная теория). Предложена Р. Кронигом (R. Kronig) и У. Дж. Пенни (W.G. Penney) в 1931. В К–П. м. потенциал V(x), создаваемый кристаллич. решёткой, аппроксимируется периодич. последовательностью прямоугольных потенц. ям глубиной V и шириной а, разделённых потенц. барьерами шириной Ь, так что постоянная решётки равна а+Ь (рис. 1). Решение ур-ния Шрёдингера с потенциалом V(x)имеет вид плоской волны, модулированной с периодом решётки:
В основе зонной теории лежит так называемое адиабатическое приближение. Кван-тово-механическая система разделяется на тяжелые и легкие частицы – ядра и электроны. Поскольку массы и скорости этих частиц значительно различаются, можно считать, что движение электронов происходит в поле неподвижных ядер, а медленно движущиеся ядра находятся в усредненном поле всех электронов. Принимая, что ядра в узлах кристаллической решетки неподвижны, движение электрона рассматривается в постоянном периодическом поле ядер.
Далее используется приближение самосогласованного поля. Взаимодействие данного электрона со всеми другими электронами заменяется действием на него стационарного электрического поля, обладающего периодичностью кристаллической решетки. Это поле создается усредненным в пространстве зарядом всех других электронов и всех ядер. Таким образом, в рамках зонной теории многоэлектронная задача сводится к задаче о движении одного электрона во внешнем периодическом поле – усредненном и согласованном поле всех ядер и электронов.
Фермио́н — частица (или квазичастица) с полуцелым значением спина. Своё название получили в честь физика Энрико Ферми.
Примеры фермионов: кварки (они формируют протоны и нейтроны, которые также являются фермионами), лептоны (электроны, мюоны, тау-лептоны, нейтрино), дырки (квазичастицы в полупроводнике)[1].
Фермионы подчиняются статистике Ферми — Дирака: в одном квантовом состоянии может находиться не более одной частицы (принцип Паули). Принцип запрета Паули ответственен за стабильность электронных оболочек атомов, делая возможным существование сложных химических элементов. Он также позволяет существовать вырожденной материи под действием высоких давлений (нейтронные звёзды). Волновая функция системы одинаковых фермионов антисимметрична относительно перестановки двух любых фермионов. Квантовая система, состоящая из нечётного числа фермионов, сама является фермионом (например, ядро с нечётным массовым числом A; атом или ион с нечётной суммой A и числа электронов).
Бозо́н (от фамилии физика Бозе) — частица с целым значением спина. Бозоны, в отличие от фермионов, подчиняются статистике Бозе — Эйнштейна, которая допускает, чтобы в одном квантовом состоянии могло находиться неограниченное количество одинаковых частиц. Системы из многих бозонов описываются симметричными относительно перестановок частиц волновыми функциями.
24. Расщепление энергетических уровней и образование зон. Различие между металлами, полупроводниками и диэлектриками в зонной теории.
Несмотря на то, что метод сильной связи применим для электронов глубоких энергетических уровней, он хорошо иллюстрирует общие закономерности образования энергетических зон при сближении изолированных атомов и образования из них кристаллической решетки. Рассмотрим качественно картину возникновения энергетических зон на примере образования кристаллической решетки из изолированных атомов натрия. Электронная структура Na (1s2s2p3s): всего в атоме 11 электронов, по два электрона на 1s и 2s уровнях, 6 электронов на уровне 2р, последний заполненный уровень в атоме натрия – 3s, на котором находится один валентный электрон. Поскольку в приближении сильной связи предполагается, что состояние электрона в кристалле незначительно отличается от его состояния в изолированном атоме, будем в оценке влияния на это состояние кристаллического поля соседних атомов исходить из энергетической структуры изолированного атома. На рис. 2.1,а показаны схематически энергетические уровни и распределение электронов на них для атомов натрия, находящихся на достаточно большом расстоянии друг от друга так, что потенциальные кривые электронов не перекрываются (взаимодействие между атомами пренебрежимо мало). Состояния электронов в этом случае описываются волновыми функциями изолированного атома, разрешенные уровни энергии дискретны и определяются квантовыми числами n, l, m – главным, орбитальным, магнитным соответственно. На каждом невырожденном по энергии уровне могут находиться с учетом спина по два электрона, а на каждом вырожденном по орбитальному квантовому числу уровне 2(2l +1) электронов.
Различие между металлами и диэлектриками с точки зрения зонной теории состоит в том, что при 0 К в зоне проводимости металлов имеются электроны, а в зоне проводимости диэлектриков они отсутствуют. Различие же между диэлектриками и полупроводниками определяется шириной запрещенных зон: для диэлектриков она довольно широка (например, для NaCl DЕ=6 эВ), для полупроводников — достаточно узка (например, для германия DЕ=0,72 эВ). При температурах, близких к 0 К, полупроводники ведут себя как диэлектрики, так как переброса электронов в зону проводимости не происходит. С повышением температуры у полупроводников растет число электронов, которые вследствие теплового возбуждения переходят в зону проводимости, т. е. электрическая проводимость проводников в этом случае увеличивается.
25. Свойства и характеристика ядер. Нейтрон и протон, их свойства. Энергия связи ядра.
26. Свойства и модель ядерных сил. Капельная модель ядра. Формула Вейцзеккера для энергии связи. Оболочечная модель ядра.
Силы, действующие между нуклонами в ядре и обеспечивающие существование устойчивых ядер, называются ядерными силами. Ядерные силы обладают рядом особых свойств:
1) Эти силы не относятся ни к одному из типов сил, известных в классической физике. 2) Ядерные силы – силы короткодействующие. Расстояние r , на котором действуют ядерные силы, называются радиусом действия ядерных сил ( r = 2*10-15 м).
3) Они обладают свойством зарядовой независимости. 4) У них имеется свойство насыщения: каждый нуклон взаимодействует только с ограниченным числом ближайших к нему нуклонов, а не со всеми нуклонами ядра.
5) Ядерные силы не являются центральными силами, в отличие от кулоновских и гравитационных сил.
6) Ядерные силы имеют обменный характер. Это проявляется в том, что силы, действующие между двумя ядерными частицами, рассматриваются как результат обмена между ними некоторой промежуточной частицей( Pi – мезоном) Ядерные силы детально не изучены до сих пор. Законченной теории ядерных сил не существует. Плодотворным методом изучения различных свойств атомного ядра является метод моделей ядра, основанной на внешней аналогии свойств атомных ядер со свойствами других систем, хорошо изученных в физике.
В капельной модели ядро рассматривается как сферическая капля несжимаемой заряженной ядерной жидкости радиуса R = rA. То есть в энергии связи ядра учитываются объемная, поверхностная и кулоновская энергии. Дополнительно учитываются выходящие за рамки чисто капельных представлений энергия симметрии и энергия спаривания. В рамках этой модели можно получить полуэмпирическую формулу Вайцзеккера для энергии связи ядра.
Eсв(A,Z) = aA – aA – aZ/A – a(A/2 – Z)/A + aA.
Первое слагаемое в энергии связи ядра, подобного жидкой капле, пропорционально массовому числу A и описывает примерное постоянство удельной энергии связи ядер. Второе слагаемое – поверхностная энергия ядра уменьшает полную энергию связи, так как нуклоны, находящиеся на поверхности имеют меньше связей, чем частицы внутри ядра. Это аналог поверхностного натяжения. Третье слагаемое в энергии связи обусловлено кулоновским взаимодействием протонов. В капельной модели предполагается, что электрический заряд протонов равномерно распределен внутри сферы радиуса R = r0A1/3.
Четвертое слагаемое – энергия симметрии ядра отражает тенденцию к стабильности ядер с N = Z. Пятое слагаемое – энергия спаривания учитывает повышенную стабильность основных состояний ядер с четным числом протонов и/или нейтронов. Входящие в формулу коэффициенты a1, a2, a3, a4 и a5 оцениваются из экспериментальных данных по знергиям связи ядер, что дает
| Экспериментальные значения удельной энергии связи и расчет по формуле Вейцзеккера |
a = 15.75 МэВ; a = 17.8 МэВ; a = 0.71 МэВ; a = 94.8 МэВ;
На рисунке показаны экспериментальные значения удельной энергии связи = Eсв/A и расчет по формуле Вайцзеккера (плавная кривая). Формула Вайцзеккера позволяет по заданным значениям A и Z вычислять энергию связи ядра с погрешностью ~10 МэВ. При A 100 это дает относительную ошибку ~10-2. Наибольшее расхождение между эспериментально измеренными величинами энергии связи ядра и расчетами по формуле Вайцзеккера наблюдается в области магических чисел. Это объясняется тем, что в капельной модели не учитываются неоднородности распределения ядерной материи, обусловленные оболочечной структурой атомных ядер.
27. Искусственная и естественная радиоактивность. Основной закон радиоактивного распада. Активность. Правила смещения.
Нет такого эксперимента, хотя есть много экспериментов, где количество электронов в атоме измеряется как побочный эффект. Мы знаем, что атомы электрически нейтральны, поэтому должно быть одинаковое количество электронов и протонов. Мы знаем, что последовательные элементы в периодической таблице создаются путем увеличения числа протонов, поэтому мы знаем, сколько электронов должно иметь атомы. Так, например, мы знаем, что атом углерода имеет шесть протонов, поэтому он должен иметь шесть электронов. Возможно, это только перемещает проблему назад на один шаг. Тогда возникает вопрос: откуда у атома углерода шесть протонов? В наши дни это невероятно просто, поскольку мы просто очень точно измеряем массу углеродного ядра и, поскольку мы знаем массы протонов и нейтронов, мы можем сказать, сколько в нем протонов и нейтронов. Исторически атомный номер был получен в основном путем дедукции, а не прямого измерения. Я сказал, что были эксперименты, которые измеряют количество электронов как побочный эффект. В течение многих лет эксперименты на коллайдере проводились с атомными ядрами. В настоящее время это делается в RHIC и эксперименте LHC ALICE, но это было сделано задолго до этого. Атомы лишены электронов при прохождении через углеродную пленку, и их ядерный заряд затем измеряется как побочный эффект их ускорения. Для ядра углерода мы измеряем заряд 6 6 следовательно, нейтральный атом углерода должен иметь шесть электронов. easymoden00b должен ли атом иметь шесть делимых электронов? Или это больше электронная пленка (с различными областями плотности), которая имеет общее значение -6? jamesqf @ easymoden00b: Да, а потом снова нет. Короткий ответ: это квант. Длинный ответ, вероятно, требует ученой степени по физике 🙂 Джон Ренни @ easymoden00b: электроны в атоме делокализованы, т.е. у них нет позиции. Это не значит, что они разложены в фильме, это означает, что у квантовых объектов просто нет позиции. Таким образом, атом углерода всегда имеет шесть электронов, но в нем нет шести маленьких точек электрона. Андалуз Итак, поскольку мы знаем массы протонов, нейтронов и электронов, мы можем вывести из этих данных количество этих частиц? Я просто не могу это проглотить. При всем моем уважении (и извините за отсутствие знаний), но я не могу понять, как вы можете подсчитать количество частиц, просто измеряя их массу. А что вы имеете в виду, отрывая электроны от атома? Все ли электроны полосаты или как внешняя оболочка?
Источники:
- www.kakprosto.ru
- www.kakprosto.ru
- cyberpedia.su
- askentire.net
Download Article
Download Article
Finding the number of protons, neutrons, and electrons in a given element isn’t as hard as it sounds. Oftentimes part of your answer will be right in front of you in the periodic table! Once you know where to look, finding the number of protons, neutrons, and electrons will be a breeze.
-

1
Get a periodic table of elements. The periodic table is a chart that organizes elements by their atomic structure. It is color-coded and assigns each element a unique 1 or 2-letter abbreviation. Other elemental information includes atomic weight and atomic number.[1]
- You can find a periodic table online or in a chemistry book.
- In tests, normally, a periodic table will be provided.
-

2
Find your element on the periodic table. The table orders elements by atomic number and separates them into three main groups: metals, non-metals, and metalloids (semi-metals). Further elemental groupings include alkali metals, halogens, and noble gases.[2]
- Using the group (columns) or period (rows) can make the element easier to locate on the table.
- You can also search the table for the symbol of the element if you don’t know any other properties.
Advertisement
-

3
Locate the element’s atomic number. The atomic number is located above the element symbol, in the upper left-hand corner of the square. The atomic number will tell you how many protons make up a single atom of an element.[3]
- For example, boron (B) has an atomic number of 5, therefore it has 5 protons.
-

4
Determine the number of electrons. Protons are particles in the nucleus of an atom that have a positive charge equal to +1. Electrons are particles that have a negative charge equal to -1. Therefore, an element in a neutral state will have the same number of protons and electrons.[4]
- For example, boron (B) has an atomic number of 5, therefore it has 5 protons and 5 electrons.
- However, if the element includes a negative or positive ion, then the protons and electrons will not be the same. You will have to calculate them. The ion number will appear as a small superscript after the element.
-

5
Look for the atomic mass of the element. To find the number of neutrons, you will first need to find the atomic mass. An element’s atomic mass (also known as the atomic weight) is the weighted average mass of atoms of an element.[5]
The atomic mass can be found underneath the symbol for the element.- Make sure that you round the atomic mass to the nearest whole number. For example, the atomic mass of boron is 10.811, but you can just round the atomic mass up to 11.
-

6
Subtract the atomic number from the atomic mass. To find the number of neutrons, you will need to subtract the atomic number from the atomic mass. Remember that the atomic number is the same as the number of protons, which you have already identified.[6]
- For our boron example, 11 (atomic mass) – 5 (atomic number) = 6 neutrons
Advertisement
-

1
Identify the net charge. The net charge of an ion will appear as a small superscript number following the element. An ion is an atom that has a positive or negative charge due to the addition or removal of electrons.[7]
Although the number of protons in the atom remains the same, the number of electrons is altered in an ion.- Because an electron has a negative charge, when you remove electrons, the ion becomes positive. When you add more electrons, the ion becomes negative.
- For example, N3- has a -3 charge while Ca2+ has a +2 charge.
- Keep in mind that you do not have to do this calculation if there is no superscripted ion number following the element.
-

2
Subtract the charge from the atomic number. When an ion has a positive charge, the atom has lost electrons. To calculate the remaining number of electrons, you subtract the amount of extra charge from the atomic number. In the case of a positive ion, there are more protons than electrons.[8]
- For example, Ca2+ has a +2 charge so it has lost 2 electrons from the neutral state. Calcium’s atomic number is 20, therefore the ion has 18 electrons.
-

3
Add the charge to the atomic number for negative ions. When an ion has a negative charge, the atom has gained electrons. To calculate the total number of present electrons, you simply add the amount of extra charge to the atomic number. In the case of a negative ion, there are fewer protons than electrons.[9]
- For example, N3- has a -3 charge; therefore, it has gained 3 electrons compared to the neutral state. Nitrogen’s atomic number is 7, therefore this ion has 10 electrons.
Advertisement
Add New Question
-
Question
How do I find the number of protons when an atom has a -ve or +ve charge?

Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.

Scientific Researcher
Expert Answer
The number of protons will never change. Atoms with negative or positive charges just indicate a gain or loss of electrons.
-
Question
How can I find the electron and proton numbers of actinium?

Meredith Juncker is a PhD candidate in Biochemistry and Molecular Biology at Louisiana State University Health Sciences Center. Her studies are focused on proteins and neurodegenerative diseases.

Scientific Researcher
Expert Answer
You will find actinium in group 3, period 7 of the periodic table. The atomic number of actinium is 89, which means there are 89 protons. Because there is no net charge, we know that # protons = # electrons, so there are 89 electrons as well.
-
Question
How do I find the number of protons are in a nucleus when given the atomic mass?

All the protons are present in the nucleus, or centre of an atom. You need the atomic number to find the amount of protons and/or electrons, unless you have the amount of neutrons and the atomic mass, in which case you can simply subtract the amount of neutrons from the atomic mass, leaving the amount of protons in the atom. The atomic number (number at the top) is the amount of protons and the amount of electrons. So if an element has an atomic number of 5, you know that it has 5 protons and 5 electrons. The atomic mass (number at the bottom) is the amount of protons and neutrons added together. Whichever you know, you subtract from the atomic mass.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
About This Article
Article SummaryX
The easiest way to find the number of protons, neutrons, and electrons for
an element is to look at the element’s atomic number on the periodic table.
That number is equal to the number of protons. The number of protons is
equal to the number of electrons, unless there’s an ion superscript listed
after the element. To find the number of neutrons, subtract the element’s
atomic number from its atomic mass (the number listed underneath the
element).
Did this summary help you?
Thanks to all authors for creating a page that has been read 2,840,321 times.
