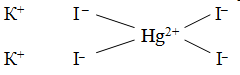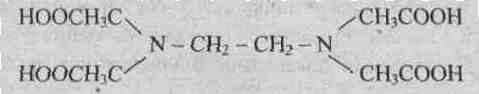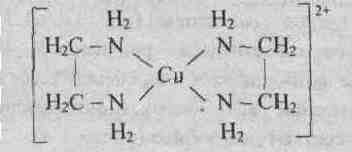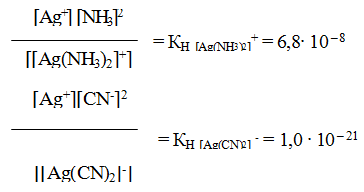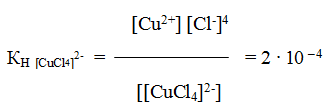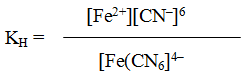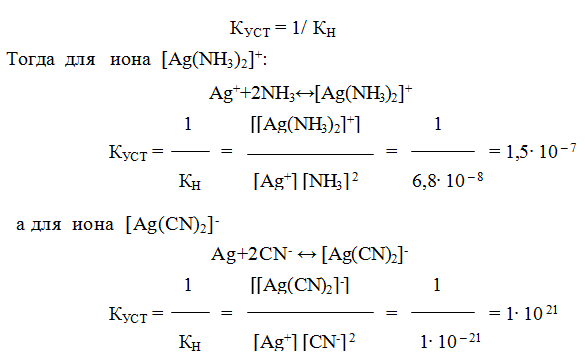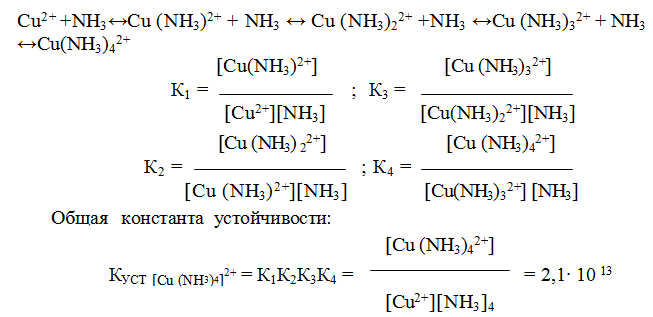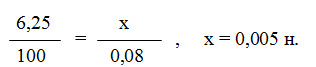Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
Комплексные соединения
При рассмотрении видов химической связи
отмечалось, что силы притяжения возникают
не только между атомами, но и между
молекулами и ионами. Такое взаимодействие
может приводить к образованию новых
более сложных комплексных (или
координационных) соединений.
Комплексныминазывают соединения,
имеющие в узлах кристаллической решетки
агрегаты атомов (комплексы), способные
к самостоятельному существованию в
растворе и обладающие свойствами,
отличными от свойств составляющих их
частиц (атомов, ионов или молекул).
В
молекуле комплексного соединения
(например, K4[Fe(CN)6])
различают следующие структурные
элементы: ион-комплексообразователь
(для данного комплекса Fe), координированные
вокруг него присоединенные частицы –
лиганды
или адденды (CN–),
составляющие вместе с комплексообразователем
внутреннюю
координационную сферу
([Fe(CN)6]4-),
и остальные
частицы,
входящие во внешнюю
координационную сферу
(K+).
При растворении комплексных соединений
лиганды остаются в прочной связи с
ионом-комплексообразователем, образуя
почти не диссоциирующий комплексный
ион. Число лигандов называется
координационным
числом
(в случае K4[Fe(CN)6]
координационное число равно 6).
Координационное число определяется
природой центрального атома и лигандов,
а также соответствует наиболее
симметричной геометрической конфигурации:
2 (линейная), 4 (тетраэдрическая или
квадратная) и 6 (октаэдрическая
конфигурация).
Характерными комплексообразователями
являются катионы: Fe2+,Fe3+,Co3+,Co2+,Cu2+,Ag+,Cr3+,Ni2+.Способность
к образованию комплексных соединений
связана с электронным строением атомов.
Особенно легко образуют комплексные
ионы элементы d-семейства,
например: Ag+,
Au+,
Cu2+,
Hg2+,
Zn2+,
Fe2+,
Cd2+,
Fe3+,
Co3+,
Ni2+,
Pt2+,
Pt4+и
др. Комплексообразователями могут быть
А13+
и некоторые неметаллы, например, Si
и В.
Лигандами могут служить как заряженные
ионы: F–, ОН–,NO3–,NO2–,Cl–, Вг–,I–,CO32-,CrO42-,S2O32-,CN–,PO43-и др., так и электронейтральные полярные
молекулы:NH3, Н2О,
РН3, СО и др. Если все лиганды у
комплексообразователя одинаковы, то
комплексноесоединение однородное,
например [Pt(NH3)4]Cl2;
если лиганды разные, то соединениенеоднородное, например
[Pt(NH3)3Cl]Cl.
Между комплексообразователем и лигандами
обычно устанавливаются координационные
(донорно-акцепторные) связи. Они
образуются в результате перекрывания
заполненных электронами орбиталей
лигандов вакантными орбиталями
центрального атома. В
комплексных соединениях донором является
комплексообразователь, акцептором –
лиганд.
Количество химических
связей между комплексообразователем
и лигандами определяет координационное
число комплексообразователя. Характерные
координационные числа:Cu+,Ag+,Au+=
2;Cu2+,Hg2+,Pb2+,Pt2+,
Pd2+
=4;Ni2+,Ni3+,Co3+,А13+
= 4 или 6; Fe2+,
Fe3+,
Pt4+,
Pd4+,
Ti4+,
Pb4+,
Si4+
=6.
Заряд комплексообразователя равен
алгебраической сумме зарядов составляющих
его ионов, например: [Fex(CN)6]4-,
x + 6(-1) = 4-; x = 2.
Входящие
в состав комплексного иона нейтральные
молекулы не оказывают влияния на заряд.
Если вся внутренняя сфера заполнена
только нейтральными молекулами, то
заряд иона равен заряду комплексообразователя.
Так, у иона [Cux(NH3)4]2+
заряд меди х = 2+. Заряд комплексного иона
равен зарядам ионов, находящихся во
внешней сфере. В K4[Fe(CN)6]
заряд [Fe(CN)6]
равен -4, так как во внешней сфере находятся
4 катиона К+,
а молекула в целом электронейтральна.
Лиганды
во внутренней сфере могут замещать друг
друга при сохранении одного и того же
координационного числа.
Классификация
и номенклатура комплексных соединений.
С
точки
зрения заряда
комплексной частицы
все
комплексные соединения можно разделить
на катионные, анионные и нейтральные.
Катионные комплексы образуют
катионы металлов, координирующие
вокруг себя нейтральные или анионные
лиганды, причем суммарный заряд
лигандов меньше по абсолютной величине,
чем степень окисления комплексообразователя,
например [Co(NH3)6]Cl3.
Катионные комплексные соединения
помимо гидроксокомплексов и солей,
могут быть кислотами, напримерH[SbF6]
– гексафторсурьмяная кислота.
В анионных комплексах, напротив,
лигандов-анионов такое число, что
суммарный заряд комплексного аниона
отрицателен, например [Ni(CO)4].
Ванионных комплексахв качестве
лигандов выступают гидроксид-анионы –
это гидроксокомплексы (например
Na2[Zn(OH)4] – тетрагидроксоцинкат
калия), или анионы кислотных остатков
– этоацидокомплексы(напримерK3[Fe(CN)6]
– гексацианоферрат (III)
калия).
Нейтральные комплексы могут
быть нескольких видов: комплекс
нейтрального атома металла с нейтральными
лигандами (напримерNi(CO)4
– тетракарбонил никеля, [Сr(С6Н6)2]
– дибензолхром). В нейтральных комплексах
другого вида заряды комплексообразователя
и лигандов уравновешивают друг друга
(например, [Pt(NH3)2Cl2]
– хлорид гексаамминплатины (IV),
[Co(NH3)3(NO2)3]
– тринитротриамминкобальт).
Классифицировать комплексные соединения
можно по природе лиганда. Среди
соединений с нейтральными лигандами
различают аквакомплексы, аммиакаты,
карбонилы металлов. Комплексные
соединения, содержащие в качестве
лигандов молекулы воды, называютаквакомплексами. При кристаллизации
вещества из раствора катион захватывает
часть молекул воды, которые попадают в
кристаллическую решетку соли. Такие
вещества называютсякристаллогидратами,
например А1С13·6Н2О.
Большинство кристаллогидратов
представляет собой аквакомплексы,
поэтому их точнее изображать в виде
комплексной соли ([А1(Н2О)6]С13– хлорид гексаакваалюминия). Комплексные
соединения с молекулами аммиака в
качестве лиганда называют аммиакатами,
например [Pt(NH3)6]C14– хлорид гексаамминплатины (IV).Карбонилами металлов называют
комплексные соединения, в которых
лигандами служат молекулы оксида
углерода (II), например,
[Fe(CO)5]
– пентакарбонил железа, [Ni(CO)4]
– тетракарбонил никеля.
Известны комплексные соединения с двумя
комплексными ионами в молекуле, для
которых существует явление координационной
изомерии, которая связана с разным
распределением лигандов между
комплексообразователями, например:
[Ni(NH3)6][Co(NO2)6]
– гексанитрокобальтат (III)
гексаамминникеля (III).
При составлении названия комплексного
соединенияприменяются следующие
правила:
1) если соединение является комплексной
солью, то первым называется анион в
именительном падеже, а затем катион в
родительном падеже;
2) при названии комплексного иона сначала
указываются лиганды, затем
комплексообразователь;
3) молекулярные лиганды соответствуют
названиям молекул (кроме воды и аммиака,
для их обозначения применяются термины
«аква» и«амин»);
4) к анионным лигандам добавляют окончание
– о, например: F– –
фторо, С1–– хлоро, О2–– оксо,CNS–– родано,NO3–– нитрато,CN–– циано,SO42-– сульфато,S2O32-– тиосульфато, СО32-–
карбонато, РО43-– фосфато,
ОН–– гидроксо;
5) для обозначения количества лигандов
используются греческие числительные:
2 – ди-, 3 –три-, 4 –тетра-, 5
–пента-, 6 –гекса-;
6) если комплексный ион – катион, то для
названия комплексообразователя
используют русское наименование
элемента, если анион – латинское;
7) после названия комплексообразователя
римской цифрой в круглых скобках
указывают его степень окисления;
8) у нейтральных комплексов название
центрального атома дается в именительном
падеже, а его степень окисления не
указывается.
Свойства комплексных соединений.Химические реакции с участием комплексных
соединений разделяют на два типа:
1)
внешнесферные – при их протекании
комплексная частица остается неизменной
(реакции обмена);
2)
внутрисферные – при их протекании
происходят изменения в степени окисления
центрального атома, в строении лигандов
или изменения в координационной сфере
(уменьшение или увеличение координационного
числа).
Одним из важнейших свойств комплексных
соединений является их диссоциация в
водных растворах. Большинство растворимых
в воде ионных комплексов – сильные
электролиты, они диссоциируют на
внешнюю и внутреннюю сферы:K4[Fe(CN)6]
↔ 4K++ [Fe(CN)6]4
–.
Комплексные ионы достаточно устойчивы,
они являются слабыми электролитами,
ступенчато отщепляя в водный раствор
лиганды:
[Fe(CN)6]4
–↔ [Fe(CN)5]3-+CN–(число ступеней
равно числу лигандов).
Если суммарный заряд частицы
комплексного соединения равен нулю, то
имеем молекулу неэлектролита, например
[Pt(NH3)2C14].
При обменных реакциях комплексные ионы
переходят из одних соединений в
другие, не изменяя своего состава.
Электролитическая диссоциация комплексных
ионов подчиняется закону действующих
масс и количественно характеризуется
константой диссоциации, которая носит
название константы нестойкостиКн . Чем меньше константа
нестойкости комплекса, тем в меньшей
степени он распадается на ионы, тем
устойчивее это соединение. У соединений,
характеризуемых высокой Кн,
комплексные ионы неустойчивы, т. е. их
практически нет в растворе, такие
соединения являютсядвойными солями.
Отличие между типичными представителями
комплексных и двойных солей заключается
в том, что последние диссоци-ируют с
образованием всех ионов, которые входят
в состав этой соли, например:KA1(SO4)2↔ К++ А13++ 2SO42-(двойная соль);
К [Fe(CN)6]
↔ 4К++ [Fe(CN)6]4-(комплексная соль).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Комплексные соединения
Общая химия. Учебное пособие — Таирова А.Р., Кузнецов А.И. — 2005
- 9.1. Определение комплексных соединений
- 9.2. Комплексообразователи
- 9.3.Лиганды
- 9.4. Номенклатура комплексных соединений
- 9.5. Диссоциация комплексных соединений
- 9.6. Константы устойчивости комплексов
- 9.7.Роль комплексных соединений
- 9.8. Комплексонометрия. Жесткость воды
9.1. Определение комплексных соединений. Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения обычные, или соединения первого порядка.
Однако имеются вещества, которые образованы в результате соединения друг с другом нейтральных молекул без возникновения новых связующих электронных пар. Например:
K2S04 + A12 (S04)3 = K2S04·AI2 (SО4)3 = 2KA1 (SO4)2
CuSO4 + 5H2O = CuSO4 · 5H2O
CuS04 + 4NH3 = CuSО4·4NH3 = [Cu (NH3)4] SO4
Fe (CN)3 + 3KCN = Fe (CN)3·3KCN = K3 [Fe (CN)6]
HgI2 + 2KI = HgI2·2KI = K2[HgI4]
Это молекулярные соединения, или соединения высшего порядка. Одни из них диссоциируют в водном растворе на простые ноны, например:
КА1 (SО4)2 ↔ K+ + А13+ + 2 SО42 —
другие — на сложные (комплексные) ионы, состоящие, в свою очередь, из более простых ионов, как, например:
К3 [Fe (CN)6] ↔ЗК + + [Fe (CN)6]3-
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называют комплексными. Но такое определение применимо лишь в известных пределах. Оно не охватывает соединений типа неэлектролитов, например карбонилов металлов —Ni(CO)4 и др., а потому не является и полным.
Чтобы объяснить, почему происходит присоединение одних простых молекул к другим, швейцарский химик А. Вернер ввел понятие о главной и побочной валентности. Тогда образование, скажем, K2[HgI4] можho представить так: ион ртути за счет своей главной валентности (обозначается сплошной линией), равной двум, присоединяет два иодид-иона, а за счет побочной — (обозначается пунктиром) — дополнительно еще два иодид-иона. По Вернеру, это может быть изображено формулой
В настоящее время главную валентность надо объяснить ионной или ковалентной связью, а побочную – ковалентной связью, возникшей по донорно-акцепторному механизму (см. раздел 4.8.2.). Исходя из механизма образования комплексных соединений, им можно дать более точное, не имеющее исключений определение: комплексные соединения – это соединения, характеризующиеся наличием хотя бы одной ковалентной связи, возникшей по донорно-акцепторному механизму.
Комплексообразование происходит во всех случаях, когда из менее сложных систем образуются системы более сложные. Согласно координационной теории А. Вернера в структуре комплексного соединения различают координационную (внутреннюю) сферу, состоящую из центральной частицы – комплексообразователя (ион или атом) – и окружающих ее лигандов (ионы противоположного знака или молекулы). Ионы, находящиеся за пределами координационной сферы, образуют внешнюю сферу комплексного соединения. Число лигандов вокруг комплексообразователя называется его координационным числом. Внутренняя сфера (комплекс) может быть анионом, катионом и не иметь заряда. Например, в комплексном соединении K3[Fe(CN)6] внешняя сфера – 3К+, внутренняя сфера [Fe(CN)6]3-, где Fe3+ — комплексообразователь, a 6CN – лиганды, причем, 6 – координационное число. Таким образом, комплексное соединение (как правило) в узлах кристаллической решетки содержит комплекс, способный к самостоятельному существованию и в растворе.
9.2. Комплексообразователи. Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической таблицы элементов.
9.3.Лиганды. К числу лигандов относятся простые анионы, такие как F— , СI—, Вr—, I—, S2-, сложные анионы, например CN– , NCS – , NO2—) , молекулы, например Н2О, NH3, C. Ионы или отдельные атомы ионов и молекул лигандов имеют неподеленные пары электронов. В зависимости от того, какое число вакантных орбиталей у комплексообразователя занимают лиганды, они подразделяются на монодентантные (одна орбиталь), например NН3, СI—, бидентантные, например N2H4или En, полидентантные, например этилендиаминтетрауксусная кислота (ЕДТА), являющаяся шестидентантным лигандом
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений, называемых комплексонами. Би- и полидентантные лиганды при взаимодействии с комлексообразователями образуют замкнутые циклы, называемые хелатными, поэтому и комплексы с би- и полидентантными лигандами называют хелатными (или клешневидными), например
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях: a) K4[Fe(CN)6]; б) Na[Ag(NO2)2]; в) K2[MoF8]; г) [Сr(Н2O)2(NН3)3С1]С12.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (H2O, NН3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
| Заряд иона | К.ч. | Степень окисления | |
| а) | -4 | 6 | +2 |
| б) | -1 | 2 | +1 |
| в) | -2 | 8 | +6 |
| г) | +2 | 6 | +3 |
9.4. Номенклатура комплексных соединений. Название комплексного катиона записывается одним словом, начинающимся с названия отрицательного лиганда с прибавлением буквы «о», затем приводятся нейтральные молекулы и центральный атом с указанием римской цифрой его степени окисления для металлов переменной валентности. Для молекул Н2О (аква), NН3 (аммин), СО (карбонил), NO (нитрозил) даются особые названия, указанные в скобках.
Число лигандов обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-, тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6 соответственно у сложных лигандов. Например, соединение [Zn(NH3)2Cl]CI называется хлорид хлородиамин цинка (II), а [Ni(En)2]Cl2 – хлорид бис(этилендиамин) никеля (II).
Комплексный анион записывается аналогично названию катиона, но с добавлением суффикса -«am» к названию комплексообразователя, например K2[Zn(CN)4] — тетрацианоцинкат (II) калия. Нейтральный комплекс записывается подобно катиону, например комплекс [Ni(CО)4] называется тетракарбонил никеля (II). Соответственно по типу лигандов комплексы называют аквакомплексы (лиганд Н2О), аминокомплексы (лиганд NH3), ацидокомплексы (лиганды анионы кислот), комплексонатные комплексы (лиганды-комплексоны) и т.д.
9.5. Диссоциация комплексных соединений. Комплексные соединения — неэлектролиты в водных растворах диссоциации не подвергаются. У них отсутствует внешняя сфера комплекса, например: [Zn(NH3)2Cl2], [Co(NH3)3(NO3)3], [Pt (NH3)2C12]. В водной среде такие молекулы гидратируются как единое образование.
Комплексные соединения — электролиты при диссоциации в водных растворах образуют комплексные ионы, например:
[Ag (NH3)2] CI ↔[Ag (NH3)2]+ +С1– ; К [Ag (CN)2 ↔K+ + [Ag (CN)2]—
Такая диссоциация протекает полностью, ионы гидратируются. Комплексные ионы в свою очередь подвергаются вторичной диссоциации:
[Ag(NH3)2]+ ↔Ag++2NH3 (a)
[Ag (CN)2] — ↔ Ag+ +2CN— (б)
Однако эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс к обратимым процессам (а) и (б), получаем выражения констант нестойкости комплексных ионов:
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного соединения. В приведенных примерах комплекс [Ag(CN)2]— более прочен, чем
комплекс [Ag(NH3)2]+, так как имеет меньшее значение КН.
Соединения с малоустойчивой внутренней сферой называют двойными солями. Обозначают их иначе, чем комплексные соединения, а именно — как соединения молекул, например K2SO4∙A12(SO4)3. Принципиальной же разницы между двойными солями и комплексными соединениями нет. В растворе двойной соли имеется некоторое количество комплексных ионов (например, [Al (SO4)2]—). Двойная соль отличается от комплексной соли лишь диссоциацией комплексного иона: у первой она практически полная, а у второй — незначительная.
Двойные соли — довольно распространенные соединения. К ним относятся соль Мора (NH4)2SO4∙FeSO4∙6H2O, двойной хлорид калия и меди 2КС1 ∙ СuС12 ∙ 2Н2О и многие другие. Если, например, растворить в воде двойной хлорид, то происходит диссоциация
2КС1∙СuС12∙2Н2О↔2К++Сu2+ + 4С1—+2Н2О
и все образовавшиеся в растворе ионы можно обнаружить с помощью соответствующих реакций. Но если это соединение рассматривать как комплексное, то его формулу надо изобразить как K2[CuС14]∙2H2О. Диссоциация K2[CuС14]∙2H2О протекает по уравнению:
К2 [CuCl4] ∙ 2H2O↔ 2К + + [CuC14]2 — + 2Н2О
и
[CuCl4]2-↔Cu2+ + 4Cl—
Образующийся комплексный ион устойчив только в концентрированных растворах, и его константа нестойкости при комнатной температуре
Сравним значение КН [CuCl4]2- со значением константы нестойкости одного из комплексных ионов меди, например КН[Cu(NH3)4]2+ = 4,6 ∙ 10 – 14. Тогда мы увидим, что КН [CuCl4]2- > КН[Cu(NH3)4]2+ на несколько порядков, а чем меньше константа нестойкости комплекса, тем больше его устойчивость.
Пример 1. Напишите выражение для константы нестойкости комплекса [Fе(СМ)6]4-.
Решение. Если комплексная соль гексацианоферрат (II) калия, являясь сильным электролитом, в водном растворе необратимо диссоциирует на ионы внешней и внутренней сфер
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]4–
то комплексный ион диссоциирует обратимо и в незначительной степени на составляющие его частицы:
[Fe(CN)6]4– ↔ Fe2+ + 6CN–
Обратимый процесс характеризуется своей константой равновесия, которая в данном случае называется константой нестойкости (Кн) комплекса:
Чем меньше KH, тем более прочен данный комплекс.
9.6. Константы устойчивости комплексов. Для характеристики устойчивости (прочности) комплексного иона применяют также величину, обратную константе нестойкости. Ее называют константой устойчивости (КУСТ) или константой образования комплекса. Величины КН и КУСТ взаимосвязаны:
Очевидно, чем выше КУСТ, тем прочнее комплексный ион и тем больше его концентрация при равновесии.
Следует подчеркнуть, что как диссоциация комплексного иона, так и его образование являются процессами обратимыми и протекают ступенчато, как у слабых электролитов. Каждой ступени соответствует определенная величина константы устойчивости — К1, К2 …, Кn. Ион [Ag(NH3)2] + будет иметь две константы устойчивости — K1 и K2:
У иона [Cu(NH3)4]2+ будет четыре константы устойчивости, так как комплексообразователь в четыре стадии присоединяет лиганд NH3
Таким образом, при образовании комплексов в растворе происходит последовательное (стадийное) внедрение лигандов во внутреннюю сферу комплексообразователя с соответствующим отщеплением молекул воды, так как исходный ион Сu2+ был гидратирован (он имел состав [Cu(H2O)4]2+). При диссоциации комплекса [Cu(NH3)4]2+, наоборот, происходит соответствующая замена лигандов на молекулы воды. Поскольку концентрация воды при таких процессах не изменяется, ее не включают в выражение констант устойчивости или констант нестойкости.
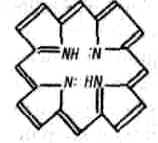
9.7.Роль комплексных соединений. Комплексные соединения широко распространены в природе. В состав многих растений и живых организмов входят соединения с макроциклическими лигандами. В упрощенном виде тетрадентантный макроцикл порфин представлен на рис. 3.3
Рис. 3.3. Структура молекул порфина
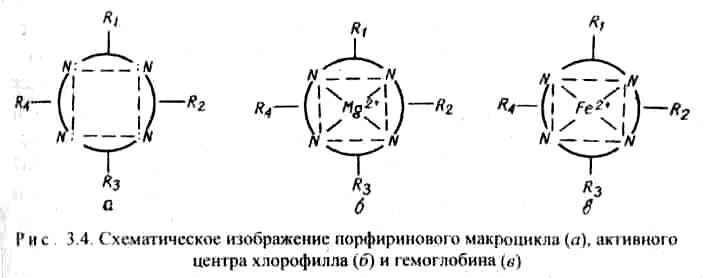
Комплексы с участием порфина называются порфи-ринами. Они отличаются друг от друга центральными ионами-комплексообразователями и заместителями, присоединенными к атомам углерода на периферии лиганда. В наиболее простом виде порфиновый цикл представлен четырьмя атомами азота, соединенными углеродными цепями (рис. 3.3). Кроме того, имеются четыре или более заместителей — радикалов R1, R2, R 3, R4. В зеленом катализаторе фотосинтеза — хлорофилле роль комплексообразователя выполняет магний (рис. 3.4). Макроциклический комплекс железа входит в состав гемоглобина (рис. 3.4).
Железо координирует кислород в комплексе гемоглобина и переносит его по организму с кровью. Связь кислорода с железом в комплексе не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Недостаток железа в организме приводит к болезни — анемии. Макроциклы крови могут взаимодействовать с каталитическими ядами, например, монооксидом углерода СО, что приводит к отравлению организма.
Сложные лиганды-комплексоны широко используются в энергетике для очистки парогенераторов от накипи, в медицине — для очистки почек от камней, для выведения ядов из организма, таких как Hg2+ Pb2+ Cd2+, в химии — как катализаторы некоторых реакций, например восстановления кислорода, в аналитической химии, в частности, при определении жесткости воды.
9.8. Комплексонометрия. Жесткость воды. Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.
Приведенные примеры решают, применяя формулу Ж = m / (mЭ ∙ V)
где: т – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости, мг;
mэ, – молярная масса эквивалента этого вещества;
V – объем воды, л.
Решение. В 1 л воды содержится 202,5 : 500 = 0,405 г Са(НСО3)2, что составляет 0,405 : 81 = 0,005 ммоль/л. 81 г/моль — эквивалентная масса Са(НСО3)2. Следовательно, жесткость воды 5ммоль. (Ж = т / (mэV)= 202 500 / (81 • 500) = 5 ммоль. 81 – эквивалентная масса Са(НСО3)2, равная половине его молярной массы).
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса CaSO4 136,14 г/моль; молярная масса эквивалента равна 136,14:2 = 68,07 г/моль. В 1 м3 воды жесткостью 4 ммоль содержится 4 · 1000 = 4000 ммоль, или 4000 · 68,07 = 272 280 мг = 272,280 г CaSO4. Из формулы Ж = m / (mэV),m = 468,071000 = 272 280 мг = 272,280 г CaSO4).
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль?
Решение. В 500 л воды содержится 500 · 5 = 2500 моль солей, обусловливающих жесткость воды. Для устранения жесткости следует прибавить 2500 · 53 = 132 500 мг = 132,5 г соды (53 г/моль — молярная масса эквивалента Na2CO3).
Пример 4. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора НС1.
Решение. Вычисляем молярную концентрацию эквивалентов раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, через х, составляем пропорцию:
Таким образом, в 1 л исследуемой воды содержится 0,005·1000 = 5 ммоль гидрокарбоната кальция или 5 ммоль Са2+-ионов. Карбонатная жесткость воды 5 ммоль.
…
Как известно, металлы имеют свойство терять электроны и, тем самым, образовывать катионы. Положительно заряженные ионы металлов могут находиться в окружении анионов или нейтральных молекул, образуя частицы, называемые комплексными и способные к самостоятельному существованию в кристалле или растворе. А соединения, содержащие в узлах своих кристаллов комплексные частицы, называются комплексными соединениями.
Структура комплексных соединений
- Большинство комплексных соединений имеют внутреннюю и внешнюю сферы. Записывая химические формулы комплексных соединений, внутреннюю сферу заключают в квадратные скобки. Например, в комплексных соединениях К[Al(OH)4] и [Ca(NH3)8]Cl2, внутренней сферой являются группы атомов (комплексы) — [Al(OH)4]— и [Ca(NH3)8]2+, а внешней сферой — ионы К+ и Сl– соответственно.
- Центральный атом или ион внутренней сферы называют комплексообразователем. Обычно, в качестве комплексообразователей выступают атомы или ионы металлов с достаточным количеством свободных орбиталей – это p-, d-, f- элементы: Cu2+, Pt2+, Pt4+, Ag+, Zn2+, Al3+и др. Но это может быть и атомы элементов, образующих неметаллы. Заряд комплексообразователя обычно положительный, но также может быть отрицательным или равным нулю и равен сумме зарядов всех остальных ионов. В приведенных выше примерах комплексообразователями являются ионы Al3+и Ca2+.
- Комплексообразователь окружен и связан сигма-связью с ионами противоположного знака или нейтральными молекулами, так называемыми лигандами. В качестве лигандов в комплексных соединениях могут выступать такие анионы, как F– , OH–, CN–, CNS–, NO2–, CO32–, C2O42–и др., или нейтральные молекулы Н2О, NН3, СО, NО и др. В наших примерах это – ионы OH— и молекулы NH3. Количество лигандов в различных комплексных соединениях лежит в пределах от 2 до 12. А само число лигандов (число сигма-связей) называется координационным числом (к.ч.) комплексообразователя. В рассматриваемых примерах к.ч. равно 4 и 8.
- Заряд комплекса (внутренней сферы) определяется как сумма зарядов комплексообразователя и лигандов.
- Внешнюю сферу образуют ионы, связанные с комплексом ионной или межмолекулярной связью и имеющие заряд, знак которого противоположен знаку заряда комплексообразователя. Числовое значение заряда внешней сферы совпадает с числовым значением заряда внутренней сферы. В формуле комплексного соединения записываются они за квадратными скобками. Внешняя сфера может и вовсе отсутствовать, в случае, если внутренняя сфера нейтральна. В приведенных примерах, внешнюю сферу образуют 1 ион K+ и 2 иона Cl— соответственно.
Классификация комплексных соединений
Основываясь на различных принципах, комплексные соединения можно классифицировать различными способами:
По электрическому заряду: катионные, анионные и нейтральные комплексы
- Катионные комплексы имеют положительный заряд и образуются если вокруг положительного иона координированы нейтральные молекулы. Например, [Al(H2O)6]Cl3, [Ca(NH3)8]Cl2
- Анионные комплексы имеют отрицательный заряд и образуются, если вокруг положительного иона координированы атомы с отрицательной степенью окисления. Например, К[Al(OH)4], K2[BF4]
- Нейтральные комплексы имеют заряд равный нулю и не имеют внешней сферы. Они могут образоваться при координации вокруг атома молекул, а также при одновременной координации вокруг центрального положительно заряженного иона отрицательных ионов и молекул.
По количеству комплексообразователей
- Одноядерные – комплекс содержит один центральный атом, например, K2[Be(SO4)2]
- Многоядерные — комплекс содержит два и более центральных атомов, например, [CrFe(NH3)6(CN)6]
По типу лиганда
- Гидраты – содержат акво-комплексы, т.е. в качестве лигандов выступают молекулы воды. Например, [Cr(H2O)6]Br3, [Co(H2O)6]Br2
- Аммиакаты – содержат аммин-комплексы, в которых в качестве лигандов выступают молекулы аммиака (NН3). Например, [Zn(NH3)4]Cl2, [Ag(NH3)2]Cl
- Карбонилы – в таких комплексных соединениях, в качестве лигандов выступают молекулы монооксида углерода. Например, [Ni(CO)4], .
- Ацидокомплексы – комплексные соединения, содержащие в качестве лигандов кислотные остатки как кислородсодержащих, так и бескислородных кислот (F–, Cl–, Br–, I–, CN–, NO2–, SO42–, PO43–и др., а также ОН–). Например, K4[Ni(CN)6], Na2[FeCl4]
- Гидроксокомплексы— комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: K2[Zn(OH)4], Cs2[Sn(OH)6]
Комплексные соединения могут содержать лиганды, относящиеся к различным классам приведенной классификации. Например: К[Pt(H2O)3Br3], [Cr(NH3)4Br2]Br
По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- Кислоты — H[AuBr4], H2[PtCl6]
- Основания — [Cu(NH3)4](OH)2,[Ag(NH3)2]OH
- Соли — Cs3[Al(OH)6], [Ni(H2O)4]Cl2
- Неэлектролиты — [Pt(NH3)2Cl2]
По количеству мест, занимаемых лигандом в координационной сфере
В координационной сфере лиганды могут занимать одно или несколько мест, т.е. образовывать с центральным атомом одну или несколько связей. По этому признаку различают:
- Монодентатные лиганды – это такие лиганды как молекулы Н2О, NH3, CO, NO и др. и ноны CN−, F−, Cl−, OH−, SCN−, и др.
- Бидентатные лиганды. К такому типу лигандов относятся ионы H2N—CH2—COO−, СО32−, SO42−, S2O32−, молекула этилендиамина H2N—CH2—CH2—H2N (сокращенно en).
- Полидентатные лиганды. Это, например, органические лиганды, содержащие несколько групп — CN или -COOH (ЭДТА). Некоторые полидентантные лиганды способны образовать циклические комплексы, называемые хелатными (например, гемоглобин, хлорофилл и др.)
Номенклатура комплексных соединений
Чтобы записать формулу комплексного соединения, необходимо помнить, что, как и любое ионное соединение, вначале записывается формула катиона, а после – формула аниона. При этом, формулу комплекса записывают в квадратных скобках, где вначале записывают комплексообразователь, затем лиганды.
А вот несколько правил, следуя которым составить название комплексного соединения не составит никакого труда:
- В названиях комплексных соединений, как и ионных солей, первым указывают анион, а затем – катион.
- В названии комплекса сначала указывают лиганды, а после – комплексообразователь. Лиганды перечисляют в алфавитном порядке.
- Нейтральные лиганды называются также, как молекулы, к анионным лигандам прибавляют окончание –о. В таблице ниже даны названия наиболее распространенных лигандов
| Лиганд | Название лиганда | Лиганд | Название лиганда |
| en | этилендиамин | O2- | Оксо |
| H2O | Аква | H— | Гидридо |
| NH3 | Аммин | H+ | Гидро |
| CO | Карбонил | OH— | Гидроксо |
| NO | Нитрозил | SO42- | Сульфато |
| NO— | Нитрозо | CO32- | Карбонато |
| NO2— | Нитро | CN— | Циано |
| N3— | Азидо | NCS— | Тиоционато |
| Cl— | Хлоро | C2O42- | Оксалато |
| Br— | Бромо |
4. Если количество лигандов больше единицы, то их число указывают греческими приставками:
2-ди-, 3-три-, 4-тетра-, 5-пента-, 6-гекса-, 7-гепта-, 8-окта-, 9-нона-, 10-дека-.
5. Если же в названии самого лиганда уже присутствует греческая приставка, то название лиганда записывают в скобках и к нему прибавляют приставку типа:
2-бис-, 3-трис-, 4-тетракис-, 5-пентакис-, 6-гексакис-.
Например, соединение [Co(en)3]Cl3 называют – трис(этилендиамин)кобальт(III).
6. Названия комплексных анионов оканчиваются суффиксом – ат
После названия металла в скобках указывают римскими цифрами его степень окисления.
Например, назовем комплексные соединения:
[Cr(H2O)4Cl2]Cl
Начнем с лигандов: 4 молекулы воды обозначаются как тетрааква, а 2 хлорид-иона – как дихлоро.
Далее указываем комплексообразователь – это хром и его степень окисления равна III.
Наконец, анионом в данном соединении является хлорид-ион.
Итак, полное название таково – хлорид тетрааквадихлорохрома(III)
K4[Ni(CN)4]
Начнем с лигандов: в комплексном анионе содержится 4 лиганда CN—, которые называются тетрациано.
Далее указываем комплексообразователь – это никель и его степень окисления равна нулю.
Так как металл входит в состав комплексного аниона, то он называется никелат(0).
Итак, полное название таково – тетрацианоникелат(0) калия
Номенклатура комплексных соединений
Для составления названия комплексной частицы (катиона, аниона, молекулы) указывают в следующем порядке: число лигандов, названия лигандов, центральный атом.
Номенклатура лигандов
Для указания числа лигандов используют греческие числовые приставки: ди-, три-, тетра-, пента-, гекса- и т.д. При наличии одного лиганда, приставка обычно опускается. Если в названии лиганда имеется числовая приставка, например этилендиамин, триметиламин и др.
, то перед названиями таких лигандов используют умножающие приставки бис- вместо ди-, трис- вместо три-, тетракис- вместо тетра- и т.д.
К названиям анионных лигандов добавляется гласная -о-: S2O32- — тиосульфато-, SO32- сульфито-, C2O42- оксалато-. Аналогично для анионов органических кислот: салицилато-, цитрато-, тартрато- и т.д.
Суффикс -ид в названиях анионов заменяется на гласную -о-: F- — фторо-, Cl- — хлоро-, CN- — циано-, ОН- — гидроксо-. Для гидросульфид-иона HS- применяется название меркапто-, для сульфид-иона S2- — тио-. Некоторые ионы, такие, как тиоцианат SCN-, нитрит NO2- и др.
, имеют по два разных донорных атома, их названия как лигандов зависят от способа координации и будут приведены ниже. Для нейтральных лигандов используются модифицированные названия: пиридин, метиламин, мочевина и др. Исключения составляют: вода — аква- и аммиак — аммин.
Группы CO и NO, если они связаны непосредственно с атомом металла, называются соответственно карбонил- и нитрозил-. В том случае если во внутренней координационной сфере находятся несколько лигандов, их перечисляют в алфавитном порядке, но сначала анионные, а затем — нейтральные.
Таблица наименований нейтральных и анионных лигандов
| Лиганд | Название |
| H- | гидридо |
| F- | фторо |
| Cl- | хлоро |
| Br- | бромо |
| I- | иодо |
| ClO- | гипохлорито |
| ClO2- | хлорито |
| ClO3- | хлорато |
| O2- | оксо |
| O22- | пероксо |
| O2- | надпероксо |
| OH- | гидроксо |
| HO2- | гидропероксо |
| H2O | аква |
| S2- | тио (или сульфидо) |
| HS- | тиоло (меркапто) |
| S22- | дисульфидо |
| SO32- | сульфито |
| HSO3- | гидросульфито |
| S2O32- | тиосульфато |
| SO42- | сульфато |
| Se2- | селено |
| SeO32- | селенито |
| SeO42- | селенато |
| Te2- | теллуро |
| N3- | нитридо |
| N3- | азидо |
| NH2- | имидо |
| NH2- | амидо |
| NH3 | аммин |
| NHOH- | гидроксиламидо |
| N2H3- | гидразидо |
| NO | нитрозил |
| NO2- | нитро |
| ONO- (NO2-) | нитрито |
| NO3- | нитрато |
| N2O22- | гипонитрито |
| P3- | фосфидо |
| PH2O2- (H2PO2-) | гипофосфито |
| PHO32- (HPO32-) | фосфито |
| PO43- | фосфато |
| AsO43- | арсенато |
| CO | карбонил |
| CH3O- | метоксо |
| C2H5O- | этоксо |
| CH3S- | метантиолато |
| C2H5S- | этантиолато |
| CN- | циано |
| OCN- | цианато |
| SCN- | тиоцианато |
| SeCN- | селеноцианато |
| TeCN- | теллуроцианато |
| CO32- | карбонато |
| HCO3- | гидрокарбонато |
| C2O42- | оксалато |
| C5H5- | циклопентадиенил |
Номенклатура комплексообразователей
Центральный атом в катионных и молекулярных комплексах называется так, как называется данный элемент в периодической системе и не имеет отличительного суффикса. Название центрального атома в анионных комплексах производят от латинского корня с добавлением суффикса — ат.
| Fe | феррат |
| Cu | купрат |
| Ag | аргентат |
| Au | аурат |
| Ni | никелат (николлат) |
| Sn | станнат |
| Mn | манганат |
| Hg | меркурат (гидраргират) |
После названия комплексообразователя в круглых скобках римской цифрой указывают степень его окисления. Для элементов с постоянной степенью окисления в соединениях (магний, цинк, алюминий и др.) этого не требуется.
Примеры
Используем приведенные номенклатурные правила, чтобы назвать комплексные соединения:
| K[Al(OH)4] | тетрагидроксоалюминат калия |
| [Zn(NH3)4](OH)2 | гидроксид тетраамминцинка |
| [Pt(NH3)2Cl2] | дихлородиамминплатина |
| [Fe(CO)5] | пентакарбонилжелезо |
| [ClO2][SbF6] | гексафторостибата(V) диоксохлора(V) |
| [H3O][SbF6] | гексафторостибат(V) гидроксония |
[Pt(NH3)2Cl2] — платина имеет переменную степень окисления, однако в данном случае она однозначно определяется как +2 из электронейтральности комплекса.Список использованной литературы
- Попков В. А., Пузаков С. А. Общая химия: учебник. — М.: ГЭОТАР-Медия, 2010. — 976 с.: ISBN 978-5-9704-1570-2. [с. 310-311]
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. — Мн.: Современная школа, 2005. — 608 с ISBN 985-6751-04-7. [c. 24-25]
Комплексные соединения
ч. 1
Методические материалы Лунькиной В.А. по теме:
Комплексные соединения.
“Все познается в сравнении”.
“Наиболее рациональный прием изучения нового — есть перенос знаний ранее изученного (известного) на новый изучаемый объект (на неизвестное)”.
Приступая к изучению вопроса о комплексных соединениях, вспомним строение азота и аммиака.
I. Азот. Аммиак. Азот затрачивает три неспаренных электрона на образование ковалентных связей с атомами водорода, т. е. образует с водородом три общие электронные пары. Собственную электронную пару азот использует на образование связи с протоном водорода.
N714 1S2 2S2 2P3 2 B=III иногда IV (при использовании
1 P пары s-электронов внешнего слоя).
S
Донорно-акцепторная связь
| ДОНОР H : N : H + H+: Cl- H акцептор | H+ H : N : H + Cl- Hхлорид аммония |
Комплексное соединение.
Соединения, образование которых не связано с возникновением новых электронных пар (общая электронная пара образовалась за счет собственной электронной пары одного из партнеров) – называются комплексными.
Создателем теории комплексных соединений, она называется координационной теорией, является шведский ученый Альфред Вернер. В начале прошлого столетия наибольший прогресс в этой области химии достигнут в нашей стране благодаря Льву Александровичу Чугаеву, который создал уникальную школу химиков — комплесников.
Если, получив гидроксид меди, добавить к осадку раствор аммиака в воде, то осадок растворится и раствор станет прозрачным и темно-синим. Это образовалось комплексное соединение. Запишем уравнения реакций.
CuSO4+2NaOH=Na2SO4+Cu(OH)2
Cu(OH)2+4NH3= [Cu2+ (NH3) 4]2+*2OH-
Гидроксид тетрааммин меди II
На примере данного соединения рассмотрим состав комплексного соединения (КС). [Cu2+ (NH3) 4]2+*2OH-
Внешняя сфера – 2ОН- , внутренняя сфера -[Cu2+ (NH3) 4]2+
Комплексообразователь — Cu2+ (центральный ион, координатор).
Координационное число (кч) – 4 (число молекул или ионов, соединенных непосредственно с атомом-комплексообразователем).
Лиганды (или аденды) — (NH3) , молекулы или ионы, расположенные около комплексообразователя.
При написании формул комплексных солей, комплекс заключается в квадратные скобки. Комплексы могут выполнять роль катионов, анионов или нейтральных молекул, напимер:
[Cu2+ (NH3) 4]2+ — катион; [Fe+2(CN)6]-4 — анион; [Pt(NH3)2Cl4] – нейтральная молекула.
Заряд комплексного иона равен сумме зарядов комплексообразователя и лигандов. Алгебраическая сумма зарядов внутренней и внешней сферы равна нулю, например Na2[Zn(CN)4]. [Zn (CN)4]2- — внутренняя сфера, 2 Na+ — внешняя сфера.
Образование внутренней сферы комплексов происходит по донорно – акцепторному механизму. Комплексообразователь – акцептор, предоставляющий свободные ячейки.
Лиганды – доноры, предоставляющие свободные пары электронов. Роль комплексообразователя могут выполнять положительно заряженные ионы, имеющие небольшую величину ионного радиуса. Чаще всего это катионы d – металлов, т. е. элементов побочных подгрупп периодической таблицы. Известны комплексные соединения катионов – f,s,p – элементов.
Лигандами, как правило, являются ионы (анионы), или нейтральные молекулы, например: ионы F— фторо, Cl— хлоро, J- — иодо,CN- — циано,OH- — гидроксо,CNS- — роданидо; нейтральные молекулы H2O — аква, NH3 – аммин. Чтобы доказать амфотерность гидроксида алюминия, надо осуществить превращение: AlCl3Al (OH) 3Na[Al(OH) 6]
Гексагидроксоалюминат натрия – комплексное соединение.
Запишем уравнения реакций и составим комплексное соединение.
AlCl3+3NaOH=3NaCl+Al (OH)3
Al (OH)3+3NaOH=Na3 [Al(OH) 6]
Координационное число (КЧ) зависит от радиуса атома комплексообразователя и его заряда.
| КЧ (четное) | Заряд комплексообразователя |
| 2 | +1 |
| (6)4 | +2 |
| (4)6 | +3 |
| (6)8 | +4 |
Чем больше радиус комплексообразователя, тем большее число лиганд соединится с ним.
- Найдем комплексообразователь и определим его заряд – А1+3 .
- Определим координационное число комплексообразователя, т. е. число лиганд – 6.
- Находим лиганды. В данном случае это – ОН-.
4. Составляем формулу комплексного иона и подсчитываем его заряд: [Al+3(OH)- 6]-3.
+3 -6 за скобкой -3.
5. К комплексному иону дописываем внешнюю сферу — 3Na+.
Самостоятельная работа.
Составьте комплексные соединения, обозначьте составные части, заряды ионов.
2AgNO3 Ag+[Ag+(NO3)2]-
Pt+4Cl4*2KCl ( кч Pt=6) K2+[Pt+4(Cl-)6]-2
Названия комплексных соединений.
Формула комплексного соединения читается справа налево. Сначала называется анион (если он есть): Cl- — хлорид, ОН- — гидроксид, SO4 — сульфат и т.д. Число лигандов указывают греческими числительными: 1-моно, 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса. Ионы лигандов внутренней сферы в названии приобретают суффикс “о”(смотри выше). Комплексообразователь –корень латинский плюс окончание “ат” (высшая степень окисления (с.о.) или “ит” (низшая с.о.) или просто название металла. Если разная с.о. — она указывается римской цифрой. После обозначения состава внутренней сферы называют внешнесферные катионы (если такие имеются).
Задание. Дайте названия в каждом конкретном примере.
[Al(H2O) 6]Cl3 — хлорид гексааквааллюминия,
K2[Pt(Cl) 6] — гексахлороплатинат (IV) калия,
Na2[Zn(OH)4] -тетрагидроксоцинкат натрия,
[Cu(NH3)4]*2OH -гидроксид тетраамминмеди (II),
NH4Cl -хлорид аммония,
[Ag(NH3)2]Cl -хлорид диамминсеребра (I).
Свойства комплексных соединений.
Свойства комплексных соединений определяются их составом и строением. В воде они диссоциируют на внешнюю сферу и комплексный ион: K3[Fe(CN)6] ↔ 3К+ + [Fe(CN)6]-3
Важнейшим свойством комплексов в растворах является их устойчивость. Количественно она характеризуется константой нестойкости. Внутренняя сфера комплекса в незначительной степени подвергается электролитической диссоциации, распадаясь на комплексообразователь и лиганды, например:
[Fe(CN)6]-3 ↔ Fe+3 + 6 CN-
Отношение произведения концентраций комплексообразователя и лигандов к концентрации недиссоциированного комплекса называется константой нестойкости, т. е. константа нестойкости – это константа диссоциации комплексного иона:
[Fe3+]*[CN- ]6
Кнест. [Fe(CN)6]-3 = —————— = 1х10-44
[Fe(CN)6]-3
Чем меньше константа нестойкости, тем прочнее комплекс.
Комплексные соли вступают в реакции обмена и другие реакции, например:
2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] ↓ + 2K2SO4
Zn+2Na [Au (CN)2] = Na2[Zn(CN)4]+2Au
т.е. комплексные соли в растворах ведут себя так же, как и простые соли.
Пример окислительно – восстановительной реакции:
2K4[Fe(CN)6] + С12 = 2К3 [Fe(CN)6] + 2КС1
окисл. С12 +2е → 2С1- │2 1 процесс восстановления
│ 2
восст. Fe+2 – 1е → Fe+3 │1 2 процесс окисления
Объяснение амфотерности гидроксидов.
Согласно протолитической теории амфотерные соединения способны быть как донорами, так и акцепторами протона. Типичным примером амфотерных соединений может служить вода:
Н2О + Н2О ↔ Н3О+ + ОН-
Из гидроксидов наиболее ярко выражены амфотерные свойства у гидроксида галлия
Ga(OH)3 , для которого константы диссоциации в водном растворе по кислотному и основному типу почти равны.
Преобладание кислотных или основных свойств у гидроксидов различных элементов связано с положением элементов в периодической системе. Ослабление основных и усиление кислотных свойств гидроксидов R(OH)m наблюдается с увеличением поляризующего действия иона Rn+ , т. е.
с уменьшением его радиуса и возрастанием числа внешних электронов. Поэтому к сильным основаниям относятся гидроксиды щелочных и щелочноземельных металлов.
Во второй группе периодической системы бериллий и цинк, а в третьей группе алюминий, галлий и индий образуют амфотерные гидроксиды.
Исследование влияния концентрации ионов Н+ в растворе на свойства различных гидроксидов показало, что амфотерность обусловлена устойчивостью гидроксокомплекса данного металла. Гидроксид цинка растворяется в кислотах и щелочах, например:
Zn(OH)2 + 2HCl ↔ ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH + Na2[Zn(OH)4]
Или в ионной форме: Zn(OH)2 + 2H+ = Zn2+ + 2H2O
Zn(OH)2 + 2ОH- + [Zn(OH)4]2-
Цинк проявляет координационное число – 4, а лигандами в ионе являются ионы ОН-.В водном растворе свободные ионы не могут существовать , а находятся в виде гидратов.
Энергия гидратации велика и при этом образуются аквакомплексы постоянного состава. Число молекул воды равно КЧ. Аквакомплексы ведут себя как кислоты.
Например, в водном растворе какой либо соли цинка его аквакомплекс дисоциирует:
[Zn(Н2О)4]2+ ↔ [Zn(Н2О)3ОН]+ + Н+
В ряду аквакомплексов и аквагидроксокомплексов цинка
[Zn(Н2О)4]2+→ [Zn(Н2О)3ОН]+ → [Zn(Н2О)2 (ОН)2]↓ → [ZnН2О(ОН)3]-→ [Zn(OH)4]2-
каждый последующий член ряда по составу молекул отличается от предыдущего на один протон. При переходе каждого предыдущего члена в последующий первый ведет себя как кислота. Обратный переход связан с притяжением протона, а, следовательно, с проявлением соединением основных свойств. Равновесие взаимоперехода одних комплексов в другие
в указанном ряду вправо смещено в щелочной среде, а влево – в кислой.
Рассмотрим образование аналогичных комплексов у алюминия. При растворении алюминия в кислоте (в сильно кислой среде) получается катион в виде аквакомплекса:
2А1 + 6Н+ + 6Н2О = 2[А1 (Н2О)6]3+ + 3Н2↑
2А1 + 6НС1 + 6Н2О = 2[А1 (Н2О)6]С13 + 3Н2↑
Хлорид гексаакваалюминия
При постепенном прибавлении раствора щелочи происходит замена молекул воды в комплексе на гидроксильные группы (переход от аквакомплексов к гидроксокомплексам):
[А1 (Н2О)6]3+ + ОН- = [А1ОН(Н2О)5]2+ + Н2О
[А1ОН(Н2О)5]2+ + ОН- = [А1(ОН)2(Н2О)4]+ + Н2О
[А1(ОН)2(Н2О)4]+ + ОН- = [ А1(ОН)3(Н2О)3]↓ + Н2О
Нейтральный гидроксид не растворяется в воде и выпадает в осадок.
При дальнейшем прибавлении раствора щелочи снова образуются ионы, но уже не катионы а анионы, и осадок растворяется: [ А1(ОН)3(Н2О)3] + ОН- = [ А1(ОН)4(Н2О)2]- + Н2О
[ А1(ОН)4(Н2О)2]- + ОН- = [ А1(ОН)5(Н2О)]2- + Н2О
[ А1(ОН)5(Н2О)]2- + ОН- = [ А1(ОН)6]3- + Н2О
Таким образом, амфотерность трехвалентного алюминия проявляется в возможности его существования в водном растворе в составе как катионов, так и анионов. Состав этих ионов зависит от кислотности среды. В школьном курсе химии принято для аниона использовать формулу А1(ОН)4- , где координационное число алюминия не 6, а- 4.
Получение комплексных солей.
Комплексные соли получаются в результате реакций обмена, соединения, окислительно-восстановительных реакций, при электролизе, например:
HgI2 + 2KI = K2 [HgI4]
избыток
CuSO4 + 4NH4OH = [Cu (NH3) 4] SO4 + 4H2O
Применение КС.
а) Гальванические покрытия — защита одного металла другим. Медью покрывают железо с помощью КС, тогда медное покрытие крепко соединяется с железом.
б) Электролитическое получение металлов
Алюминий в расплаве криолита: Nа3[AlF6]. Из расплавов соединений комплексных солей получают Nb, Tl, Th, Mg.
в) Защита металлов от коррозии. Ингибиторы — комплексные органические вещества или комплексные соли.
г) Аналитическая химия.
КС — реактивы, индикаторы, которые помогают распознать вещества или ионы
соединений, заряды ионов: железо +2 можно распознать с помощью реакции 3Fe+2SO4+2K3[Fe+3(CN)6]-3=3K2 SO4+Fe3+2[Fe+3(CN)6]2-3
синий осадок (турнбулева синь)
II опыт: 4Fe+3Cl3+3K4[Fe+2(CN)6]-4=12KCl +Fe4+3[Fe+2(CN)6]3-4
темно-синий осадок (берлинская лазурь)
д) Получение металлов (золота).
Золотой песок растворяется в растворе цианида натрия (NaCN), в присутствии кислорода и воды. Образуется комплексное соединение.
4Au + O2 + 2H2O + 8Na CN = 4Na[Au+(CN) 2] -+ 4Na OH (C.O. Au-+1, кч-2)
Из полученного КС золото вытесняют цинком.
Zn+2Na [Au (CN)2]=Na2[Zn(CN)4]+2Au
е) Комплексные соединения — важнейшие органические соединения – гемоглобин и хлорофилл (схема строения данных соединений в книге «Металлы в живых организмах» автор Николаев Л.А. или Соросовский образовательный журнал №3 1997год), ферменты, витамины и т.д. Синтез лекарственных препаратов, витаминов, биодобавок и многих других веществ, связан с комплексными соединениями.
Литература:
- Гузей Л.С., Суровцева Р.П. учебник “Химия 10 класс”
- Л.А. Николаев “Металлы в живых организмах”, М.:Просвещение,1983
- Вузовский учебник Глинка Н.Л. “Общая химия”
- Хомченко Г.П. “Неорганическая химия”
- Ф.Б. Гликина, Н.Г. Ключников “Химия комплексных соединений М.: Просвещение 1982”
- Соросовский образовательный журнал №3 1997 г стр.58
- Ю.Н. Кукушкин “Соединения высшего порядка”, Ленинград “Химия” 1991.
Лунькина В.А., учитель МОУ СОШ №1, р.п. Колышлей, Пензенской области.
ч. 1
Структура, классификация, номенклатура комплексных соединений
Как известно, металлы имеют свойство терять электроны и, тем самым, образовывать катионы.
Положительно заряженные ионы металлов могут находиться в окружении анионов или нейтральных молекул, образуя частицы, называемые комплексными и способные к самостоятельному существованию в кристалле или растворе. А соединения, содержащие в узлах своих кристаллов комплексные частицы, называются комплексными соединениями.
Структура комплексных соединений
- Большинство комплексных соединений имеют внутреннюю и внешнюю сферы. Записывая химические формулы комплексных соединений, внутреннюю сферу заключают в квадратные скобки.
Например, в комплексных соединениях К[Al(OH)4] и [Ca(NH3)8]Cl2, внутренней сферой являются группы атомов (комплексы) — [Al(OH)4]— и [Ca(NH3)8]2+, а внешней сферой — ионы К+ и Сl– соответственно.
- Центральный атом или ион внутренней сферы называют комплексообразователем.
Обычно, в качестве комплексообразователей выступают атомы или ионы металлов с достаточным количеством свободных орбиталей – это p-, d-, f- элементы: Cu2+, Pt2+, Pt4+, Ag+, Zn2+, Al3+и др. Но это может быть и атомы элементов, образующих неметаллы.
Заряд комплексообразователя обычно положительный, но также может быть отрицательным или равным нулю и равен сумме зарядов всех остальных ионов. В приведенных выше примерах комплексообразователями являются ионы Al3+и Ca2+.
- Комплексообразователь окружен и связан сигма-связью с ионами противоположного знака или нейтральными молекулами, так называемыми лигандами. В качестве лигандов в комплексных соединениях могут выступать такие анионы, как F– , OH–, CN–, CNS–, NO2–, CO32–, C2O42–и др., или нейтральные молекулы Н2О, NН3, СО, NО и др.
В наших примерах это – ионы OH— и молекулы NH3. Количество лигандов в различных комплексных соединениях лежит в пределах от 2 до 12. А само число лигандов (число сигма-связей) называется координационным числом (к.ч.) комплексообразователя. В рассматриваемых примерах к.ч. равно 4 и 8.
- Заряд комплекса (внутренней сферы) определяется как сумма зарядов комплексообразователя и лигандов.
- Внешнюю сферу образуют ионы, связанные с комплексом ионной или межмолекулярной связью и имеющие заряд, знак которого противоположен знаку заряда комплексообразователя. Числовое значение заряда внешней сферы совпадает с числовым значением заряда внутренней сферы. В формуле комплексного соединения записываются они за квадратными скобками. Внешняя сфера может и вовсе отсутствовать, в случае, если внутренняя сфера нейтральна. В приведенных примерах, внешнюю сферу образуют 1 ион K+ и 2 иона Cl— соответственно.
Классификация комплексных соединений
Основываясь на различных принципах, комплексные соединения можно классифицировать различными способами:
- По электрическому заряду: катионные, анионные и нейтральные комплексы.
- Катионные комплексы имеют положительный заряд и образуются если вокруг положительного иона координированы нейтральные молекулы. Например, [Al(H2O)6]Cl3, [Ca(NH3)8]Cl2
- Анионные комплексы имеют отрицательный заряд и образуются, если вокруг положительного иона координированы атомы с отрицательной степенью окисления. Например, К[Al(OH)4], K2[BF4]
- Нейтральные комплексы имеют заряд равный нулю и не имеют внешней сферы. Они могут образоваться при координации вокруг атома молекул, а также при одновременной координации вокруг центрального положительно заряженного иона отрицательных ионов и молекул.
- По количеству комплексообразователей
- Одноядерные – комплекс содержит один центральный атом, например, K2[Be(SO4)2]
- Многоядерные — комплекс содержит два и более центральных атомов, например, [CrFe(NH3)6(CN)6]
- Гидраты – содержат акво-комплексы, т.е. в качестве лигандов выступают молекулы воды. Например, [Cr(H2O)6]Br3, [Co(H2O)6]Br2
- Аммиакаты – содержат аммин-комплексы, в которых в качестве лигандов выступают молекулы аммиака (NН3). Например, [Zn(NH3)4]Cl2, [Ag(NH3)2]Cl
- Карбонилы – в таких комплексных соединениях, в качестве лигандов выступают молекулы монооксида углерода. Например, [Ni(CO)4], .
- Ацидокомплексы – комплексные соединения, содержащие в качестве лигандов кислотные остатки как кислородсодержащих, так и бескислородных кислот (F–, Cl–, Br–, I–, CN–, NO2–, SO42–, PO43–и др., а также ОН–). Например, K4[Ni(CN)6], Na2[FeCl4]
- Гидроксокомплексы— комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: K2[Zn(OH)4], Cs2[Sn(OH)6]
Комплексные соединения могут содержать лиганды, относящиеся к различным классам приведенной классификации. Например: К[Pt(H2O)3Br3], [Cr(NH3)4Br2]Br
- По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- Кислоты — H[AuBr4], H2[PtCl6]
- Основания — [Cu(NH3)4](OH)2,[Ag(NH3)2]OH
- Соли — Cs3[Al(OH)6], [Ni(H2O)4]Cl2
- Неэлектролиты — [Pt(NH3)2Cl2]
- По количеству мест, занимаемых лигандом в координационной сфере
В координационной сфере лиганды могут занимать одно или несколько мест, т.е. образовывать с центральным атомом одну или несколько связей. По этому признаку различают:
- Монодентатные лиганды – это такие лиганды как молекулы Н2О, NH3, CO, NO и др. и ноны CN−, F−, Cl−, OH−, SCN−, и др.
- Бидентатные лиганды. К такому типу лигандов относятся ионы H2N—CH2—COO−, СО32−, SO42−, S2O32−, молекула этилендиамина H2N—CH2—CH2—H2N (сокращенно en).
- Полидентатные лиганды. Это, например, органические лиганды, содержащие несколько групп — CN или -COOH (ЭДТА). Некоторые полидентантные лиганды способны образовать циклические комплексы, называемые хелатными (например, гемоглобин, хлорофилл и др.)
Номенклатура комплексных соединений
Чтобы записать формулу комплексного соединения, необходимо помнить, что, как и любое ионное соединение, вначале записывается формула катиона, а после – формула аниона. При этом, формулу комплекса записывают в квадратных скобках, где вначале записывают комплексообразователь, затем лиганды.
А вот несколько правил, следуя которым составить название комплексного соединения не составит никакого труда:
- В названиях комплексных соединений, как и ионных солей, первым указывают анион, а затем – катион.
- В названии комплекса сначала указывают лиганды, а после – комплексообразователь. Лиганды перечисляют в алфавитном порядке.
- Нейтральные лиганды называются также, как молекулы, к анионным лигандам прибавляют окончание –о. В таблице ниже даны названия наиболее распространенных лигандов
| Лиганд | Название лиганда | Лиганд | Название лиганда |
| en | этилендиамин | O2- | Оксо |
| H2O | Аква | H— | Гидридо |
| NH3 | Аммин | H+ | Гидро |
| CO | Карбонил | OH— | Гидроксо |
| NO | Нитрозил | SO42- | Сульфато |
| NO— | Нитрозо | CO32- | Карбонато |
| NO2— | Нитро | CN— | Циано |
| N3— | Азидо | NCS— | Тиоционато |
| Cl— | Хлоро | C2O42- | Оксалато |
| Br— | Бромо |
- Если количество лигандов больше единицы, то их число указывают греческими приставками:
2-ди-, 3-три-, 4-тетра-, 5-пента-, 6-гекса-, 7-гепта-, 8-окта-, 9-нона-, 10-дека-.
Если же в названии самого лиганда уже присутствует греческая приставка, то название лиганда записывают в скобках и к нему прибавляют приставку типа:
2-бис-, 3-трис-, 4-тетракис-, 5-пентакис-, 6-гексакис-.
Например, соединение [Co(en)3]Cl3 называют – трис(этилендиамин)кобальт(III).
- Названия комплексных анионов оканчиваются суффиксом – ат
- После названия металла в скобках указывают римскими цифрами его степень окисления.
Например, назовем следующие соединения:
Начнем с лигандов: 4 молекулы воды обозначаются как тетрааква, а 2 хлорид-иона – как дихлоро.
Далее указываем комплексообразователь – это хром и его степень окисления равна III.
Наконец, анионом в данном соединении является хлорид-ион.
Итак, полное название таково – хлорид тетрааквадихлорохрома(III)
Начнем с лигандов: в комплексном анионе содержится 4 лиганда CN—, которые называются тетрациано.
Далее указываем комплексообразователь – это никель и его степень окисления равна нулю.
Так как металл входит в состав комплексного аниона, то он называется никелат(0).
Итак, полное название таково – тетрацианоникелат(0) калия