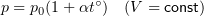Как найти число молекул в газе
Молекула – это электрически нейтральная частица, обладающая всеми химическими свойствами, присущими данному конкретному веществу. В том числе и газам: кислороду, азоту, хлору и т.д. Как можно определить количество молекул газа?

Инструкция
Если вам необходимо подсчитать, сколько молекул кислорода содержится в 320 граммах этого газа при нормальных условиях, прежде всего, определите, какое количество молей кислорода заключено в этом количестве. По таблице Менделеева, можно увидеть, что округленная атомная масса кислорода – 16 атомных единиц. Поскольку молекула кислорода – двухатомная, масса молекулы составит 32 атомные единицы. Следовательно, количество молей 320/32 = 10.
Дальше вам поможет универсальное число Авогадро, названное в честь ученого, предположившего, что равные объемы идеальных газов при постоянных условиях содержат одинаковые количества молекул. Оно обозначается символом N(A) и очень велико – приблизительно составляет 6,022*10(23). Умножьте это число на вычисленное количество молей кислорода и вы узнаете, что искомое количество молекул в 320 граммах кислорода – 6,022*10(24).
А если вам известно давление кислорода, а также объем, занимаемый им, и температура? Как вычислить количество его молекул при таких данных? И тут нет ничего сложного. Надо лишь записать универсальное уравнение Менделеева-Клапейрона для идеальных газов:
PV = RTM/m
Где P – давление газа в паскалях, V – его объем в кубических метрах, R – универсальная газовая постоянная, M – масса газа, а m – его молярная масса.
Cлегка преобразуя это уравнение, вы получите:
M = PVm/RT
Поскольку у вас есть все необходимые данные (давление, объем, температура заданы изначально, R = 8,31, а молярная масса кислорода = 32 грамма/моль), вы элементарно найдете массу газа при данном объеме, давлении и температуре. А дальше задача решается точно так же, как и в вышеописанном примере: N(A)M/m. Произведя вычисления, вы узнаете, сколько молекул кислорода содержится при заданных условиях.
Можно еще более упростить решение, поскольку в полученной дроби N(A)PVm/RTm молярные массы сокращаются, и остается: N(A)PV/RT. Подставив в формулу известные вам величины, вы получите ответ.
Видео по теме
Полезный совет
Ни один реальный газ (включая кислород), конечно же, не является идеальным, поэтому уравнение Менделеева-Клапейрона можно использовать для расчетов лишь при условиях, не очень сильно отличающихся от нормальных.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
как узнать количество молекул газа ?
Pom4er
Знаток
(409),
закрыт
12 лет назад
Андрей Б
Просветленный
(32352)
12 лет назад
Нужно определить массуу газа, затем эту массу разделить на молярную массу, получим число молей. Число молей умножаем на число Авогадро, 6 с чем-то на 10 в 23 степени, получится число частиц газа. Молярная масса численно равна молекулярной массе газа, только выражается в гмоль
При решении задачек по физике периодически встречается такая константа, как число Авогадро. Число это появилось не случайно, а является следствием закона Авогадро.
Давайте обсудим этот закон в режиме “для чайников”. Правда относится он больше к химии, нежели к физике, но и в физике мы встретим его ни раз, а уж инженеру этак вообще нужно знать всё :)…
Начнем, пожалуй, с самого Амедео Авогадро. Чуть выше приведен его портрет и я надеюсь, что выглядел он не так, как его изображают :)…Ибо статуя Авогадро гораздо более лицеприятная. Да и с именем парню “повезло”. Амедео звучит почти как A-media. Название какой-то фирмы по продаже болванок. Ну да ладно. Человек внёс огромный вклад в развитие химии и физической химии, открыв воистину фундаментальный закон. Поэтому, подшучивать над внешностью как-то неуместно.
Интересно отметить, что закон был открыт гораздо раньше, чем его удалось доказать экспериментально и существовал чисто в эмпирическом виде. Позже исследователи подтвердили, что Авогадро был совершенно прав и закон назвали его именем.
Формулировка закона Авогадро
В равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул
Встречается и ещё одна формулировка, которая, собственно, следует из закона.
Один моль любого газа при одинаковых температуре и давлении занимает один и тот же объём при нормальных условиях, равный 22,4 л
Напомню, что нормальные условия – это давление 1 атмосфера и температура 273,15 К.
Разбираем текст закона
Теперь разберем сам текст закона. Какие вопросы тут могут возникнуть?
Обратите внимание, что речь идёт про равные объемы. Если взять кислород и азот в разных объемах, одного кубический метр, а второго – два кубических метра, то соотношение Авогадро уже не выполняется.
Важно также отметить, что мы говорим про идеальные газы. Сравниваем именно их. Если же газ близок к идеальному, то чем он дальше от идеального, тем больше отклонение от закона Авогадро. Напомню, что идеальные газы – это такие газы, у которых нет взаимодействия между частицами, а размеры пренебрежимо малы. Правда про идеальные газы полезно знать побольше, но это тема отдельного материала.
Отдельно отмечается, что должны соответствовать давление и температура. Это тоже логично. Ведь это только в теории мы можем представить себе “кубик” газа, будь то водород или кислород, который обособлен. В реальности всё немного иначе и вытянуть такой кусок не получится. От того и множество влияний, который следовало бы учитывать при изменении давления и температуры. Если газы рассматривать при разных температурах и давлениях, то и та же плотность газов будет отличаться от тех, при которых мы проводим сравнение. Значит в глобальных масштабах частицы смогут перетекать из одного объема в другой, что уже некорректно.
Ну и интересная фраза “содержится одно и то же количество молекул“. А какое это количество молекул? :)…Про то, как его определяли и определяют до сих пор есть множество статей. Например, про это я писал на своем сайте.
6,02 ∙ 1023 молекул (1 моль) газа или смеси газов при н.у. занимает объём равный 22,4 л. Это количество молекул и есть число Авогадро Nа = 6,022 140 76⋅1023 моль−1.
Правда если уж мы заговорили про число Авогадро, то там употребляется формулировка “структурных единиц”, вместо “молекул”. Да и “сфера действия” распространяется на все тела. Тогда как закон Авогадро справедлив только для твердых тел.
Как появился закон Авогадро и почему стоит ему доверять
Пытливые умы, конечно же, начинают вникать в возможность существования закона Авогадро не только на бумаге. Давайте посмотрим, как всё начиналось и что является подтверждением обозначенного выше закона.
Гей-Люссак изучал реакцию, в которой из двух газов – хлористого водорода и аммиака получался твердых хлорид амония.
При многократных повторениях эксперимента обнаружилось, что для реакции требуются равные объемы обоих газов. Если одного газа было больше другого, то в результате реакции, тот газ которого больше, оставался неиспользованным. Причем именно в таком количестве, во сколько раз его было больше.
Гей-Люссак записал эти наблюдения в свой “живой журнал” и сам забыл об этом :)…Но эти записи ненароком попали к Амедео Авогадро.
Авогадро сделал вывод, что равные объемы любых газов содержат равное число молекул. Или же как ещё объяснить наблюдение, что в результате взаимодействия неравных объемов, в дело идут только равные их части!?
Объяснение было простым. Для того, чтобы наблюдалась описываемая картина, нужно чтобы каждая из частичек рассматриваемого газа провзаимодействовала с частичкой другого газа. “Один на один“, скажем так.
Впоследствии гипотеза подтвердилось в многочисленных экспериментах для множества газов. Воспроизводилось результата и дала понимание того, что мы имеем дело не со спецификой какого-то конкретного набора газов, которые оказались в паре, а со всеобъемлющим законом.
Очень советую ознакомиться со следующими нашими статьями:
Молекула – это электрически нейтральная частица, обладающая всеми химическими свойствами, присущими данному конкретному веществу. В том числе и газам: кислороду, азоту, хлору и т.д. Как можно определить количество молекул газа?
Если вам необходимо подсчитать, сколько молекул кислорода содержится в 320 граммах этого газа при нормальных условиях, прежде всего, определите, какое количество молей кислорода заключено в этом количестве. По таблице Менделеева, можно увидеть, что округленная атомная масса кислорода – 16 атомных единиц. Поскольку молекула кислорода – двухатомная, масса молекулы составит 32 атомные единицы. Следовательно, количество молей 320/32 = 10.
Дальше вам поможет универсальное число Авогадро, названное в честь ученого, предположившего, что равные объемы идеальных газов при постоянных условиях содержат одинаковые количества молекул. Оно обозначается символом N(A) и очень велико – приблизительно составляет 6,022*10(23). Умножьте это число на вычисленное количество молей кислорода и вы узнаете, что искомое количество молекул в 320 граммах кислорода – 6,022*10(24).
А если вам известно давление кислорода, а также объем, занимаемый им, и температура? Как вычислить количество его молекул при таких данных? И тут нет ничего сложного. Надо лишь записать универсальное уравнение Менделеева-Клапейрона для идеальных газов:
PV = RTM/m
Где P – давление газа в паскалях, V – его объем в кубических метрах, R – универсальная газовая постоянная, M – масса газа, а m – его молярная масса.
Cлегка преобразуя это уравнение, вы получите:
M = PVm/RT
Поскольку у вас есть все необходимые данные (давление, объем, температура заданы изначально, R = 8,31, а молярная масса кислорода = 32 грамма/моль), вы элементарно найдете массу газа при данном объеме, давлении и температуре. А дальше задача решается точно так же, как и в вышеописанном примере:N(A)M/m. Произведя вычисления, вы узнаете, сколько молекул кислорода содержится при заданных условиях.
Можно еще более упростить решение, поскольку в полученной дроби N(A)PVm/RTm молярные массы сокращаются, и остается: N(A)PV/RT. Подставив в формулу известные вам величины, вы получите ответ.
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.