Загрузить PDF
Загрузить PDF
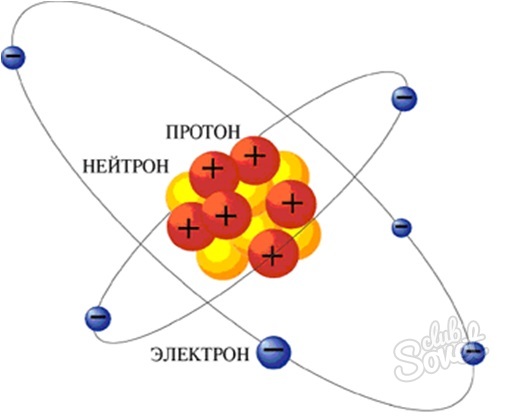
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-

1
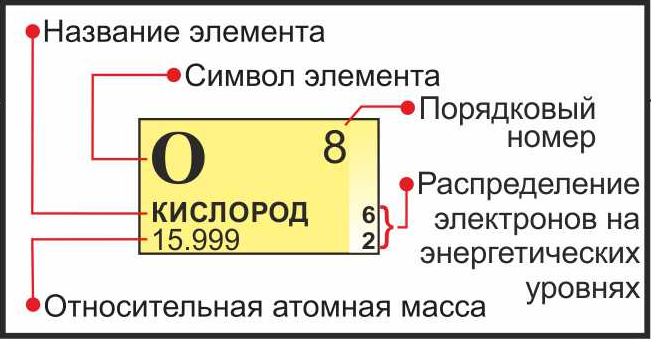
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-

2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-

3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-

4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-

5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-

6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-

1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-

2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-

3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 950 363 раза.
Была ли эта статья полезной?
Как определить число нуклонов в ядре атома?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как определить число протонов в атоме?
Число протонов в атоме равно заряду его ядра (обозначается как Z) или порядковому номеру элемента в периодической таблице Менделеева.
Как определить число нейтронов в атоме?
Очень просто!
N = A – Z
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а.е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Примеры
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а.е.м.
Z (Na) = 11 (протонов)
N = Ar (Na) – Z (Na) = 23 – 11 = 12 (нейтронов)
Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.
Z (P) = 15 (протонов)
N = Ar (P) – Z (P) = 31 – 15 = 16 (нейтронов)
Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.
Z (Au) = 79 (протонов)
N = Ar (Au) – Z (Au) = 197 – 79 = 118 (нейтронов)
Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.
Z (Si) = 14 (протонов)
N = Ar (Si) – Z (Si) = 28 – 14 = 14 (нейтронов)
Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.
Z (C) = 6 (протонов)
N = Ar (C) – Z (C) = 12 – 6 = 6 (нейтронов)
Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.
Z (K) = 19 (протонов)
N = Ar (K) – Z (K) = 39 – 19 = 20 (нейтронов)
Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.
Z (Fe) = 19 (протонов)
N = Ar (Fe) – Z (Fe) = 56 – 26 = 30 (нейтронов)
Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Ar (Al) = 27 а.е.м.
Z (Al) = 13 (протонов)
N = Ar (Al) – Z (Al) = 27 – 13 = 14 (нейтронов)
Ответ: число протонов в атоме алюминия равно 13, а число нейтронов в атоме алюминия равно 14 .
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.
Z (F) = 9 (протонов)
N = Ar (F) – Z (F) = 19 – 9 = 10 (нейтронов)
Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а.е.м.
Z (Cl) = 17 (протонов)
N = Ar (Cl) – Z (Cl) = 35 – 17 = 18 (нейтронов)
Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.
Z (O) = 8 (протонов)
N = Ar (O) – Z (O) = 16 – 8 = 8 (нейтронов)
Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.
Z (S) = 16 (протонов)
N = Ar (S) – Z (S) = 32 – 16 = 16 (нейтронов)
Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.
Z (Mg) = 16 (протонов)
N = Ar (Mg) – Z (Mg) = 24 – 12 = 12 (нейтронов)
Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.
Z (Zn) = 30 (протонов)
N = Ar (Zn) – Z (Zn) = 65 – 30 = 35 (нейтронов)
Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?

Как найти нейтроны
Под запросом “Как найти нейтроны” понимается метод поиска числа нейтронов в атоме. Нейтрон – это тяжелая частица, которая не имеет электрического заряда и вместе с протоном составляет атомное ядро элемента. Число нейтронов в атоме определяется с помощью таблицы Менделеева.
1
Как найти нейтроны – ищем число нейтронов в атомах
- Берем таблицу Менделеева и находим нужный элемент.
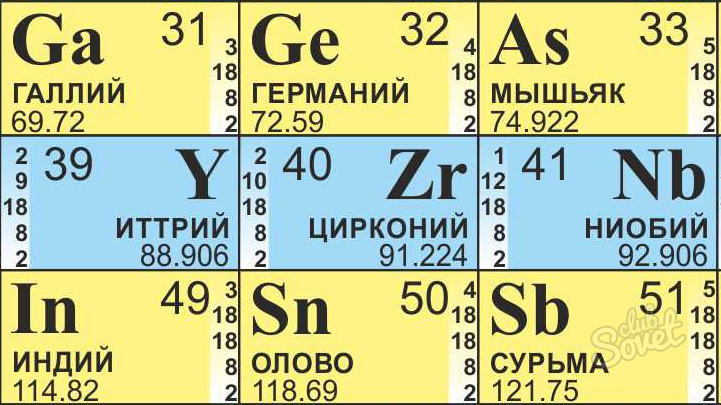
- Как вы знаете, химические элементы расположены не случайным образом. Порядковый номер элемента соответствует числу протонов, находящихся в одном атоме элемента – атомному номеру. Вот он нам и нужен. Это самое крупное число в ячейке, его нетрудно обнаружить, так как элементы следуют друг за другом практически по порядку (по возрастанию).
- Запоминаем атомный номер.
- Находим массу атома. Это значение также располагается в ячейке элемента периодической системы, чье количество нейтронов мы ищем. Как правило, масса записана более мелким шрифтом, чем номер атома, в виде десятичной дроби. У более сложных элементов заключена в квадратные скобки.
- Для расчетов атомную массу округляем до целого числа.
- Так как ядро атома состоит из нейтронов и протонов, то путем вычитания из массы атома протонов (атомного номера), мы получим величину содержания нейтронов в атоме данного элемента.
2
Как найти нейтроны – пример
- Например, нам нужно найти, сколько нейтронов находится в атоме Циркония.
- Будем использовать формулу: N = M – n, где:
М – атомная масса, n – атомный номер (число протонов), N – число нейтронов.
- Находим Цирконий в таблице Менделеева, для химических расчетов она всегда должна быть под рукой.
- Его атомная масса равна 91,22, округляем до 91.
- Атомный номер равен 40.
- Получаем, что в атоме Циркония находится 51 (N = 91 – 40) нейтрон.
3
Как найти нейтроны – находим сколько нейтронов у изотопов
- Изотопы – это разновидности одного и того же элемента, но имеющие различную массу атомов. Но атомный номер, который мы научились искать выше, у них совпадает.
- Нужно знать, что все изотопы определенного элемента помещаются в одну ячейку в таблице Менделеева.
- Раз атомный номер у изотопов одного и того же элемента совпадает, значит нам нужно лишь найти атомную массу для расчета величины нейтронов.
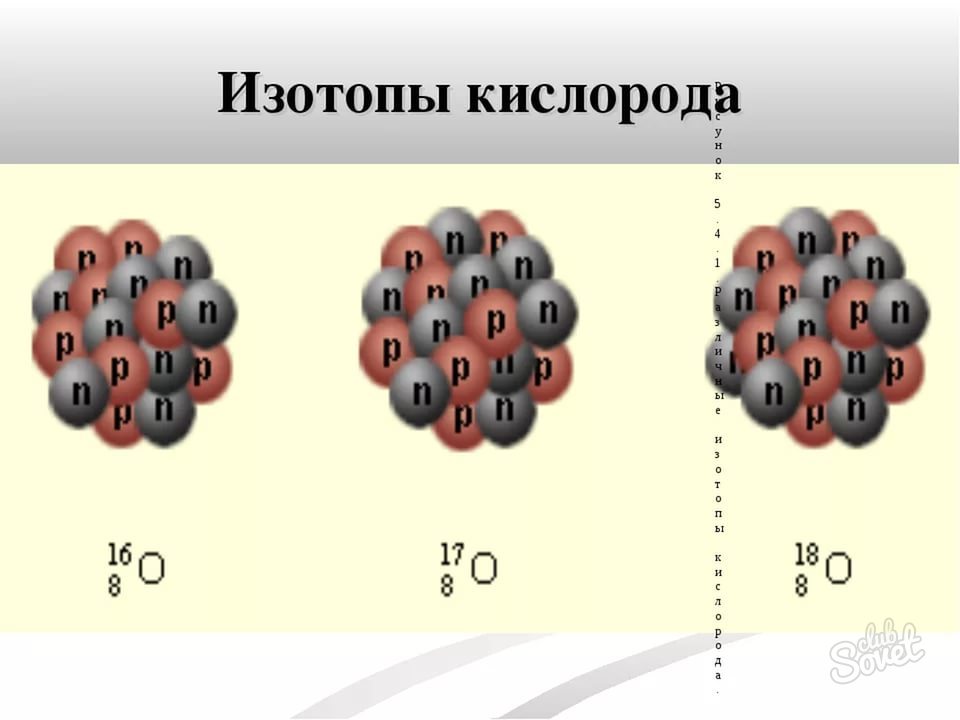
- Атомную массу изотопа найти очень просто – она заключена в самом названии изотопа. Например, О-16, О-17, О-18 – изотопы кислорода с атомной массой 16, 17 и 18 соответственно. Иногда атомную массу записывают как верхний индекс слева от символа хим. элемента.
- Таким образом, нам известны все составляющие для формулы. Нам не составит труда вычислить, какое количество нейтронов находится в изотопе.
4
Как найти нейтроны – пример, изотоп О-17
- Атомный номер всех изотопов кислорода, как и самого элемента равен 8.
- Атомная масса указана в названии изотопа – она равна 17.
- Вычисляем по формуле N = M – n, что количество нейтронов в атоме изотопа О-17 равно 9 (17 – 8).
Теперь вы знаете, как рассчитать число нейтронов в атоме любого элемента и изотопа. Конечно, для расчетов вам всегда понадобится иметь под рукой периодическую таблицу Менделеева.
Download Article
Download Article
Although all atoms of the same element contain the same number of protons, their number of neutrons can vary. Knowing how many neutrons are in a particular atom can help you determine if it’s a regular atom of that element or an isotope, which will have either extra or fewer neutrons.[1]
Determining the number of neutrons in an atom is fairly simple and doesn’t even require any experimentation. To calculate the number of neutrons in a regular atom or an isotope, all you need to do is follow these instructions with a periodic table in hand.
-

1
Locate the element on the periodic table. For this example, we’ll look at osmium (Os), which is in the sixth row down.[2]
-

2
Find the element’s atomic number. This tends to be the most visible number pertaining to a given element and usually sits above the element symbol, either in the middle of the box or in the upper left corner. (On the chart we’re using, in fact, no other numbers are listed.) The atomic number is the number of protons in a single atom of that element.[3]
Os is number 76, meaning one atom of osmium has 76 protons.- The proton number never changes in an element; it’s basically what makes that element that element.[4]
Advertisement
- The proton number never changes in an element; it’s basically what makes that element that element.[4]
-

3
Find the element’s atomic weight. This number is usually found beneath the atomic symbol. Note that the chart in this example is based solely on atomic number and doesn’t list the atomic weight. This won’t always usually be the case. Osmium has an atomic weight of 190.23.[5]
-

4
Round off the atomic weight to the nearest whole number to find the atomic mass.[6]
In our example, 190.23 would be rounded to 190, resulting in an atomic mass of 190 for osmium.- The atomic weight is an average of the isotopes of the element, so that’s why it’s not usually a whole number.[7]
- The atomic weight is an average of the isotopes of the element, so that’s why it’s not usually a whole number.[7]
-

5
Subtract the atomic number from the atomic mass. Since the vast majority of an atom’s mass is made up of its protons and neutrons, subtracting the number of protons (i.e. the atomic number) from the atomic mass will give you the calculated number of neutrons in the atom. The numbers after the decimal point represent the usually very small mass of the electrons in the atom. In our example, this is: 190 (atomic weight) – 76 (number of protons) = 114 (number of neutrons).[8]
-

6
Remember the formula. To find the number of neutrons in the future, simply use this formula:[9]
-
N = M – n
- N = number of Neutrons
- M = atomic Mass
- n = atomic number
-
N = M – n
Advertisement
-

1
Locate the element on the periodic table. As an example, we’ll look at the carbon-14 isotope. Since the non-isotopic form of carbon-14 is simply carbon (C), find carbon on the periodic table (in the second row down).[10]
-

2
Find the element’s atomic number. This tends to be the most visible number pertaining to a given element and usually sits above the element symbol. (On our example chart, in fact, no other numbers are listed.) The atomic number is the number of protons in a single atom of that element.[11]
C is number 6, meaning one atom of carbon has 6 protons. -

3
Find the atomic mass. This is incredibly easy with isotopes, as they are named according to their atomic mass. Carbon-14, for example, has an atomic mass of 14. Once you find the atomic mass of the isotope, the process is the same as it is for finding the number of neutrons in a regular atom.[12]
-

4
Subtract the atomic number from the atomic mass. Since the vast majority of an atom’s mass is found its protons and neutrons, subtracting the number of protons (i.e. the atomic number) from the atomic mass will give you the calculated number of neutrons in the atom. In our example, this is: 14 (atomic mass) – 6 (number of protons) = 8 (number of neutrons).
-

5
Remember the formula. To find the number of neutrons in the future, simply use this formula:[13]
-
N = M – n
- N = number of Neutrons
- M = atomic Mass
- n = atomic number
-
N = M – n
Advertisement
Add New Question
-
Question
How do you find the number of electrons, neutrons and protons?

Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.

Environmental Scientist
Expert Answer
Support wikiHow by
unlocking this expert answer.Fortunately, there’s a WikiHow article that can help you! It’s called Find the Number of Protons, Neutrons, and Electrons. While the answer section here doesn’t allow links, you can search for it in the search box at the top of the page using this title.
-
Question
How many neutrons are in oxygen?

Atomic mass minus the atomic number. Atomic mass of Oxygen is 16, and the atomic number is 8. 16 – 8 = 8.
-
Question
Where can I locate the atomic mass in a modern periodic table?

The modern periodic table has the atomic number on the top of each element’s symbol and the atomic mass right below the symbol.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Protons and neutrons make up almost all of the weight of the elements, whereas electrons and miscellaneous particles represent negligible mass (approaching zero mass). Since one proton has approximately the same weight as one neutron, and the atomic number represents the number of protons, we can simply subtract the number of protons from the total mass.[14]
-
If you’re ever unsure which number is which in a periodic table, just remember that the table is usually designed around the atomic number (i.e. number of protons), which starts at 1 (hydrogen) and ascends one unit at a time from left to right, ending at 118 (oganesson). This is because the number of protons in an atom determines what that atom is, making it the easiest elemental trait to organize by. (Ex. an atom with 2 protons is always helium, just as an atom with 79 protons is always gold.)
Advertisement
References
About This Article
Article SummaryX
To find the number of neutrons in an atom, you just need a periodic table that lists the atomic number as well as the atomic weight of each element. First, locate the elemental symbol for your atom on the periodic table. Then, find the atomic number for the element. It’s usually located somewhere above the element symbol. This number represents the number of protons in the atom. For instance, the atomic number of niobium (Nb) is 41, meaning that a niobium atom has 41 protons. Next, find the atomic weight of the element, which is usually underneath the element symbol. Round up the atomic weight to the nearest whole number. Niobium has an atomic weight of 92.906, so you would round it up to 93. Finally, subtract the number of protons from the rounded up atomic weight to find the number of neutrons in the atom. In the case of niobium, 93 minus 41 is 52, which means that a niobium atom has 52 neutrons. To find out how to calculate the number of neutrons in an isotope, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,159,230 times.
Reader Success Stories
-

“I didn’t know what atomic mass was, and I didn’t know that we had to round it off. So it really helped.…” more
Did this article help you?
Мы знаем, что масса атома определяется массой ядра. Ядро состоит из протонов и нейтронов, относительные массы которых равны (1). Масса ядра равна сумме масс протонов и нейтронов. Число протонов определяем по порядковому номеру элемента. Значит, число нейтронов в ядре можно найти, если от относительной атомной массы отнять порядковый номер.
Пример:
фтор — элемент № (9). Его относительная атомная масса равна (19).
В ядре атома фтора — (9) протонов и (19) (–) (9) (=) (10) нейтронов.
Рубидий — элемент № (37). Его относительная атомная масса равна (85).
В ядре атома рубидия — (37) протонов и (85) (–) (37) (=) (48) нейтронов.
Нуклиды
Вид атомов с определённым числом протонов и нейтронов в ядре называется нуклидом.
Нуклид обозначается следующим образом: внизу слева записывается число протонов (Z) (порядковый номер), вверху слева указывается массовое число (A) (сумма чисел протонов и нейтронов) —
RZA
, например:
C612
,
Se3479
.
Для обозначения нуклидов используют и другие способы записи:
углерод — (12),
C
— (12),
C12
;
селен — (79),
Se
— (79),
Se79
.
Изотопы
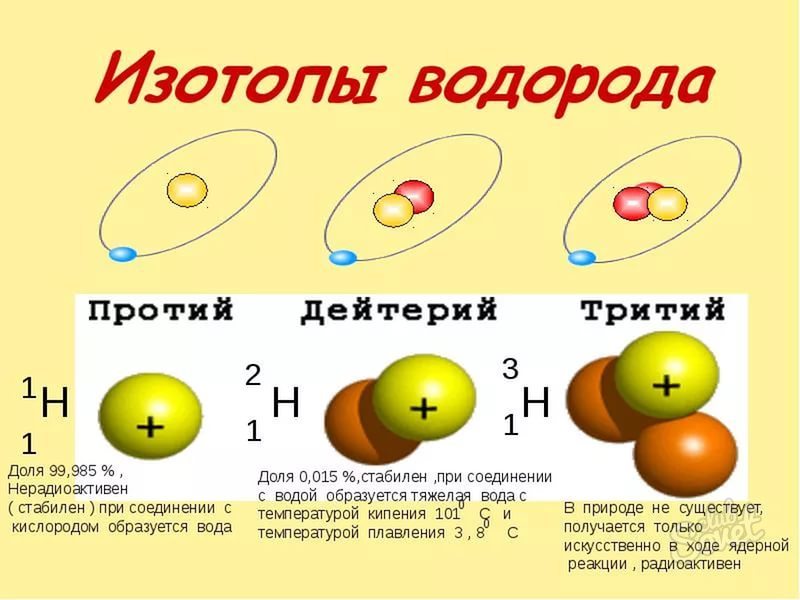
Атомы одного и того же химического элемента могут иметь разные массы. Существуют атомы водорода с массами (1), (2) и (3), атомы хлора с массами (35) и (37) и т. д.
Разновидности атомов одного химического элемента, имеющие разные атомные массы, называют изотопами.
С учётом знаний о строении ядра это определение можно сформулировать по-другому.
Изотопы — разновидности атомов с одинаковым числом протонов в ядре (зарядом ядра), но разным числом нейтронов.
Значит, изотопы отличаются только числом нейтронов.
Рис. (1). Изотопы водорода
Протоны определяют свойства атома, то есть придают ему индивидуальность. А нейтроны не влияют на свойства атома, а отражаются на его массе. Поэтому все изотопы одного и того же элемента химически неотличимы.
Химический элемент — это вид атомов с определённым зарядом ядра.
Относительная атомная масса элемента
Большинство химических элементов существуют в виде смеси изотопов. Приведённая в Периодической таблице относительная атомная масса элемента — это средняя величина атомных масс всех его изотопов.
Пример:
определим относительную атомную массу хлора. (25) % его атомов — это атомы с массой (37), а (75) % — с массой (35). Найдём среднее значение:
·25+35
·75)100
= 35,5.
Источники:
Рис. 1. Изотопы водорода © ЯКласс
