Как определить неспаренные и спаренные электроны?
Ева Р.
25 октября 2018 · 89,8 K
Если на орбитали находится один электрон, то он называется неспаренным, а если два – то это спаренные электроны. Легче всего определить, какие они, при помощи графической формулы. Эта схема размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. Дляего составления следует знать:
1. Порядковый номер элемента, т.е. заряд его ядра и соответствующее ему число электронов в атоме.
2. Номер периода, определяющий число энергетических уровней атома.
3. Квантовые числа и связь между ними.
65,7 K
Комментировать ответ…Комментировать…
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас активно… · 25 янв 2019
Число электронов определяется исходя из номера элемента, далее исходя из количества нужно рисовать уровни, на каждом уровне может быть 2 электрона, они будут спаренными, если на последнем уровне останется 1 электрон, то он и будет неспаренным.
40,5 K
Комментировать ответ…Комментировать…
по электронной формуле
к примеру возьмём углерод, у которого электронная формула – 1s2 2s2 2p2
видишь на s-орбиталях по 2 электрона? это значит, что они СПАРЕНЫ
на p-орбиталях по два электрона, но 2р орбиталей – 3, а значит по правилу Гунда, два электрона займут две разных р-орбитали, отсюда следует что у углерода 2 неспаренных электрона!
Объяснение:
Электроны располагаются вне ядра на различных уровнях, а на каждом уровне есть определенные орбитали.
Орбиталь – пространство вокруг ядра, где наиболее вероятно расположение электрона.
Если на орбитали находится один электрон, то он называется неспаренным, а если два – то это спаренные электроны.
Чтобы понять, как образуются неспаренные электроны, нужно научиться изображать электронно-графическое строение атома. Электроны стремятся занять сначала сободные орбитали, а кому не хватает свободной орбитали, он подселяется к электрону первой орбитали.
Например,
1) Калий:
порядковый номер – № 19 ,
Заряд ядра атома калия Z=+19 Вокруг ядра атома 4 энергетических уровня, на которых располагаются 19 электронов.
Изобразим модели строение атома калия:
а). Модель атома калия при помощи дуг:
₊₁₉K)₂)₈ )₈)₁
б). Модель атома -электронная формула калия
₊₁₉K 1s²2s²2p⁶3s²3p⁶4s¹
в).Электронно-графическая модель атома:
4 уровень s↑
p ⇅ ⇅ ⇅
3уровень s⇅
p ⇅ ⇅ ⇅
2уровень s⇅
1уровень s⇅
₊₁₉K
У калия легко определить неспареный электрон, так как он на последнем уровне всего один.
2) Азот
порядковый номер – № 7 ,
Заряд ядра атома калия Z=+7 Вокруг ядра атома 2 энергетических уровня, на которых располагаются 7 электронов.
Изобразим модели строение атома азота:
а). Модель атома азота при помощи дуг:
₊₇N)₂)₅
б). Модель атома -электронная формула калия
₊₇N 1s²2s²2p³
в).Электронно-графическая модель атома:
p ↑↑↑
2уровень s⇅
1уровень s⇅
₊₇N
У азота на p-орбитали 3 электрона, орбиталей тоже 3 вот электроны и расположились каждый на отдельной орбитали и получилось3 неспаренных электрона.
3) Хлор
порядковый номер – № 17 ,
Заряд ядра атома калия Z=+17 Вокруг ядра атома 3 энергетических уровня, на которых располагаются 17 электронов.
Изобразим модели строение атома хлора:
а). Модель атома калия при помощи дуг:
₊₁₇CI)₂)₈ )₇
б). Модель атома -электронная формула калия
₊₁₇CI 1s²2s²2p⁶3s²3p⁵3d⁰
в).Электронно-графическая модель атома:
d – – – – –
p ⇅ ⇅ ↑
3уровень s⇅
p ⇅ ⇅ ⇅
2уровень s⇅
1уровень s⇅
₊₁₇CI
У хлора один неспаренный электрон.
Но у хлора есть еще d-орбиталь и в возбужденном состоянии электроны из s-орбитали и р-орбитали могут распариться и занять место на d-орбиталь:
г).Электронно-графическая модель атома хлора в возбужденном состоянии:
spd ↑↑ ↑↑↑↑↑
3уровень
p ⇅ ⇅ ⇅
2уровень s⇅
1уровень s⇅
₊₁₇CI*
Таким образом у хлора в возбужденном состоянии будет 7 неспаренных электронов, он может в таком состоянии, иметь степень окисления -7 , например оксид хлора(VII) CI₂⁺⁷O₇⁻²
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
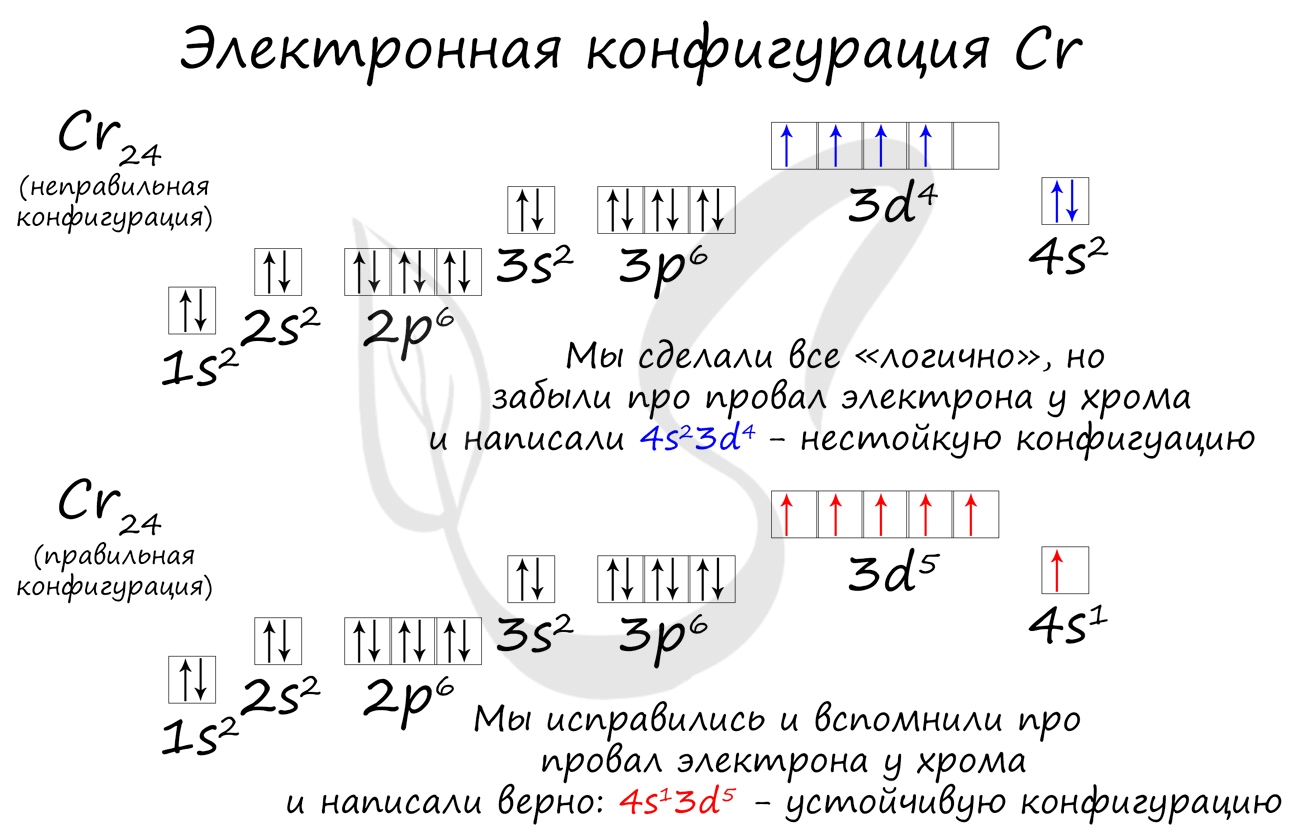
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
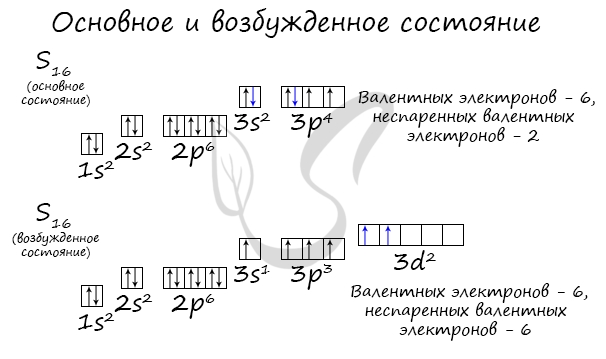
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
На этой странице вы узнаете
- Какой паспорт у атомов?
- Что общего у электронов и студентов?
Всё, что окружает нас в повседневной жизни имеет сложное строение: от чайника на плите до улиц города. Не менее сложным строением обладает и крохотный атом. В этой статье поговорим о его электронных конфигурациях.
Общее об атоме
Вспомним самую важную информацию об атоме.
Долгое время ученые не могли выяснить, из чего состоит атом. Впоследствии было установлено, что атом состоит из элементарных частиц: протонов, нейтронов и электронов.
Чтобы объяснить расположение элементарных частиц была предложена планетарная модель атома. Она гласит следующее: вокруг каждого ядра находятся электроны, которые располагаются вокруг него определенным образом, как и планеты вокруг Солнца. Подробнее о строении атома можно почитать в статье «Строение атома и электронные конфигурации 1.0».
В это статье мы сфокусируемся на электронах в атоме.
Валентные и неспаренные электроны
Последний энергетический уровень называют внешним. На нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
Таким образом, можно сказать, что неспаренные и валентные электроны — близкие родственники: похожи, но не одинаковы.
Сравним, какая же связь существует между валентными и неспаренными электронами. При образовании химической связи возможны два механизма: обменный и донорно-акцепторный. Более распространен обменный механизм, благодаря которому атомы выделяют по одному электрону на внешнем электронном уровне и образуют “коннекшн” (общую электронную пару).
Из этого следует правило:
Все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.

Какой паспорт у атомов?
У каждого атома или иона есть “паспорт” расположения электронов по энергетическим уровням. Такой паспорт называется электронной конфигурацией.
Электронная конфигурация — это формула, отражающая распределение электронов по электронным оболочкам атома.

Пусть электрон — это студент. А где обычно живут студенты? В общаге! Давайте нарисуем общежитие для электронов:
— В нём есть отдельные комнаты — максимум 2 электрона.
— Блоки с общей кухней, в которые эти комнаты собираются — их мы назовем энергетическими подуровнями.
— И целые этажи, в которые собираются отдельные блоки, которые являются энергетическими уровнями.

Более подробно про расположение электронов можно почитать в статье «Особенности строения электронных оболочек атомов элементов». .
Электронную конфигурацию ионов можно написать по тем же правилам, что и электронную конфигурацию атомов, только при этом нужно учитывать, какой заряд (положительный или отрицательный) у частицы.
Если атом принимает электроны, то он становится анионом, если отдаёт электроны – то катионом.

Атом может отдать или принять электроны таким образом, чтобы внешний энергетический уровень был максимально заполнен, так как это энергетически выгодно. Полностью заполненный подуровень является очень устойчивым — такую конфигурацию имеют все благородные газы, и к ней стремятся ионы.
Рассмотрим пример с образованием сульфид-аниона S2-.
- 3 энергетический уровень является внешним для атома серы, на нем располагается 6 электронов, 2 из которых являются неспаренными.
- К этим электронам могут добавиться два “соседа”, благодаря которым p-подуровень заполняется полностью и обретает стабильную конфигурацию.
- Так как каждый из электронов имеет заряд (-1), то суммарно после их присоединения к сере образуется сульфид-анион S2-

Фактчек
- Электроны заполняются определенным образом на энергетических уровнях вокруг атома.
- Электронная конфигурация помогает нам узнать, на каком уровне и подуровне располагается определенное число электронов.
- Если к нейтральному атому добавить электроны, то он превращается в анион, если же отобрать электроны — образуется катион.
- Атом стремится обладать наиболее устойчивой электронной конфигурацией, при которой энергетический уровень/подуровень является заполненным.
Проверь себя
Задание 1.
Внешним энергетическим уровнем называется :
- Первый энергетический уровень
- Последний энергетический уровень
- Энергетический уровень с наименьшей энергией
Задание 2.
Максимальное число электронов на внешнем энергетическом уровне равно:
- 5
- 6
- 7
- 8
Задание 3.
Количество валентных электронов, в большинстве случаев, равно:
- Номеру группы
- Номеру периода
- Порядковому номеру элемента
- Массовому числу элемента
Задание 4.
Сколько электронов необходимо для заполнения энергетического уровня атома углерода?
- 2
- 3
- 4
- 5
Задание 5.
Электронной конфигурации какого благородного газа будет соответствовать электронная конфигурация хлорид-иона?
- Аргона
- Неона
- Криптона
- Ксенона
Ответы: 1. — 2; 2. — 4; 3. — 1; 4. — 3; 5. — 1.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите “Нет”.
Атом (греч: atomos – неделимый) – химически неделимая нейтральная частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Атомное ядро – состоит из нуклонов (лат. nucleus ядро ): протонов (греч. protos – первый) и нейтронов (греч. neitrum – ни то, ни другое).
Электронная оболочка – совокупность движущихся вокруг ядра отрицательно заряженных электронов.
Протон (p⁺) – частица в составе ядра, имеет положительный заряд, относительную массу 1, 0073.
Число протонов равно порядковому номеру и обозначается Z – заряд ядра.
Нейтрон (n⁰) – частица в составе ядра. Не имеет заряда. Относительная масса 1,0087.
Число нейтронов обозначается буквой N. Может меняться в атомах одного и того же элемента.
Электрон (е) – частица в составе электронной оболочки. Имеет отрицательный заряд, равный по величине, но противоположный по знаку заряду протона. Масса электрона примерно в 2000 раз меньше массы протона и практически не влияет на массу атома.
Так как атом – электронейтральная частица, то число протонов равно числу электронов
(число р⁺ = числу е):
N(e) = N(p⁺) = Z
Массовое число А (относительная атомная масса) складывается из числа протонов и нейтронов в ядре данного атома.
Число нейтронов равно разности массового числа и заряда ядра.
А = N(p⁺) + N(nº)
N(nº) = A – Z
Строение атома
Планетарная модель атома
Химический элемент – вид атомов с определѐнным зарядом ядра (количеством протонов).
Количество протонов неизменно, количество нейтронов может меняться.
Атомы с одинаковым зарядом ядра (количеством протонов), но разным числом нейтронов в ядре, т.е. разной массой, называются изотопами (нуклидами).
Один и тот же элемент может существовать в виде двух или нескольких изотопов. Все изотопы одного и того же элемента химически неотличимы.
Электронное строение атома
Электрон — уникальная элементарная частица: обладая свойствами, отличающими его от всех других частиц, он одновременно является и частицей, и волной, т.е. имеет двойственную природу.
С одной стороны, обладая малой массой, электрон проявляет свойства частицы. С другой стороны, электрон движется с такой высокой скоростью, что фактически «размазан» по атому, он находится не в одной конкретной точке, а образует «электронное облако».
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона называется электронной орбиталью.
КВАНТОВЫЕ ЧИСЛА
Состояние электрона в атоме описывается 4 квантовыми числами:
- Главное квантовое число n;
- Побочное (орбитальное) квантовое число l;
- Магнитное квантовое число ml;
- Спиновое квантовое число ms.
- ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО – n.
Главное квантовое число – n – определяет энергетический уровень электрона (равно номеру периода).
Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.
- ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО l
Определяет геометрическую форму атомной орбитали. Принимает любые целочисленные значения с l = 0 (l = n -1)
- МАГНИТНОЕ КВАНТОВОЕ ЧИСЛО
определяет ориентацию орбитали в пространстве (ml). Принимает любые целочисленные значения от -1 до +1, включая 0.
( ml = 2l +1)
Для s-орбитали:
l=0, ml= 1(0) – одна равноценная ориентация в пространстве (одна орбиталь).
Для p-орбитали:
l=1, ml= 3 (-1,0,+1) – три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали:
l=2, ml= 5 (-2,-1,0,1,2) – пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали:
l=3, ml= 7 (-3,-2,-1,0,1,2,3) – семь равноценных ориентаций в пространстве (семь орбиталей).
- СПИНОВОЕ КВАНТОВОЕ ЧИСЛО – ms
На каждой орбитали могут максимально размещаться два электрона, обладающие равной энергией, но отличающиеся особым свойством, спином.
Графически орбиталь принято изображать в виде квадрата, а электроны — в виде стрелок, направленных вверх или вниз.
Стрелки, направленные в противоположные стороны, означают электроны с двумя противоположными спинами.
Следовательно, электроны в электронной оболочке занимают определенные
уровни (дом),
подуровни (этаж),
орбитали (квартира).
Подуровни состоят из одной или нескольких одинаковых по энергии орбиталей.
На каждой орбитали может быть не больше двух электронов.
На
s-подуровне (одна орбиталь) могут находиться два электрона,
p-подуровне (три орбитали) – шесть электронов ,
d-подуровне (пять орбиталей) – десять электронов.
Элементы, у которых последним заполняется s-подуровень, называются s –элементами, p-подуровень – p –элементами, d-подуровень – d –элементами.
ПРИНЦИПЫ ПОСТРОЕНИЯ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ ЭЛЕМЕНТА
Количество электронов в атоме элемента равно его порядковому номеру.
Количество энергетических уровней атома равно номеру периода, в котором расположен элемент.
Количество электронов на внешнем (валентном) уровне равно номеру группы, в которой расположен элемент.
При более подробном описании электронной конфигурации рассматривают не только количество электронов на данном энергетическом уровне, но и их распределение по подуровням. Каждая незаполненная орбиталь обозначается пустым квадратиком.
При заполнении орбиталей электронами используют следующие правила.
1. ПРИНЦИП МИНИМУМА ЭНЕРГИИ
Орбитали заполняются в порядке увеличения энергии, снизу вверх. Каждый электрон располагается так, чтобы его энергия была минимальной, т. е. среди свободных орбиталей он выбирает орбиталь с самой низкой энергией.
Порядок заполнения энергетических подуровней (см. рис.) можно запомнить в виде ряда:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
2. ПРИНЦИП ПАУЛИ
На каждой орбитали может находиться не более двух электронов. Если два электрона находятся на одной орбитали, то они обладают противоположными спинами (стрелки направлены в разные стороны). Такие электроны называют спаренными. Если на орбитали находится только один электрон, то его называют неспаренным.
3. ПРАВИЛО ХУНДА (ГУНДА)
Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
4s-орбиталь обладает меньшей энергией, чем 3d-орбиталь, поэтому в первую очередь электроны заполнят 4s-подуровень и лишь затем 3d-подуровень.
Для удобства запоминания порядка заполнения энергетических подуровней лучше воспользоваться следующей схемой: в каждой отдельной строке написать возможные типы орбиталей для каждого уровня, провести стрелки под углом 450 и «расселять» электроны по подуровням, ориентируясь по стрелкам сверху вниз.
ЗАПИСЬ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ АТОМА
Подробные электронные конфигурации атомов изображают двумя способами:
- графически, с помощью квадратиков со стрелками (часто называют энергетическими диаграммами);
- в строчку, когда перечисляются все занятые энергетические подуровни с указанием общего числа электронов на каждом из них.
Последовательность заполнения орбиталей и максимальное число электронов на каждом подуровне:
ПРОСКОК» ИЛИ «ПРОВАЛ» ЭЛЕКТРОНА
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома.
ВОЗБУЖДЕННОЕ СОСТОЯНИЕ АТОМА
Все электронные конфигурации, о которых мы говорили выше, являются конфигурациями с наименьшей энергией и соответствуют основному состоянию атома.
Получив энергию извне (облучение или нагревание системы), один либо несколько электронов могут переходить на более высокий энергетический подуровень.
Состояние атома, при котором электрон из электронной пары с предыдущего подуровня «распаривается» и переходит на следующий подуровень, называется возбужденным состоянием атома.
ВАЛЕНТНЫЕ ВОЗМОЖНОСТИ
Валентность атома определяется числом неспаренных электронов.
При наличии свободных орбиталей электроны атома могут распариваться, перескакивать на на другой подуровень, т.е. атом переходит в возбужденное состояние, поэтому валентность может быть постоянной и переменной. При этом число неспаренных электронов, а, следовательно, число связей, образуемых атомом, увеличивается.
Высшая валентность всегда равна номеру группы.
Для определения низшей переменной валентности (количества свободных электронов) , которой чаще всего обладают неметаллы, необходимо из 8 вычесть номер группы.
Валентность зависит:
1. От количества электронов на внешнем уровне
2. От количества свободных неспаренных электронов
3. От наличия свободных орбиталей
Электронные формулы ионов
Ионы – заряженные частицы, они получаются из атомов путем отдачи электронов (тогда образуются катионы) или принятия электронов (образуются анионы).
Примеры:
S2- (16+2=18е)
P3+ (15-3=12е)
Na+ (11-1=10е)
Электронная формула иона получается путем добавления или вычитания электронов из электронной формулы атома ( до инертной оболочки – 8е).
1(Б) Тесты ЕГЭ ФИПИ 2015 к теме “Строение атома”
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)



































