Лучший ответ
Тыква ОО””
Ученик
(239)
12 лет назад
m чис. в-ва= W ч. в. *m смеси/100%
Остальные ответы
Соня Рома
Ученик
(109)
12 лет назад
Пример. Масса 98г ето 100 %. примеси 27% ето х г. Решение Х=(98*27)/100=26,46г (Масса примесей)
98-26,46=71.54( масса чистого вещества)
anna Panteleewa
Профи
(671)
12 лет назад
можно найти процент примесей, отнять от 100% общей массы, найдёшь процент чистого вещ-ва, потом процент этот умн на общ массу => массу ч вещ-ва
Каждое вещёство наряду с основным компонентом включает то или иное количество примесей. Именно поэтому абсолютно чистых веществ в природе не существует.
Образец (вещество, навеску), содержащий примеси, принято называть техническим (технически чистым). Его массу обозначают mтехн, массу примесей — mприм, а массу основного (чистого) вещества — mчист.
Обрати внимание!
(=) mчист (+)
mприм
.
Содержание примесей в техническом образце обычно указывается с помощью массовой доли, которую выражают в долях от единицы или в процентах:
Сумма массовых долей примесей
ωприм
и основного вещества
ωчист
равна (1) ((100) %):
(+) ωчист (=) (1) ((100) %).
При проведении расчётов по уравнениям химических реакций, если исходное вещество содержит определённую долю примесей, придерживаются алгоритма:
1. если необходимо, записывают уравнение химической реакции.
2. Находят массу чистого вещества.
Её можно рассчитать по формуле:
mчист (=) mтехн (·) ωчист (=) mтехн (·) ((1 -) ωприм )
— либо используя пропорцию. При этом mтехн соответствует (100) %, а mчист — (x) %.
3. Определяют химическое количество чистого вещества по формуле:
n=mM.
4. Подчёркивают формулы интересующих веществ в уравнении реакции.
Под этими формулами записывают химические количества вступивших в реакцию и образовавшихся веществ (коэффициенты перед веществами в уравнении реакции). Над формулами веществ указывают известную величину (найденное по формуле химическое количество чистого вещества), а также неизвестную, которую обозначают за (x) — (химическое количество образующегося продукта реакции или вступившего в реакцию исходного вещества).
5. Составляют пропорцию и находят неизвестную величину.
6. Если необходимо, рассчитывают по формуле массу продукта реакции или массу вступившего в реакцию вещества:
m=n⋅M.
Обрати внимание!
Если необходимо найти объём газообразного вещества ( при н. у.) — используют формулу: V(вещ)=Vm⋅n(вещ); Vm=22,4 л/моль.
Вычисли массу негашёной извести
CaO
, которую получили при обжиге известняка массой (300) г, если массовая доля примесей в нём равна (0,08) ((8) %).
1. Запиши уравнение химической реакции:
2. Определи массовую долю чистого карбоната кальция в известняке и найди массу соли:
ωчист (=) (1) (-) ωприм (= 1 – 0,08 = 0,92).
(0,92) — массовая доля (в долях от единицы) карбоната кальция в известняке.
mчист (=) mтехн (·) ωчист (= 300 · 0,92 = 276) г.
(276) г — масса чистого карбоната кальция в известняке.
3. Определи химическое количество чистого вещества:
моль.
4. (2,76) моль (x) моль
(1) моль (1) моль
5. Составь пропорцию и найди неизвестную величину:
(2,76) моль — химическое количество образовавшейся негашёной извести.
6. Определи массу негашёной извести:
г.
Ответ: (m()CaO()) (=) (154,56) г.
Как найти массу чистого вещества
Абсолютно чистых веществ не бывает, любое всегда содержит какое-то количество примесей. Это содержание может быть весьма большим, может быть очень малым, но примеси все равно есть. А можно ли найти массу чистого вещества?

Инструкция
Согласно принятым нормам, любая химическая продукция, выпущенная на государственных или частных предприятиях, должна иметь сертификат качества, в котором указано процентное содержание основного вещества и наиболее значимых примесей. Это определяется лабораторным путем с помощью методов качественного и количественного анализа. Сертификат прилагается к любой конкретной партии продукции, а его основные показатели должны быть отражены на каждой единице упаковки.
Например, хорошо известная поваренная соль — хлористый натрий. Покупая упаковку марки «Экстра» массой 1 килограмм, сколько чистой соли вы приобретаете? Посмотрите на информацию с упаковки. Если содержание основного вещества 99,7%, это очень хороший показатель, что неудивительно, поскольку «экстра» означает высокую степень очистки. Следовательно, чистого вещества в единице упаковки содержится: 1000*0,997=997 грамм. Остальные три грамма распределятся между различными примесями. Разумеется, в других, менее очищенных сортах поваренной соли, содержание чистого вещества будет ниже.
Или вот задача, которая наверняка заинтересует прекрасный пол. Предположим, имеется золотое кольцо 585-й пробы, массой 20 грамм. Сколько чистого золота оно содержит? Дать ответ на этот вопрос очень просто, достаточно лишь вспомнить, каков смысл понятия «проба». В России ее величина указывает, какова доля чистого благородного металла в 1000 весовых долей изделия. Следовательно, 585-я проба соответствует концентрации, равной 58,5%. Произведите вычисление в одно действие: 20*0,585=11,7 грамма. Именно столько чистого золота содержится в кольце.
А как быть, к примеру, если кольцо работы английского мастера, и весит те же 20 грамм, но на клейме вместо пробы указано что-то непонятное — «18К»? Как в таком случае найти количество чистого золота в изделии? И тут нет абсолютно ничего сложного. Дело в том, что в Великобритании принята «каратная» шкала чистоты благородных металлов. Наивысшей теоретически, 100% концентрации, соответствует 24 карата. Тогда изделие было бы промаркировано «24К». Раз стоит клеймо «18К», это значит, что в изделии 18 весовых частей золота, и 6 весовых частей примесей. Разделите: 18/24=0,75. Изделие соответствует вашей 750-й пробе. Произведите вычисление: 20*0,75=15 грамм. Вот сколько чистого золота содержится в этом кольце.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Решение расчетных задач по химии очень тесно связано с физикой и математикой. Эти межпредметные связи надо постоянно иметь в виду.
В курсе физики величина «количество вещества» изучается значительно позднее, чем в химии. Поэтому важно правильно сформировать понятие о ней, чтобы в дальнейшем у учащихся не возникало противоречий.
Методику решения задач также полезно связать с физикой, сохраняя форму записи условия и решения. Этого требует и соблюдаемый в школе единый орфографический режим. Кроме того, гораздо более рационален физико-математический путь решения, когда все расчеты производят сначала в буквенных выражениях и лишь после этого подставляют числовые значения.
Традиционная методика обучения решения химических задач (чаще всего — это решение задач методом составления пропорций) имеет ряд недостатков. В результате лишь немногие учащиеся сознательно и творчески овладевают общим подходом к решению, умеют оценивать свои действия в процессе решения, самостоятельно составлять условия задач, умеют выбирать рациональные способы решения и др.
Представленная методика обучения решения задач от общих приёмов к частным позволяет решить недостатки традиционных способов обучения. Мы будем опираться на приёмы решения задач с использованием основных физических величин. Среди них величина n (или v) — количество вещества — позволяет связать все основные физические величины друг с другом. Это даёт возможность составлять логические схемы решения задач с использованием этих физических величин.
Задача учителя состоит в том, чтобы научить учащихся понимать смысл этих физических величин и применять физические формулы при решении расчётных задач различных типов, научить анализировать условия задач через составление логической схемы решения конкретной задачи на основе знания общего подхода к решению. Составление логической схемы задачи предотвращает многие ошибки, которые допускают учащиеся.
Ниже приведены основные формулы физических величин и их взаимосвязи, которые учащиеся должны знать в обязательном порядке и использовать их при решении.
Рассмотрим примеры решения основных типов задач, по которым можно понять методический подход при обучении учащихся.
Исходные формулы, отображающие взаимосвязь физических величин:
- Относительная атомная масса (Ar):
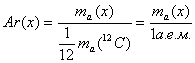 , где x — любой химический элемент.
, где x — любой химический элемент. - Относительная молекулярная масса (Mr):
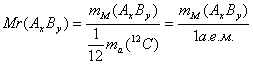 ;
;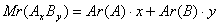 .
. - Плотность вещества (ρ) позволяет связать собой массу (m) и объем (V) вещества:
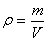 .
. - Масса, объем, число частиц (N), количество теплоты (Q) связаны между собой универсальной физической величиной — количеством вещества — n (или v):
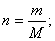
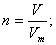
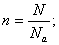
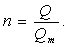
- Относительная плотность (D):
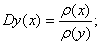
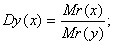
- Массовая доля ω:
элемента в веществе: ![]() ;
;![]() ;
;
примеси в веществе:![]() ;
;
растворенного вещества в растворе: ![]() ;
;
m р-ра = m р.в+ mр-ля
mр-ра=Vр-ра· ρр-ра.
- Объемная доля вещества в смеси (φ) (для газов):
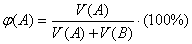 .
. - Молярная концентрация (Сm или С):
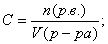
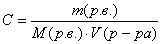 .
. - Уравнение Клапейрона – Менделеева:
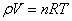 .
.
Методика решения задач различных типов.
Расчеты по химическим формулам.
Решение данного типа задач начинается с осмысления понятия записи химической формулы, с осмыслением того, что учащиеся могут узнать по записи химической формулы. Рассмотрим примеры решения задач с использованием веществ только молекулярного строения. Молекулярная (истинная) формула показывает действительное число атомов каждого элемента в молекуле.
Алгоритм решения базовой задачи:
- Заданный по условиям параметр переводим в количество вещества (n или v;).
- По индексам определяем количество вещества искомого химического элемента (n(х) или v(х)).
- По формулам, отображающим взаимосвязь величин, рассчитываем неизвестный параметр.
Графическая схема решения базовой задачи.
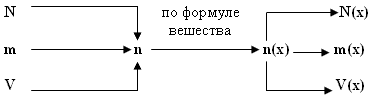
Примеры задач
Задача. Рассчитайте число атомов углерода и кислорода в 11,2 л. (н.у.) углекислого газа.
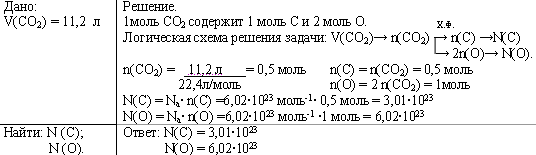
Задача. В каком объеме углекислого газа содержится 9,03·1023 атомов кислорода?
Какова его масса?
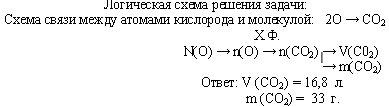
Задача. Газ, плотность которого равна 1,96 г/л (н.у.), состоит из углерода и кислорода, причем ω(C) = 0,27. Определите формулу данного вещества.
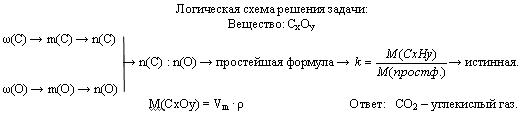
Расчёты по химическим уравнениям
Химическими уравнениями называют условную запись химической реакции посредством химических знаков, формул и коэффициентов.
Уравнение химической реакции показывает, какие вещества вступают в реакцию и какие образуются, а также соотношение количеств этих веществ. Иными словами, химическое уравнение — это способ выражения (передачи) качественной и количественной информации о химическом явлении.
Запишем уравнение реакции в общем виде: aA + bB → cC +dD, где А и В — исходные вещества, С и D — продукты реакции, a, b, c, d — стехиометрические коэффициенты.
Стехиометрические коэффициенты подбирают на основе того, что число атомов каждого элемента до и после реакции остается неизменным. Это можно рассматривать как следствие закона сохранения массы.
Рассмотрим информацию, содержащуюся в стехиометрических коэффициентах. Отношение стехиометрических коэффициентов равно:
- отношению числа частиц, вступивших в реакцию и образовавшихся в результате реакции
a : b : c : d = N(A) : N(B) : N(C) : N(D) - отношению молярных количеств веществ, вступивших в реакцию и образовавшихся в результате реакции
a : b : c : d = n(A) : n(B) : n(C) : n(D) - отношению объемов, вступивших в реакцию и образовавшихся в результате реакции газообразных веществ
a : b : c : d = V(A) : V(B) : V(C) : V(D).
Последнее отношение выполняется, если:
- это газообразные вещества, близкие по свойствам к идеальному газу,
- объемы этих газов измерены при одинаковом давлении и температуре.
Несмотря на большое разнообразие задач данного типа, принцип решения их одинаков: по известному параметру (N, m, V) одного вещества рассчитывается неизвестный параметр X (Nx, mx, Vx) другого вещества. Такая задача является простейшей (базовой).
Алгоритм решения базовой задачи (последовательность действий):
- Составляем уравнение химической реакции и выписываем мольные соотношения прореагировавших и получившихся веществ.
- По формулам, отображающим взаимосвязь физических величин, переводим заданную по условию величину в количество (n или ν) исходного вещества.
- По мольным отношениям рассчитываем n определяемого вещества (Х).
- По формулам, отображающим взаимосвязь физических величин, рассчитываем неизвестный параметр X.
Графическая схема решения базовой задачи.
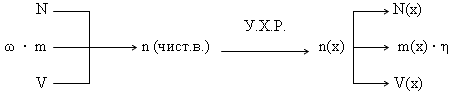
В качестве базовых рассмотрим решение следующих задач:
Задача. Вычислите n, m, V углекислого газа, полученного при действии на 50 г карбоната кальция избытком раствора соляной кислоты.
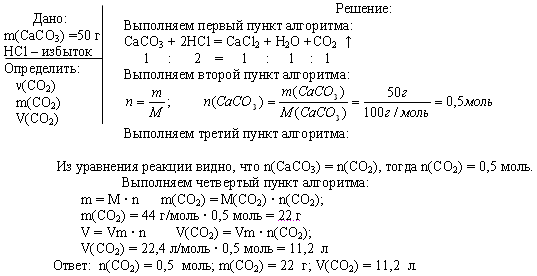
Задача. При взаимодействии цинка с избытком раствора соляной кислоты выделилось 1,12 л водорода (н.у.). Вычислите массы растворившегося цинка и образовавшейся соли.
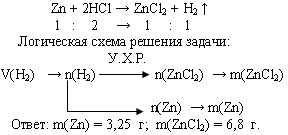
Задача. При взаимодействии с избытком соляной кислоты металла (валентность, которого во всех соединениях равна II) массой 12 г образовался водород объемом 6,72 л (н.у.). Определите, какой это металл.
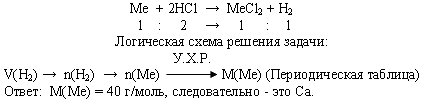
Усложнение базовой задачи.
Расчет массы реагирующих или образующихся химических соединений на практике осложнен. Это обусловлено несколькими причинами:
- Исходные вещества или продукты реакции задаются в условиях отличных от нормальных.
- Исходные вещества вводятся в виде растворов.
- Во многих случаях реагенты содержат примеси, которые в данной конкретной реакции либо не участвуют вообще, либо образуют отличные от целевого продукта вещества.
- Выход продуктов не соответствует теоретическому, т.к. очистка целевого вещества приводит не только к освобождению от многочисленных примесей, но и к частичной потери основного вещества.
Таким образом, перед использованием исходных данных для решения задачи и подстановки их в основную цепь расчетов необходимо провести те или иные дополнительные преобразования. Для перевода условий, отличных от нормальных (для газообразных веществ) используется исходная формула 9 — расчеты физико-химических величин по управлению Клапейрона – Менделеева.
Задача. Сколько граммов 10%-ного раствора гидроксида натрия требуется для нейтрализации 20 г 4,9%-нго раствора серной кислоты?
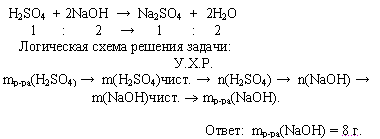
Расчет количественных параметров продуктов реакции, если исходные вещества содержат примеси, расчет массовой доли примеси
Абсолютно чистого вещества в природе не бывает, поэтому в химических производствах вынуждены использовать исходные вещества, содержащие примеси. Эти примеси обычно имеют отличные от основного вещества свойства и, поэтому не образуют в процессе производства нужные продукты.
В связи с этим, чтобы определить количественные параметры получаемого продукта, необходимо вначале рассчитать количественные параметры вступающего в реакцию чистого вещества, которое содержится в исходном объекте. После этого решается базовая задача.
Обратные задачи заключаются в оценке чистоты исходных веществ по количеству продуктов реакции.
Содержание примеси обычно выражают в частях от единицы (или выражают в %). Эта величина показывает массовую долю чистого вещества (примеси) в исходном образе (формула 1).
Для вычисления массы чистого вещества (или примесей), содержащегося в смеси, используют формулу 2.
![]() (1)
(1)
m(смеси) = m(осн.в.) + m(прим.) (2)
Задача. При взаимодействии 10,8 г кальцинированной соды (безводный карбонат натрия) с избытком раствора соляной кислоты получили 2,24 л (н.у.) оксида углерода (IV). Вычислите содержание примеси в соде.
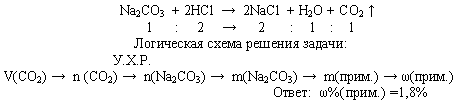
Расчеты по химическим уравнениям, если одно из реагирующих веществ дано в избытке
Как быть, если одновременно заданы параметры нескольких реагирующих веществ? По какому из них вести расчет? Это определяют, сравнения отношения стехиометрических коэффициентов и отношение количеств вещества, взятых для данной реакции.
Если один из реагентов присутствует в количестве больше, чем стехиометрическое, то часть его остается неиспользованной после окончания реакции (избыток вещества). Очевидно, что расчеты нужно вести по веществу, которое в данной реакции расходуется полностью (т.е. находится в недостатке).
Задача. В реакционном сосуде смешали 6,72 л оксида углерода (II) и 2,24 л кислорода и смесь подожгли. Определите объемный состав полученной смеси.
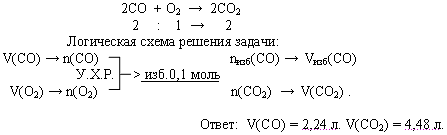
№3. Доля (массовая или объемная) примесей – это безразмерная величина, которая показывает отношение массы (объема) примесей к общей массе (объему) смеси.
Чтобы найти массу (объем) чистого вещества, если известна массовая (объемная) доля примесей, необходимо:
1) из 100% вычесть массовую (объемную) долю примесей и найти массовую (объемную) долю чистого вещества;
2) по формуле рассчитать массу (объем) чистого вещества:
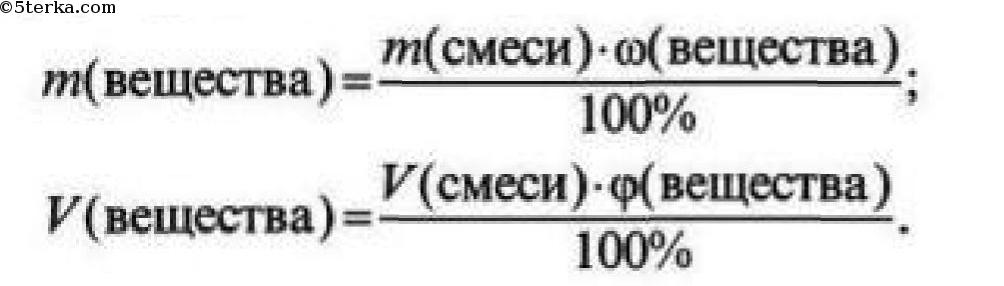
Источник:

Решебник
по
химии
за 11 класс (О.С. Габриелян, 2007 год),
задача №3
к главе «§12 Состав вещества. Смеси».
Все задачи
← 2 Что называют массовой (объемной) долей компонента смеси? Как ее рассчитывают?
4 Не производя расчета, укажите, в каком из оксидов, формулы которых Fe2O3 и Fe3O4, содержание железа выше. Ответ подтвердите расчетами. →
Комментарии
