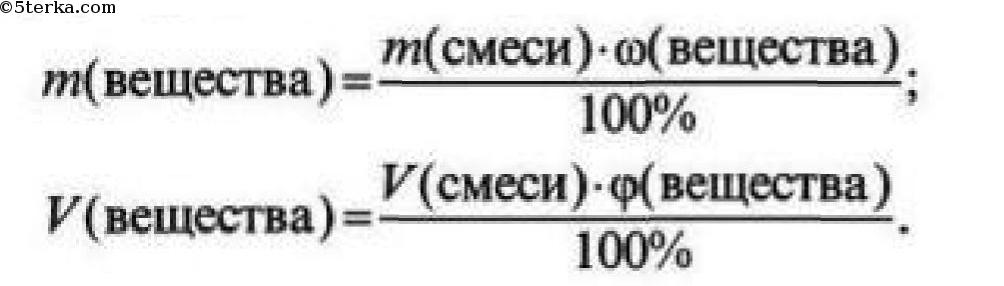Лучший ответ
Тыква ОО””
Ученик
(239)
12 лет назад
m чис. в-ва= W ч. в. *m смеси/100%
Остальные ответы
Соня Рома
Ученик
(109)
12 лет назад
Пример. Масса 98г ето 100 %. примеси 27% ето х г. Решение Х=(98*27)/100=26,46г (Масса примесей)
98-26,46=71.54( масса чистого вещества)
anna Panteleewa
Профи
(671)
12 лет назад
можно найти процент примесей, отнять от 100% общей массы, найдёшь процент чистого вещ-ва, потом процент этот умн на общ массу => массу ч вещ-ва
Каждое вещёство наряду с основным компонентом включает то или иное количество примесей. Именно поэтому абсолютно чистых веществ в природе не существует.
Образец (вещество, навеску), содержащий примеси, принято называть техническим (технически чистым). Его массу обозначают mтехн, массу примесей — mприм, а массу основного (чистого) вещества — mчист.
Обрати внимание!
(=) mчист (+)
mприм
.
Содержание примесей в техническом образце обычно указывается с помощью массовой доли, которую выражают в долях от единицы или в процентах:
Сумма массовых долей примесей
ωприм
и основного вещества
ωчист
равна (1) ((100) %):
(+) ωчист (=) (1) ((100) %).
При проведении расчётов по уравнениям химических реакций, если исходное вещество содержит определённую долю примесей, придерживаются алгоритма:
1. если необходимо, записывают уравнение химической реакции.
2. Находят массу чистого вещества.
Её можно рассчитать по формуле:
mчист (=) mтехн (·) ωчист (=) mтехн (·) ((1 -) ωприм )
— либо используя пропорцию. При этом mтехн соответствует (100) %, а mчист — (x) %.
3. Определяют химическое количество чистого вещества по формуле:
n=mM.
4. Подчёркивают формулы интересующих веществ в уравнении реакции.
Под этими формулами записывают химические количества вступивших в реакцию и образовавшихся веществ (коэффициенты перед веществами в уравнении реакции). Над формулами веществ указывают известную величину (найденное по формуле химическое количество чистого вещества), а также неизвестную, которую обозначают за (x) — (химическое количество образующегося продукта реакции или вступившего в реакцию исходного вещества).
5. Составляют пропорцию и находят неизвестную величину.
6. Если необходимо, рассчитывают по формуле массу продукта реакции или массу вступившего в реакцию вещества:
m=n⋅M.
Обрати внимание!
Если необходимо найти объём газообразного вещества ( при н. у.) — используют формулу: V(вещ)=Vm⋅n(вещ); Vm=22,4 л/моль.
Вычисли массу негашёной извести
CaO
, которую получили при обжиге известняка массой (300) г, если массовая доля примесей в нём равна (0,08) ((8) %).
1. Запиши уравнение химической реакции:
2. Определи массовую долю чистого карбоната кальция в известняке и найди массу соли:
ωчист (=) (1) (-) ωприм (= 1 – 0,08 = 0,92).
(0,92) — массовая доля (в долях от единицы) карбоната кальция в известняке.
mчист (=) mтехн (·) ωчист (= 300 · 0,92 = 276) г.
(276) г — масса чистого карбоната кальция в известняке.
3. Определи химическое количество чистого вещества:
моль.
4. (2,76) моль (x) моль
(1) моль (1) моль
5. Составь пропорцию и найди неизвестную величину:
(2,76) моль — химическое количество образовавшейся негашёной извести.
6. Определи массу негашёной извести:
г.
Ответ: (m()CaO()) (=) (154,56) г.
Как найти массу чистого вещества
Абсолютно чистых веществ не бывает, любое всегда содержит какое-то количество примесей. Это содержание может быть весьма большим, может быть очень малым, но примеси все равно есть. А можно ли найти массу чистого вещества?

Инструкция
Согласно принятым нормам, любая химическая продукция, выпущенная на государственных или частных предприятиях, должна иметь сертификат качества, в котором указано процентное содержание основного вещества и наиболее значимых примесей. Это определяется лабораторным путем с помощью методов качественного и количественного анализа. Сертификат прилагается к любой конкретной партии продукции, а его основные показатели должны быть отражены на каждой единице упаковки.
Например, хорошо известная поваренная соль — хлористый натрий. Покупая упаковку марки «Экстра» массой 1 килограмм, сколько чистой соли вы приобретаете? Посмотрите на информацию с упаковки. Если содержание основного вещества 99,7%, это очень хороший показатель, что неудивительно, поскольку «экстра» означает высокую степень очистки. Следовательно, чистого вещества в единице упаковки содержится: 1000*0,997=997 грамм. Остальные три грамма распределятся между различными примесями. Разумеется, в других, менее очищенных сортах поваренной соли, содержание чистого вещества будет ниже.
Или вот задача, которая наверняка заинтересует прекрасный пол. Предположим, имеется золотое кольцо 585-й пробы, массой 20 грамм. Сколько чистого золота оно содержит? Дать ответ на этот вопрос очень просто, достаточно лишь вспомнить, каков смысл понятия «проба». В России ее величина указывает, какова доля чистого благородного металла в 1000 весовых долей изделия. Следовательно, 585-я проба соответствует концентрации, равной 58,5%. Произведите вычисление в одно действие: 20*0,585=11,7 грамма. Именно столько чистого золота содержится в кольце.
А как быть, к примеру, если кольцо работы английского мастера, и весит те же 20 грамм, но на клейме вместо пробы указано что-то непонятное — «18К»? Как в таком случае найти количество чистого золота в изделии? И тут нет абсолютно ничего сложного. Дело в том, что в Великобритании принята «каратная» шкала чистоты благородных металлов. Наивысшей теоретически, 100% концентрации, соответствует 24 карата. Тогда изделие было бы промаркировано «24К». Раз стоит клеймо «18К», это значит, что в изделии 18 весовых частей золота, и 6 весовых частей примесей. Разделите: 18/24=0,75. Изделие соответствует вашей 750-й пробе. Произведите вычисление: 20*0,75=15 грамм. Вот сколько чистого золота содержится в этом кольце.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
СЛУШАТЕЛЯ ПРОГРАММЫ
ДОПОЛНИТЕЛЬНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ПОВЫШЕНИЯ КВАЛИФИКАЦИИ
«МЕТОДИЧЕСКИЕ ПОДХОДЫ К РЕШЕНИЮ РАСЧЁТНЫХ И ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ ДЛЯ
ПОДГОТОВКИ К ОГЭ И ЕГЭ ПО ХИМИИ»
По теме «Методика
решения химических задач по уравнениям реакций по известным параметрам
исходного вещества без примесей и с примесями.
в формате ОГЭ и ЕГЭ»
Учителя
МБОУ Нахабинская СОШ № 3
Г.о.
Красногорск п. Нахабино
Московской
области
Новиковой
Татьяны Юрьевны
ГОРОД КРАСНОГОРСК
2018
Расчётные задачи по химии учащиеся решают с начала VIII класса и
до конца обучения в школе. Решение задач позволяет:
- расширять
кругозор учащихся; - развивать
умение логически мыслить; - воспитывать
самостоятельность, внимательность, умение анализировать, делать правильные
выводы; - устанавливать
связь химии с другими науками: физикой, математикой, биологией, экологией
и др.; - способствует
политехнической подготовке учащихся, готовиться к успешной аттестации по
предмету (в том числе в форме ОГЭ и ЕГЭ).
Решая задачи, учащиеся более глубоко усваивают учебный материал,
учатся применять приобретённые теоретические знания на практике.
Использование задач в школе позволяет решать основные функции
обучения и воспитания.
- Обучающие функции обеспечиваются
формированием важных структурных элементов знаний, осмыслением химической
сущности явлению, умением применять усвоенные знания в конкретно заданной
ситуации. Решение задач – это активный познавательный процесс. - Воспитывающие функции реализуются
формированием мировоззрения, расширением кругозора. Учебные задачи
являются действенным средством воспитания трудолюбия, настойчивости, воли,
характера. - Развивающиеся функции проявляются
в результате формирования логического, творческого мышления, развитие
смекалки учащихся. Решение задач – это мыслительный процесс.
Традиционная методика обучения решения химических задач (чаще
всего – это решение задач методом составления пропорций) имеет ряд недостатков.
В результате лишь немногие учащиеся сознательно и творчески овладевают общим
подходом к решению, умеют оценивать свои действия в процессе решения, самостоятельно
составлять условия задач, умеют выбирать рациональные способы решения и др.
Представленная методика обучения решения задач от общих приёмов
к частным позволяет решить недостатки традиционных способов обучения. В данной
работе показываются приёмы решения задач с использованием основных физических
величин. Среди них величина n (или ν) – количество вещества – позволяет связать
все основные физические величины друг с другом. Это даёт возможность составлять
логические схемы решения задач с использованием этих физических величин.
Задача учителя состоит в том, чтобы научить учащихся понимать
смысл этих физических величин и применять физические формулы при решении
расчётных задач различных типов, научить анализировать условия задач, через
составление логической схемы решения конкретной задачи на основе знания общего
подхода к решению. Составление логической схемы задачи предотвращает многие
ошибки, которые допускают учащиеся.
При решении задач необходимо
руководствоваться несколькими простыми правилами:
Порядок решения задачи:
1)
Прочитайте
задачу, запишите краткое условие.
2)
Составьте
уравнение химической реакции.
3)
Рассчитайте
массу чистого вещества, необходимого для реакции по уравнению реакции.
4)
Вычислите
массу примесей в образце по условию.
5)
Вычислите
массовую долю примесей по формуле: ωприм. = mприм./mсмеси.
Образец
решения:
Определите
массовую долю примесей в техническом образце карбида кальция, если из 200 г его
получили 56 л ацетилена.
Р
е ш е н и е:
1.
Записываем
уравнение химической реакции:
CaC2
+ 2Н2О = С2Н2
+ Са(ОН)2
Определяем количество
вещества ацетилена:
n=
V/Vm
n=
56/22,4 =2,5 моль,
следовательно,
по уравнении химической реакции чистого CaC2
вступило в реакцию 2,5 моль
m(CaC2)
=n× M (CaC2)
m(CaC2)
= 2,5 ×64 = 160г
m примесей = 200-160=40 г
3)
определяем массовую долю примесей:
ωприм = 40 г/ 200 г = 0,2 (или 20%).
Ответ: ωприм = 20%.
Решение
расчетных задач «на примеси» и определение массовой доли вещества в растворе
после реакции.
При решении задач такого типа считается,
что примеси – это вещества, не способные вступать в реакцию по составленному
для решения уравнению.
Пример 1. 10 г железа, содержащего
16 % примесей, растворили в 150 мл 10 % раствора соляной кислоты (плотностью 1,05
г/мл). Вычислите объем выделяющегося газа (н. у.) и массовую долю хлороводорода
в полученном растворе.
Алгоритм решения:
1. Составляем
уравнение реакции по условию задачи, расставляем коэффициенты.
Fe
+ 2HCl = FeCl2 + H2
16%
от 10 г – примеси, которые не реагируют по составленному уравнению. Находим
массу чистого вещества железа. m(Fe) = 10 . (1 – 0,16) = 8,4
Находим
количество вещества железа по формуле n = m/M,
(n(Fe)
= 8,4/56 = 0,15 моль
2. Учитываем,
что коэффициенты в любом химическом уравнении указывают на соотношение
количеств веществ участников реакции. Следовательно, количество вещества
израсходованной HCl будет в два раза больше, чем количество вещества железа
(коэффициенты 2 и 1, соответственно), а количество вещества водорода будет
равно количеству вещества железа (коэффициенты 1 и 1, соответственно).
Находим
массу израсходованного хлороводорода m(HCl) = 0,3 . 36,5 = 10,95 г
Объем
образующегося водорода (н. у.) рассчитываем по формуле V = n . 22,4, что
составит V(HCl) = 0,15 . 22,4 = 3,36 л.
3. По
условию задачи требуется найти массовую долю хлороводорода в растворе после
прохождения реакции (соляная кислота – это раствор хлороводорода в воде).
Массовую долю находим по формуле w
= m части/mцелого.
В
данном случае часть – это масса оставшегося после прохождения реакции
хлороводорода, целое – масса раствора после реакции.
Очень
важно понимать, что в состав раствора входит растворитель (вода в данном
случае) и вещества, растворенные в этом растворителе. Образующийся
нерастворимый в воде газ и осадки не входят в состав раствора.
Находим
массу исходного раствора соляной кислоты по формуле:
mраствора
= Vраствора . p(плотность раствора)
После
чего массу вещества хлороводорода в растворе рассчитываем по формуле
m
= mраствора × массовую долю вещества (выраженную десятичным числом).
Соединяем
две последние формулы и получаем m(HCl) = 150 × 1,05 ×0.1 = 15,75 г.
Из
этой массы израсходовано на растворение железа 10,95 г хлороводорода,
следовательно осталось 15,75 – 10,95 = 4,8 г.
Находим
массу раствора после реакции. Для этого надо сложить массу исходных железа (оно
растворилось в кислоте полностью) и раствора соляной кислоты, затем вычесть из
полученной суммы массу улетевшего из раствора водорода
m(раствора
после реакции) = 8,4 + 150 . 1,05 – 0,15 . 2 = 166,2 г
Определяем
массовую долю хлороводорода в растворе после прохождения реакции
w
= 4,8/166,2 = 0,0289 или 2,89 %.
Пример
2. 11,2 г мрамора растворили в избытке соляной кислоты
и получили 2, 24 л газа (н.у.). Рассчитайте массовую долю примесей в
израсходованном образце мрамора.
Алгоритм
решения
1. Мрамор
– это минерал, основу которого составляет карбонат кальция. Составляем
уравнение реакции, расставляем коэффициенты
CaCO3
+ 2HCl = CaCl2 + CO2 + H2O
Рассчитываем
количество вещества газа (газ – это углекислый газ)
n
(CO2) = 2,24/22,4 = 0,1 моль
Исходя
из соотношения количеств веществ в уравнении (1 к 1 при формуле карбоната
кальция и углекислого газа), количество вещества карбоната кальция такое же,
0,1 моль. 2. Находим массу чистого карбоната кальция в образце мрамора.
m(CaCO3)
= 0,1 . 100 = 10 г
Следовательно,
масса примесей составит 11,2 – 10 = 1,2 г
Массовая
доля примесей w(примесей) = 1,2/11,2 =
0,1071 или 10,71%.
Пример 3.
Технический карбид кальция массой 20 г обработали избытком воды, получив
ацетилен, при пропускании которого через избыток бромной воды образовался
1,1,2,2 –тетрабромэтан массой 86,5 г. Определите массовую долю СаС2 в
техническом карбиде.
Дано: m = 20 г; m(C2H2Br4)=86,5 г.
Найти: ω(СаC2) =?
Решение: записываем уравнения взаимодействия карбида кальция с водой и
ацетилена с бромной водой и расставляем стехиометрические коэффициенты.
CaC2 +2 H2O = Ca(OH)2 + C2H2
C2H2 +2 Br2 = C2H2Br4
Находим количество вещества тетрабромэтана.
n(C2H2Br4)
= m(C2H2Br4)/ М(C2H2Br4) = 86,5/ 346 = 0,25 моль.
Из уравнений реакций следует, что
n(C2H2Br4)
=n(C2H2)
= n(СаC2)
=0,25 моль. Отсюда мы можем найти массу чистого карбида кальция (без примесей).
m(СаC2) =
n(СаC2) • М(СаC2) = 0,25•
64 = 16 г.
Определяем массовую долю СаC2 в техническом карбиде.
ω(СаC2) =m(СаC2)/m = 16/20 = 0,8 = 80%.
Пример 4. В бензоле объемом 170 мл растворили серу массой 1,8 г.
Плотность бензола равна 0,88 г/мл. Определите массовую долю серы в растворе.
Дано: V(C6H6) =170 мл;
m(S) = 1,8 г;
ρ(C6H6)=0,88 г/мл.
Найти: ω(S) =?
Решение: для нахождения массовой доли серы в растворе необходимо рассчитать
массу раствора. Определяем массу бензола.
m(C6H6) = ρ(C6H6) •V(C6H6)
= 0,88•170 = 149,6 г.
Находим общую массу раствора.
m(р-ра) = m(С6C6) + m(S) =149,6 + 1,8 = 151,4 г.
Рассчитаем массовую долю серы.
ω(S) =m(S)/m=1,8 /151,4 = 0,0119 = 1,19 %.
Задачи для самостоятельного решения 9
класс
1.Какая масса азотной кислоты образуется
при взаимодействии серной кислоты с 200г нитрата натрия, содержащего 10%
примесей?
2.Какой объем газа выделится при разложении
300г нитрата лития, содержащего 20% примесей?
3. Какая масса азотной кислоты образуется
при взаимодействии 196г серной кислоты и 100г нитрата калия, сод.20% примесей?
4.При разложении 250г нитрата натрия
выделился газ объемом 22,4л. Найдите долю чистого вещества нитрата натрия
в исходном образце?
№3. Доля (массовая или объемная) примесей – это безразмерная величина, которая показывает отношение массы (объема) примесей к общей массе (объему) смеси.
Чтобы найти массу (объем) чистого вещества, если известна массовая (объемная) доля примесей, необходимо:
1) из 100% вычесть массовую (объемную) долю примесей и найти массовую (объемную) долю чистого вещества;
2) по формуле рассчитать массу (объем) чистого вещества:
Источник:
Решебник
по
химии
за 11 класс (О.С. Габриелян, 2007 год),
задача №3
к главе «§12 Состав вещества. Смеси».
Все задачи
← 2 Что называют массовой (объемной) долей компонента смеси? Как ее рассчитывают?
4 Не производя расчета, укажите, в каком из оксидов, формулы которых Fe2O3 и Fe3O4, содержание железа выше. Ответ подтвердите расчетами. →
Комментарии