Каждое вещёство наряду с основным компонентом включает то или иное количество примесей. Именно поэтому абсолютно чистых веществ в природе не существует.
Образец (вещество, навеску), содержащий примеси, принято называть техническим (технически чистым). Его массу обозначают mтехн, массу примесей — mприм, а массу основного (чистого) вещества — mчист.
Обрати внимание!
(=) mчист (+)
mприм
.
Содержание примесей в техническом образце обычно указывается с помощью массовой доли, которую выражают в долях от единицы или в процентах:
Сумма массовых долей примесей
ωприм
и основного вещества
ωчист
равна (1) ((100) %):
(+) ωчист (=) (1) ((100) %).
При проведении расчётов по уравнениям химических реакций, если исходное вещество содержит определённую долю примесей, придерживаются алгоритма:
1. если необходимо, записывают уравнение химической реакции.
2. Находят массу чистого вещества.
Её можно рассчитать по формуле:
mчист (=) mтехн (·) ωчист (=) mтехн (·) ((1 -) ωприм )
— либо используя пропорцию. При этом mтехн соответствует (100) %, а mчист — (x) %.
3. Определяют химическое количество чистого вещества по формуле:
n=mM.
4. Подчёркивают формулы интересующих веществ в уравнении реакции.
Под этими формулами записывают химические количества вступивших в реакцию и образовавшихся веществ (коэффициенты перед веществами в уравнении реакции). Над формулами веществ указывают известную величину (найденное по формуле химическое количество чистого вещества), а также неизвестную, которую обозначают за (x) — (химическое количество образующегося продукта реакции или вступившего в реакцию исходного вещества).
5. Составляют пропорцию и находят неизвестную величину.
6. Если необходимо, рассчитывают по формуле массу продукта реакции или массу вступившего в реакцию вещества:
m=n⋅M.
Обрати внимание!
Если необходимо найти объём газообразного вещества ( при н. у.) — используют формулу: V(вещ)=Vm⋅n(вещ); Vm=22,4 л/моль.
Вычисли массу негашёной извести
CaO
, которую получили при обжиге известняка массой (300) г, если массовая доля примесей в нём равна (0,08) ((8) %).
1. Запиши уравнение химической реакции:
2. Определи массовую долю чистого карбоната кальция в известняке и найди массу соли:
ωчист (=) (1) (-) ωприм (= 1 – 0,08 = 0,92).
(0,92) — массовая доля (в долях от единицы) карбоната кальция в известняке.
mчист (=) mтехн (·) ωчист (= 300 · 0,92 = 276) г.
(276) г — масса чистого карбоната кальция в известняке.
3. Определи химическое количество чистого вещества:
моль.
4. (2,76) моль (x) моль
(1) моль (1) моль
5. Составь пропорцию и найди неизвестную величину:
(2,76) моль — химическое количество образовавшейся негашёной извести.
6. Определи массу негашёной извести:
г.
Ответ: (m()CaO()) (=) (154,56) г.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса – Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса – Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль – единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) – число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль – международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов – вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается “ню”).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса – M
Молярная масса – масса одного моля вещества, выражается в “г/моль” (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы – массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl – 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково – 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика – лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем – объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как – VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. – константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор – Cl2.


Моль (количество вещества) – самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи – выполнена 🙂

Относительная плотность и газы – D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): “Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества”

Относительная плотность и водный раствор – ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении – так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам “как к числам”, то не запутаетесь.
В ходе ваших действий “грамм” и “грамм” должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 🙂
К примеру, даны масса раствора HCl – 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля – ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах – его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Как найти массу чистого вещества
Абсолютно чистых веществ не бывает, любое всегда содержит какое-то количество примесей. Это содержание может быть весьма большим, может быть очень малым, но примеси все равно есть. А можно ли найти массу чистого вещества?

Инструкция
Согласно принятым нормам, любая химическая продукция, выпущенная на государственных или частных предприятиях, должна иметь сертификат качества, в котором указано процентное содержание основного вещества и наиболее значимых примесей. Это определяется лабораторным путем с помощью методов качественного и количественного анализа. Сертификат прилагается к любой конкретной партии продукции, а его основные показатели должны быть отражены на каждой единице упаковки.
Например, хорошо известная поваренная соль — хлористый натрий. Покупая упаковку марки «Экстра» массой 1 килограмм, сколько чистой соли вы приобретаете? Посмотрите на информацию с упаковки. Если содержание основного вещества 99,7%, это очень хороший показатель, что неудивительно, поскольку «экстра» означает высокую степень очистки. Следовательно, чистого вещества в единице упаковки содержится: 1000*0,997=997 грамм. Остальные три грамма распределятся между различными примесями. Разумеется, в других, менее очищенных сортах поваренной соли, содержание чистого вещества будет ниже.
Или вот задача, которая наверняка заинтересует прекрасный пол. Предположим, имеется золотое кольцо 585-й пробы, массой 20 грамм. Сколько чистого золота оно содержит? Дать ответ на этот вопрос очень просто, достаточно лишь вспомнить, каков смысл понятия «проба». В России ее величина указывает, какова доля чистого благородного металла в 1000 весовых долей изделия. Следовательно, 585-я проба соответствует концентрации, равной 58,5%. Произведите вычисление в одно действие: 20*0,585=11,7 грамма. Именно столько чистого золота содержится в кольце.
А как быть, к примеру, если кольцо работы английского мастера, и весит те же 20 грамм, но на клейме вместо пробы указано что-то непонятное — «18К»? Как в таком случае найти количество чистого золота в изделии? И тут нет абсолютно ничего сложного. Дело в том, что в Великобритании принята «каратная» шкала чистоты благородных металлов. Наивысшей теоретически, 100% концентрации, соответствует 24 карата. Тогда изделие было бы промаркировано «24К». Раз стоит клеймо «18К», это значит, что в изделии 18 весовых частей золота, и 6 весовых частей примесей. Разделите: 18/24=0,75. Изделие соответствует вашей 750-й пробе. Произведите вычисление: 20*0,75=15 грамм. Вот сколько чистого золота содержится в этом кольце.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
3 апреля 2023 11:37
1030
Помогите! Пожалуйста!Как найти массу чистого вещества если известно масса и массовая доля раствора
Посмотреть ответы
Ответ:
Объяснение:
Если речь идет о растворе, то правильно говорить “найти массу растворенного вещества”. Для того чтобы найти массу растворенного вещества, необходимо знать формулу нахождения массовой доли растворенного вещества.
ω = m(р.в.)/m(p-pa) Эта формула показывает, что массовая доля прямо пропорциональна массе растворенного вещества и обратно пропорциональна массе раствора, или массовая доля – это отношение массы растворенного вещества к массе раствора. Из этой формулы находим массу растворенного вещества:
m(р.в.) = m(p-pa)*ω
Из формулы вытекает, что масса растворенного в-ва есть произведение массы раствора на его массовую долю.
Еще вопросы по категории Химия
№3. Доля (массовая или объемная) примесей – это безразмерная величина, которая показывает отношение массы (объема) примесей к общей массе (объему) смеси.
Чтобы найти массу (объем) чистого вещества, если известна массовая (объемная) доля примесей, необходимо:
1) из 100% вычесть массовую (объемную) долю примесей и найти массовую (объемную) долю чистого вещества;
2) по формуле рассчитать массу (объем) чистого вещества:
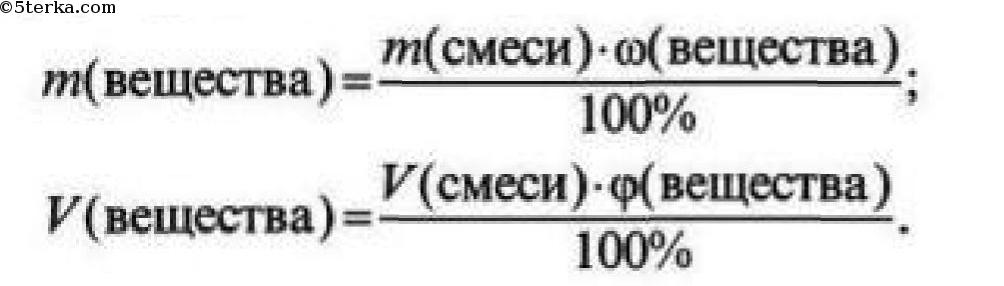
Источник:

Решебник
по
химии
за 11 класс (О.С. Габриелян, 2007 год),
задача №3
к главе «§12 Состав вещества. Смеси».
Все задачи
← 2 Что называют массовой (объемной) долей компонента смеси? Как ее рассчитывают?
4 Не производя расчета, укажите, в каком из оксидов, формулы которых Fe2O3 и Fe3O4, содержание железа выше. Ответ подтвердите расчетами. →
Комментарии
