A chiral centre is an atom that has four different groups bonded to it in such a manner that it has a nonsuperimposable mirror image.
The term “chiral centre” has been replaced by the term chirality centre.
In the molecule below, the carbon atom is a chirality centre.
It has four different groups attached, and the two structures are nonsuperimposable mirror images of each other.
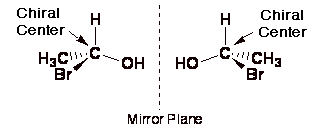
Molecules with a single chirality centre are chiral.
Molecules with more than one chirality centre are usually chiral. The exceptions are meso compounds.
For example, tartaric acid has two chirality centres, so you would expect it to have #2^2 = 4# stereoisomers.
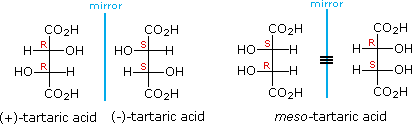
But there are only three isomers.
The (#S,R#) and (#R,S#) isomers are a single meso compound because they are superimposable on each other. They are achiral because they have an internal plane of symmetry.
The most common chirality centres in organic molecules are sp³ hybridized carbon atoms, because they can form four bonds.
Other types of chirality centre are
- quaternary N atoms

- tetravalent P atoms

Many nerve gases contain chiral P atoms.
- sulfoxides

In sulfoxides, the fourth group is a lone pair. Unlike in amines, the energy required to invert this stereocentre is high, so sulfoxides are optically stable.
Понятие
хиральности
– одно из
важнейших в современной стереохимии.Модель
является хиральной, если она не обладает
никакими элементами симметрии (плоскостью,
центром, зеркально-поворотными осями),
кроме простых осей вращения. Мы
называем молекулу, которая описывается
такой моделью, хиральной (что означает
«подобная руке», от греч.
хиро – рука)
по той причине, что, как и руки, молекулы
не совместимы со своими зеркальными
отображениями.На
рис. 1
приведен
ряд простых хиральных молекул. Совершенно
очевидны два факта: во-первых, пары
приведенных молекул представляют
зеркальные отражения друг друга,
во-вторых, эти зеркальные отражения
нельзя совместить друг с другом. Можно
заметить, что в каждом случае молекула
содержит углеродный атом с четырьмя
различными заместителями. Такие атомы
называют асимметрическими.
Асимметрический атом углерода является
хиральным или стереогенным центром.
Это наиболее распространенный тип
хиральности. Если молекула хиральна,
то она может существовать в двух
изомерных формах, связанных как предмет
и его зеркальное отражение и несовместимых
в пространстве. Такие изомеры (пара)
называются энантиомерами.
Термин
«хиральный» не допускает вольного
толкования. Когда хиральной является
молекула, то она, по аналогии с рукой,
должна быть либо левой, либо правой.
Когда же мы называем хиральным вещество
или некоторый его образец, то это просто
обозначает, что оно (он) состоит из
хиральных молекул; при этом вовсе не
обязательно, что все молекулы одинаковы
с точки зрения хиральности (левые или
правые,
R
или
S,
см.
раздел 1.3). Можно выделить два предельных
случая. В первом образец состоит из
одинаковых с точки зрения хиральности
молекул (гомохиральных, только R
или только S);
такой образец называют энантиомерно
чистым.
Во-втором (противоположном) случае
образец состоит из одинакового числа
разных с точки зрения хиральности
молекул (гетерохиральных, мольное
соотношение R:S=1:1);
такой образец тоже хиральный, но
рацемический.
Есть и промежуточный случай –
неэквимолярная смесь энантиомеров.
Такую смесь называют скалемической
или нерацемической. Таким образом,
утверждение, что макроскопический
образец (в отличие от индивидуальной
молекулы) хирален, следует считать не
вполне ясным и поэтому в некоторых
случаях недостаточным. Может потребоваться
дополнительное указание, является ли
образец рацемическим или нерацемическим.
Отсутствие точности в понимании этого
ведет к определенного рода заблуждениям,
например, в заголовках статей, когда
провозглашается синтез некоторого
хирального соединения, но остается
непонятным, желает ли автор просто
привлечь внимание к самому факту
хиральности обсуждаемой в статье
структуры, либо продукт действительно
был получен в виде единственного
энантиомера (т.е. ансамбля гомохиральных
молекул; этот ансамбль, впрочем, не стоит
называть гомохиральным образцом). Таким
образом, в случае хирального нерацемического
образца правильнее говорить «энантиомерно
обогащенный»
или «энантиомерно
чистый».
-
Способы
изображения оптических изомеров
Способ
изображения выбирается автором
исключительно из соображений удобства
передачи информации. На рисунке 1
изображения энантиомеров даны с помощью
перспективных картинок. При этом принято
связи, лежащие в плоскости изображения,
рисовать сплошной линией; связи, уходящие
за плоскость, – пунктиром; а связи,
направленные к наблюдателю, – жирной
линией. Такой способ изображения вполне
информативен для структур с одним
хиральным центром. Эти же молекулы можно
изобразить в виде проекции Фишера.
Данный способ был предложен Э.Фишером
для более сложных структур (в частности,
углеводов), имеющих два и более хиральных
центра.





















Зеркальная
плоскость
Рис.
1
Для
построения проекционных формул Фишера
тетраэдр поворачивают так, чтобы две
связи, лежащие в горизонтальной плоскости,
были направлены к наблюдателю, а две
связи, лежащие в вертикальной плоскости,
– от наблюдателя. На плоскость изображения
попадает только асимметрический атом.
При этом сам асимметрический атом, как
правило, опускают, сохраняя лишь
перекрещивающиеся линии и символы
заместителей. Чтобы помнить о
пространственном расположении
заместителей, часто сохраняют в
проекционных формулах прерывистую
вертикальную линию (верхний и нижний
заместитель удалены за плоскость
чертежа), однако часто этого не делают.
Ниже приведены примеры различных
способов изображения одной и той же
структуры с определенной конфигурацией
(рис. 2)

Проекция
Фишера

Рис.
2
Приведем
несколько примеров проекционных формул
Фишера (рис.3)

(+)-(L)-аланин
(-)-2-бутанол
(+)-(D)-глицериновый
альдегид
Рис.
3
Поскольку
на тетраэдр можно смотреть с разных
сторон, то каждый стереоизомер может
быть изображен двенадцатью (!) различными
проекционными формулами. Чтобы
стандартизировать проекционные формулы,
введены определенные правила их
написания. Так, главную (номенклатурную)
функцию, если она находится в конце
цепи, принято ставить наверху, главную
цепь изображать вертикально.
Для
того чтобы сопоставлять “нестандартно”
написанные проекционные формулы, надо
знать следующие правила преобразования
проекционных формул.
1.
Формулу нельзя выводить из плоскости
чертежа и нельзя поворачивать на 90о,
хотя можно вращать в плоскости чертежа
на 180о,
не меняя их стереохимического смысла
(рис. 4)

Рис.
4
2.
Две (или любое четное число) перестановки
заместителей у одного асимметрического
атома не меняют стереохимического
смысла формулы (рис.5)

Рис.
5
3.
Одна (или любое нечетное число) перестановка
заместителей у асимметрического центра
приводит к формуле оптического антипода
(рис.6)
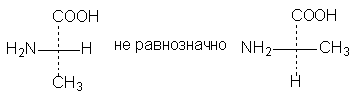
Рис.
6
4.
Поворот в плоскости чертежа на 900
превращает формулу в антиподную, если
только при этом одновременно не изменить
условие расположения заместителей
относительно плоскости чертежа, т.е.
считать, что теперь боковые заместители
находятся за плоскостью чертежа, а
верхний и нижний – перед ней. Если
пользоваться формулой с пунктиром, то
изменившаяся ориентация пунктира прямо
напомнит об этом (рис.7)

Рис.
7
5.
Вместо перестановок проекционные
формулы можно преобразовывать путем
вращения любых трех заместителей по
часовой стрелке или против нее (рис.8);
четвертый заместитель при этом положения
не меняет (такая операция эквивалентна
двум перестановкам):

Рис.
8
Проекции
Фишера нельзя применять к молекулам,
хиральность которых связана не с
хиральным центром, а с другими элементами
(осью, плоскостью). В этих случаях
необходимы трехмерные изображения.
-
D,L–
Номенклатура Фишера
Одну
проблему мы обсудили – как изобразить
трехмерную структуру на плоскости.
Выбор способа диктуется исключительно
удобством представления и восприятия
стреоинформации. Следующая проблема
связана с составлением названия для
каждого индивидуального стереоизомера.
В названии должна быть отражена информация
о конфигурации стереогенного центра.
Исторически первой номенклатурой для
оптических изомеров была D,L–
номенклатура, предложенная Фишером. До
1960–х годов боле привычным было обозначать
конфигурацию хиральных центров на
основании плоских проекций (Фишера), а
не на основании трехмерных 3D
– формул, при этом использовались
дескрипторы D
и L.
В настоящее время D,L
–система используется ограниченно –
главным образом для таких природных
соединений, как аминокислоты, оксикислоты
и углеводы. Примеры, иллюстрирующие ее
применение, показаны на рис.10.

Рис.
10
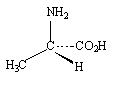
Для
α – аминокислот конфигурация обозначается
символом L,
если в проекционной формуле Фишера
амино –(или аммонийная) группа расположена
слева,; символ D
используется
для противоположного энантиомера. Для
сахаров обозначение конфигурации
основано на ориентации ОН – группы с
высшим номером (самой удаленной от
карбонильного конца). Если ОН – группа
направлена вправо, то это – конфигурация
D;
если ОН слева – конфигурация L.
Система
Фишера в свое время позволила создать
логичную и непротиворечивую стереохимическую
систематику большого числа природных
соединений, ведущих свое происхождение
от аминокислот и сахаров. Однако
ограничения Фишеровской системы, а
также тот факт, что в 1951 г. появился
рентгеноструктурный метод определения
истинного расположения групп вокруг
хирального центра, привели к созданию
в 1966 г. новой, более строгой и непротиворечивой
системы описания стереоизомеров,
известной под названием R,S
–
номенклатуры Кана—Ингольда—Прелога
(КИП). В системе КИП к обычному химическому
названию прибавляются специальные
дескрипторы R
или
S
(в тексте выделяются курсивом), строго
и однозначно определяющие абсолютную
конфигурацию.
-
Номенклатура
Кана—Ингольда—Прелога
Для
того,чтобы определить дескриптор R
или
S
для
данного хирального центра, используется
так называемое правило
хиральности. Рассмотрим
четыре заместителя, связанные с хиральным
центром. Их следует расположить в
единообразной последовательности
стереохимического старшинства; для
удобства
давайте обозначим эти заместители
символами А, В, D
и Е и условимся считать, что в общей
последовательности старшинства (иначе
говоря, по приоритету) А старше В, В
старше D,
D
старше E(A>B>D>E).
Правило хиральности КИП требует, чтобы
модель рассматривалась со стороны,
противоположной той, которую занимает
заместитель Е с низшим приоритетом или
стереохимически младший заместитель
(рис.11).
Тогда остальные три заместителя образуют
нечто вроде треножника, ножки которого
направлены на зрителя.
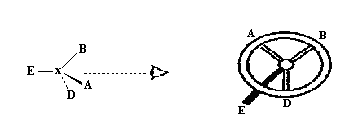
Рис.
11
Если
падение старшинства заместителей в
ряду A>B>D
осуществляется по часовой стрелке (как
на рис
11
), то центру присваивается конфигурационный
дескриптор R
(от
латинского
слова rectus
—
правый). При другом расположении, когда
стереохимическое старшинство заместителей
падает против часовой стрелки, центру
присваивается конфигурационный
дескриптор
S
(от
латинского sinister
— левый).
При
изображении соединений с помощью
Фишеровских проекций можно легко
определить конфигурацию без построения
пространственных моделей. Формулу надо
записать так, чтобы младший заместитель
находился внизу или вверху, так как по
правилам представления проекций Фишера
вертикальные связи направлены от
наблюдателя (рис.12). Если при этом
остальные заместители в порядке
уменьшения старшинства располагаются
по часовой стрелке, соединение относят
к (R)-ряду,
а если против часовой стрелки, то к
(S)-ряду,
например:

Рис.
12
Если
младшая группа не находится на вертикальных
связях, то следует поменять ее местами
с нижней группой, но следует помнить,
что при этом происходит обращение
конфигурации. Можно сделать две любые
перестановки – при этом конфигурация
не изменится.
Таким
образом, определяющим является
стереохимическое
старшинство.
Обсудим теперь правила
последовательности старшинства,
т.е. правила, по которым группы А,В,D
и Е располагают в порядке приоритета.
-
Предпочтение
по старшинству отдается атомам с большим
атомным
номером.
Если номера одинаковы (в случае изотопов),
то более старшим становится атом с
наибольшей атомной массой (например,
D>Н).
Самый младший «заместитель» – неподеленная
электронная пара (например, у азота).
Таким образом, старшинство возрастает
в
ряду:
неподеленная
пара <H<D<T<Li<B<C<N<O<F
<Si<P<S<Cl<Br<I
Рассмотрим
простой пример: в бромхлорфторметане
CHBrCIF
(рис.13)
имеется один стереогенный центр, и два
энантиомера можно различить следующим
образом. Сначала ранжируют заместители
по их стереохимическому старшинству:
чем больше атомный номер, тем старше
заместитель. Поэтому в данном примере
Br
> С1 > F
> Н, где «>» обозначает «более
предпочтителен» (или «старше»). Следующий
шаг — рассмотреть молекулу со стороны,
противоположной самому младшему
заместителю, в данном случае водороду.
Видно, что три остальных заместителя
расположены в углах треугольника и
направлены к наблюдателю. Если старшинство
в этой тройке заместителей уменьшается
по часовой стрелке, то этот энантиомер
обозначают как R.
При другом расположении, когда старшинство
заместителей падает против часовой
стрелки, энантиомер обозначают как S.
Обозначения
R
и
S
пишут
курсивом и
помещают
в скобках перед названием структуры.
Таким образом, два рассмотренных
энантиомера имеют названия
(S)-бромхлорфторметан
и (R)-бромхлорфторметан.
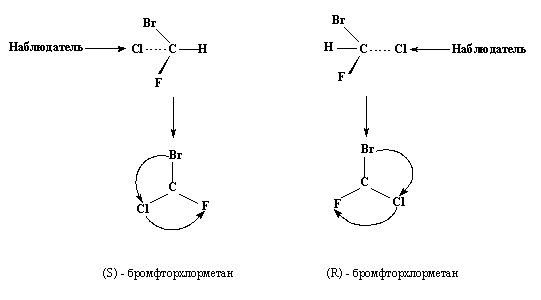
Рис.
13
2.
Если с асимметрическим атомом
непосредственно связаны два, три или
все четыре одинаковых атома, старшинство
устанавливается по атомам второго
пояса, которые связаны уже не с хиральным
центром, а с теми атомами, которые имели
одинаковое старшинство.

Рис.
14
Например,
в молекуле 2-бром-3-метил-1-бутанола
(рис.14)
по первому
поясу легко определяется самый старший
и самый младший заместители – это бром
и водород соответственно. Но по первому
атому групп СН2ОН
и СН(СН3)2
установить старшинство не удается, так
как в обоих случаях это атом углерода.
Для того чтобы определить, какая из
групп старше, снова применяют правило
последовательности, но теперь рассматривают
атомы следующего пояса. Сравнивают два
набора атомов (две тройки), записанных
в порядке падения старшинства. Старшинство
теперь определяют по первой точке, где
обнаруживается различие. Группа СН2ОН
– кислород, водород, водород С(ОНН)
или в цифрах 6(811).
Группа СН(СН3)2
– углерод, углерод, водород С(ССН)
или 6(661).
Первая точка различия подчеркнута:
кислород старше углерода (по атомному
номеру), поэтому группа СН2ОН
старше СН(СН3)2.
Теперь можно обозначить конфигурацию
энантиомера, изображенного на рисунке
14 как (R).
Если
и такая процедура не привела к построению
однозначной иерархии, ее продолжают на
все более возрастающих расстояниях
от центрального атома, пока, наконец,
не встретятся различия,
и все четыре заместителя получат свое
старшинство. При этом любое
предпочтение, приобретаемое тем или
иным заместителем на одной из стадий
согласования старшинства, считается
окончательным и на последующих стадиях
переоценке не подлежит.
3.
Если в молекуле встречаются точки
разветвления, процедуру установления
старшинства атомов следует продолжать
вдоль молекулярной цепи наибольшего
старшинства. Предположим, следует
определить последовательность старшинства
двух заместителей, изображенных на
рис.15. Очевидно, что решение не будет
достигнуто ни в первом (С), ни во втором
(С,С,Н) ни в третьем (С,Н,F,С,Н,Br) слоях. В
этом случае придется переходить в
четвертый слой, но сделать это следует
по пути, преимущество которого установлено
в третьем слое (Br >F).
Следовательно, решение о приоритете
заместителя В
над заместителем А
делается на основании того, что в
четвертом слое Br
>CI
для той ветви, переход на которую
диктуется старшинством в третьем слое,
а не на основании того, что наибольшим
атомным номером в четвертом слое обладает
атом I (который находится на менее
предпочтительной и поэтому не исследуемой
ветви).

Рис.
15
4.
Кратные связи представляются как сумма
соответствующих простых связей. В
соответствии с этим правилом каждому
атому, связанному кратной связью,
ставится в соответствие дополнительный
«фантомный» атом (или атомы) того же
сорта, расположенный на другом конце
кратной связи. Комплементарные
(дополнительные или фантомные) атомы
заключаются в скобки, и считается, что
они не несут никаких заместителей в
следующем слое.
В
качестве примера рассмотрим
представления следующих групп (рис.16).
Группа
Представление

Рис.
16
5.
Искусственное увеличение числа
заместителей требуется и тогда, когда
заместитель (лиганд) является бидентатным
(или три-, или тетрадентатным),а также
когда заместитель содержит циклический
или бициклический фрагмент. В таких
случаях каждая ветвь циклической
структуры рассекается после точки
ветвления [где она раздваивается сама
по себе], и атом, являющий точкой ветвления,
помещается (в скобках) в конце цепи,
возникшей в результате рассечения. На
рис.17
на примере производного тетрагидрофурана
(ТГФ) рассмотрен случай бидентатного
(циклического) заместителя. Две ветви
пятичленного кольца (по отдельности)
рассекаются по связям с хиральным
атомом, который после этого добавляется
к концу каждой из двух вновь образованных
цепей. Видно, что в результате рассечения
А
получается гипотетический заместитель
–СН2ОСН2СН2-(С),
который оказывается старше, чем реальный
ациклический заместитель -СН2ОСН2СН3
по причине преимущества фантомного (С)
на конце первого заместителя. Напротив,
образованный в результате рассечения
В
гипотетический лиганд –СН2СН2ОСН2–(С)
по старшинству оказывается ниже реального
заместителя –СН2СН2ОСН2СН3,
поскольку у последнего к концевому
углероду присоединены три атома водорода,
а у первого в этом слое нет ни одного.
Следовательно, с учетом установленного
порядка старшинства заместителей,
конфигурационным символом для данного
энантиомера оказывается S.
Определяют
старшинство
Заместитель
А
В>A
Заместитель
А

Рис.17

Рис.
18
Сходный
случай рассечения циклического
заместителя поясняется на примере
соединения на рис. 18 , где структура В
иллюстрирует трактовку циклогексильного
кольца (в структуре А).
В этом случае правильной последовательностью
старшинства является ди-н-гесилметил
> циклогексил > ди-н-пентилметил
> Н.
Теперь
мы достаточно подготовлены, чтобы
рассмотреть такой заместитель, как
фенил (рис.19
структура А).
Схему раскрытия каждой кратной связи
мы обсудили выше. Поскольку (в любой
структуре Кекуле) каждый из шести атомов
углерода связан двойной связью с другим
атомом углерода, то (в системе КИП) каждый
углеродный атом кольца несет в качестве
«заместителя» дополнительный углерод.
Дополненное таким образом кольцо
(рис.19, структура В)
затем раскрывается по правилам для
циклических систем. В результате
рассечение описывается схемой,
изображенной на рис.19, структура С.

Рис.
19
6.
Теперь мы рассмотрим хиральные соединения,
в которых различия между заместителями
носят не материальный или конституционный
характер, а сводятся к различиям в
конфигурации. Соединения, содержащие
более одного хирального центра, будут
рассмотрены ниже (см.
раздел 1.4)
Здесь же мы коснемся заместителей,
которые отличаются цис–
транс –
изомерией (олефинового типа). Согласно
Прелогу и Хельмхену, олефиновый лиганд,
в котором старший заместитель, расположен
по ту же
сторону от
двойной связи олефина, что и хиральный
центр, обладает преимуществом над
лигандом, в котором старший заместитель
оказывается в
транс–положении
к хиральному центру. Это положение не
имеет отношения ни к классической
цис–транс-,
ни к E–Z–номенклатуре
для конфигурации двойной связи. Примеры
изображены на рис.20.

Рис.
20
-
С
оединения с несколькими хиральными
центрами
Если
в молекуле имеются два хиральных центра,
то, поскольку каждый
центр может иметь (R)-
или
(S)-конфигурацию,
возможно существование четырех изомеров
— RR,
SS,
RS
и SR:

Рис.
21
Поскольку
молекула имеет только одно зеркальное
отображение, энантиомером соединения
(RR)
может быть только изомер (SS).
Аналогично
другую пару энантиомеров образуют
изомеры (RS)
и (SR).
Если меняется
конфигурация лишь одного асимметрического
центра, то такие изомеры называются
диастереомерами.
Диастереомеры
— это стереоизомеры, не являющиеся
энантиомерами. Так, диастереомерны пары
(RR)/(RS),
(RR)/(SR),
(SS)/(RS)
и (SS)/(SR).
Хотя в общем случае при сочетании двух
хиральных центров образуются четыре
изомера, сочетание центров одинакового
химического строения дает лишь три
изомера: (RR)
и (SS),
являющиеся
энантиомерами, и (RS),
находящийся
в диастереомерном отношении к обоим
энантиомерам (RR)
и (SS).
Типичным
примером является винная кислота
(рис.22), которая имеет только три изомера:
пару энантиомеров и мезо-форму.

Рис.
22
мезо-Винная
кислота
является (R,S)-изомером,
который оптически неактивен, поскольку
объединение двух зеркально-симметричных
фрагментов приводит к появлению
плоскости симметрии (а). мезо-Винная
кислота
представляет собой пример ахирального
соединения мезо-конфигурации, которое
построено из равного числа одинаковых
по структуре, но разных по абсолютной
конфигурации хиральных элементов.
Если
в молекуле имеется п
хиральных
центров, максимальное число
стереоизомеров можно рассчитать по
формуле 2n
; правда, иногда число изомеров будет
меньше благодаря наличию мезо-форм.
Для
наименований стереоизомеров молекул,
содержащих два асимметрических атома
углерода, два заместителя при каждом
из которых одинаковы, а третьи отличаются,
часто используют префиксы эритро-
и трео–
от названий сахаров эритрозы и треозы.
Эти префиксы характеризуют систему в
целом, а не каждый хиральный центр в
отдельности. При изображении таких
соединений с помощью проекций Фишера
в паре эритро-
изомеров
одинаковые группы располагаются с одной
стороны, и если бы разные группы (С1 и Вг
в приведенном ниже примере)
были одинаковы, получилась бы мезо-форма.
В паре трео-изомеров
одинаковые группы располагаются с
разных сторон, и если бы разные группы
были одинаковы, новая пара осталась бы
энантиомерной парой.

Рис.
23
Все
рассмотренные
выше
примеры
соединений
имеют центр хиральности. Таким центром
является асимметрический атом углерода.
Однако, центром хиральности могут быть
и другие атомы (кремния, фосфора, серы),
как, например, в метилнафтилфенилсилане,
о-анизилметилфенилфосфине,
метил-п-толилсульфоксиде (рис. 24)

Рис.
24
-
Хиральность
молекул, лишенных хиральных центров
Н
еобходимым и достаточным условием
хиральности молекулы является ее
несовместимость со своим зеркальным
изображением. Наличие единственного
(конфигурационно устойчивого) хирального
центра в молекуле является достаточным,
но вовсе не необходимым условием
существования хиральности. Рассмотрим
хиральные молекулы, лишенные хиральных
центров. Некоторые примеры приведены
нарисунках 25
и 26.

Рис.
25

Рис.
26
Это
соединения с осями хиральности (аксиальный
тип хиральности):
аллены; алкилиденциклоалканы; спираны;
так называемые атропоизомеры (бифенилы
и похожие соединения, хиральность
которых возникает благодаря затрудненному
вращению вокруг простой связи). Другой
элемент хиральности – плоскость
хиральности (планарный
тип хиральности).
Примерами таких соединений являются
анса-соединения (в которых алициклическое
кольцо слишком мало, чтобы ароматическое
кольцо могло через него провернуться);
парациклофаны; металлоцены. Наконец
хиральность молекулы может быть связана
со спиральной организацией молекулярной
структуры. Молекула может заворачиваться
либо в левую, либо в правую спираль. В
этом случае говорят о спиральности
(спиральный тип хиральности).
Для
того чтобы определить конфигурацию
молекулы, обладающей осью
хиральности,
необходимо ввести дополнительный пункт
в правило последовательности: ближайшие
к наблюдателю группы считаются старше
удаленных от наблюдателя групп. Это
дополнение необходимо сделать, так как
для молекул с аксиальной хиральностью
допустимо наличие одинаковых заместителей
на противоположных концах оси. Применение
этого правила к молекулам, изображенным
на рис.
25, показано
на рис.
27.

Рис.
27
Во
всех случаях молекулы рассматриваются
вдоль хиральной оси слева. При этом
следует понимать, что если молекулы
рассматриваются справа, то конфигурационный
дескриптор останется тем же. Таким
образом, пространственное расположение
четырех опорных групп соответствует
вершинам виртуального тетраэдра и может
быть представлено с помощью соответствующих
проекций (рис.27).
Для определения соответствующего
дескриптора пользуемся стандартными
правилами R,S-номенклатуры.
В случае бифенилов важно заметить, что
заместители в кольце рассматриваются,
начиная от центра (через который проходит
ось хиральности) к перифирии, в нарушении
стандартных правил последовательности.
Так, для бифенила на рис. 25
правильная последовательность
заместителей в правом кольце С-ОСН3
>С-Н; атом хлора слишком удален, чтобы
принимать его во внимание. Опорные атомы
(те, по которым определяют конфигурационный
символ) оказываются теми же самыми, если
молекулу рассматривать справа. Иногда,
чтобы отличить аксиальную хиральность
от других типов, используют дескрипторы
aR
и aS
(или
Ra
и Sa),
однако использование префикса «a»
не носит обязательного характера.
Альтернативно,
молекулы с осями хиральности можно
рассматривать как спиральные, и их
конфигурацию можно обозначать символами
Р и
М.
При этом для определения конфигурации
рассматриваются только заместители с
высшим приоритетом как в передней, так
и задней (удаленной от наблюдателя)
части структуры (заместители 1 и 3 на
рис.27). Если переход от переднего
заместителя 1 с высшим приоритетом к
приоритетному заднему заместителю 3
осуществляется по часовой стрелке, то
это конфигурация Р;
если против часовой стрелки, – это
конфигурация М.
На
рис. 26 показаны молекулы с плоскостями
хиральности.
Дать определение плоскости хиральности
не так легко, и оно не столь однозначно,
как определение центра и оси хиральности.
Это плоскость, которая содержит как
можно больше атомов молекулы, но при
этом не все. Фактически хиральность
потому (и только потому), что по крайней
мере один заместитель (чаще больше) не
лежит в плоскости хиральности. Так,
хиральной плоскостью анса-соединения
А является
плоскость бензольного кольца. В
парациклофане В
в качестве хиральной плоскости
рассматривается наиболее замещенное
(нижнее) кольцо. Для того чтобы определить
дескриптор для планарно-хиральных
молекул, на плоскость смотрят со стороны
ближайшего к плоскости, но не лежащего
в этой плоскости атома (если имеется
два или более кандидата, то выбирается
тот, который находится ближе к атому с
высшим приоритетом согласно правилам
последовательности). Этот атом, иногда
называемый пробным или пилотным атомом,
на рис.26 отмечен стрелкой. Тогда, если
три последовательных атома (a,
b,
c)
c
наивысшим приоритетом образуют в
хиральной плоскости ломаную линию,
изгибающуюся по часовой стрелке, то
конфигурация соединения pR
(или Rp),
а если ломаная линия изгибается против
часовой стрелки, то дескриптор конфигурации
pS
(или Sp).
Планарная хиральность, подобно аксиальной
хиральности, может альтернативно
рассматриваться как разновидность
хиральности. Для того чтобы определить
направление (конфигурацию) спирали,
нужно рассматривать пилотный атом
вместе с атомами a,b
и c,
как они определены выше. Отсюда видно,
что pR-соединениям
соответствует Р-,
а pS–соединениям
– М–спиральность.
Как определить хиральный центр?
Профи
(690),
закрыт
11 лет назад
NiNa Martushova
Искусственный Интеллект
(153334)
11 лет назад
Надо найти в молекуле асимметрический, или хиральный атом – атом углерода в органическом соединении, к которому присоединены четыре различных атома или группы.
Молекула, содержащая один или несколько асимметирических атомов углерода обычно является асмметрической (хиральной) . Такую молекулу никакими вращениями в пространстве нельзя совместить с ее зеркальным отражением.
Александр Крючков
Ученик
(151)
11 лет назад
Обычно лучший метод определения конфигурации хирального центра заключается в том, чтобы представить себе тетраэдрическую модель и выбрать такое направление взгляда, чтобы ваш мысленный взор проходил через тетраэдр в направлении младшего заместителя. Поскольку иногда это оказывается трудным умственным упражнением, а также поскольку во многих учебниках широко используются проекционные формулы Фишера – стоит научиться обращению с ними.
У этого термина существуют и другие значения, см. Хиральность.

Хиральность (др.-греч. χείρ — рука) — свойство молекулы не совмещаться в пространстве со своим зеркальным отражением[1]. Термин основан на древнегреческом названии наиболее узнаваемого хирального предмета — руки. Так, левая и правая руки являются зеркальными отражениями, но не могут быть совмещены друг с другом в пространстве. Подобным образом, свойством хиральности обладают молекулы, в которых отсутствуют зеркально-поворотные оси симметрии Sn, что эквивалентно наличию в молекуле элементов хиральности (центра, оси, плоскости хиральности и др.). Такие зеркально-симметричные формы химических соединений называются энантиомерами.
История[править | править код]

Энантиоморфные кристаллы правовращающего и левовращающего тартратов
Хиральность молекул была открыта Л. Пастером в 1848 году. Пастер обратил внимание на то, что кристаллы, выпадающие из раствора рацемического тартрата натрия-аммония, имеют две формы, представляющие собой зеркальные отражения, которые не совмещаются друг с другом в пространстве. Напротив, кристаллы индивидуального правовращающего тартрата натрия-аммония имели одинаковую форму с малыми плоскостями, направленными в одну сторону. Пастер провёл подобные кристаллизации с тринадцатью энантиомерно чистыми соединениями (различными тартратами и винной кислотой), а также с шестью рацемическими тартратами и сделал вывод о существовании хиральности молекул и объяснил ранее неизвестный вид изомерии винных кислот — энантиомерию[2].
Структурная трактовка хиральности стала возможной после введения в 1874 году Я. Вант-Гоффом и Ж. Ле Белем концепции асимметрического атома углерода, то есть тетраэдрического атома углерода с четырьмя различными заместителями[2].
Понятие хиральности было введено лордом Кельвином в конце XIX в.[3][4]
Я называю какую-либо геометрическую фигуру, или группу точек, хиральной и говорю, что она обладает хиральностью, если её изображение в идеальном плоском зеркале не может быть с ней совмещено.
I call any geometrical figure, or group of points, chiral, and say it has chirality, if its image in a plane mirror, ideally realized, cannot be brought to coincide with itself.
— У. Т. Кельвин. Балтиморские лекции по молекулярной динамике и волновой теории света, 1904
Позже В. Мейер распространил понятие о хиральности на соединения азота, а У. Дж. Поуп — на атомы серы, селена и олова. Хиральность комплексных соединений металлов была изучена А. Вернером![]() [5] .
[5] .
Симметрия хиральных молекул[править | править код]
Поскольку хиральность является геометрической характеристикой, её можно определить путём отнесения молекулы к той или иной группе симметрии. Очевидно, не являются хиральными молекулы с центром инверсии (i) или плоскостью симметрии (s), поскольку эти молекулы состоят из двух одинаковых частей, которые при отражении превращаются друг в друга, и отражение является эквивалентным исходной молекуле. Ранее геометрический критерий хиральности формулировали так: «у хиральной молекулы не должно быть плоскости симметрии и центра инверсии». В настоящее время пользуются более точным критерием, который предполагает отсутствие у хиральной молекулы также зеркально-поворотных осей Sn[1][6].
Виды хиральности[править | править код]

Примеры молекул, обладающих (а) центральной хиральностью; (б) аксиальной хиральностью; (в) планарной хиральностью; (г) спиральной хиральностью; (д) топологической хиральностью
В зависимости от элемента молекулы, наличие которого приводит к возникновению хиральности, различают следующие виды хиральности:
- центральная (центр хиральности)
- аксиальная (ось хиральности)
- планарная (плоскость хиральности)
- спиральная (спираль)
- топологическая.[6][7]
Центральная хиральность[править | править код]
Центральная хиральность возникает в результате наличия в молекуле центра хиральности (хирального центра), которым, как правило, является асимметрический атом углерода, имеющий 4 различных заместителя. Хиральными центрами могут быть также атомы Si, P, S, реже — N[8]. В хиральных производных адамантана центр хиральности находится в середине углеродного каркаса, где атомов нет вовсе[6].
Аксиальная (осевая) хиральность[править | править код]
Аксиальная хиральность возникает в результате неплоского расположения заместителей относительно некоторой оси — оси хиральности[9]. Ось хиральности существует в несимметрично замещённых алленах. sp-гибридный атом углерода в аллене имеет две взаимно перпендикулярные p-орбитали. Их перекрывание с p-орбиталями соседних атомов углерода приводит к тому, что заместители в аллене лежат во взаимно перпендикулярных плоскостях. Подобная ситуация наблюдается также в замещённых бифенилах, в которых вращение вокруг связи, соединяющей ароматические кольца, затруднено, а также в спироциклических соединениях.
Планарная хиральность[править | править код]
Плоскость хиральности присутствует в производных ферроцена, замещённых парациклофанах и др. При помощи данного термина описывают хиральное расположение внеплоскостных элементов молекулы относительно плоскости хиральности[10].
Спиральная хиральность[править | править код]
Спиральная хиральность характерна для соединений, имеющих элементы в форме спирали, пропеллера или винта, например для гелиценов[11]. Шесть ароматических колец в гексагелицене не могут уложиться в одной плоскости, поэтому образовывают спираль, которая может быть закручена влево или вправо. Данный вид хиральности наблюдается также в белках и нуклеиновых кислотах.
Топологическая хиральность[править | править код]
Топологическая хиральность связана с наличием структурной несимметричности, характерной для супрамолекул, например, катенанов, ротаксанов, молекулярных узлов[6].
Хиральность соединений со стереогенной парой электронов[править | править код]
В аминах, фосфинах, ионах сульфония, оксония, сульфоксидах хиральность может возникать из-за пространственного окружения атомов азота, фосфора, серы и кислорода. Несмотря на то, что в данных соединениях все они имеют только три заместителя, четвёртое координационное место занимает неподелённая пара электронов и происходит возникновение центра хиральности.
Хиральные амины отличаются от хиральных соединений кислорода, фосфора и серы, поскольку энантиомеры аминов, возникающие из-за стереогенного атома азота, редко могут быть разделены, так как они легко превращаются друг в друга за счёт инверсии атома азота (рассчитанная энергия активации EA для триметиламина составляет около 30 ккал/моль). В то же время соответствующие фосфины подвергаются инверсии весьма медленно (рассчитанная энергия активации EA для триметилфосфина составляет около 190 ккал/моль)[12]. Исключением из данной особенности являются амины, в которых инверсия азота невозможна, поскольку его конфигурация пространственно закреплена, как, например, в основании Трёгера[en].

Хиральность в неорганической химии[править | править код]
Многие комплексные соединения обладают хиральностью. Классическими в данной области являются работы А. Вернера, синтезировавшего более 40 оптически активных координационных соединений. Например, октаэдрический комплекс рутения с бипиридином [Ru(bipy)3]2+ является хиральным, поскольку три бипиридиновых лиганда в нём занимают хиральное расположение в форме пропеллера.

Связь с оптической активностью[править | править код]
Хиральные соединения и их растворы обладают способностью вращать плоскость поляризации плоскополяризованного света, что можно наблюдать при помощи поляриметра. По этой причине хиральные вещества также называют оптически активными, или оптически деятельными.
Световую волну, проходящую через раствор оптически активного вещества, можно представить в виде правой и левой циркулярно поляризованных составляющих, которые в хиральной среде распространяются с различными фазовыми скоростями, за счёт чего и возникает вращение плоскости поляризации света[13].
Хиральность в биологии[править | править код]
Многие биологически активные молекулы обладают хиральностью, причём природные аминокислоты и сахара представлены в природе преимущественно в виде одного из энантиомеров: аминокислоты, в основном, имеют l-конфигурацию, а сахара — d-конфигурацию[14].
Две энантиомерные формы одной молекулы обычно имеют различную биологическую активность. Это связано с тем, что рецепторы, ферменты, антитела и другие элементы организма также обладают хиральностью, и структурное несоответствие между этими элементами и хиральными молекулами препятствует их взаимодействию. Например, ферменты, являющиеся хиральными молекулами, часто проявляют специфическую реакционную способность по отношению к одному из энантиомеров. Подобные примеры характерны и для лекарственных соединений. Так, биологической активностью обладает лишь один энантиомер ибупрофена — (S)-(+)-ибупрофен, в то время как его оптический антипод (R)-(−)-ибупрофен в организме неактивен[15].
Гомохиральность[править | править код]
За редкими исключениями, природные хиральные аминокислоты и моносахариды представлены в виде единственного изомера из двух возможных. Так, в состав белков входят практически исключительно l-аминокислоты, а ДНК и РНК построены только на основе d-углеводов. Данное свойство химических соединений называется гомохиральностью (хиральной чистотой). Происхождение и назначение данного явления до конца не установлены, однако его часто связывают с проблемой происхождения жизни[16].
См. также[править | править код]
- Оптическая активность
- Стереоизомеры
- Стереоселективный синтез
Примечания[править | править код]
- ↑ 1 2 IUPAC Gold Book – chirality. Дата обращения: 24 февраля 2013. Архивировано 26 февраля 2013 года.
- ↑ 1 2 Flack H. D. Louis Pasteur’s discovery of molecular chirality and spontaneous resolution in 1848, together with a complete review of his crystallographic and chemical work (англ.) // Acta Cryst. Sect. A. — 2009. — Vol. A65. — P. 371–389. — doi:10.1107/S0108767309024088. Архивировано 6 сентября 2012 года.
- ↑ Kelvin W. T. Baltimore lectures on molecular dynamics and the wave theory of light (1904). — London: C. J. Clay and sons, 1904.
- ↑ Cintas P. Tracing the Origins and Evolution of Chirality and Handedness in Chemical Language (англ.) // Angew. Chem. Int. Ed. — 2007. — Vol. 46, no. 22. — P. 4016–4024. — doi:10.1002/anie.200603714.
- ↑ Азимов А. Краткая история химии = A Short History of Chemistry / Пер. с англ. З. Е. Гельмана, под ред. А. Н. Шамина. — М.: Мир, 1983. — С. 88—89.
- ↑ 1 2 3 4 Бутин К. П. Теоретическая стереохимия. Дата обращения: 23 февраля 2013.
- ↑ Потапов В. М. Стереохимия. — М.: Химия, 1988. — С. 18-20. — ISBN 5-7245-0376-X.
- ↑ IUPAC Gold Book – chirality centre. Дата обращения: 24 февраля 2013. Архивировано 26 февраля 2013 года.
- ↑ IUPAC Gold Book – axial chirality. Дата обращения: 24 февраля 2013. Архивировано из оригинала 23 декабря 2010 года.
- ↑ IUPAC Gold Book – planar chirality. Дата обращения: 24 февраля 2013. Архивировано 26 февраля 2013 года.
- ↑ IUPAC Gold Book – helicity. Дата обращения: 24 февраля 2013. Архивировано 26 февраля 2013 года.
- ↑ Kölmel С., Oehsenfeld C., Ahlrichs R. An ab initio investigation of structure and inversion barrier of triisopropylamine and related amines and phosphines (англ.) // Theor. Chim. Acta. — 1991. — Vol. 82, no. 3-4. — P. 271-284. — ISSN 1432-2234. — doi:10.1007/BF01113258.
- ↑ Трофимова Т. И. Курс физики. — М.: Высшая школа, 1990. — С. 315. — 478 с. — ISBN 5-06-001540-8.
- ↑ Овчинников Ю. А. Биоорганическая химия. — М.: Просвещение, 1987. — С. 27.
- ↑ Tracy T. S., Hall S. D. Metabolic inversion of (R)-ibuprofen. Epimerization and hydrolysis of ibuprofenyl-coenzyme A (англ.) // Drug Metab. Dispos. — 1992. — Vol. 20, no. 2. — P. 322-327. — PMID 1352228.
- ↑ Bonner W. A. Origins of Chiral Homogeneity in Nature (англ.) // Topics in Stereochemistry. — 2007. — Vol. 18. — P. 1-96. — doi:10.1002/9780470147276.ch1.
Литература[править | править код]

Содержание
- Что такое киральный углерод
- Как определить хиральный углерод
- Почему важно определить хиральный углерод
Изомерия является одной из основных областей в органической химии, которая имеет широкий набор молекул, перечисленных под ним. Два типа изомерии – структурная изомерия и стереоизомерия. Концепция хиральности подпадает под стереоизомеризм, В отличие от структурной изомерии, стереоизомерия включает молекулы, имеющие одинаковое строение атомов, но различные пространственные расположения. хиральности является свойством молекулы, которая говорит, что ее зеркальное отображение не накладывается на молекулу. Хиральность определенной молекулы определяется хиральными центрами, присутствующими в этой молекуле. В органической химии хиральные центры называют хиральными углеродами.
Ключевые области покрыты
1. Что такое киральный углерод
– Определение, характеристики
2. Как определить хиральный углерод
– Методы идентификации хиральных углеродов в алифатической структуре и кольцевой структуре
3. Почему важно определить хиральный углерод
Ключевые слова: алифатическая структура, хиральность, хиральный углерод, хиральный центр, кольцевая структура, стереоизомерия

Что такое киральный углерод
Хиральный углерод представляет собой асимметричный углерод. Атом углерода может иметь максимум четыре связи. Хиральный углерод связан с четырьмя различными группами. Поэтому он асимметричный. Атом углерода всегда должен быть sp3 гибридизуется, чтобы стать хиральным углеродом. Обычно хиральная молекула содержит по меньшей мере один хиральный углерод.Гибридизированные атомы углерода sp или sp2 не могут быть хиральными, поскольку они не могут иметь вокруг себя четыре различные группы из-за наличия π-связей.
Молекулы, имеющие более одного хирального атома углерода, имеют два стереоизомера на один хиральный атом углерода. Следовательно, молекулы такого типа могут иметь более двух стереоизомеров. Например, молекула, имеющая два хиральных углерода, по существу имеет четыре стереоизомера, по два на каждый хиральный углерод.
Как определить хиральный углерод
Как определить хиральный углерод в алифатических структурах
Хиральный углерод, присутствующий в молекуле, может быть идентифицирован в два этапа следующим образом.
Шаг 1
Определите геометрию молекулы, взяв атом, который считается хиральным углеродом в центре.
– Если геометрия вокруг атома углерода является тетраэдрической, то это может быть хиральный углерод. Если геометрия не тетраэдрическая, то она ахиральная.
Шаг 2
Определите, отличаются ли четыре группы, связанные с этим атомом углерода, друг от друга.
– Если атом углерода с тетраэдрическим расположением присоединен к четырем различным группам, это хиральный углерод.

Рисунок 1: Хиральная молекула и ее зеркальное отображение
В приведенном выше примере молекула имеет тетраэдрическую геометрию, и центральный атом углерода присоединен к четырем различным атомам. Следовательно, этот углерод является хиральным углеродом.
Как определить хиральный углерод в кольцевых структурах
Для кольцевой структуры с замещениями хиральность атома углерода может быть определена следующим образом. Рассмотрим следующий пример.

Рисунок 2: Метилциклогексан
Шаг 1
Сначала определите, отличаются ли группы, присоединенные к атому углерода, друг от друга. Если они разные, мы можем догадаться, что это как хиральный углерод. На изображении выше молекула имеет атом водорода и метильную группу, присоединенную к одному и тому же атому углерода. Но две другие группы сформировали кольцо.
Шаг 2
Преобразуйте две группы в кольце в гипотетические группы, не входящие в кольцо. Самый простой способ сделать это – разорвать связь между атомом, который, как предполагается, является хиральным углеродом, и соседним атомом углерода с левой стороны и представить его как лиганд. Затем разорвите соседнюю связь с правой стороны и представьте ее как другой лиганд.
Шаг 3
Теперь мы можем определить, является ли предполагаемый хиральный атом углерода хиральным или ахиральным. При рассмотрении вышеуказанной молекулы оба гипотетических лиганда идентичны, поскольку в кольцевой структуре нет других замен. Следовательно, предполагаемый атом углерода является ахиральным.
Почему важно определить хиральный углерод
Идентификация хирального углерода объясняет, является ли молекула хиральной или ахиральной. Определение количества хиральных атомов углерода, присутствующих в молекуле, является ключом для определения количества стереоизомеров, которые она может иметь. Эти стереоизомеры не наложены друг на друга с молекулой. Следовательно, он дает информацию о различных молекулах, имеющих одинаковое строение.
Резюме
Эта статья объясняет, как идентифицировать хиральные атомы углерода в молекуле в алифатических или кольцевых структурах. Присутствие хирального углерода указывает на то, что он имеет стереоизомеры. Это очень важно при наблюдении за связями и реакциями молекул.
Рекомендации:
1. «Хиральный центр». ОЧЕМПАЛ. Н.п., н.д. Web.
