С тех пор как они были введены Гилбертом Н. Льюисом в 1916 году, химики использовали точечные диаграммы Льюиса для представления связи ковалентных молекул и координационных комплексов. Вы представляете валентные электроны в виде точек и размещаете их таким образом, чтобы внешние оболочки элементов в соединении имели заполненную оболочку из восьми или двенадцати электронов, в зависимости от элемента. За исключением водорода, для заполнения его внешней оболочки требуется всего два электрона. Чтобы построить диаграмму Льюиса, вы должны начать с центрального атома, вокруг которого собираются все остальные атомы. Центральный атом – это атом с самой низкой электроотрицательностью, и вы можете сравнить электроотрицательность, посмотрев на таблицу Менделеева. Вы также можете использовать один или оба из двух других методов для определения центрального атома.
Метод 1: Сравните электроотрицательность
Электроотрицательность элемента – это его склонность притягивать электроны, и элемент в соединении с самой низкой электроотрицательностью обычно является центральным. Исключением из этого правила является водород, который никогда не является центральным атомом, кроме молекулы H 2.
Сравнение электроотрицательности является наиболее надежным способом определения центрального атома. Вы можете определить относительную электроотрицательность, посмотрев на периодическую таблицу. Если не считать нескольких исключений, электроотрицательность возрастает по мере движения вверх и вправо. Франций, элемент № 87 в нижней части первого периода, имеет очень низкую электроотрицательность, в то время как фтор, элемент № 9 в верхней части периода 17, имеет очень высокий уровень. Благородные газы, которые образуют последний столбец в таблице, не образуют соединений.
Способ 2: найти наименее многочисленный элемент
Как правило, элемент, который встречается в соединении наименьшее количество раз, является центральным. Это простой в использовании метод, поскольку он позволяет определить центральный атом, просто взглянув на химическую формулу. Например, кислород является центральным атомом в H 2 O (вода), а углерод является центральным атомом в CO 2 (диоксид углерода). К сожалению, этот метод оставляет вас полностью в неведении, когда речь идет о соединениях, которые содержат элементы, встречающиеся в равных количествах, таких как HCN (цианистый водород).
Способ 3: запомнить список
Короткий список элементов, расположенных в порядке приоритета, может очень легко определить центральный атом, а в сочетании с методом 2 в большинстве случаев избавляет от необходимости обращаться к периодической таблице. Список C, Si, N, P, S и O. Если у вас есть соединение, которое содержит один или несколько из этих элементов, то первым в списке будет центральный атом. Например, в молекуле фосфата углерода (C 3 O 16 P 4) углерод является центральным атомом, поскольку он встречается первым в списке. Вы также можете сказать, что это центральный атом, потому что он наименее многочислен.
Since they were introduced by Gilbert N. Lewis in 1916, chemists have been using Lewis dot diagrams to represent the bonding of covalent molecules and coordination complexes. You represent valence electrons as dots and arrange them in such a way that the outer shells of the elements in the compound have a filled shell of either eight or twelve electrons, depending on the element. Hydrogen, the exception, needs only two electrons to fill its outer shell. To construct a Lewis diagram, you have to start with a central atom around which all the other atoms congregate. The central atom is the one with the lowest electronegativity, and you can compare electronegativity by looking at the periodic table. You can also use one or both of two other methods to determine the central atom.
Method 1: Compare Electronegativity
The electronegativity of an element is its propensity to attract electrons, and the element in a compound with the lowest electronegativity is usually the central one. The exception to this rule is hydrogen, which is never the central atom except in the H2 molecule.
Comparing electronegativity is the most reliable way to determine the central atom. You can determine relative electronegativity by looking at the periodic table. Allowing for a few exceptions, electronegativity increases as you move up and toward the right. Francium, element number 87 at the bottom of the first period, has a very low electronegativity while fluorine, element number 9 at the top of period 17, has a very high one. The noble gases, which form the last column in the table, do not form compounds.
Method 2: Find the Least Numerous Element
As a rule, the element that occurs the least number of times in the compound is the central one. This is an easy method to use, because it allows you to determine the central atom simply by looking at the chemical formula. For example, oxygen is the central atom in H2O (water), and carbon is the central atom in CO2 (carbon dioxide). Unfortunately, this method leaves you completely in the dark when it comes to compounds that contain elements that occur in equal numbers, such as HCN (hydrogen cyanide).
Method 3: Memorize a List
A short list of elements, arranged in priority order, can make determining the central atom very easy, and when combined with method 2, eliminates the need to consult the periodic table in the majority of cases. The list is C, Si, N, P, S and O. If you have a compound that contains one or more of these elements, the one that occurs first on the list is the central atom. For example, in the carbon phosphate molecule (C3O16P4), carbon is the central atom because it occurs first on the list. You can also tell it’s the central atom because it’s the least numerous one.
Центральный атом в соединении – это тот, что имеет больший заряд?
Знаток
(303),
закрыт
3 года назад
Антон Дятлов
Гений
(83312)
3 года назад
Центральный атом в соединении – это тот, который, как правило имеет максимальную валентность в соединении. И в таблице у Вас ошибка в 1-м столбце! Вы сами нарисовали во втором и третьем столбцах у алюминия по три черточки, почему у Вас у оксихлорида только две отходят от алюминия и одна от кислорода? Куда пропали валентности алюминия и кислорода? пи-связей в оксихлориде будет одна. Далее, почему Вы для кислорода взяли электроотрицательность фтора – самую максимальную? Ведь у кислорода ЭО=3.5. Я, так полагаю, Вы же брали таблицу Полинга?
У хлора ЭО=2.83, и 1.5<2.1, а Вы пишите больше.
И там далее полно неточностей… К тому же, оценка по разности ЭО не совсем корректна.
Viktor Rudjak
Искусственный Интеллект
(192494)
3 года назад
Мдя, путанница у вас в голове замечательная. Центральный атом, в данном случае – это алюминий
Анна ТарасенкоЗнаток (303)
3 года назад
Я бы не сомневалась, если б не увидела такой вариант.
Чем меньше достойных материалов в интернете, тем больше накапливается глупых вопросов!
Антон ДятловГений (83312)
3 года назад
Центральный атом в соединении – это тот, который, как правило имеет максимальную валентность в соединении. И в таблице у Вас ошибка в 1-м столбце! Вы сами нарисовали во втором и третьем столбцах у алюминия по три черточки, почему у Вас у оксихлорида только две отходят от алюминия и одна от кислорода? Куда пропали валентности алюминия и кислорода? пи-связей в оксихлориде будет одна. Далее, почему Вы для кислорода взяли электроотрицательность фтора – самую максимальную? Ведь у кислорода ЭО=3.5. Я, так полагаю, Вы же брали таблицу Полинга?
У хлора ЭО=2.83, и 1.5<2.1, а Вы пишите больше.
И там далее полно неточностей… К тому же, оценка по разности ЭО не совсем корректна.
Занятие № 9 ПОЛУЧЕНИЕ И СВОЙСТВА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ.
Вопросы к занятию:
1.Координационная теория А.Вернера и ее развитие Л.А.Чугаевым.
2.Понятие о координационном числе, комплексообразователе и лигандах.
3.Классификация и номенклатура комплексных соединений. Внутрикомплексные соединения.
4.Понятие об изомерии комплексных соединений и ее типы.
5.Природа химической связи в комплексных соединениях в свете метода валентных связей.
6.Факторы, влияющие на комплексообразующую способность d- элементов.
7.Ионные равновесия в растворах комплексных соединений. Константа нестойкости комплекса.
8.Значение комплексных соединений в биологии и медицине.
§1.Строение комплексных соединений. Основные положения теории Вернера о строении комплексных соединений
Многие процессы жизнедеятельности организма протекают с участием комплексных соединений. В живых организмах присутствуют комплексные соединения биогенных металлов с белками, витаминами и другими веществами, играющими роль ферментов или выполняющими специфические функции в обмене веществ.
В в. в химии было накоплено большое число фактов, необъяснимых с точки зрения существовавшей тогда теории валентности. Многие вещества, в которых элементы, казалось бы, уже полностью использовали свои валентности, сохраняли способность к дальнейшему присоединению различных ионов и молекул. При этом новые, «незаконные» (с точки зрения теории валентности) связи оказывались не менее прочными, чем «обычные» валентные связи. Некоторые из вновь открытых соединений были названы двойными солями (например, 3КF·AlF3), другие – аммиакатами, (например CuSO4·4NH3), третьи – кристаллогидратами
(CuCl2∙·6H2O) и т. д.
Крупнейший русский химик Лев Александрович Чугаев, получивший мировое признание за работы по химии комплексных соединений, писал, что эта область «по своей запутанности, по противоречивости фактических данных и отсутствию какой-либо общей руководящей идеи казалась совершенно безнадежной для систематической разработки».
Такой «общей руководящей идеей» стала разработанная к 1893 г. швейцарским химиком Альфредом Вернером теория строения
комплексных (или координационных) соединений
Вернер разделил все неорганические вещества на так называемые соединения первого и высшего порядка. К соединениям первого порядка он отнес главным образом достаточно простые по своей структуре вещества (H2O, NaCl, PCl3). Соединениями высшего порядка ученый предложил считать продукты взаимодействия между собой соединений первого порядка
– кристаллогидраты, аммиакаты, полисульфиды, двойные соли, а также комплексные соединения.
Комплексное соединение, по Вернеру, имеет в своей структуре центральный атом (ион), названный комплексообразователем, который равномерно окружен различными ионами или нейтральными молекулами.
Комплексообразователь (центральный атом) – атом или ион, предоставляя свободные атомные орбитали, является акцептором электронных пар и занимает центральное положение в комплексном соединении.
|
Молекулы или ионы, которые окружают комплексообразователь, |
||
|
позднее названные лигандами (от лат. ligare |
– «связывать») являются |
|
|
донорами электронных пар и непосредственно |
связанны |
с центральным |
|
атомом (ионом) ковалентной связью, образованной |
по донорно- |
акцепторному механизму.
Роль комплексообразователя может играть любой элемент периодической системы. В соответствии со своей химической природой неметаллические элементы обычно дают анионные комплексы, в которых роль лигандов играют атомы наиболее электроотрицательных элементов.
|
Типичные |
металлические элементы |
(щелочные |
и щелочноземельные |
|
|
металлы) |
проявляют слабую |
способность к |
комплексообразованию. |
Амфотерные элементы, которые занимают промежуточное положение между типичными металлическими и неметаллическими элементами, образуют как катионные, так и анионные комплексные соединения, например [Al(H2O)6]Cl3 и K[Al(OH)4]. Наиболее выраженную способность к комплексообразованию проявляют атомы или ионы d-, и f-элементов, так как они имеют достаточно большой заряд ядра и способны предоставлять необходимое количество вакантных орбиталей для образования связей с лигандами.
Число донорных атомов лигандов, непосредственно связанных с центральным атомом, называется его координационным числом. Значение координационного числа комплексообразователя зависит от многих факторов, но обычно оно равно удвоенному заряду иона комплексообразователя.
Вернер предложил в каждом комплексном соединении различать две координационные сферы: внутреннюю и внешнюю. Внутренняя сфера комплексного соединения есть совокупность центрального атома и лигандов. При записи состава комплексных соединений принято центральный атом вместе со всеми ионами и молекулами, входящими во внутреннюю сферу, заключать в квадратные скобки. Вне скобок остаются лишь ионы внешней
сферы, нейтрализующие заряд комплексного иона; в ряде комплексных соединений внешняя сфера может отсутствовать. Ионы внешней сферы связаны с комплексным ионом посредством ионной связи.
Именно внешние ионы при растворении комплексного соединения в воде легко отщепляются и находятся в растворе самостоятельно, обуславливая (совместно с комплексным ионом) его электропроводность. Лиганды внутренней координационной сферы связаны с центральным атомом настолько прочно, что, по меткому выражению Вернера, словно «исчезают» внутри комплекса, не проявляя себя ни в аналитических реакциях, ни в электропроводности раствора. Именно поэтому,
комплексными Вернер назвал соединения, устойчивые в растворах и не проявляющие свойств исходных для них соединений первого порядка.
|
центральный атом |
|
|
(комплексообразователь) |
лиганды |
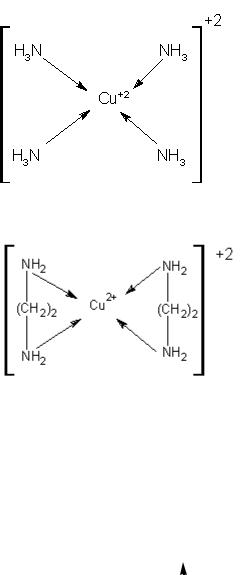
[Cu(NH3)4(H2O)2]SO4
|
внутренняя сфера |
ионы внешней сферы |
Рис.1.Общее строение комплексных соединений.
§2. Классификация комплексных соединений
По характеру электрического заряда комплексного иона различают катионные, анионные и нейтральные комплексные соединения.
Заряд комплексного иона определяется алгебраической суммой зарядов комплексообразователя и всех лигандов.
Например, комплексный ион [Cu+2(NH3)4]z, z = +2 + 4∙0 = +2, то есть
[Cu+2(NH3)4]2+.
Внутренняя сфера может быть:
А) заряжена положительно – такие комплексы называют катионными: [Al(H2O)6]Cl3 – хлорид гексаакваалюминия (ІІІ),
[Zn(NH3)4]SO4 –сульфат тетраамминцинка (ІІ).
Катионные комплексы образованы положительно заряженным комплексообразователем и нейтральными лигандами.
Б) заряжена отрицательно – комплексы называют анионные: K2[BeF4] – тетрафторобериллат (ІІ) калия, Na3[Fe(CN)6] – гексацианоферрат (ІІІ) натрия.
В роли комплексообразователя в анионном комплексе выступает положительно заряженный ион, а лигандами являются атомы с отрицательной степенью окисления.
В) электронейтральные:
[Pt(NH3)4Cl2] – дихлородиамминплатина (ІІ), [Ni(CO)4] – тетракарбонилникеля
Нейтральные комплексы образуются при координации вокруг атома молекул, а также при одновременной координации вокруг положительно заряженного комплексообразователя отрицательных ионов и молекул.
По природе входящих в комплексный ион лигандов комплексные соединения могут быть классифицированы следующим образом: если в составе комплексного иона лиганды молекулы аммиака, то такие комплексы называются аммиакатами, например [Cu(NH3)4]SO4 – сульфат тетраамминмеди (ІІ); лиганды молекулы воды – аквакомплексы ил гидраты: [Cr(H2O)6]Br3 – бромид гексааквахрома (ІІІ); лиганды представлены остатками кислот – ацидокомплексы: K2[Be(SO4)2] – дисульфатобериллат (ІІ) калия.
Лиганды могут занимать в координационной сфере одно или несколько мест, т.е. образовывать одну или несколько связей с комплексообразователем. Это свойство лигандов получило название – дентантность. По этому признаку различают моно-, би-, полидентантные комплексные соединения.
Примерами монодентантных лигандов являются ионы Cl–, OH–, Br–, молекулы H2O, NH3, CO и др.
Структуру монодентантного комплексного иона [Cu(NH3)4]+2 можно представить следующим образом:
К бидентантным комплексным соединениям относится (бис) этилендиамминмеди (ІІ):
Известно множество полидентантных лигандов, которые могут занимать сразу несколько координационных мест. Если они координируются одним и тем же центральным атомом, образуются комплексы, которые называются хелатными (от греч. «хеле» – «клешня»). В хелатных комплексах лиганды как бы обхватывают центральный атом, подобно клешням краба.
|
Так, диметилглиоксим (реактив Чугаева) служит аналитическим реагентом на никель: он образует с ионами Ni+2 малиново-красный хелатный комплекс:
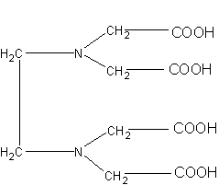
К полидентантным комплексным соединениям относится этилендиаминтетрауксусная кислота (EDTA) или другое ее название – Трилон А:
§3. Номенклатура комплексных соединении
Для того чтобы составить название комплекса необходимо в соединении выделить внутреннюю и внешнюю сферы, определить тип комплексного иона (катионный, анионный, электронейтральный), заряд комплексообразователя, количество и природу лигандов.
Для катионных комплексов название строится следующим образом: обозначается внешняя сфера, которая заряжена отрицательно. Название ионов внешней сферы записывается отдельным словом, как бы разграничивая их с внутренней сферой комплексного соединения. Затем единым словом описывается строение внутренней сферы: сначала называя лиганды, указывая греческим числительным ( ди-, три-, тетра-, пента-, гекса-) их количество. Если в состав комплексного соединения входят лиганды различной природы, то описание состава лигандов начинают с отрицательно заряженных ионов, а затем описывают состав нейтральныхмолекул. После этого добавляется название комплексообразователя, которое ставится в родительном падеже, и далее в скобках, римскими цифрами указывается его степень окисления.
Например:
[Cr (H2O)4Br2]Cl – хлорид дибромотетрааквахрома (ІІІ), [Cu (NH3)4]SO4 – сульфат тетраамминмеди (ІІ).
Для комплексных соединений, которые относят к анионному типу, название начинают составлять с описания строения внутренней сферы комплекса. Аналогично катионному типу описывают лиганды, а затем латинское название комплексообразователя с прибавлением к нему суффикса
– ат, что указывает на отрицательный заряд комплексного иона. Затем указывается степень окисления центрального иона и отдельным словом название ионов внешней сферы в родительном падеже.
Na4[Be (OH)6] – гексагидроксобериллат (ІІ) натрия, K3[Fe (CN)6] – гексацианоферрат (ІІІ) калия,
Ba[Zn Cl4] – тетрахлороцинкат (ІІ) бария.

Электронейтральные комплексные соединения называют, описывая строение комплексного иона, так как отсутствуют ионы внешней сферы:
[Pt(H2O)2Cl4] – тетрахлородиакваплатина (ІV)
Таблица 1. Названия некоторых типов лигандов, встречающихся в комплексных соединениях.
|
Формула лиганда |
Название лиганда |
Формула лиганда |
Название лиганда |
|
CN– |
циано– |
SCN– |
родано– |
|
Br– |
бромо– |
NO3– |
нитро– |
|
Cl– |
хлоро– |
NO2– |
нитрито– |
|
SO42– |
сульфато– |
CO32– |
карбонато– |
|
OH– |
гидроксо– |
H2O |
аква– |
|
SO32– |
сульфито– |
NH3 |
аммин– |
|
(S2O3)2– |
иосульфато– |
CO |
карбонил– |
Помимо использования номенклатурных названий, некоторые комплексные соединения имеют тривиальные названия, т.е. исторически сложившиеся.
Например: K3[Fe (CN)6] – красная кровяная соль, K4[Fe (CN)6] – желтая кровяная соль,
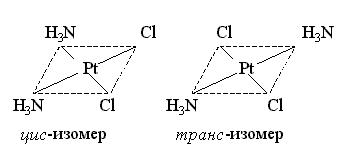
Fe4[Fe (CN)6] – берлинская лазурь, цис-[Pt(NH3)2Cl2] – соль Пейроне, транс-[Pt(NH3)2Cl2] – соль Рейзе.
§4. Изомерия комплексных соединений
Нередко комплексные соединения, имеющие одинаковый состав, различаются строением и свойствами. Это явление носит название – изомерия. В комплексных соединениях возможны следующие виды изомерии: геометрическая, ионизационная, координационная.
Геометрическая (цис – транс) изомерия проявляется для комплексов с разнообразными лигандами, например, для соединений состава [Pt(NH3)2Cl4]
и [Pt(NH3)2Cl2].
Диамминтетрахлороплатина [Pt(NH3)2Cl4] существует в виде двух соединений октаэдрического строения:
|
Cl |
|||
|
Cl |
PP |
Cl |
|
|
Pt |
|||
|
H3N |
NH3 |
||
Cl
цис-изомер (оранжевого цвета)
Pt
Cl
транс-изомер (желтого цвета)
В первом соединении молекулы аммиака расположены в соседних вершинах октаэдра. Такие соединения называются цис – изомерами (cis-по одну сторону). Во втором соединении молекулы аммиака расположены в противоположных вершинах октаэдра, такого типа соединения называются
транс – изомерами (trans – по ту сторону).
Соединение [Pt(NH3)2Cl2] – квадратный комплекс также существует в виде цис- и транс-изомера:
Геометрические изомеры комплексных соединений различаются не только по физическим и химическим свойствам, но и по биологической активности. Так, цис-изомер [Pt(NH3)2Cl2] проявляет ярко выраженную противоопухолевую активность, а транс – изомер – не проявляет. Следовательно, не только состав, но и геометрия внутренней сферы комплексных соединений чрезвычайно важна для их биологического действия.
Координационная изомерия выражается в различной координации двух типов лигандов относительно двух разных комплексообразователей, например:
|
[Co(NH3)6][Cr(CN)6] |
[Cr(NH3)6][Co(CN)6] |
Ионизационная изомерия проявляется в неодинаковом распределении анионов между внутренней и внешней сферами, например, для соединения состава:
|
[Co Br(NH3)5]SO4 |
[Co SO4(NH3)5]Br |
|
красно-фиолетовый цвет |
красный цвет |
Из растворов изомера красно-фиолетового цвета не удается осадить бромид ионы Br–, но при действии ионами Ba2+ осаждается BaSO4 (сульфат бария). В растворе изомера красного цвета, наоборот, не удается осадить SO42– – ионы, но действием AgNO3 осаждается бромид серебра AgBr.
§5. Устойчивость комплексных соединений.
Комплексные соединения – устойчивые химические соединения, в узлах кристаллической решетки которых находятся ионы, способные самостоятельно существовать в растворах.

В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация комплексного соединения – это распад комплексного соединения в растворе на комплексный ион и ионы внешней сферы. В водных растворах первичная диссоциация комплексных соединений связана с разрывом в них ионной связи, и поэтому она практически необратима:
[Ag(NH3)2]Cl 

Возникающий в результате первичной диссоциации комплексный ион ведет себя в растворе как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты. Этот вид диссоциации комплексного соединения связан с разрывом ковалентной связи, поэтому вторичная диссоциация сильно затруднена и имеет ярко выраженный равновесный характер подобно диссоциации слабых электролитов:
1-я ступень [Ag(NH3)2]+ 
2-я ступень [Ag(NH3)]+ 
Вторичная диссоциация, как всякий равновесный процесс, характеризуется константой равновесия. Для количественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную диссоциацию внутренней сферы комплексного соединения, называемую константой нестойкости (неустойчивости).
Для комплексного иона [Ag(NH3)2]+ выражение константы нестойкости имеет вид:
|
[ Ag ] [NH |
]2 |
|||||
|
[Ag(NH3)2]+ |
Ag+ +2NH3, |
KÍ |
3 |
|||
|
[[ Ag(NH3 )2 ] ] |
||||||
Чем меньше Кн., тем стабильнее комплексный ион, т.е. тем меньше он диссоциирует в водном растворе. Значение константы нестойкости зависит от природы комплексного соединения и свидетельствует о прочности связывания ионов в водных растворах.
Таблица 2. Константы нестойкости комплексных ионов.
|
Комплексный ион |
Кн. |
|
[Ag(NH3)2]+ |
9,3∙10–8 |
|
[Cu(NH3)4]2+ |
2,1∙10–13 |
|
[Zn(OH)4]2– |
3,6∙10–16 |
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
центральный атом
- центральный атом
-
Центральный атом (атом комплексообразователь) – атом или ион, который занимает центральное положение в комплексном соединении, непосредственно связан с лигандами и образует вместе с ними внутреннюю координационную сферу.
Общая химия : учебник / А. В. Жолнин [1]
Общая химия : учебник .
.
2012.
Смотреть что такое “центральный атом” в других словарях:
-
центральный атом — kompleksodaris statusas T sritis chemija apibrėžtis Atomas (jonas, atomų grupė), išlaikantis apie save kitus komplekso atomus (jonus, molekules). atitikmenys: angl. central atom; complexing agent rus. комплексообразователь; центральный атом;… … Chemijos terminų aiškinamasis žodynas
-
центральный атом — комплексообразователь … Cловарь химических синонимов I
-
центральный ион — kompleksodaris statusas T sritis chemija apibrėžtis Atomas (jonas, atomų grupė), išlaikantis apie save kitus komplekso atomus (jonus, molekules). atitikmenys: angl. central atom; complexing agent rus. комплексообразователь; центральный атом;… … Chemijos terminų aiškinamasis žodynas
-
атом комплексообразователь — см. центральный атом … Химические термины
-
АТОМ — (от греч. atomos неделимый), наименьшая возможная частица любого из простейших химических веществ, называемых элементами. Понятие атома, как и само слово, древнегреческого происхождения, но только в 20 в. истинность атомной гипотезы была твердо… … Энциклопедия Кольера
-
комплексообразователь — центральный атом … Cловарь химических синонимов I
-
комплексные соединения — (координационные соединения), химические соединения, в молекулах которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы так называемые лиганды; количество последних (обычно 4 или 6)… … Энциклопедический словарь
-
Химическая связь — взаимное притяжение атомов, приводящее к образованию молекул и кристаллов. Принято говорить, что в молекуле или в кристалле между соседними атомами существуют Х. с. Валентность атома (о чём подробнее сказано ниже) показывает число связей … Большая советская энциклопедия
-
Лиганд — (от лат. ligare связывать) атом, ион или молекула, связанные с неким центром (акцептором). Понятие применяется в биохимии для обозначения агентов, соединяющихся с биологическими акцепторами (рецепторами, иммуноглобулинами), а также в… … Википедия
-
Теория отталкивания электронных пар — валентных орбиталей (ОЭПВО) один из подходов в химии, необходимый для объяснения и предсказания геометрии молекул. Согласно этой теории молекула всегда будет принимать форму, при которой отталкивание внешних электронных пар минимально… … Википедия

