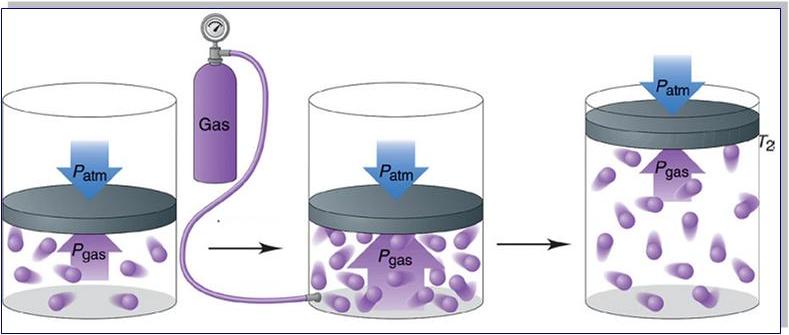
Формулы для определения давления газа применимы только для так называемого идеального газа. Это такой газ, когда пренебрегается взаимодействием между молекулами. Для этого газ должен быть достаточно разряженным. Газ с хорошей точностью можно считать идеальным вплоть до давлений 20 – 30 атмосфер. Так что атмосферу Земли можно считать идеальной даже у самой поверхности Земли. Давление газа на какую-либо поверхность определяется ударами молекул об эту поверхность. Естественно, что тогда давление газа должно зависеть от скоростей движения молекул. Вот формула для определения давления газа р
p = (Nmv^2)/3V (1)
Естественно, что давление зависит от числа молекул N, от массы молекулы m, от средней скорости движения молекул v и от объема сосуда V, где находятся молекулы. Средняя кинетическая энергия молекулы равна Е = mv^2/2. Тогда получим следующую формулу для расчета давления газа через среднюю энергию молекул
р = 2NЕ/3V (2)
Больцман рассчитал, что средняя кинетическая энергия молекул пропорциональна абсолютной температуре Т. Е = (3/2)kT, где k – постоянная Больцмана и T – абсолютная температура. Тогда получим для давления идеального газа формулу р = (NkT)/V. Перепишем эту формулу в следующем виде
рV = NkT (3)
Концентрация молекул в газе равна n = N/V. Тогда формула (3) примет такой вид
pV = NkT (4)
Концентрацию молекул можно выразить через произведение числа молей ν на число частиц в моле N = νNa. Произведение Na*k = R. Где R – газовая постоянная. Тогда (4) запишется в виде
pV = νRT (5)
Число молей газа ν = M/μ, где М – масса газа и μ – масса одного моля (молярная масса). Тогда уравнение (5) примет вид
pV = (M/μ)RT (6)
Уравнение состояния идеального газа в таком виде называют уравнением Клапейрона – Менделеева. При постоянных температуре и массе из (6) следует, что
pV = const (7)
То есть давление будет обратно пропорционально объему газа. Такой закон получил название закона Бойля – Мариотта. Если же постоянным является давление, то
V = (MR/Vμ)T (8)
Давление пропорционально абсолютной температуре. Этот закон получил название закон Шарля.
Вот и используйте любую из этих формул для расчета давления газа.
- Идеальный газ:
- — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах;
- — газ, взаимодействие между молекулами которого пренебрежимо мало;
- — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией.
Общие сведения
В модели идеального газа:
-
- предполагается, что составляющие газ частицы не взаимодействуют друг с другом, то есть их размеры пренебрежимо малы, поэтому в объёме, занятом идеальным газом, нет взаимных столкновений частиц. Частицы идеального газа претерпевают столкновения только со стенками сосуда;
- между частицами газа нет дальнодействующего взаимодействия, например, электростатического или гравитационного;
- упругих столкновений между молекулами и стенками сосуда в рамках молекулярно-кинетической теории приводит к термодинамике идеального газа.
Модель идеального газа имеет широкое применения в ряде задач, например в инженерных расчетах (аэродинамический, гидравлический, теплотехнический и т.д.), связанные с воздухом и другими газами, при давлении и температуре близких к нормальным (стандартным) условиям.
При условиях сильно отличных от нормальных (стандартных) условий модель идеального газа дает результаты с погрешностью так, как модель не учитывает:
-
- притяжение между молекулами;
- конечные размеры молекул.
При высоких давления газа следует использовать различные варианты уравнений реальных газов, разработанных на базе модели идеального газа. Наиболее из известных уравнений реального газа — полуэмпирическое уравнение Ван-дер-Ваальса.
Основные уравнения состояние идеального газа
Уравнения состояния идеального газа служат для получения неизвестных параметров идеального газа или газов схожих по свойствам с моделью идеального газа.
В данном разделе будут рассмотрены варианты уравнение состояния идеального газа на основе уравнения Менделеева — Клапейрона (или уравнение Клапейрона).
P⋅VM=R⋅T или P⋅V=(m/M)⋅R⋅T
Эти уравнение имеет наибольшее практическое значение при инженерных расчетах. Но так же существуют другие варианты записи уравнения состояния идеального газа.
Основными параметрами идеального газа служат:
-
- давление идеального газа (Р), Па;
- температура идеального газа (T), °К;
- объем идеального газа (V), м3;
- молярная масса идеального газа (M), кг/моль;
- количества идеального газа (n), моль;
- масса идеального газа (m), кг;
- молярный объем (VM), м3/моль;
Другие физические величины используемые в уравнении состояния идеального газа:
-
- плотность идеального газа (ρ), кг/м3.
Калькуляторы параметров идеального газа
Калькулятор молярного объема идеального газа
Согласно закону Авогадро, одинаковые количества газов при одинаковых условиях занимают одинаковый объём. Молярный объём идеального газа рассчитается по формуле:
VM=(R⋅T)/P
Введите универсальную газовую постоянную (Run0)
Введите температуру газа (T0)
Введите давление газа (абсолютного) (PA0)
Результат расчета молярного объема газа (Vm0)
Формула расчета молярного объема газа:
Скачать результат расчета молярного объема газа:

Поделится ссылкой на расчет молярного объема:
Если по калькулятору, приведенному выше, посчитать молярный объем газа при нормальных условиях:
-
- давление Р=101325 Па;
- температура Т=273,15 ºК.
В результате получится молярный объем идеального газа при нормальных условиях равный 22,413971 литр/моль (частный случай закона Авогадро).
Молярные объёмы реальных газов и идеального газа для практических вычислений имеют не значительные отклонения и принимаются равными .
Калькулятор давления идеального газа
При решении инженерных задач часто необходимо определять давление газа в технических устройствах, для решения задачи по организации технологии, для выполнения расчета на прочность технических устройств или просто для выполнения гидравлических (аэродинамических расчетов).
Расчет давления газа, если известны:
-
- масса газа;
- объем занимаемый газом (внутри сосуда, трубопровода или другого устройства);
- молярная масса газа;
- температура газа,
выполняется по формуле:
P=(m⋅R⋅T)/(M⋅V)
Введите универсальную газовую постоянную (Run2)
Введите температуру газа (T2)
Введите молярную массу газа (Mg2)
Результат расчета давления газа (абсолютного) (PA2)
Формула расчета давления газа (абсолютного):
Скачать результат расчета давления газа (абсолютного):

Поделится ссылкой на расчет давления:
Калькулятор температуры идеального газа
Температуру газа необходимо обычно рассчитывать для:
-
- возможности принятия технологических решения;
- возможности проведения расчета на прочность технологического оборудования;
- расчета теплоизоляции оборудования и защиты персонала от повышенной или пониженной температуры.
Расчет температуры газа, если известны:
-
- масса газа;
- объем занимаемый газом (внутри сосуда, трубопровода или другого устройства);
- молярная масса газа;
- абсолютное давление газа.
выполняется по формуле:
T=(P⋅M⋅V)/(m⋅R)
Введите давление газа (абсолютное) (PA3)
Введите молярную массу газа (Mg3)
Введите универсальную газовую постоянную (Run3)
Результат расчета температуры газа (T3)
Формула расчета температуры газа:
Скачать результат расчета температуры газа:

Поделится ссылкой на расчет температуры:
Калькулятор объема идеального газа
Расчет объем занимаемый газом (внутри сосуда, трубопровода или другого устройства), если известны:
-
- масса газа;
- давление газа;
- молярная масса газа;
- температура газа,
выполняется по формуле:
V=(m⋅R⋅T)/(M⋅P)
На основе этого уравнения, так же находят объемный расход газа при различных условиях.
Введите универсальную газовую постоянную (Run4)
Введите температуру газа (T4)
Введите молярную массу газа (Mg4)
Введите давление газа (абсолютного) (PA4)
Результат расчета объема газа (V4)
Формула расчета объема газа:
Скачать результат расчета объема газа:

Поделится ссылкой на расчет объема:
Калькулятор массы идеального газа
Масса газа рассчитывают для:
-
- решения технологических задач;
- возможности проведения расчета на прочность технологического оборудования и трубопроводов (сбор нагрузок);
- на опасных производственных объектах с опасными веществами для расчета массы опасных веществ для возможности идентификации производственного объекта, как ОПО.
Расчет массы газа, если известны:
-
- абсолютное давление газа;
- молярная масса газа;
- объем занимаемый газом (внутри сосуда, трубопровода или другого устройства);
- температура газа,
выполняется по формуле:
m=(P⋅M⋅V)/(T⋅R)
Введите давление газа (абсолютное) (PA5)
Введите молярную массу газа (Mg5)
Введите температуру газа (T5)
Введите универсальную газовую постоянную (Run5)
Результат расчета массы газа (m5)
Формула расчета массы газа:
Скачать результат расчета массы газа:

Поделится ссылкой на расчет массы:
Калькулятор плотности идеального газа
Расчет плотности газа, если известны:
-
- абсолютное давление газа;
- молярная масса газа;
- температура газа,
выполняется по формуле:
ρ=(P⋅M)/(T⋅R)
Введите давление газа (абсолютное) (PA6)
Введите молярную массу газа (Mg6)
Введите температуру газа (T6)
Введите универсальную газовую постоянную (Run6)
Результат расчета плотности газа (pl6)
Формула расчета плотности газа:
Скачать результат расчета плотности газа:

Поделится ссылкой на расчет плотности :
Калькулятор параметров идеального газа системы исходя из разных состояний системы
Выполняется по формуле:
P1⋅V1/T1=P2⋅V2/T2=P3⋅V3/T3=…=const
Рассмотрим изменение параметров системы по двумя состояниям:
P1⋅V1/T1=P2⋅V2/T2
Калькулятор давления идеального газа
P1=(P2⋅V2⋅T1)/(T2⋅V1)
Введите давление газа (абсолютное) (Pg2)
Введите температуру газа (Tg1)
Введите температуру газа (Tg2)
Результат расчета давления газа (абсолютного) (Pg1)
Формула расчета давления газа (абсолютного):
Скачать результат расчета давления газа (абсолютного):

Поделится ссылкой на расчет давления:
Калькулятор температуры идеального газа
T3=(P3⋅V3⋅T4)/(P4⋅V4)
Введите давление газа (абсолютное) (Pg3)
Введите температуру газа (Tg4)
Введите температуру газа (абсолютное) (Pg4)
Результат расчета температуры газа (Tg3)
Формула расчета температуры газа:
Скачать результат расчета температуры газа:

Поделится ссылкой на расчет температуры:
Калькулятор объема идеального газа
V5=(P6⋅V6⋅T5)/(P5⋅T6)
Введите давление газа (абсолютное) (Pg6)
Введите температуру газа (Tg5)
Введите давление газа (абсолютное) (Pg5)
Введите температуру газа (Tg6)
Результат расчета объема газа (Vg5)
Формула расчета объема газа:
Скачать результат расчета объема газа:

Поделится ссылкой на расчет объема:
Поделиться ссылкой:
Калькулятор закона идеального газа, позволяет найти одно из четырех составляющих, входящих в уравнение состояния (давление, объем, температура или количество вещества), если известны три другие величины.
.
Калькулятор расчета состояния идеального газа
(введите три известных значений)
Закон идеального газа
Любой газ, можно охарактеризовать четырьмя переменными и одной постоянной, а именно:
- давление (P), измеряется в паскалях (ПА)
- объем (V), измеряется в м³
- количество вещества (n), измеряется в моль
- температура (T)
- универсальная газовая постоянная (R), точное значение равно 8,31446261815324 Дж⋅К⁻¹⋅моль⁻¹
Второе название закона идеального газа: уравнение Менделеева — Клапейрона
PV=nRT
Используя данную формулу можно находить любую одну искомую величину.
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия – упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
P = F/S
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
F*Δt = Δp
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 1023), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
P = N*m*v2/(3*V)
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния
В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
P*V = n*R*T
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
P = n*R*T/V
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.
Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление в газовой смеси
Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
P = N*m*v2/(3*V)
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
m = M/NA;
n = N/NA;
m*N = M*n;
P = M*n*v2/(3*V)
Объем сосуда в кубических метрах равен 0,01 м3. Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Давление идеального газа, теория и онлайн калькуляторы
Давление идеального газа
Определение давления идеального газа
Определение
Давление идеального газа – это один из самых важных макроскопических параметров, при помощи которого характеризуют состояние
системы в молекулярной физике.
Обозначают давление буквой $p$. Если для известной массы идеального газа определены давление и температура (или объем), то полагают, что состояние термодинамической системы в состоянии равновесия определяется однозначно, так как существующие законы и уравнения молекулярно кинетической теории (МКТ) позволяют все остальные параметры вычислить.
В общем случае давление определяют как:
[p={mathop{lim }_{Delta Sto 0} frac{Delta F_n}{Delta S} }left(1right),]
где $F_n$ проекция силы на нормаль к поверхности S данная сила оказывает воздействие, $Delta S$- площадь поверхности.
Идеальный газ оказывает давление на стенки сосуда, в котором он находится, за счет того, что молекулы этого газа движутся и ударяются о стенки сосуда. Давление идеального газа можно найти, применяя основные положение МКТ. При этом получают, что давление идеального газа равно:
[p=frac{1}{3}nm_0{leftlangle v_{kv}rightrangle }^2left(2right),]
где $m_0$ – масса одной молекулы газа; $n$- концентрация молекул газа; $leftlangle v_{kv}rightrangle =sqrt{frac{1}{N}sumlimits^N_{i=1}{v^2_i}}, N $- количество молекул в объеме газа равном $V$. Уравнение (2) называют основным уравнением МКТ. Его можно записать в другом виде, используя среднюю кинетическую энергию молекул ($leftlangle E_krightrangle $):
[p=frac{2}{3}nleftlangle E_krightrangle left(3right).]
С таким важным термодинамическим параметром как термодинамическая температура давление связывает формула:
[p=nkT left(4right),]
где $k$ – постоянная Больцмана. Уравнение (4) называют уравнением состояния идеального газа.
Если проводить изохорный процесс ($V=const$) с некоторой массой идеального газа, то давление его будет подчинено закону Шарля:
[p_2=p_1frac{T_2}{T_1}left(5right),]
где $p_1$- давление газа имеющего температуру $T_1$.
При проведении изотермического процесса ($T=const$) c постоянной массой некоторого газа поведение давления можно характеризовать, используя уравнение:
[p_1V_1=p_2V_2left(6right).]
В соответствии с законом Дальтона давление смеси газов можно найти как сумму давлений каждого газа:
[p=sumlimits^N_{i=1}{p_i} left(7right),]
где $p_i$ – давление каждого газа в отдельности.
Уравнения МКТ, содержащие давление идеального газа
Уравнение Менделеева – Клапейрона (еще один вариант уравнения состояния):
$pV=frac{m}{mu }RT$(8),
где $frac{m}{mu }=nu $ -количество вещества; $m$ – масса газа; $mu $- молярная масса газа; $R$ – универсальная газовая постоянная.textit{}
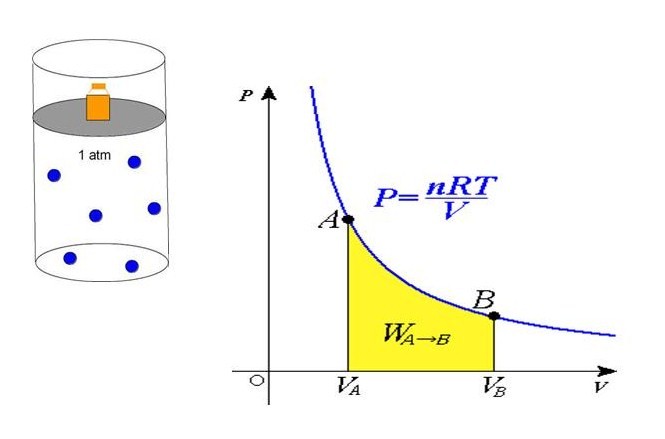
Определение работы газа в термодинамике:
[A=intlimits^{V_2}_{V_1}{pdV}left(9right).]
Соответственно, первое начало термодинамики для идеального газа в дифференциальном виде запишем как:
[delta Q=pdV+frac{i}{2}nu RdTleft(10right),]
где $i$ – число степеней свободы молекулы газа; $delta Q$ – элементарное количество теплоты, которое получает идеальный газ; $frac{i}{2}nu RdT=dU$ – изменение внутренней энергии термодинамической системы.textit{}
Примеры задач с решением
Пример 1
Задание. В идеальном газе проводят процесс, при котором $p=frac{AU}{V},$ где $U$ – внутренняя энергия газа; $A=const$ для определенного газа. Сравните коэффициенты пропорциональности $A$, если в первом случае газ одноатомный, во втором двух атомный. textit{}
Решение. Внутренняя энергия идеального газа для любого процесса равна:
[U=frac{i}{2}nu RT left(1.1right).]
Состояние идеального газа описывает уравнение Менделеева – Клайперона:
[pV=nu RT left(1.2right).]
Подставим правую часть уравнения, которое описывает заданный в условиях задачи процесс ($p=frac{AU}{V}$) вместо давления в (1.2), имеем:
[frac{AU}{V}V=nu RT left(1.3right).]
Получим из (1.3), что внутренняя энергия вычисляется как:
[U=frac{1}{A}nu RTleft(1.4right).]
Сравним выражения для внутренней энергии (1.1) и (1.4), имеем:
[frac{i}{2}=frac{1}{A}left(1.5right).]
Для одноатомного газа $i=3$; для двухатомного газа (без учета колебаний молекул) $i=5$.
[frac{3}{2}=frac{1}{A_1};; frac{5}{2}=frac{1}{A_2}to frac{A_2}{A_1}=frac{3}{2}cdot frac{2}{5}=frac{3}{5}.]
Ответ. $frac{A_2}{A_1}=frac{3}{5}$
Пример 2
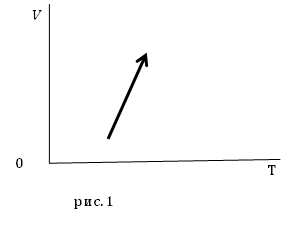
Задание. На рис.1 представлены процессы, проводимые с постоянной массой идеального газа, укажите, как изменяются давления в процессах?
Решение. Уравнение процесса можно аналитически описать уравнением:
[V(T)=AT-B left(2.1right),]
где $A$ и $B$ положительные постоянные величины.
Состояние газа определим при помощи уравнения Менделеева – Клапейрона:
[pV=nu RT left(2.2right).]
Вместо объема подставим уравнение процесса в (2.2):
[pleft(AT-Bright)=nu RTleft(2.3right).]
Раздели обе части (2.3) на температуру:
[frac{pleft(AT-Bright)}{T}=nu Rto pleft(A-frac{B}{T}right)=nu Rto p=frac{nu R}{A-frac{B}{T}} left(2.4right).]
Из уравнения (2.4) следует, что при увеличении температуры $frac{B}{T}$ уменьшается, следовательно, знаменатель дроби правой части выражения (2.4) увеличивается, значит, давление уменьшается.
Ответ. Давление в заданном процессе уменьшается.
Читать дальше: диэлектрический гистерезис.

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 396 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!