найти давление кислорода?
Hasmik
Ученик
(165),
на голосовании
13 лет назад
в баллоне объемом V= 100л находится m=2,5кг сжатого кислорода при температуре t=20 C. Найти давление кислорода.
Голосование за лучший ответ
Андрей Степанов
Просветленный
(22749)
13 лет назад
Уравнение состояния идеального газа (Менделеева-Клайперона) :
PV = nRT
где n – количество молей газа, R – универсальная газовая постоянная.
Считаем что кислород – газ идеальный (ну приблизительно) .
Все составляющие даны в условии задачи. Подставляете – находите давление.
aththesur
Вопрос по физике:
Определить давление кислорода в баллоне объёмом 1 м^3 при температуре t=27 градусов цельсия. Масса кислорода 1 кг.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
bowhatheite
Дано: СИ
V = 1 м³
t = 27°C T = t + 273 = 300 К
m = 1 кг
M = 32·10⁻³ кг/ моль (молярная масса молекулы кислорода)
___________
p – ?
Решение:
Из уравнения Клапейрона-Менделеева:
p·V = m·R·T / M
p = m·R·T / (M·V) = 1·8,31·300 / (32·10⁻³·1) ≈ 80·10³ Па
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Физика.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Физика — область естествознания: естественная наука о простейших и вместе с тем наиболее общих законах природы, о материи, её структуре и движении.
Рекомендуемые сообщения
Решение задач, рефераты, курсовые!
Онлайн сервис помощи учащимся.
Цены в 2-3 раза ниже!

-
- Поделиться
Помогите с последней задачкой из контрольной, пожалуйста, люди добрые!
Рассчитать давление кислорода (мм.рт.ст.) над кристаллическим оксидом по значению энергии Гиббса реакции синтеза оксида металла из элементов Fe(k)+1|2O2=FeO(k)
dG=-251кДж
Очень – очень прошу, перерыла все что было можно, но доходчивой формулы не нашла, и еще как Па перевести в мм.рт.ст.?
Ссылка на комментарий
–>
-
- Поделиться
как Па перевести в мм.рт.ст.?
P(давление)=плотность*g*высоту столба жидкости.
плотность ртути-13600кг/м^3
g=9,8м/с^2 – ускорение своьодного падения
высота столба жидкости =1мм=0,001м
P=133,3Па=1мм. рт. ст.
Ссылка на комментарий

-
- Поделиться
Помогите с последней задачкой из контрольной, пожалуйста, люди добрые!
Рассчитать давление кислорода (мм.рт.ст.) над кристаллическим оксидом по значению энергии Гиббса реакции синтеза оксида металла из элементов Fe(k)+1|2O2=FeO(k)
dG=-251кДж
Очень – очень прошу, перерыла все что было можно, но доходчивой формулы не нашла, и еще как Па перевести в мм.рт.ст.?
Надо рассмотреть обратную реакцию – разложение оксида железа
FeO(k) = Fe(k) + 0,5O2
Константа равновесия Kp этой реакции запишется так:
Kp = P0.5(O2). (1) Давления остальных веществ сюда не входят т.к. они твердые (а не газы)
Теперь надо найти Kp исходя из энергии Гиббса реакции . Энергия Гиббса прямой реакции равна с обратным знаком энергии Гиббса обратной реакции
ΔG = 251кДж
ΔG связано с Kp:
ΔG = -RTlnKp (2)
Остается найти Kp из 2 и посчитать, а затем из (1) выразить P(O2).
Ссылка на комментарий

- Автор
-
- Поделиться
Спасибо, вы даже не представляете как помогли мне!))))) да еще так быстро!!! Отдельное спасибо Wergilius, уже второй раз меня выручил!
Ссылка на комментарий
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
16
3. В баллоне кислородного изолирующего
противогаза (КИП) ёмкостью 1 л находится
сжатый кислород. Определить удельный
объём и плотность кислорода при указанных
условиях. Какой объём займёт данная
масса кислорода при нормальных физических
условиях, если масса кислорода в баллоне
0,2 кг.
|
Дано: кислород O2 V=1л m=0,2 кг |
СИ: Нормальные
Объем 1л = Молярная Плотность кислорода O2: |
|
Найти: v -? ρ-? |
Решение.
а) Анализ данных и формул.
Задача на определение параметров
состояния газа.
Уравнение состояния идеального газа
(иногда уравнение Клапейрона или
уравнение Менделеева — Клапейрона) —
формула, устанавливающая зависимость
между давлением, молярным объёмом и
абсолютной температурой идеального
газа. Уравнение имеет вид:
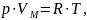
где
p – давление,
VM
– молярный объём,
R – универсальная газовая
постоянная,
T – абсолютная температура,
К.
Так как,
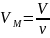
где ν – количество вещества, а
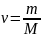
,
где m – масса, M
– молярная масса, уравнение состояния
можно записать:
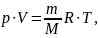
Эта форма записи носит имя уравнения
(закона) Менделеева — Клапейрона.
Из этой формулы легко выразить объем:
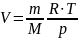
Удельный объём
тела (системы):
v
= V/m
, где V
– объём тела (системы) массой m.
Удельная масса
(плотность) тела (системы):
= m/V
или из
уравнения Клапейрона
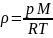
б) Вычисления.
Удельный объем газа, находящегося в
баллоне:
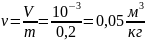
Плотность кислорода, при указанных
условиях:
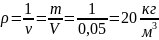
Объем кислорода, при нормальных физических
условиях::
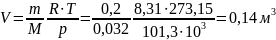
Ответ: удельный объем и плотность
кислорода, находящегося в баллоне
соответственно равны 0,05 м3/кг и
20 кг/м3; при нормальных условиях
объем кислорода той же массы: 0,14 м3
4. Кислород изотермически сжимается
до пятикратного уменьшения объёма.
Определить объём и давление кислорода
после сжатия, работу сжатия и количество
тепла, отведённого от газа, если
первоначальные объём и давление
кислорода и температура соответственно
равны
|
V, м3 |
Р, кПа |
t, °С |
|
0,6 |
120 |
30 |
|
Дано: кислород O2 T=const; V1=0,6 p1=120 |
СИ: Т1=30°С=30+273,15=303,15 p1=120 Молярная Плотность кислорода O2: |
|
Найти: V2 , p2, |
Решение.
а) Анализ данных и формул.
Изотермический процесс – термодинамический
процесс, происходящий в физической
системе при постоянной температуре.
(T = const,
m = const,
M =const).
Уравнение изотермического процесса
(закон Бойля – Мариотта):
рV = const
,
где р и V – соответственно
давление и объём газа.
Работа расширения газа:
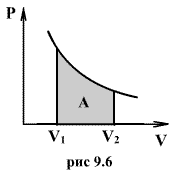
Рис.1.
Изотермический процесс.
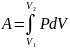
Из уравнения Менделеева-Клапейрона
выражаем давление p:

и подставим в уравнение работы:
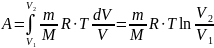
Таким образом, работа в изотермическом
процессе:
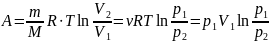
где р1, V1 и p2, V2
– соответственно начальные и конечные
значения давления и объёма газа.
Изменение внутренней энергии: U
= 0.
Первый закон термодинамики, количество
теплоты:
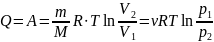
б) Вычисления.
Из закона Бойля-Мариотта следует:
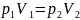
Отсюда найдем давление p2:
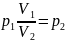
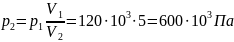
Объем после сжатия V2:
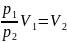

Известно, что масса газа при сжатии не
меняется:
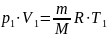
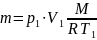
Тогда работа сжатия:
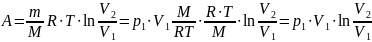
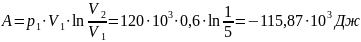
Количество теплоты:
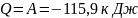
(знак минус указывает на то, что газ
сжимается)
Ответ: объём и давление кислорода
после сжатия равны соответственно 0,12
м3 и 600кПа, работа сжатия равна
количеству тепла, отведённого от газа
и равна 115,9 кДж
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Загрузить PDF
Загрузить PDF
В химии «парциальным давлением» называют давление, которое оказывает отдельно взятый компонент из газовой смеси внешней среды, например, на колбу, баллон или границу атмосферы. Вы можете подсчитать давление каждого газа, если знаете его количество, какой объем он занимает и какова его температура. Затем вы можете сложить парциальные давления и найти общее парциальное давление смеси газов, или найдите вначале общее давление, а затем — парциальное.
-

1
Примите каждый газ как «идеальный». В химии «идеальный газ» — тот, который взаимодействует с другими веществами, не вступая с ними в соединение. Отдельные молекулы могут сталкиваться друг с другом и отталкиваться, как шары для бильярда, не деформируясь при этом.[1]
- Давление идеального газа возрастает, если его поместить в меньший объем, и уменьшается, если газ находится в большем объеме. Это отношение называется законом Бойля-Мариотта, по имени ученых Роберта Бойля и Эдма Мариотта. Математическая запись закона: k = P x V или, упрощенно, k = PV, где k представляет константу соотношения, P — давление, а V — объем.[2]
- Давление может быть указано в нескольких различных единицах. Одна из них, Паскаль (Па), определяется как сила в 1 ньютон, приложенная к площади в 1 квадратный метр. Другой вариант представления давления — в атмосферах (атм). Эта единица определяется как давление земной атмосферы на уровне моря. Давление в 1 атмосферу равно 101,325 Па.[3]
- Температура идеального газа возрастает при увеличении его объема и снижается при уменьшении объема. Это отношение называют законом Чарльза, по имени Жака Чарльза. Математическая запись закона: k = V / T, где k — константа соотношения между объемом и температурой, V вновь представляет объем газа, а T — его температуру.[4]
[5]
- Температура газов в этих уравнениях приведена в градусах Кельвина, ее можно найти, прибавив 273 к числу градусов Цельсия в температуре газа.
- Эти два отношения можно объединить в одно уравнение: k = PV / T, которое также можно записать как PV = kT.
- Давление идеального газа возрастает, если его поместить в меньший объем, и уменьшается, если газ находится в большем объеме. Это отношение называется законом Бойля-Мариотта, по имени ученых Роберта Бойля и Эдма Мариотта. Математическая запись закона: k = P x V или, упрощенно, k = PV, где k представляет константу соотношения, P — давление, а V — объем.[2]
-

2
Определите количество газов. У газов есть и масса, и объем. Объем обычно измеряют в литрах (л), но есть два варианта подсчета массы.
- Обычно массу измеряют в граммах или, если она достаточно велика, в килограммах.
- Поскольку газы обычно весят очень мало, их масса также вычисляется в отдельной единице измерения, называемой молекулярной массой, или молярной массой. Молярная масса определяется как сумма атомарных весов всех атомов в газообразном веществе, каждый атом сравнивается с массой карбона (12)[6]
- Поскольку атомы и молекулы слишком малы, чтобы работать с ними непосредственно, количество газа определяется в молях. Количество молей в данном газе можно найти, разделив массу на молярную массу, значение отмечается буквой n.
- Мы можем заменить постоянную k константу в уравнении газа числом n, количеством молей (mol), и ввести новую константу R. Тогда уравнение будет записано в виде nR = PV/T или PV = nRT.[7]
- Значение R зависит от единиц, в которых измеряются давление газа, объемы и температура. Для объема в литрах, температуры в Кельвинах и давления в атмосферах, значение равно 0,0821 л атм/K мол. Это можно записать в виде 0,0821 л атм K-1 мол -1, чтобы избежать использования разделительной черты при указании единиц измерения.[8]
-

3
Понимание закона Дальтона о парциальном давлении. Закон, открытый химиком и физиком Джоном Дальтоном, который первым предположил, что химические элементы состоят из отдельных атомов,[9]
гласит: общее давление смеси газов равняется сумме давлений каждого газа в смеси.- Закон Дальтона можно записать в таком виде: Pобщее = P1 + P2 + P3 … с таким количеством слагаемых после знака равенства, каково количество газов в смеси.
- Уравнение закона Дальтона можно расширить при работе с газами, чье индивидуальное давление неизвестно, но для которых известны температура и объем. Парциальное давление газа — такое же, как и для равного объема газа, полностью занимающего отведенный объем.
- Для каждого парциального давления мы можем переписать уравнение идеального газа. Вместо PV = nRT мы может оставить только P в левой части перед знаком равенства. Чтобы сделать это, обе части уравнения нужно разделить на V: PV/V = nRT/V. Две V слева сокращаются, остается P = nRT/V.
- Затем для каждого P справа мы можем выполнить замену, вписав уравнение парциального давления: Pобщее =(nRT/V) 1 + (nRT/V) 2 + (nRT/V) 3 …
Реклама
-

1
Определите уравнение парциального давления для газов, с которыми вы работаете. Для вычислительных целей возьмем пример: в колбе объемом 2 литра содержится 2 газа, нитроген (N2), оксиген (O2) и карбон диоксид, углекислый газ (CO2). Каждого газа — по 10 г, температура каждого газа в колбе равна 37 градусам Цельсия. Нужно найти парциальное давление каждого газа и общее давление смеси газов на емкость.
- Наше уравнение парциального давления будет выглядеть следующим образом: Ptotal = Pнитроген + Pоксиген + Pкарбон диоксид.
- Поскольку мы пытаемся найти давление, которое оказывает каждый из газов, знаем объем и температуру и можем найти количество молей каждого газа, основываясь на массе вещества, мы можем переписать уравнение в следующей форме: Pобщее =(nRT/V) нитроген + (nRT/V) оксиген + (nRT/V) карбон диоксид
-

2
Переведите температуру в градусы Кельвина. Температура по Цельсию равна 37 градусам, потому мы добавим 273 к 37 и получим 310 градусов K.
-

3
Найдите количество молей каждого газа в образце. Число молей газа равно массе газа, деленной на его молярную массу,[10]
которая, как уже говорилось, равна сумме весов всех атомов в составе.- Для нашего первого газа, нитрогена (N2), каждый атом обладает атомарной массой 14. Поскольку нитроген содержит два атома (состоит из двухатомных молекул), мы должны умножить 14 на 2, чтобы найти молярную массу нитрогена, она равна 28. Затем мы делим массу в граммах, 10 г, на 28, чтобы получить количество молей, которое приблизительно равно 0,4 моль.
- У второго газа, оксигена (O2), масса каждого атома равна 16. Оксиген также двухатомный газ, потому мы умножаем 16 на 2 и получаем молярную массу, равную 32. Разделив 10 г на 32, мы получим примерно 0,3 моль оксигена в составе образца смеси газов.
- Третий газ, карбон диоксид (CO2), состоит из 3 атомов: одного атома карбона с атомарной массой 12 и двух атомов оксигена, каждый с атомарной массой 16. Мы складываем все три веса: 12 + 16 + 16 = 44 составляет молярную массу. Разделив 10 г на 44, мы получим примерно 0,2 моля карбон диоксида.
-

4
Подставьте значения для молей, объема и температуры. Наше уравнение будет выглядеть так: Pобщее =(0,4 * R * 310/2) нитроген + (0,3 *R * 310/2) оксиген + (0,2 * R *310/2) карбон диоксид.
- Для простоты мы оставили текущие значения единиц измерения. Эти единицы уйдут после математических вычислений, и останутся только те, которые участвуют в определении давления.
-

5
Подставьте значение константы R. Мы будем указывать парциальное и общее давление в атмосферах, потому используем значение R, равное 0,0821 л атм/K моль. Подстановка этого значения в уравнение дает нам Pобщее =(0,4 * 0,0821 * 310/2) нитроген + (0,3 *0,0821 * 310/2) оксиген + (0,2 * 0,0821 * 310/2) карбон диоксид.
-

6
Подсчитайте парциальное давление каждого газа. Сейчас все значения на месте, пора перейти к математическим вычислениям.
- Чтобы найти парциальное давление нитрогена, умножим 0,4 моль на нашу константу 0,0821 и температуру 310 градусов K, затем разделим на 2 литра: 0,4 * 0,0821 * 310/2 = 5,09 атм, приблизительно.
- Для получения парциального давления оксигена умножим 0,3 моль на константу 0,0821 и температуру 310 градусов K, затем разделим на 2 литра: 0,3 *0,0821 * 310/2 = 3,82 атм, приблизительно.
- Чтобы найти парциальное давление карбон диоксида, умножаем 0,2 моль на константу 0,0821 и температуру 310 градусов K, затем делим на 2 литра: 0,2 * 0,0821 * 310/2 = 2,54 атм, приблизительно.
- Теперь сложим полученные значения давлений и найдем общее давление: Pобщее = 5,09 + 3,82 + 2,54, или 11,45 атм, приблизительно.
Реклама
-

1
Определите парциальное давление, как и раньше. Вновь, возьмем в пример колбу на 2 литра с тремя газами: нитрогеном (N2), оксигеном (O2) и карбон диоксидом (CO2). У нас по 10 г каждого газа, температура каждого газа в колбе равна 37 °C.
- Температура по Кельвину будет такой же, 310 градусов, как и раньше, у нас будет примерно 0,4 моль нитрогена, 0,3 моль оксигена и 0,2 моль карбон диоксида.
- Мы также будем указывать давление в атмосферах, потому будем использовать значение 0,0821 л атм/K моль для константы R.
- Таким образом, наше уравнение парциального давления на текущий момент выглядит так же, как раньше: Pобщее =(0,4 * 0,0821 * 310/2) нитроген + (0,3 *0,0821 * 310/2) оксиген + (0,2 * 0,0821 * 310/2) карбон диоксид.
-

2
Сложите количество молей каждого газа в образце, чтобы найти общее количество молей в смеси газов. Поскольку объем и температура одинаковы для всех газов, не говоря о том, что каждая молярная масса умножается на одну и ту же константу, мы можем использовать распределительное свойство умножения и переписать уравнение в следующем виде: Pобщее = (0,4 + 0,3 + 0,2) * 0,0821 * 310/2.
- Складываем 0,4 + 0,3 + 0,2 = 0,9 моль смеси газов. Это упростит наше выражение до Pобщее = 0,9 * 0,0821 * 310/2.
-

3
Найдите общее давление смеси газов. Умножаем 0,9 * 0,0821 * 310/2 = 11,45 моль, приблизительно.
-

4
Найдите пропорцию каждого газа в смеси. Для этого разделите количество молей каждого газа на общее количество молей в смеси.
- У нас 0,4 моль нитрогена, потому 0,4/0,9 = 0,44 (44 процента) в образце, приблизительно.
- У нас 0,3 моль оксигена, потому 0,3/0,9 = 0,33 (33 процента) в образце, приблизительно.
- У нас 0,2 моль карбон диоксида, потому 0,2/0,9 = 0,22 (22 процента) в образце, приблизительно.
- Хотя в вычислениях выше сумма приблизительных значений в процентах дает всего 0,99, точные значения являются периодическими, так что сумма на самом деле будет равна повторяющимся девяткам после запятой. По определению это то же самое, что 1 или 100 процентов.
-

5
Умножим пропорциональное количество каждого газа на общее давление, чтобы найти парциальное давление.
- Умножаем 0,44 * 11,45 = 5,04 атм, приблизительно.
- Умножаем 0,33 * 11,45 = 3,78 атм, приблизительно.
- Умножаем 0,22 * 11,45 = 2,52 атм, приблизительно.
Реклама
Советы
- Вы заметите небольшую разницу в значениях при вычислении сначала парциального давления, а затем общего, и при подсчете вначале общего, а затем парциального давления. Помните, что приведенные значения даны приблизительно, поскольку они округлены до 1 или 2 знаков после запятой для простоты подсчетов и понимания. Если вы выполняете вычисления самостоятельно без округления, вы заметите или меньшую разницу между значениями или не заметите ее вовсе.
Реклама
Предупреждения
- Знание парциального давления газов может стать вопросом жизни и смерти для дайверов. Слишком низкое парциальное давление кислорода может привести к бессознательному состоянию или смерти, но слишком высокое парциальное давление азота или кислорода также может привести к отравлению.[11]
[12]
Реклама
Вам потребуются
- Калькулятор
- Справочник атомарных весов / молярных масс
Об этой статье
Эту страницу просматривали 82 598 раз.
