При испарении жидкости может наступить особое состояние, когда число частиц, покидающих поверхность, равно числу возвращающихся. Вещество как бы одновременно испаряется и конденсируется с одинаковой скоростью.
Если пар над водой находится в таком динамическом равновесии, то он называется насыщенным. Можно измерить давление насыщенного водяного пара, а также изучить другие свойства.
Содержание
- Что за параметр, в чем измеряется?
- От чего зависит?
- Как меняется от изменения температуры?
- Таблица зависимости
- Как найти?
- Пример
- Использование под избыточным давлением
- Применение в жизни
- Заключение
Что за параметр, в чем измеряется?
Давление насыщенного пара – это давление газообразного вещества, молекулы которого находятся в термодинамическом равновесии с жидкостью, из которой он образовался. В таком состоянии концентрация молекул (плотность) максимальная.
Как и любое другое Р, оно измеряется в Паскалях (Па), атмосферах (атм.) или мм ртутного столба (мм рт. ст.). При заданной температуре Р насыщенного пара всегда больше Р ненасыщенного.
От чего зависит?
Есть всего два фактора, влияющие на значение этого параметра:
- Особенности строения вещества. Для каждой жидкости параметр принимает свое значение. Так, при 20℃ давление насыщенных паров воды в 10 раз меньше хлороформа, и в 100 раз меньше сернистой кислоты.
- Температура. С ростом температуры концентрация молекул газа и их скорость увеличиваются, значит, возрастает давление. С уменьшением температуры давление уменьшается.
Если при постоянной температуре уменьшать объем, в котором находится насыщенный пар, то он начнет конденсироваться – превращаться в воду. Если увеличивать – то испарение возрастет, а концентрация молекул и давление останутся неизменным. То есть давление не зависит от объема. В этом состоит отличие насыщенного пара от обычного.
Для насыщенного пара не работают законы Бойля-Мариотта (изотермический процесс), Гей-Люссака (изобарный) и Шарля (изохорный). Однако можно использовать уравнение Менделеева-Клапейрона.

Как меняется от изменения температуры?
У обычного газа давление зависит от температуры линейно, то есть на графике зависимости p от T будет прямая. У насыщенного пара ситуация другая. С ростом температуры давление растет быстрее, чем у обычного газа.
Это объясняется тем, что при нагревании не только повышается температура, но и увеличивается испарение, то есть возрастает концентрация молекул газа.
На рисунке участок 1-2 показывает, как меняется давление насыщенного пара над водой в закрытом сосуде. Как только жидкость испарится полностью, концентрация молекул газа будет постоянной, и давление начнет изменяться по линейным законам, чему соответствует участок 2-3.

Таблица зависимости
Измерения, полученные экспериментальным путем, заносят в таблицу. Данными пользуются при расчетах, инженерных изысканиях.
| Температура, ℃ | Давление, мм рт. ст. |
| 0 | 4,58 |
| 5 | 6,55 |
| 10 | 9,21 |
| 20 | 17,54 |
| 50 | 92,59 |
| 75 | 289,2 |
| 90 | 525,9 |
| 100 | 760 |
Как видно из таблицы, пар может становиться насыщенным даже при нуле градусов, когда он на границе со своей твердой фазой (льдом). При этом давление его довольно низкое.
При нормальных условиях (при 20 градусах С и 1 атм.) параметр повышается, но все еще незначительно – до 17,54 мм рт. ст. (0,023 атм.). При температуре кипения воды 100 ℃ он равен атмосферному (1 атм.).
Чтобы повысить температуру кипения жидкости, повышают давление в системе. Это явление часто используется на практике.
Как найти?
 Для нахождения параметров газа пользуются уравнением Менделева-Клайперона. Оно хорошо описывает идеальный газ и пар.
Для нахождения параметров газа пользуются уравнением Менделева-Клайперона. Оно хорошо описывает идеальный газ и пар.
P*V=n*R*T, где R – универсальная газовая постоянная, равна приблизительно 8,314 Дж/(моль*К).
Используется также понятие относительной влажности. Обозначается греческой буквой «фи»: φ = Р/Рн * 100%.
Давление паров воды, находящихся в воздухе, поделенное на Р насыщенного пара при вполне конкретной температуре. Для удобства части перевели в проценты.
Если относительная влажность равна 100%, то воздух настолько насыщен парами воды, что уже не может их принять.
Пример
Если в закрытом помещении при температуре 10 ℃ относительная влажность воздуха 70%, при температуре 20 ℃ влажность составляет 30%, во сколько раз давление насыщенного пара при высокой температуре больше, чем при низкой?
Решение:
- Необходимо перевести градусы Цельсия в кельвины. 10+273 = 283 К, 20+273=293 К.
- Так как объем помещения постоянный, а воздух в нем ненасыщенный, то можно применить уравнение Шарля: Р1/Р2 = Т1/Т2
- Из уравнения влажности следует: Р = φ* Рн/100.
Подставляя значение Р в формулу уравнения Шарля: φ1* Рн1/ φ2* Рн2 = Т1/Т2.
Рн2/ Рн1 = Т2* φ1/Т1* φ2 = 293*70/283*30=2,4.
Использование под избыточным давлением
Если за точку отсчета взять атмосферное давление, то все, что свыше его называют избыточным. Оно создается искусственно в замкнутых объемах (трубах, сосудах, паровых котлах), измеряют манометром, потому встречается еще одно название – монометрическое.
Р абсолютное = Р атмосферное + Р избыточное. Дело в том, что при Р избыточном вода начинает кипеть не при 100 градусах, а выше. Температура достигает значений 110-160 градусов. Создаются прекрасные условия для дезинфекции и разогрева веществ.
Насыщенный пар применяют:
 Чтобы убивать микробы, грибок, вирусы.
Чтобы убивать микробы, грибок, вирусы.- Им стерилизуют хирургический инструмент, лабораторные приборы, оборудование, одежду. Метод применим к материалам, неподвергающимся коррозии.
- В парогенераторах для быстрого размораживания льда, пластов наледи, предотвращения смерзания песка и гравия.
- Для подогревания различных смесей в строительной, пищевой, химической промышленности.
- В пароочистителях. Им удаляют загрязнения и проводят дезинфекцию поверхностей.
Прибор для стилизации насыщенным паром называется паровым автоклавом.
Применение в жизни
Знания о насыщенном паре применяют при приготовлении пищи. Есть прибор, называемый скороваркой. Это плотно закрытая кастрюля, в которой собирается пар под высоким давлением. Благодаря этому температура кипения в скороварке повышается. И можно быстрее готовить пищу.
В горах, наоборот, сварить овощи становится проблематично, так как из-за низкого значения Р Т кипения понижается. Вода выкипает, не успев достаточно разогреть продукты.
В жизни также приходится сталкиваться с понятием «точка росы». Это Т, при которой водяной пар становится насыщенным при постоянном Р. В таких условиях в воздухе начинается образовываться конденсат.
Если в помещении точка росы выше 20 ℃, это указывает на высокую влажность, люди чувствуют духоту, дискомфорт, им тяжело двигаться, работать. Точку росы учитывают строители, применяя тепло и влагоизоляционные материалы.
Заключение
Один из важных параметров насыщенного пара – давление. Оно не зависит от объема, а при нагревании вещества повышается, причем быстрее, чем у обычного газа. При фиксированной температуре насыщенный пар принимает максимальную плотность.
Пар под избыточным давлением имеет широкое применение в быту, промышленности и медицине, так как он закипает при температуре более 100 ℃.
Насыщенный пар
-
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
-
Испарение и конденсация
-
Динамическое равновесие
-
Свойства насыщенного пара
-
Влажность воздуха
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее — испарится. Что такое испарение и почему оно происходит?
Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и большую сторону.
На рис. 1 изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный «хвост» графика — это небольшое число «быстрых» молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.

Рис. 1. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т.е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение — это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости (при особых условиях превращение жидкости в пар может происходить по всему объёму жидкости. Данный процесс вам хорошо известен — это кипение).
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара — процесс, обратный испарению жидкости.
к оглавлению ▴
Динамическое равновесие
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
Давление и плотность насыщенного пара обозначаются и
. Очевидно,
и
— это максимальные давление и плотность, которые может иметь пар при данной температуре. Иными словами, давление и плотность насыщенного пара всегда превышают давление и плотность ненасыщенного пара.
к оглавлению ▴
Свойства насыщенного пара
Оказывается, что состояние насыщенного пара (а ненасыщенного — тем более) можно приближённо описывать уравнением состояния идеального газа (уравнением Менделеева — Клапейрона). В частности, имеем приближённое соотношение между давлением насыщенного пара и его плотностью:
(1)
Это весьма удивительный факт, подтверждаемый экспериментом. Ведь по своим свойствам насыщенный пар существенно отличается от идеального газа. Перечислим важнейшие из этих отличий.
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма.
Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастёт, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернётся к своему прежнему значению.
Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т.е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объёма.
Это следует из того, что плотность насыщенного пара не зависит от объёма, а давление однозначно связано с плотностью уравнением (1).
Как видим, закон Бойля — Мариотта, справедливый для идеальных газов, для насыщенного пара не выполняется. Это и не удивительно — ведь он получен из уравнения Менделеева — Клапейрона в предположении, что масса газа остаётся постоянной.
3. При неизменном объёме плотность насыщенного пара растёт с повышением температуры и уменьшается с понижением температуры.
Действительно, при увеличении температуры возрастает скорость испарения жидкости.
Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится.
Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара.
Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону.
В самом деле, с увеличением температуры возрастает плотность насыщенного пара, а согласно уравнению (1) давление пропорционально произведению плотности на температуру.
Зависимость давления насыщенного пара от температуры является экспоненциальной (рис. 2). Она представлена участком 1–2 графика. Эту зависимость нельзя вывести из законов идеального газа.

Рис. 2. Зависимость давления пара от температуры
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3).
Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
к оглавлению ▴
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Из уравнения Менделеева-Клапейрона (1) следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1), напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Насыщенный пар» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
Это пар, находящийся в термодинамическом равновесии с жидкой (или твёрдой) фазой одного и того же вещества.
Одним из параметров, характеризующим насыщенный пар, является его давление.
Давление насыщенного пара зависит от температуры и не зависит от объема.
Разберемся подробнее, почему так происходит.
Почему давление насыщенного пара не зависит от объема?
Рассмотрим этот вопрос на примере дистиллированной воды.
Возьмем цилиндр с поршнем, в полости которого находится дистиллят в термодинамическом равновесии с паром. Начинаем двигать поршень вниз, объем цилиндра начинает уменьшаться, происходит сжатие насыщенного пара, при этом мы поддерживаем постоянную температуру.
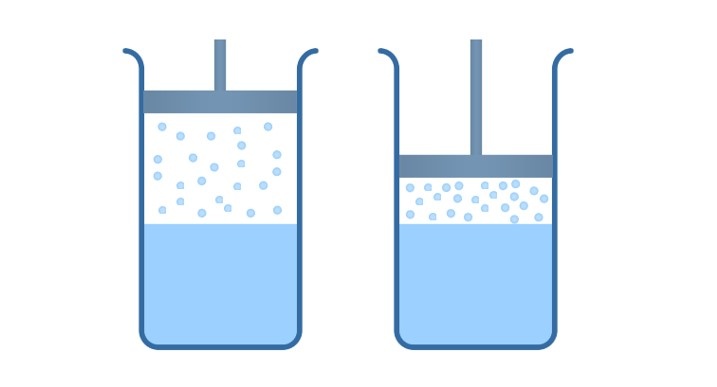
Система начнёт выходить из равновесия, плотность пара будет увеличиваться, и из газообразной фазы в жидкую будет переходить молекул больше, чем из жидкой в газообразную.
Другими словами, мы будем наблюдать процесс превращения насыщенного пара обратно в жидкость, этот процесс называется конденсация.
Если мы начнем поднимать поршень, объем полости увеличится, концентрация водяных паров над жидкостью начнет уменьшаться, вследствие чего, вода в сосуде начнет испаряться до тех пор, пока давление и концентрация насыщенного пара над жидкостью не придет в исходное состояние, то есть пока не наступит термодинамическое равновесие.
Из выше сказанного мы делаем вывод, что концентрация молекул насыщенного пара над жидкостью при постоянной температуре не зависит от его объема.
P=nkT,P=nkT,
где PP – давление пара (Па), nn – концентрация молекул пара (м-3), kk – постоянная Больцмана (равна 1,380649 Дж/К), ТТ – температура (К).
Из приведенной формулы мы видим, что давление насыщенного пара прямо пропорционально концентрации молекул и температуре паров над жидкостью (или твердым веществом) и, следовательно, не зависит от занимаемого им объема.
Как давление насыщенного пара зависит от температуры?
Из формулы, приведенной выше, мы наблюдаем, что давление насыщенного пара прямо пропорционально температуре термодинамической системы.
Несмотря на это, экспериментальная зависимость отличается от описанной уравнением, и давление пара увеличивается с большей скоростью с повышением температуры, нежели по линейному закону. Почему так происходит?
Всё дело в том, что во время увеличения подведенной температуры растёт и скорость испарения жидкости (или сублимации твёрдого вещества), вследствие этих факторов, увеличивается и концентрация испарённых (или сублимированных) молекул в газообразном состоянии над жидкой (или твёрдой) фазой. Поэтому и давление насыщенных паров изменяется быстрее. Плотность пара будет возрастать до тех пор, пока термодинамическое равновесие для данной температуры вновь не восстановится.
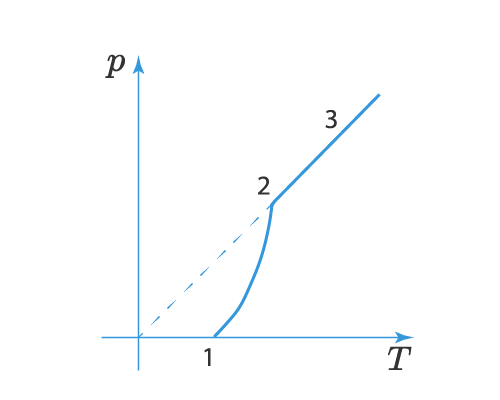
На участке 1-2 мы как раз видим влияние двух факторов – увеличение температуры и концентрации паров. В точке 2 вся жидкость испаряется (или твердое вещество сублимируется) и пар становится ненасыщенным, тогда давление начинает расти по линейному закону, что видно на участке 2-3.
Значения давления насыщенного пара для воды и других веществ при различных температурах получены эмпирическим методом. Эти данные можно найти в справочных материалах.
Тест по теме «Давление насыщенного пара»
Калькулятор определяет парциальное давления водяного пара в зависимости от температуры.
Определение парциального давления водяного пара.
Примечание.
Расчет выполнен на основании п.8.6. СП 50.13330.2012 «Тепловая защита зданий». Парциальное давление насыщенного водяного пара по данной формуле определяется в пределах температур от минус 40 °С до плюс 45 °С.
Для внутреннего воздух помещения парциальное давления рассчитывается с учетом относительной влажности:
Расчет парциального давления насыщенного водяного пара внутреннего воздуха.
Для наружного воздух парциальное давление определяется согласно таблицы 7 СП 131.13330.2018 «Строительная климатология. Актуализированная редакция СНиП 23-01-99*»:
Строительная климатология онлайн. Данные из СП 131.13330.2018 (СП 131.13330.2012).
В комментарии приветствуются пожелания, замечания и рекомендации по улучшению программы.
Поделиться ссылкой:
Как рассчитать давление насыщенного пара?
Анонимный вопрос
15 января 2019 · 5,6 K
Мои интересы: разнообразны, но можно выделить следующие: литература, история… · 28 янв 2019
Чтобы найти давление пара при данной температуре, воспользуйтесь уравнением Клапейрона-Клаузиуса: ln(P1/P2) = (ΔHvap/R)((1/T2) – (1/T1)), где:
- ΔHvap – энтальпия испарения жидкости. Ее, как правило, можно найти в таблице в учебниках по химии.
- R – газовая постоянная, равная 8,314 Дж/(K×моль)
- T1 – начальная температура (при которой давление пара известно).
- T2 – конечная температура (при которой давление пара неизвестно).
- P1 и P2 – давление пара при температуре T1 и T2, соответственно.
4,4 K
Комментировать ответ…Комментировать…
