Насыщенный пар
-
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
-
Испарение и конденсация
-
Динамическое равновесие
-
Свойства насыщенного пара
-
Влажность воздуха
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее — испарится. Что такое испарение и почему оно происходит?
Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и большую сторону.
На рис. 1 изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный «хвост» графика — это небольшое число «быстрых» молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.

Рис. 1. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т.е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение — это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости (при особых условиях превращение жидкости в пар может происходить по всему объёму жидкости. Данный процесс вам хорошо известен — это кипение).
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара — процесс, обратный испарению жидкости.
к оглавлению ▴
Динамическое равновесие
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
Давление и плотность насыщенного пара обозначаются и
. Очевидно,
и
— это максимальные давление и плотность, которые может иметь пар при данной температуре. Иными словами, давление и плотность насыщенного пара всегда превышают давление и плотность ненасыщенного пара.
к оглавлению ▴
Свойства насыщенного пара
Оказывается, что состояние насыщенного пара (а ненасыщенного — тем более) можно приближённо описывать уравнением состояния идеального газа (уравнением Менделеева — Клапейрона). В частности, имеем приближённое соотношение между давлением насыщенного пара и его плотностью:
(1)
Это весьма удивительный факт, подтверждаемый экспериментом. Ведь по своим свойствам насыщенный пар существенно отличается от идеального газа. Перечислим важнейшие из этих отличий.
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма.
Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастёт, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернётся к своему прежнему значению.
Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т.е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объёма.
Это следует из того, что плотность насыщенного пара не зависит от объёма, а давление однозначно связано с плотностью уравнением (1).
Как видим, закон Бойля — Мариотта, справедливый для идеальных газов, для насыщенного пара не выполняется. Это и не удивительно — ведь он получен из уравнения Менделеева — Клапейрона в предположении, что масса газа остаётся постоянной.
3. При неизменном объёме плотность насыщенного пара растёт с повышением температуры и уменьшается с понижением температуры.
Действительно, при увеличении температуры возрастает скорость испарения жидкости.
Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится.
Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара.
Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону.
В самом деле, с увеличением температуры возрастает плотность насыщенного пара, а согласно уравнению (1) давление пропорционально произведению плотности на температуру.
Зависимость давления насыщенного пара от температуры является экспоненциальной (рис. 2). Она представлена участком 1–2 графика. Эту зависимость нельзя вывести из законов идеального газа.

Рис. 2. Зависимость давления пара от температуры
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3).
Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
к оглавлению ▴
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Из уравнения Менделеева-Клапейрона (1) следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1), напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Насыщенный пар» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
Анализируя материал предыдущего раздела
можно сформулировать другое определение
давления насыщенных паров – это
давление пара, находящегося в равновесии
с жидкостью при данных термодинамических
условиях и соотношении объемов фаз.
Такая характеристика позволяет судить
о склонности нефтей и нефтепродуктов
к образованию паровых пробок, например
в трубопроводе, потерях при испарении
и хранении в резервуарах и т.д., и является
основным показателем испаряемости и
стабильности товарных нефтепродуктов.
![]()
(1.19)
Давление насыщенных паров рS
химически однородных жидкостей и
азеотропных (не изменяющих свой состав
в процессе испарения) веществ изучено
достаточно хорошо. Установлено, что рS
зависит от температуры и может быть
определено с помощью простой формулы:
где рST – давление насыщенных
паров при температуре Т; рSTo
– давление насыщенных паров при известной
температуре То; k –
эмпирический коэффициент.
Таблица 1.8
Давление насыщенных паров алканов
(рАБС)
|
ºС |
Давление, МПа |
||||||||
|
С2Н5 |
С3Н8 |
i-С4Н16 |
С4Н10 |
i-С5Н10 |
C5Н10 |
С6Н14 |
С7Н16 |
С8Н18 |
|
|
-10 |
1,786 |
0,332 |
0,105 |
0,087 |
– |
– |
– |
– |
– |
|
-5 |
2,040 |
0,392 |
0,125 |
0,082 |
0,041 |
– |
– |
– |
– |
|
0 |
2,308 |
0,448 |
0,150 |
0,100 |
0,033 |
0,023 |
0,003 |
– |
– |
|
5 |
2,502 |
0,332 |
0,179 |
0,121 |
0,051 |
0,029 |
– |
– |
– |
|
10 |
2,922 |
0,617 |
0,211 |
0,143 |
0,075 |
0,036 |
0,010 |
0,003 |
0,001 |
|
15 |
3,253 |
0,711 |
0,247 |
0,171 |
0,062 |
0,046 |
0,012 |
0,004 |
– |
|
20 |
3,672 |
0,817 |
0,289 |
0,197 |
0,105 |
0,055 |
0,016 |
0,005 |
0,002 |
|
25 |
4,051 |
0,934 |
0,334 |
0,238 |
0,089 |
0,066 |
0,020 |
0,005 |
– |
|
30 |
4,504 |
1,050 |
0,386 |
0,274 |
0,145 |
0,079 |
0,024 |
0,008 |
0,003 |
|
35 |
4,795 |
1,204 |
0,443 |
0,318 |
0,125 |
0,084 |
– |
0,010 |
– |
|
40 |
tкип |
1,353 |
0,508 |
0,365 |
– |
0,112 |
0,037 |
0,012 |
0,004 |
|
29 45 |
– |
1,527 |
0,579 |
0,420 |
0,171 |
0,131 |
0,040 |
0,015 |
– |
Давление рS
паров индивидуальных углеводородов и
нефтяных фракций можно определить,
пользуясь различными графиками или
например табл. 1.8.
![]()
(1.20)
Для смеси жидких углеводородов
согласно закону Рауля
давление насыщенных паров зависит от
давления насыщенных паров отдельных
компонентов и от мольных концентраций.
Парциальное давление рi
любого компонента в жидкой смеси равно
произведению давления насыщенного пара
рSi
чистого компонента на его мольную
концентрацию хi в чистом
виде, т.е. упругость паров жидкости равна
сумме давлений компонентов этой смеси,
которую они бы имели, если бы каждый
занимал при данной температуре весь
объем смеси, т.е. сумме парциальных
давлений, или согласно закону Дальтона
(1802 г.) парциальное давление рi
компонента, входящего в состав паровой
фазы, равно произведению мольной
концентрации компонента в паровой фазе
на общее давление, т.е
![]()
(1.21)
рi = рSyi.
(1.22)
Таким образом, из уравнений (1.21÷1.22) имеем
хiрSi
= рSyi.
(1.23)
Уравнение (1.23) известно под названием
объединенного закона Дальтона
– Рауля, согласно которому можно
сделать важный вывод – в состоянии
равновесия парциальное давление любого
компонента смеси в паровой фазе равно
парциальному давлению того же компонента
в жидкости.
Из приведенного уравнения следует, что
рSi/pS
= yi/xi = ki
= const
или
рSi = kpiрS
и yi = kpixi.
(1.24)
Коэффициент kрi,
который называют константой
равновесия, у отдельных компонентов
зависит от температуры и давления и
определяется, как правило, из специально
составленных графиков. Приведенные
уравнения позволяют, например, найти
состав газовой фазы по известному
составу жидкостей и наоборот.
Константы равновесия (в зарубежной
литературе больше известны как константы
фазового распределения) дают возможность
прогнозировать материальный баланс
многокомпонентных двухфазных систем
(концентрации компонентов в разных
фазах) при условии, если заданы давление
и температура и известна также молярная
концентрация i-го компонента в
однофазном состоянии xi0.
30
Для любого компонента число молей в
двух фазах определяется как сумма Niг
и Niж, т.е. Ni0
= Niг + Niж.
Отсюда молярная концентрация:
xi0
= уiг + хiж,
где г и ж
– числа, показывающие соответственно,
какая доля общего количества молей
находится в газообразном и жидком
состоянии (г + ж= 1).
На практике при расчете ж используют
метод последовательного приближения,
легко реализуемого с помощью персонального
компьютера. При этом полагают, что
xi = 1.
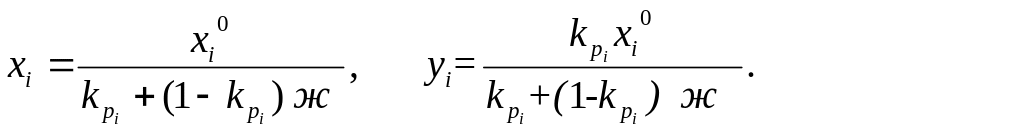
Учитывая,
что уi/xi = 1,
можно получить следующее выражение для
концентрации i-го компонента в жидкой
и газообразной фазах:
а) для жидкой фазы:
![]()
![]()
б) для
газообразной фазы:
В двухкомпонентной системе равновесные
составы могут быть определены значительно
проще.
Приоритет в исследовании констант
фазового равновесия углеводородов
принадлежит американскому нефтяному
институту АРJ,
диаграммы которого широко используются
в нефтепереработке. Известна также
методика NGPSA, позволяющая
определить значение kр
при температурах, достигающих 430С.
Опубликованные в печати варианты этих
методик весьма сложны и неудобны для
практического использования, а варианты
компьютеризации схем являются
собственностью разработчиков: Тодда,
Лесли, Доулинга, Сталла, Соавва, Шервуда
и др. Можно отметить публикации
отечественных авторов: А.И. Гриценко,
Г.Р. Гуревича, В.П. Мамуны, Т.Д. Островского,
Г.М. Ярышева, и др. В Сибирском
научно-исследовательском институте
(СибНИИНП) Шиловым В.И. впервые
экспериментально подтвержден метод
определения kp
в зависимости от молекулярной массы
различных нефтей Западной Сибири
применительно к условиям нефтепромыслов
с высокими значениями абсолютного
давления со средней погрешностью 13,8%.
Максимальное отклонение 44% установлено
для нормального октана.
Д
31
аже при низких давлениях и температурах
константы равновесия мало зависят от
состава смеси, а постоянными их можно
считать при фиксированных давлениях и
температуре и лишь для идеальных
растворов. В настоящее время в России
накоплен достаточно большой
экспериментальный материал, однако
значение константы kiр
можно использовать в расчетах
парожидкостного равновесия только для
систем, адекватных лабораторным.
Последнее условие в значительной степени
снижает достоинства такой информации
в условиях постоянного изменения
составов фаз, имеющих место, например
при испарении нефтей с открытой
поверхности. Расчетные методы основаны
на использовании уравнений реальных
газов и могут быть весьма полезными.
при статистической
обработке большого объема информации
в ТюмГНГУ были разработаны методики
расчета коэффициента kp
при низких давлениях (0,10,2
МПа) и температурах от 273 до 330 К. Для
алканов получена зависимость
lg kp
= 6,8 – 2,7nH
+ (2000 + 540nH)T-1
–
р/рат,
(1.25)
для алкенов и аренов рекомендуется
следующая формула
lg kp =
6,8 – 2,7nH +
1990[1 + 0,302nH –
9,95(nH –
nHФ)nНФ-1]T-1
– р/рат
(1.26)
где nH
– число атомов водорода у алканов;
nНФ
– число атомов водорода у нафтенов
(цикланов) или у аренов; р и рат
– абсолютное и атмосферное давление,
соответственно.
В
предложенных уравнениях (1.25,
1.26) впервые
использован количественный состав
водорода, определяющий, по мнению
авторов, летучесть нефтяной фракции
или конденсата. Это предположение в
значительной степени упрощает
соответствующие расчеты по сравнению
с зарубежными аналогами.
Закономерность изменения коэффициентов
фазового распределения компонентов
kрi
от температуры системы t,
заданная с помощью экспериментальных
данных, оказалась близкой к экспоненциальной
![]()
.
(1.27)
32
Для нахождения коэффициентов Ai
и Ci
разработаны программы
на ПЭВМ, реализующая вышеописанный
метод нелинейной регрессии.
Использование разработанного алгоритма
оказалось весьма удобным и эффективным
при обработке автором настоящей работы
результатов последующих аналогичных
экспериментальных исследований,
описанных в следующих главах. В качестве
примера в табл. 1.9
приведены значения коэффициентов
полученной зависимости (1.27)
для чистых компонентов смеси.
Таблица
1.9
Значения
коэффициентов для чистых углеводородов
|
Коэффи-циенты |
Компонент |
|||||||
|
CH4 |
C2H6 |
C3H8 |
iC4H10 |
C4H10 |
IC5H12 |
C5H12 |
C6H14 |
|
|
Аi |
127,14 |
17,31 |
4,55 |
1,57 |
1,08 |
0,32 |
0,24 |
0,055 |
|
Сi |
0,324 |
0,529 |
0,622 |
0,757 |
0,811 |
0,973 |
1,027 |
1,270 |
Закономерность
изменения коэффициентов фазового
распределения kрi
узких фракций от температуры системы
t, также близка к экспоненте и
удовлетворительно аппроксимируется
следующей функцией:
![]()
, (1.28)
где tК
– средняя температура кипения
фракции, С.
регрессионные
модели (1.27),
(1.28) адекватны
по критерию Фишера и
характеризуются малой погрешностью
расчета (не более 5÷15%) с коэффициентом
множественной корреляции R
= 0,97. В качестве примера для ряда
углеводородов на рис. 1.7
показано графически отклонение расчетных
значений коэффициента фазового
распределения kрi
от экспериментальных.
С повышением температуры и общего
давления давление насыщенных паров
отдельных компонентов смеси существенно
увеличивается, дополнительно характеризуя
отклонение от идеального газа. Таким
образом, в уравнения, характеризующие
состояние и соотношения паровоздушной
среды, Л.Г. Льюисом (1901 г.) была введена
величина фугитивность f,
значение которой приближается к давлению
насыщенных паров при бесконечном
уменьшении последней, т.е.
![]()
(1.29)
В ряде случаев целесообразно использовать
соотношение фугитивности и давления
насыщенных паров, называемое коэффициентом
активности вещества аФ
(в зарубежной литературе часто
встречается под названием коэффициента
летучести):
![]()
Коэффициент
фугитивности показывает, во сколько
раз фугитивность больше давления
насыщенных паров и более точно выражает
стремление вещества переходить из
жидкой фазы в паровую.
Для инженерных расчетов обычно используют
зависимость аФ
от приведенных рПР
и ТПР.
33
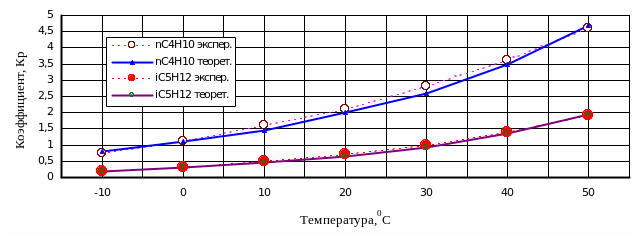

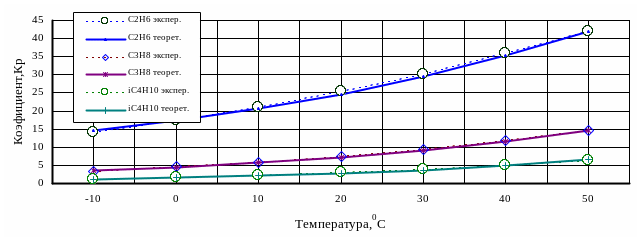
Рис. 1.7. Отклонение
расчетных значений коэффициента
фазового распределения от экспериментальных
34
Рис. 1.7. Отклонение расчетных значений
коэффициента фазового распределения
kрi
от экспериментальных
значений
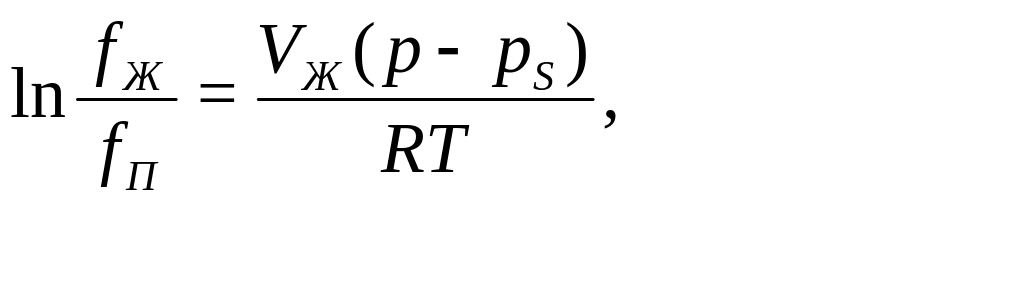
При
отсутствии равновесия отношение
фугитивности жидкости к фугитивности
пара можно определить по уравнению
где fЖ – фугитивность компонента
в чистом виде при давлении р и
температуре Т; fП –
фугитивность компонента при давлении
насыщенного пара; р – давление
смеси; рS – давление насыщенных
паров компонента.
К понятию фугитивности легко прийти
путем анализа уравнений состояния
идеального газа при постоянной
температуре:
Vdр = RT d(ln р) = RT d(ln f).

Когда
величина объема известна как функция
давления или определена непосредственным
измерением или расчетным путем по
уравнениям состояния, изменение
фугитивности можно установить путем
интегрирования:
![]()
Т.к.
аФ = 1 при р = 0, то можно
определить абсолютное значение
коэффициента фугитивности:
Таким образом, очевидно, что интегрируемая
функция представляет собой отклонения
от поведения идеального газа и при р
= 0 также стремится к нулю.
Ф
35
азовые превращения (переход из
жидкого состояния в газообразное) в
условиях транспорта и хранения таких
многокомпонентных веществ, как нефть
и нефтепродукты, вследствие исключительной
сложности их состава протекают значительно
сложнее, чем химически однородных
веществ. В процессе испарения постепенно
испаряются более легкие фракции, в
результате чего жидкая фаза утяжеляется.
Таким образом, в течение процесса
изменяются и парциальные давления
индивидуальных углеводородов, общее
давление насыщенного пара нефтепродуктов
всегда выше на 1030%,
чем следовало бы ожидать из закона
аддитивности. Напомним, что аддитивность
– свойство ряда химических веществ,
состоящее в том, что значение величины,
соответствующее целому объекту, равно
сумме значений величин, соответствующих
его частям. Например, масса вещества
равна сумме масс его компонентов.
![]()
(1.31)
Давление рS
паров моторных топлив при нормальных
условиях t = 0ºC
можно определить по известной формуле
Г.Ф Большакова:
где tК – средняя температура
кипения, ºС.
В интервале температур от –30 до +100ºС
можно использовать формулу П.А. Рыбакова:
рSt
= р38 · 104,6-1430/T,
мм. рт. ст.
(1.32)
или следующую зависимость Г.Ф. Большакова:
lg рS
= B – A/T,
(1.33)
где рS – давление насыщенных
паров, Па; А и В – коэффициенты.
При определении давления насыщенных
паров нефтей и нефтепродуктов на практике
необходимо учитывать два случая:
-
когда
объем паровой фазы VП по
сравнению с объемом жидкой фазы VЖ
невелик, можно считать, что в состоянии
насыщения состав жидкой фазы не меняется
и что последняя находится в равновесии
с насыщенным паром; -
когда
VП значительно больше VЖ,
испарение наиболее летучих компонентов
продукта приводит к изменению состава
жидкости и в состоянии насыщения пар
находится в равновесии с жидкостью, но
уже измененного состава. Давление пара
в этом случае будет отличаться от
давления пара, определенного для
небольшого объема VП и
будет тем больше, чем меньше соотношение
VП/VЖ.
Давление рS при объеме паровой
фазы, близком к нулю, принимает максимальное
значение и определяется давлением паров
наиболее легких углеводородов:
Т![]()
аким
образом, при характеристике давления
насыщенного пара нефтепродуктов или
нефтей необходимо указывать кроме
температуры и соотношение объемов VП
и VЖ, при котором
проведены следующие соответствующие
измерения рS. При решении
инженерных задач выбор соотношения
VП/VЖ (при
котором следует определять рS)
должен исходить из конкретных
производственных условий. Особенно
это важно для таких случаев, когда
VП/VЖ
и пары далеки от
насыщения, или когда
VП/VЖ
0 и давление
насыщенных паров имеет максимальное
значение.
З![]()
36
ависимость давления насыщенных
паров нефтяных топлив от соотношения
фаз с достаточной точностью описывается
формулой Н.И. Тихонова:
Известно аналогичное
уравнение для определения рS
в резервуаре:
рS = 1,29(t/38)0,69(VЖ/V)0,19рS38,
(1.34)
где t
– температура поверхности жидкости.
На практике давление насыщенных паров
обычно определяется различными методами:
-
методом
Рейда, заключающимся в регистрации по
манометру избыточного давления
насыщенных паров нефтепродуктов,
помещенном в специальную «бомбу» и
нагретым до 37,8ºС (38ºС),
причем соотношение жидкой и паровой
фаз в бомбе Рейда составляет 1:4 (ГОСТ
1756-52); -
методом Валявского-Бударова, основанным
на определении изменения объема паров
смеси при нагреве нефтепродуктов до
37,8ºС в стеклянном приборе, при этом
соотношение жидкой и паровой фаз принято
равным 1:1.
В настоящее время известно значительное
количество работ: Ф.Ф. Абузовой, И.С.
Бронштейна, Л.Р. Хакимьяновой, Д.М.
Саттаровой, В.Ф. Новоселова, А.А. Коршака
и других специалистов ВНИИ НП, ГрозНИИ,
БашНИИ, МИН и ГП, ВНИИгаз, УНИ,
УфНИИ, ТПИ и др., в которых на достаточно
высоком уровне изучены давления
насыщенных паров различных нефтепродуктов
и нефтей. Отмечается, например,
несовершенство, длительность, трудоемкость,
плохая сходимость результатов изменения
рS по методу Рейда.
Точность метода невысока, расхождения
между параллельными определениями
составляют около 4 кПа, на что влияет
отбор и заправка бомбы, квалификация
персонала, время года и т.д. Величины
давления насыщенных паров, определенные
по методу Рейда, обычно на 0,0080,01
МПа ниже значений, полученных по методу
Валявского-Бударова.
Следует отметить, что в процессе хранения
нефтепродуктов величина соотношения
жидкой и паровой фаз может меняться от
бесконечности (при хранении в резервуаре
с плавающими крышами или понтонами,
когда практически отсутствует паровая
фаза) до нуля при полной откачке
нефтепродукта из резервуара. Так, для
автомобильных бензинов при отношении
объема жидкой фазы к паровой 10:1 (при
заполнении резервуаров на 90%) давление
насыщенных паров может быть в 2 раза
больше, чем при заполнении резервуара
на 10% (отношение фаз 1:10).
У
37
совершенствованный метод
экспериментального определения давления
насыщенных паров нефтей, летучих невязких
нефтепродуктов и моторных топлив
установлен ГОСТом 28781-90. Особенность
этого метода состоит в предварительном
диспергировании анализируемой пробы
в аэрозольное состояние (с использованием
аппарата механического диспергирования
типа «Вихрь»).

![]()
(1.35)
Расчетное
определение давления рS (в
МПа) насыщенного пара жидких углеводородных
смесей по ГОСТ 28656-90 осуществляется при
фиксированной температуре, исходя из
известного компонентного состава и
фугитивности компонентов смеси.
Используется следующая приближенная
формула:
где xi и fi –
содержание и фугитивность i-го
компонента в жидкой среде, соответственно.
Поскольку фугитивности компонентов
заметно зависят от общего давления в
системе, то расчет по этой формуле
проводят итерационно. В обсуждаемом
стандарте приведены подробные таблицы
фугитивности чистых компонентов
сжиженного газа при разных температурах
и давлениях.
Давление рS у различных
нефтепродуктов по Рейду колеблется в
следующих пределах (в Па): автобензин –
до 9,33·104, авиабензин – до 4,8·104,
керосин – 0,4·1040,8·104,
дизельное топливо – 0,08·1040,13·104.
В
38
работах Ф.Ф. Абузовой, И.С.
Бронштейна для бензинов
уфимских нефтеперерабатывающих заводов
установлен более широкий диапазон
изменений рS38,
от 86 кПа до 126 кПа. В некоторых опытах
рS38
достигало примерно 149 кПа, а закипание
нефтей в резервуарах и транспортных
емкостях отмечалось при температурах
ниже температуры начала кипения,
определенной по ГОСТ 2177-66 и принятой за
единицу стабильности. В трубопроводном
транспорте стабильность нефтей ограничена
условиями поставки, согласно которым
рS38
не должно превышать 66650 Па. Тем не менее,
в реальных условиях эксплуатации
нефтепроводов с малым объемом газовой
фазы следует ожидать более высоких
значений давления равновесия, что очень
важно при производстве аварийно-восстановительных
работ.
И
39
сследования, проведенные под
руководством профессора Н.Н.
Константинова, а позднее сотрудниками
кафедры теплотехники Уфимского нефтяного
института под руководством Ф.Ф. Абузовой
показывают, что давление насыщенных
паров нефтей в большей степени зависит
от соотношения газовой и жидкой фаз. На
рис. 1.10 по кривым
равновесного состояния можно определить
значение рS38
при температуре, например 20ºС. Следует
обратить внимание на то, что рS
при соотношении Vп/Vж
= 0,1 превышало давление,
лимитированное техническими
условиями на нефть. Более того, при
соотношении Vп/Vж, близком к нулю,
давление насыщенных паров превышает
нормируемое практически во всем диапазоне
положительных температур. Данный факт
еще раз объясняет наблюдающееся повышение
давления в трубопроводе при производстве
аварийно-восстановительных работ,
обусловленных нарушением герметичности
линейной части. Температура начала
кипения бензинов также не всегда является
определяющим фактором величины давления
насыщения, что для нефтей и конденсатов
может быть значимо.
Давление насыщенных паров рS
характеризуется также величиной потерь
σ углеводородов, испарившихся из
первоначального объема. Но потери от
испарения нефтей, имеющих одинаковую
исходную и конечную упругость паров,
различны и зависят от углеводородного
состава.
При уменьшении
упругости паров с 1180 мм. рт. ст. до 450 мм.
рт. ст. (при 38ºС) потери нефти
Кулешовского месторождения составляют
4, Ромашкинского – 2, Усть-Балыкского –
всего 0,25%. Поэтому для определения
давления насыщенных паров необходимо
априори знать зависимость рS
= ƒ(σ) для каждой нефти. В случае,
когда экспериментальным путем найдена
величина рS при потере вещества
σ, давление насыщенных паров при
той же температуре и при любом значении
σi можно рассчитать по
формуле
рSi
= рS
e –k(σi-
σ) .
(1.36)
Здесь следует напомнить,
что если смесь не
является постоянно испаряющейся, то
величина давления данных компонентов
над смесью будет также изменяться.
Зависимость рS
от температуры для разных нефтей также
неодинакова. Для точных расчетов
необходимо еще знать зависимость рS
от температуры для каждого вещества.
Экспериментальные исследования
показывают УфНТУ, что значение pS
при заданной температуре для различных
сортов нефтепродуктов и даже для разных
образцов одного нефтепродукта значительно
различаются и не могут
быть точно рассчитаны по стандартным
физико-химическим показателям, хотя
при расчете потерь от испарения в
резервуарах при относительно небольших
уровнях потерь σ = 10,5%
весовых параметр pS является
одним из основных. В условиях
испарения нефтей с открытой поверхности,
когда объем паровой фазы бесконечно
превосходит объем жидкой фазы, пары
далеки от насыщения.
Целесообразно заметить,
что стандартизованный метод определения
давления насыщенных паров по ГОСТ
28656-90 в силу предельного упрощения
расчетной схемы также оказывается не
очень точным. Поэтому в настоящее время
лучше использовать более строгие
расчетные методы, основанные на
современных уравнениях состояния
многокомпонентных смесей.
Таким образом, исходя
из сказанного выше, для определения
потерь нефтей от испарения с открытой
поверхности использование давления
насыщенных паров в качестве исходной
характеристики представляется не
корректным.
![]()
Для
расчета давления насыщенных паров
чистых углеводородов рекомендуется
использовать известную формулу Антуана:
г
40
де Ai, Bi, Ci – коэффициенты в табл.
1.3.
![]()
Давление
насыщенных паров конденсатов с известным
углеводородным составом можно определить
по следующей зависимости:
где kР – эмпирический
коэффициент; xi – концентрация
углеводорода в конденсате.
Результаты исследований pS
стабильных и деэтанизированных
конденсатов по методу Рейда, представленные
на рис. 1.10, указывают на значительный
разброс данных, особенно для
деэтанизированного конденсата, что
легко объясняется различным составом
в конденсатах легких углеводородов.
При известной концентрации легких
углеводородов в конденсатах
экспериментальные значения pS
удовлетворительно аппроксимируются
следующей зависимостью:
![]()
(1.38)
где рSi, xi –
парциальное давление и концентрация
i-го компонента, kS –
коэффициент, характеризующий отклонение
формулы (1.38)
от закона аддитивности. Для исследованных
стабильных конденсатов kS
= 1,3, для деэтанизированных kS
= 1,15.
Таблица
1.10
Значения
коэффициентов Антуана
|
Углеводороды |
А |
Б |
С |
От Т |
до Т |
|
С2Н6 |
9,5784 |
1030,628 |
39,083 |
244 |
305 |
|
С3Н8 |
9,4337 |
1048,900 |
5,610 |
232 |
301 |
|
n-С4Н8 |
9,1181 |
1030,340 |
-22,190 |
272 |
348 |
|
i-С4Н8 |
9,3117 |
1120,165 |
-1,297 |
252 |
407 |
|
n-С5Н10 |
8,9995 |
1075,820 |
-39,791 |
244 |
393 |
|
i-С5Н10 |
8,9345 |
1020,010 |
-40,053 |
244 |
737 |
|
С6Н10 |
9,0026 |
1171,530 |
-48,784 |
214 |
423 |
В заключение следует отметить, что
давление насыщенных паров не следует
путать с давлением насыщения, которое
соответствует моменту появления первых
пузырьков газа из газонасыщенной нефти
при понижении давления. Как правило,
абсолютное значение давления насыщенных
паров значительно меньше давления
насыщения, которое, например, для
пластовых нефтей обычно составляет
1,2÷9,0 МПа.
Насыщенный пар используется во многих областях промышленности, поэтому для работы различных устройств важно поддерживать состояние насыщения пара.
Рассмотрим, как определить насыщенный пар или нет. Также в статье даны способы определения насыщенности пара, формула и примеры расчета.
Содержание
- Данные для определения насыщенности
- Методы
- Как найти?
- Как рассчитать?
- Несколько примеров
- Где эти расчеты могут пригодиться на практике?
- Заключение
Данные для определения насыщенности
Насыщенный пар или нет, можно определить, зная условия его возникновения и зависимость от различных факторов:
- Этот тип пара образуется только в закрытых сосудах.
- Образуется только над поверхностью исходной жидкости или льдом.
- Имеет свойство конденсации.
- Насыщен влагой.
- Температура пара всегда равна температуре его жидкости.
- Плотность и давления такого пара не зависят от объема.
- Насыщенный пар имеет прямую зависимость от температуры и давления.
Насыщенный пар находится в термодинамическом равновесии с жидкостью из которой он образован. На это указывает равенство массы испарения и последующей конденсации.

Методы
Математический способ определения насыщенного пара используется при вычислении на основе имеющихся данных о его давлении, температуре, влажности и по иным параметрам.
Также есть метод определения на основе отдельных данных:
- Замер температуры пара. Указывает на состояние насыщенного пара при условии равенства температур газа и жидкости. Любое отклонение от равенства укажет на потерю динамического равновесия и уровня влажности.
- По давлению. Измеряется давление пара и сравнивается с табличной величиной при актуальной температуре.
- По степени конденсации. Рассчитывается температура конденсата и скорость его образования.
- По уровню влажности. Влажность насыщенного пара всегда равна 100%.
Также существует метод определения по точке кипения. Он основан на расчете скорости парообразования при актуальном давлении. Например, при давлении 101 кПа, точкой парообразования является температура 100 градусов.
Существуют также некоторые лабораторные методы определения:
- статический,
- динамический,
- кинетический.
Они также основаны на замерах температуры, давления, плотности, влажности и конденсации при определенных условиях и сравнении полученных данных с таблицей насыщенного пара по температуре и давлению.
Как найти?
Свойства насыщенного пара не позволяют приравнивать его к идеальному газу, поэтому для его расчета используется формула Менделеева-Клапейрона.
Как рассчитать?
Расчет выполнятся по формуле: pV=vRT.
 Уравнение состоит из:
Уравнение состоит из:
- «p» — давление насыщенного пара (Па);
- «V» — его объем (м3);
- «v» — общее количество вещества (моль);
- «R» — газовая постоянная (8,31 м2);
- «T» — температура среды (К).
Данная формула помогает рассчитать не только параметры насыщенного пара, но и их изменения при изменении плотности, объема или давления.
Несколько примеров
Задача:
- В цилиндре находится насыщенный пар и вода при постоянной температуре.
- Поршень сдвигается, уменьшая свободный объем пространства.
- Выяснить, как повлияет уменьшение объема на общую массу жидкости.
Ответ: масса жидкости увеличится, по причине обратного фазового перехода пара в жидкость.
Согласно уравнению pV=m/u*Rt, при снижении общего объема пара не последует снижения его давления, а значит пар конденсируется обратно в воду, увеличив ее общую массу.
Задача:
- Температура насыщенного пара 100 градусов.
- Давление 101 кПа.
- Плотность неизвестна.
Решение: P=pu/Rt=105*18*10-3/8,31*373=0,5 кг/м3.
Ответ: насыщенный пар при температуре 100 градусов по Цельсию и при давлении 101 кПа имеет плотность 0,5 кг/м3. При решении данной задачи использовались табличные величины молярной массы, газовой постоянной и давлении при данной температуре.
Где эти расчеты могут пригодиться на практике?
 Расчет состояния насыщенного пара используется во многих сферах:
Расчет состояния насыщенного пара используется во многих сферах:
- при проектировании бытовых систем вентиляции и кондиционирования;
- для эффективной работы отопительных систем;
- при проектировании и поддержании работы паровых турбинных установок.
На основе этих расчетов строятся «умные» датчики влажности, которые реагируют на количество молекул воды или иных веществ в воздухе. Свойства насыщенного пара также применяются при выпаривании летучих веществ с их очисткой за счет последующей конденсации их насыщенных паров.
Заключение
Свойства насыщенного пара не делают его идеальным газом, но позволяют использовать в быту и в промышленности. Этот пар является идеальным источником тепла, влажности и помогает разделять химические элементы за счет способности к конденсации.
Формула расчета по уравнению Менделеева-Клапейрона позволяет рассчитать основные параметры пара и определить степень его схожести с насыщенным.
Как найти давление насыщенного пара
Насыщенный пар находится в динамическом равновесии с жидкостью или твердым телом такого же химического состава. Давление насыщенного пара зависит от других показателей пара: к примеру, температурная зависимость давления насыщенного пара позволяет судить о температуре кипения вещества.
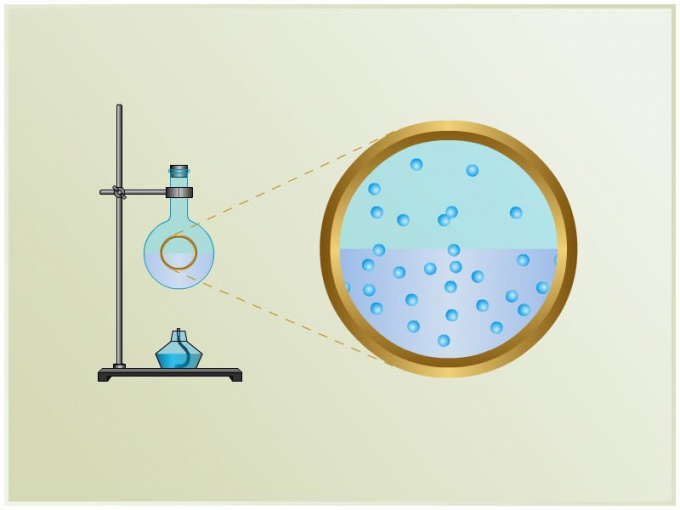
Вам понадобится
- – сосуд;
- – ртуть;
- – пипетка;
- – вода;
- – спирт;
- – трубки;
- – эфир.
Инструкция
Количество молекул, вылетающих за одну секунду с единицы площади поверхности жидкости, напрямую зависит от температуры этой жидкости. При этом количество молекул, возвращающихся из пара в жидкость, обусловлено концентрацией пара и скоростью теплового движения его молекул. А значит, концентрация молекул пара при равновесии пара и жидкости зависит от равновесной температуры.
Поскольку давление пара находится в зависимости с его температурой и концентрацией, напрашивается вывод: давление насыщенного пара зависит лишь от температуры. С увеличением температуры возрастает давление насыщенного пара, а также его плотность, при этом же плотность жидкости из-за теплового расширения уменьшается.
Давление насыщенных паров разных жидкостей при одинаковой температуре может сильно отличаться. Убедиться в этом поможет проведенный опыт.
В сосуд, в котором находится ртуть, опустите несколько барометрических трубок. Трубка а будет служить барометром. Трубку b при помощи пипетки наполните водой, в трубку c введите спирт, а в трубку d – эфир.
Наблюдайте за происходящим. Так, в трубке b часть воды в «торричеллиевой пустоте» очень быстро испарится, а оставшаяся часть скопится над ртутью в виде жидкости (это признак того, что над ртутью находится насыщенный водяной пар).
Сравните высоту ртутного столба в барометре с высотой ртути в трубках b, c и d. Разность между высотой столба ртути в каждой из трех трубок и высотой ртутного столба в барометре и будет показателем давления насыщенного пара этой жидкости. Проведенный опыт доказывает, что наибольшим давлением в этом случае обладают насыщенные пары эфира, а наименьшим – водяные пары.
Если температура в закрытом сосуде достигает критического значения (Ткр) для вещества, которое в нем находится, то плотность его жидкости и пара становятся одинаковыми. Последующее увеличение температуры приводит к исчезновению физических различий между жидкостью и насыщенным паром.
Обратите внимание
Соблюдайте осторожность при работе с ртутью: этот металл токсичен!
Полезный совет
С повышением температуры в насыщенном паре увеличивается средняя кинетическая энергия движения молекул, а также их концентрация. Ввиду этого при увеличении температуры давление насыщенного пара значительно быстрее возрастает, чем давление идеального газа.
Источники:
- Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 26 мая 2021 года; проверки требуют 4 правки.

Прибор Рамзая для обнаружения парциального давления.
Во внутреннем сосуде Р из палладия находится смесь азота и водорода под общим давлением в 1 атм. Сосуд Р соединён с дифференциальным манометром и помещён в сосуд большего размера. При высоких температурах водород легко диффундирует через палладиевую оболочку, и стенки сосуда Р становятся полупроницаемыми — они проницаемы для водорода, но непроницаемы для азота. Пропуская нагретый водород с давлением в 1 атм через больший сосуд, исследователь обнаружит, что давление смеси газов в сосуде Р превысит 1 атм на величину парциального давления азота при данной температуре.
Парциа́льное давление (лат. partialis «частичный» от pars «часть») — давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре[1][2][3]. Общее давление газовой смеси является суммой парциальных давлений её компонентов.
В химии парциальное давление газа в смеси газов определяется как указано выше. Парциальное давление газа, растворённого в жидкости, является парциальным давлением того газа, который образовался бы в фазе газообразования в состоянии равновесия с жидкостью при той же температуре. Парциальное давление газа измеряется как термодинамическая активность молекул газа. Газы всегда будут вытекать из области с высоким парциальным давлением в область с более низким давлением; и чем больше разница, тем быстрее будет поток. Газы растворяются, диффундируют и реагируют соответственно их парциальному давлению и не обязательно зависимы от концентрации в газовой смеси.
Законы Дальтона парциального давления[править | править код]
Для идеального газа парциальное давление в смеси равно давлению, которое будет оказываться, если бы он занимал тот же объём, что и вся смесь газов, при той же температуре. Причина этого в том, что между молекулами идеального газа по определению не действуют силы притяжения или отталкивания, их соударения между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Насколько условия реально существующей смеси газов близки этому идеалу, настолько общее давление смеси равно сумме парциальных давлений каждого газа смеси, как это формулирует закон Дальтона[4]. Например, дана смесь идеального газа из азота (N2), водорода (H2) и аммиака (NH3):
, где:




Смеси идеальных газов[править | править код]
Мольная доля отдельных компонентов газа в идеальной газовой смеси может быть выражена в пределах парциальных давлений компонентов или молей компонентов:
и парциальное давление отдельных компонентов газов в идеальном газе может быть получено при использовании следующего выражения:
, где:





Мольная доля отдельного компонента в газовой смеси равна объёмной доле этого компонента в газовой смеси[5].
См. также[править | править код]
- Пар
- Газ, Идеальный газ и Уравнение состояния идеального газа
- Мольная доля и Моль
- Законы Дальтона
- Объёмный процент
- Закон Генри
Примечания[править | править код]
- ↑ Парциальное давление. Статья в физической энциклопедии. Дата обращения: 6 июля 2012. Архивировано 5 июля 2012 года.
- ↑ Charles Henrickson. Chemistry (неопр.). — Cliffs Notes, 2005. — ISBN 0-764-57419-1.
- ↑ Парциальное давление. Большая советская энциклопедия. www.booksite.ru. Дата обращения: 11 января 2021. Архивировано 13 января 2021 года.
- ↑ Dalton’s Law of Partial Pressures. Дата обращения: 29 января 2010. Архивировано из оригинала 22 декабря 2008 года.
- ↑ Pittsburgh University chemical engineering class notes. Дата обращения: 29 января 2010. Архивировано из оригинала 23 апреля 2009 года.

