Давление насыщенного пара растворителя над раствором. Закон Рауля
Если в замкнутый
сосуд, из которого предварительно
удалили воздух, поместить чистый
растворитель, например, воду (рис. 27), то
в результате естественного процесса
испарения над жидкостью образуется
пар. Он будет состоять из молекул
жидкости, оторвавшихся от ее верхнего
слоя в результате своего хаотического
теплового движения и перешедших в
газовую фазу. На совершение данного
процесса необходимо затратить определенное
количество энергии, чтобы преодолеть
силы притяжения между молекулами жидкой
фазы. Эндотермический процесс испарения
обратим. По мере накопления молекул в
газовой фазе над поверхностью жидкости
одновременно начнет протекать и обратный
процесс – конденсация пара, т.е. переход
молекул растворителя обратно в жидкость.
Причем конденсация является экзотермическим
процессом и сопровождается выделением
теплоты.
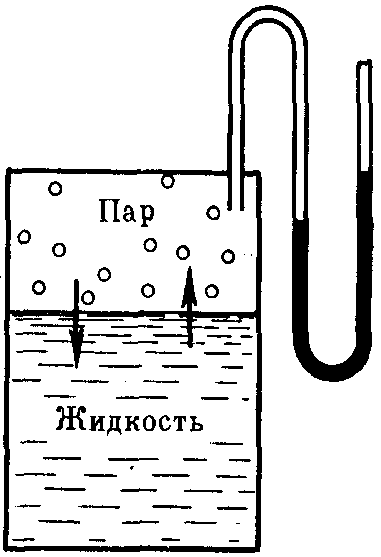
Рис. 27.Равновесие жидкость — пар (схема)
Со временем скорости
обоих процессов уравняются и в системе
установится динамическое равновесие,
при котором число молекул растворителя,
испарившихся с поверхности жидкости
за единицу времени, будет равно числу
молекул, перешедших в жидкость из
газообразной среды. Но при этом какое-то
постоянное и не меняющееся во времени
число молекул растворителя будет
находиться над его поверхностью, образуя
насыщенный пар. Давление этого пара
на жидкость называютдавлением
насыщенного пара чистого растворителя
(р0).Его можно измерить
с помощью манометра (рис. 27).
При неизменной
температуре и внешнем давлении р0
остается постоянным и зависит только
от природы жидкости и поэтому
является одной из ее физических
характеристик.
Так, при 293 K(20оС) давление насыщенного пара
Н2О равно 2,319 кПа; этилового спирта
– 5,85 кПа; диэтилового эфира – 58,93 кПа.
При повышении
температуры согласно принципа Ле-Шателье
равновесие смещается в сторону
эндотермического процесса испарения.
В результате чего количество молекул
жидкости над ее поверхностью начнет
увеличиваться. Это приведет к возрастанию
давления насыщенного пара, когда система
снова придет в равновесие.
Если растворить
небольшое количество какого-нибудь
нелетучего вещества1(молекулы которого не могут переходить
в газовую фазу) концентрация свободных
молекул растворителя в верхнем слое
жидкости уменьшится, т.к. часть мест там
займут частицы растворенного вещества.
Они к тому же будут удерживать вокруг
себя (связывать) ближайшие молекулы
растворителя, формируя из них сольватные
оболочки.
В этом случае
равновесие между жидкостью и ее насыщенным
паром устанавливается при более низком
давлении (р) по сравнению с давлением
насыщенного пара над чистым растворителем
(р0).
Опытным путем
было установлено, что для растворов
понижение давления насыщенного пара
растворителя (р0
– р = р)
не зависит от природы растворенного
вещества, а определяется только его
концентрацией.
Французский физик
Франсуа Рауль установил математическую
зависимость между р и мольной долей
растворителя, которая называется законом
Рауля:
р = р02,
где
2
– мольная доля растворителя в раствор.

Франсуа
Мари Рауль
(1830
– 1901) –
французский химик и физик, член-корреспондент
Парижской АН (1890). С 1867 работал в
Гренобльском университете (профессор
с 1870). Член-корреспондент Петербургской
АН (1899). Исследуя в 1882–1888
понижение температуры кристаллизации,
а также понижение давления пара (или
повышение температуры кипения)
растворителя при введении в него
растворённого вещества, открыл закон
Рауля, применяемый для определения
молекулярных масс веществ в растворённом
состоянии.
Таким образом,
согласно закону Рауля давление насыщенного
пара растворителя над раствором прямо
пропорционально мольной доле растворителя.
Часто закон Рауля
математически записывают по-другому:
![]() или
или
![]() ,
,
где
![]() – относительное понижение
– относительное понижение
давления насыщенного пара растворителя
над раствором; 1
– мольная доля растворенного вещества;
n1 –
химическое количество (моль) растворенного
вещества; n2
– химическое количество растворителя.
В этом случае его
формулировка звучит несколько иначе:
Относительное
понижение давления насыщенного пара
растворителя над раствором
равно мольной доле растворенного
вещества.
Растворы, которые
строго подчиняются закону Рауля, являются
идеальными. Для реальных растворов
неэлектролитов закон Рауля соблюдается
тем точнее, чем более разбавленным
является этот раствор. По мере повышения
концентрации растворенного вещества
для большинства растворов наблюдаются
отклонения от закона Рауля.
Не подчиняются
закону Рауля растворы электролитов
(кислот, оснований, солей). Причем, даже
в тех случаях, когда они являются
разбавленными. Причина этого явления
будет нами рассмотрена позже.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
…
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К коллигативным свойствам растворов относятся:
- Понижение давление паров
- Повышение температуры кипения
- Понижение температуры затвердевания (кристаллизации)
- Осмотическое давление раствора.
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давления паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу.
Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль
p = p0 · nр-ля/(nв-ва + nр-ля), где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку:
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
(p0 – p)/p0 = χв-ва
(p0 – p)/p0 = nв-ва/(nв-ва + nр-ля)
При этом принимаем, что χв-ва + χр-ль= 1
Изотонический коэффициент Вант-Гоффа
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
p0 – p = Δр
Δp = i · p0 · χв-ва, где
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
χв-ва — мольная доля вещества в растворе
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе.
То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
i = 1+α(n-1), где
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации). Второй закон Рауля
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления.
При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя.
Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля:
ΔTкип = E· mв-ва,
ΔTкрист = K·mв-ва, где
E—эбулиоскопическая константа,
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
ΔTкип = i·E·mв-ва
ΔTкрист = i·К·mв-ва
Осмотическое давление раствора
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида.
Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию.
Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением.
Осмотическое давление и концентрацию раствора неэлектролита позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
π = C·R·T,
где C — молярная концентрация раствора, моль/м3,
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
π·V = m·R·T /M
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
π` = i·C·R·T ,
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими.
Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
Макеты страниц
При данной температуре давление насыщенного пара над каждой жидкостью — величина постоянная. Опыт показывает, что при растворении в жидкости какого-либо вещества давление насыщенного пара этой жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность между этими величинами принято называть понижением давления пара над раствором (или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара над чистым растворителем называется относительным понижением давления пара над раствором.
Обозначим давление насыщенного пара растворителя над чистым растворителем через  , а над раствором через
, а над раствором через  . Тогда относительное понижение давления пара над раствором будет представлять собою дробь:
. Тогда относительное понижение давления пара над раствором будет представлять собою дробь:

В 1887 г. французский физик Рауль, изучая растворы различных нелетучих жидкостей и веществ в твердом состоянии, установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с концентрацией:
Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
Математическим выражением закона Рауля является уравнение:

Здесь  — молярная доля растворенного вещества.
— молярная доля растворенного вещества.
Явление понижения давления насыщенного пара над раствором вытекает из принципа Ле Шателье. Представим себе равновесие между жидкостью, например, водой, и ее паром.

Рис. 78. Диаграмма состояния воды и водного раствора нелетучего вещества.
Это равновесие, которому отвечает определенное давление насыщенного пара, можно выразить уравнением

Если теперь растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в жидкости понизится и пойдет процесс, увеличивающий ее, — конденсация пара. Новое равновесие установится при более низком давлении насыщенного пара.
Понижение давления пара над раствором находит отражение на диаграмме состояния. На рис. 78 приведена схема диаграммы состояния воды и водного раствора нелетучего вещества. Согласно закону Рауля, давление водяного пара над водным раствором ниже, чем над водой. Поэтому кривая кипения для раствора лежит ниже, чем для воды. При переходе от воды к раствору изменяется также положение кривой плавления. И кривая кипения, и кривая плавления раствора расположены тем дальше от соответствующих кривых воды, чем концентрированнее раствор.
