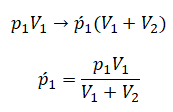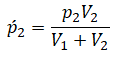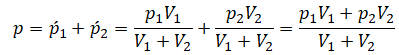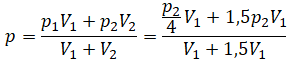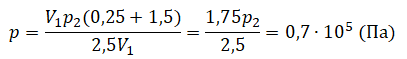Давление смеси газов равно сумме их парциальных давлений.
p = p1’ + p2’ + … .
К примеру, давление воздуха складывается из давления азота, кислорода, углекислого газа, водяного пара и т. д.
Определение
Парциальное давление — давление, которое производил бы данный газ, если бы другие газы отсутствовали.
Применение закона Дальтона при решении задач
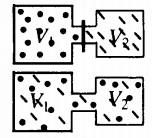
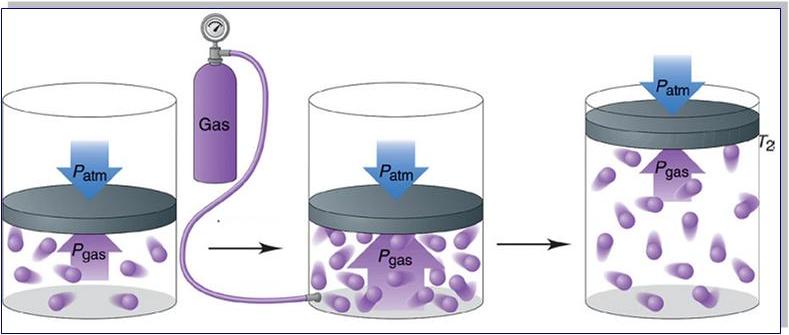
Самая популярная задача на закон Дальтона, это случай, когда газы находятся в сосудах, соединенных трубкой с краном. По условию этой задачи нужно найти давление, которое установится после того, как этот кран будет открыт.
После открытия крана первый и второй газы заполнят оба сосуда. Используем закон Бойля — Мариотта для первого газа (так как температура остается постоянной):
Этот же закон можем применить для второго газа. Тогда мы получим:
Применим закон Дальтона и получим:
Пример №1. Два сосуда соединены трубкой с краном. Определить давление, которое установится после того, как кран будет открыт. Считать, что объем второго сосуда в 1,5 раза больше первого. Давление во втором сосуде составляет половину от атмосферного давления. В первом сосуде оно меньше в 4 раза.
Проанализируем условия задачи и запишем:
V2 = 1,5V1
p2 = 4p1
p2 = 105 Па
Теперь можем применить выведенную ранее формулу:
Преобразуем выражение и найдем установившееся давление:
Задание EF17512
Три одинаковых сосуда, содержащих разреженный газ, соединены друг с другом трубками малого диаметра: первый сосуд – со вторым, второй – с третьим. Первоначально давление газа в сосудах было равно соответственно р, 3р и р. В ходе опыта сначала открыли и закрыли кран, соединяющий второй и третий сосуды, а затем открыли и закрыли кран, соединяющий первый сосуд со вторым. Как изменилось в итоге (уменьшилось, увеличилось или осталось неизменным) количество газа в первом сосуде? (Температура газа оставалась в течение всего опыта неизменной.)
Алгоритм решения
1.Записать исходные данные.
2.Применить закон Дальтона для определения давления в первом сосуде.
3.Применить закон Менделеева — Клапейрона для установления характера изменения количества газа в первом сосуде в ходе эксперимента.
Решение
Запишем исходные данные:
• Объемы сосудов равны: V1 = V2 = V3 = V.
• Температуры равны: T1 = T2 = T3 = T.
• Давления распределены следующим образом: p1 = p, p2 = 3p, p3 = p.
После того, как открыли кран между 2 и 3 сосудом, объем возрос вдвое, и давление распределилось по нему равномерно. Согласно закону Дальтона, оно стало равным сумме давлений, оказываемых газами в количестве вещества ν2 и ν3. Так как объем после открытия крана увеличивается вдвое, то парциальное давление каждого из количества вещества равно половине исходного давления:
p23=p2+3p2=2p
Потом кран 2–3 закрыли, но открыли кран 1–2. Применим закон Дальтона, получим:
p12=2p2+p2=3p2
Теперь применим закон Менделеева — Клапейрона:
pV=νRT
Для начального состояния газа в 1 сосуде:
pV=ν1RT
Для конечного состояния газа в 1 сосуде:
3p2V=ν2RT
Так как температура и объем неизменны, но давление увеличилось в 1,5 раза, то и количество газа в первом сосуде увеличилось в 1,5 раза.
Ответ: Увеличилось
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18873

Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
1.Записать исходные данные.
2.Установить характер изменения парциального давления неона.
3.Применить закон Менделеева — Клапейрона, чтобы установить характер изменения общего давления смеси газов.
Решение
Исходные данные:
• Количество неона: ν1 = 1 моль.
• Количество аргона: ν2 = 1 моль.
• Количество впущенного аргона: ν4 = 1 моль.
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Из уравнения видно, что давление и количество вещества — прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
Ответ: 23
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 3.5k
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия – упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
P = F/S
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
F*Δt = Δp
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 1023), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
P = N*m*v2/(3*V)
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния
В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
P*V = n*R*T
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
P = n*R*T/V
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.
Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление в газовой смеси
Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
P = N*m*v2/(3*V)
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
m = M/NA;
n = N/NA;
m*N = M*n;
P = M*n*v2/(3*V)
Объем сосуда в кубических метрах равен 0,01 м3. Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Изобретение относится к измерительной технике. Цель изобретения – повьппение точности измерения. Величина газоотделения происходит следующим образом. Измеряют промежуток времечи от момента закрытия крана 9 до достижения максимального тормозящего момента от привода 8 ротора, что фиксирзтот по максимальной деформации упругой связи, удерживающей двигатель ротора от поворота вокруг оси наооса. Этой деформации соответствует сигнал рассогласования с датчика 6 регулятора 7. Величину газоотделения определяют из математического выражения, приведенного в описании работы устрва. 3 ил. W с
союз советских
СОЦИАЛИСТИЧЕСКИХ
РЕСПУБЛИК
„„SU„940
А1 (51)4 G 01 L 21/02:
1 ф, !
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСМОМ,Ф СВИДЕТЕЛЬСТВУ
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
ПО ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ (21) 3986244/24-10 (22) 09,!2,85 (46) 07.05.88. Бюл. В 17 (71) Научно-исследовательский институт прикладной математики и киберне- . тики при Горьковском государственном университете им, Н.И. Лобачевского (72) В.П. Иванов (53) 531.787(088,8) (56) Дэшман С. Научные основы вакуумной техники. — М.: Мир, 1964, с. 515.
Авторское свидетельство СССР
1! 836537, кл. G 01 L 21/02, 1981. (54) СПОСОБ ИЗМЕРЕНИЯ ДАВЛЕНИЯ РАЗРЕЖЕННОГО ГАЗА (57) Изобретение относится к измерительной технике. Цель изобретения— повышение точности измерения. Величина газоотделения происходит следующим образом. Измеряют промежуток времени от момента закрытия крана 9 до достижения максимального тормозящего момента от привода 8 ротора, что фиксируют по максимальной деформации упругой связи, удерживающей двигатель ротора от поворота вокруг оси насоса.
Этой деформации соответствует сигнал рассогласования с датчика 6 регулятора 7. Величину газоотделения определяют из математического выражения, приведенного в описании работы устрва ° 3 ил.
1394077
Изобретение относится к измери-. ельной технике, а именно к способам средствам измерения давления разреенных газов, и может найти применение в вакуумной технологии прибороСтроения, при физических и космических исследованиях.
Цель изобретения — повышение точности измерения. 10
На фиг. 1 изображена схема устройства для реализации предлагаемого пособа; на фиг. 2 — градуировочная зависимость коэффициента сжатия Ко асоса в безрасходном режиме от час” тоты вращения ротора; на фиг. 3— градуировочная зависимость вероятности P прохода молекул газа с входа
12 на выход от частоты вращения ротоIpa f. 20
Устройство для реализации предлагаемого способа (фиг. 1) содержит ,, îáúåì 1 с исследуемым газом, камеру
2 для отбора пробы, вакуумный молекулярный насос 3 с ротором на магнит-25 ном подвесе, кран 4 .(показан в положении, соединяющем объем 1 с насосом 3), форвакуумный насос 5. Камера 2 снабжена датчиком 6 давления, который через регулятор 7, воздейст— вующий на привод 8 ротора (электроI, двигатель), управляет скоростью вращения ротора насоса 3, кран 9 (показан в положении “открыто”) соединяет камеру 2 отбора с насосом 3. В поло- .35 жении “закрыто” он изолирует камеру 2 от насоса 3.
Способ осуществляют следующим. образом.
Первый этап состоит из обезгажива- 0 ния стенок устройства путем их прогрева под вакуумом. Для этого кран 9 открывают, а кран 4 переводят в положение, соединяющее молекулярный насос 3 с форвакуумным насосом 5. Этими А5 насосами откачивают камеру 2. При этом камера 2 и насос 3 прогреваются (устройства прогрева не показаны).
После обезгаживания устройства нагрева отключают.
На следующем этапе краном 4 соединяют насос 3 с исследуемым объемом 1 и сменой направления вращения ротора, осуществляемого с помощью электродвигателя 8 производят отбор пробы газа
У
55 в камеру 2 и его сжатие. При отборе пробы скорость вращения ротора насоса 3 плавно регулируется датчиком 6 давления через регулятор 7 до получения пробы заданного давления Р, По получении заданного давления измеряют установившуюся скорость f вращения ротора и по градуировочным кривым (фиг. 2 и 3), полученным экспериментально, или расчетным путем на ЭВИ определяют степень сжатия К насоса 3 в безрасходном.режиме и вероятность
Р, прохода молекул газа через насос 3 соответственно.
На следующем этапе кран 9 закрывают. Давление в камере 2 отбора из-за газоотделения со стенок начинает повышаться (камера 2 изолирована, и все молекулы газа, отделившиеся со стенок, скапливаются внутри камеры 2), что вызывает реакцию регулятора — нарастающее ускорение ротора, направленное в сторону, противоположную его вращению. На этом этапе производится определение величины газоотделения следующим образом. Измеряют промежуток времени t от момента закрытия крана 9 до достижения макси” мального тормозящего мбмента от привода 8 ротора, что фиксируют по максимальной деформации упругой связи (например, пружины), удерживающей двигатель ротора от поворота вокруг оси насоса. Этой деформации соответствует сигнал рассогласования с датчика 6 регулятора 7, равный ЛР . Величина 1Рд определяется по величине максимальной деформации, которая регистрируется, например, тензодатчиком, связанным с пружиной и предварительно отградуированным в единицах давления. Величину газоотделения Q находят по формуле
Ча Р
Ъ где Ъ вЂ” объем камеры 2 отбора °
Определив величины g,, Ка и Р„, определяют искомую величину давления
Ра Я
Ка Ою 25 Р12 Б1 где V — средняя арифметическая скорость теплового движения молекул газа;
S — площадь входного сечения насоса.
Предлагаемый способ измерения давления разреженного газа позволяет повысить точность измерения по сравнению с известными. з 394077
Формула изобретения Ф
10>
Составитель А. Соколовский Редактор Н. Тупица Техред N.Äèäûê Корректор А. Тяско
Заказ 2212/38 Тираж 847 Подписное
ВНИИПИ Государственного комитета СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, 4
Способ измерения давления разреженного газа, основанный на отборе пробы газа в предварительно обезга-женную камеру и его сжатии вакуумным молекулярным насосом до заданного давления и определении соответствующей частоты Г вращения ротора, о т- 10 л и ч а ю шийся тем, что, с целью повышения точности измерения, отсекают камеру от насоса, определяют изменение давления dP в ней за время t, а искомое давление Р„, опреде- 15 ляют из соотношения
Р ЧИ
К, 0 25 vP р $ где Ко — степень сжатия газа насосом, определяемая по градиуровочному графику Ко(Г);
Ч вЂ” объем камеры;
v — средняя арифметическая скорость теплового движения молекул газа;
Р— вероятность прохода газа с входа на выход насоса, определяемая по градуировочному графику P1> (f );
Б — площадь входного сечения
1 насоса.


Видеоурок: МКТ. Смеси газов. Закон Дальтона
Лекция: Закон Дальтона для давления смеси разреженных газов
Очень редко в реальном мире можно встретить газ, состоящий только из одного компонента. Наиболее популярны смеси газов. Так как мы знаем, что газы имеют свойство занимать весь представленный объем, то для каждого из газов в смеси объем будет тот же, но концентрация будет меняться в зависимости от количества структурных единиц.
Если подставить общую концентрацию в уравнение для определения давления, то получим:
Из этого можно сделать вывод, что общее давление всех газов равно сумме давлений каждого из них. Каждое давление по отдельности называется парциальным.
Закон Дальтона:
Давление идеального газа, теория и онлайн калькуляторы
Давление идеального газа
Определение давления идеального газа
Определение
Давление идеального газа – это один из самых важных макроскопических параметров, при помощи которого характеризуют состояние
системы в молекулярной физике.
Обозначают давление буквой $p$. Если для известной массы идеального газа определены давление и температура (или объем), то полагают, что состояние термодинамической системы в состоянии равновесия определяется однозначно, так как существующие законы и уравнения молекулярно кинетической теории (МКТ) позволяют все остальные параметры вычислить.
В общем случае давление определяют как:
[p={mathop{lim }_{Delta Sto 0} frac{Delta F_n}{Delta S} }left(1right),]
где $F_n$ проекция силы на нормаль к поверхности S данная сила оказывает воздействие, $Delta S$- площадь поверхности.
Идеальный газ оказывает давление на стенки сосуда, в котором он находится, за счет того, что молекулы этого газа движутся и ударяются о стенки сосуда. Давление идеального газа можно найти, применяя основные положение МКТ. При этом получают, что давление идеального газа равно:
[p=frac{1}{3}nm_0{leftlangle v_{kv}rightrangle }^2left(2right),]
где $m_0$ – масса одной молекулы газа; $n$- концентрация молекул газа; $leftlangle v_{kv}rightrangle =sqrt{frac{1}{N}sumlimits^N_{i=1}{v^2_i}}, N $- количество молекул в объеме газа равном $V$. Уравнение (2) называют основным уравнением МКТ. Его можно записать в другом виде, используя среднюю кинетическую энергию молекул ($leftlangle E_krightrangle $):
[p=frac{2}{3}nleftlangle E_krightrangle left(3right).]
С таким важным термодинамическим параметром как термодинамическая температура давление связывает формула:
[p=nkT left(4right),]
где $k$ – постоянная Больцмана. Уравнение (4) называют уравнением состояния идеального газа.
Если проводить изохорный процесс ($V=const$) с некоторой массой идеального газа, то давление его будет подчинено закону Шарля:
[p_2=p_1frac{T_2}{T_1}left(5right),]
где $p_1$- давление газа имеющего температуру $T_1$.
При проведении изотермического процесса ($T=const$) c постоянной массой некоторого газа поведение давления можно характеризовать, используя уравнение:
[p_1V_1=p_2V_2left(6right).]
В соответствии с законом Дальтона давление смеси газов можно найти как сумму давлений каждого газа:
[p=sumlimits^N_{i=1}{p_i} left(7right),]
где $p_i$ – давление каждого газа в отдельности.
Уравнения МКТ, содержащие давление идеального газа
Уравнение Менделеева – Клапейрона (еще один вариант уравнения состояния):
$pV=frac{m}{mu }RT$(8),
где $frac{m}{mu }=nu $ -количество вещества; $m$ – масса газа; $mu $- молярная масса газа; $R$ – универсальная газовая постоянная.textit{}
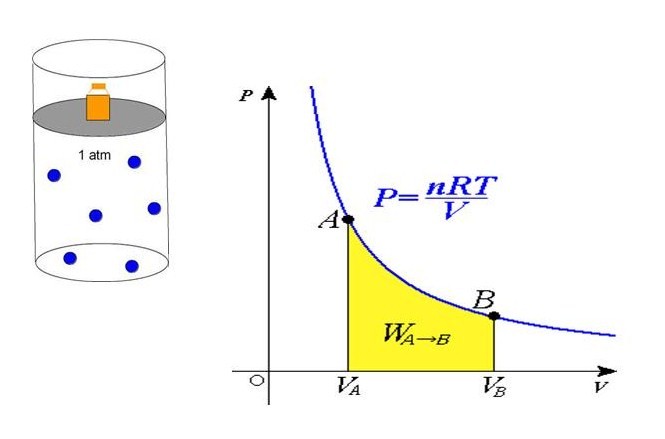
Определение работы газа в термодинамике:
[A=intlimits^{V_2}_{V_1}{pdV}left(9right).]
Соответственно, первое начало термодинамики для идеального газа в дифференциальном виде запишем как:
[delta Q=pdV+frac{i}{2}nu RdTleft(10right),]
где $i$ – число степеней свободы молекулы газа; $delta Q$ – элементарное количество теплоты, которое получает идеальный газ; $frac{i}{2}nu RdT=dU$ – изменение внутренней энергии термодинамической системы.textit{}
Примеры задач с решением
Пример 1
Задание. В идеальном газе проводят процесс, при котором $p=frac{AU}{V},$ где $U$ – внутренняя энергия газа; $A=const$ для определенного газа. Сравните коэффициенты пропорциональности $A$, если в первом случае газ одноатомный, во втором двух атомный. textit{}
Решение. Внутренняя энергия идеального газа для любого процесса равна:
[U=frac{i}{2}nu RT left(1.1right).]
Состояние идеального газа описывает уравнение Менделеева – Клайперона:
[pV=nu RT left(1.2right).]
Подставим правую часть уравнения, которое описывает заданный в условиях задачи процесс ($p=frac{AU}{V}$) вместо давления в (1.2), имеем:
[frac{AU}{V}V=nu RT left(1.3right).]
Получим из (1.3), что внутренняя энергия вычисляется как:
[U=frac{1}{A}nu RTleft(1.4right).]
Сравним выражения для внутренней энергии (1.1) и (1.4), имеем:
[frac{i}{2}=frac{1}{A}left(1.5right).]
Для одноатомного газа $i=3$; для двухатомного газа (без учета колебаний молекул) $i=5$.
[frac{3}{2}=frac{1}{A_1};; frac{5}{2}=frac{1}{A_2}to frac{A_2}{A_1}=frac{3}{2}cdot frac{2}{5}=frac{3}{5}.]
Ответ. $frac{A_2}{A_1}=frac{3}{5}$
Пример 2
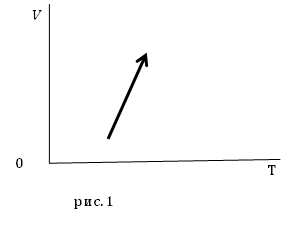
Задание. На рис.1 представлены процессы, проводимые с постоянной массой идеального газа, укажите, как изменяются давления в процессах?
Решение. Уравнение процесса можно аналитически описать уравнением:
[V(T)=AT-B left(2.1right),]
где $A$ и $B$ положительные постоянные величины.
Состояние газа определим при помощи уравнения Менделеева – Клапейрона:
[pV=nu RT left(2.2right).]
Вместо объема подставим уравнение процесса в (2.2):
[pleft(AT-Bright)=nu RTleft(2.3right).]
Раздели обе части (2.3) на температуру:
[frac{pleft(AT-Bright)}{T}=nu Rto pleft(A-frac{B}{T}right)=nu Rto p=frac{nu R}{A-frac{B}{T}} left(2.4right).]
Из уравнения (2.4) следует, что при увеличении температуры $frac{B}{T}$ уменьшается, следовательно, знаменатель дроби правой части выражения (2.4) увеличивается, значит, давление уменьшается.
Ответ. Давление в заданном процессе уменьшается.
Читать дальше: диэлектрический гистерезис.

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 430 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!