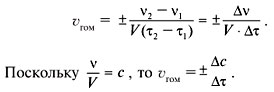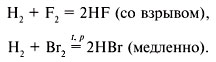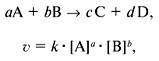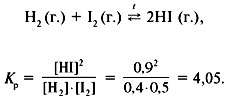Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
2NO(г) + O2(г) → 2NO2(г); ΔHо298 = — 113,4 кДж/моль.
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
2NO(г) + O2(г) → 2NO2(г)
константа химической реакции Кс есть отношение:
Кс = [NO2]2/([NO]2 · [O2]) (1)
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGTо = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
2CO(г) + O2(г) →2CO2(г)
|
Вещество |
CO | O2 | CO2 |
| Сисходн, моль/л | 0,36 | 0,40 | 0 |
| Спрореагир,моль/л | 0,16 | 0,08 | 0,16 |
| Сравн, моль/л | 0,2 | 0,32 | 0,16 |
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
3 H2 (г) + N2 (г) →2 NH3 (г) при 298 К.
Решение.
ΔG298о = 2·(- 16,71) кДж = -33,42·103 Дж.
ΔGTо = — RTlnK.
lnK = 33,42·103/(8,314× 298) = 13,489. K = 7,21× 105.
Задача 3. Определите равновесную концентрацию HI в системе
H2(г) + I2(г) →2HI(г),
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х)2/((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔНоТ » ΔНо298, а ΔSоT » ΔSо298.
Решение.
Если К = 1, то ΔGоT = — RTlnK = 0;
ΔGоT = ΔНо298 — ТΔ Sо298 .
ΔНо298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 103 Дж;
ΔSо298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Т = 786,15К
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
SO2(г) + Cl2(г) →SO2Cl2(г)
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Тогда получаем:
(х + 1)/(2 — х)2 = 4
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
1) 2 NH3 (г) → 3H2 (г) + N2 (г)
2) ZnCO3 (к) → ZnO(к) + CO2 (г)
3) 2HBr (г) → H2 (г) + Br2 (ж)
4) CO2 (г) + C (графит) →2CO (г)
|
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества |
2. При некоторой температуре равновесные концентрации в системе:
2HBr (г) →H2 (г) + Br2 (г)
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
CO2(г) + C(графит) →2CO(г)
становится равной 1. Примите, что ΔНоТ≈ΔНо298, а ΔSоT≈ΔSо298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
С2Н4(г) →С2Н2(г) + Н2(г) при 298 К
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
СО2(г) + 3Н2(г) → СН3ОН(г) + Н2О(г)
равна 3,4·10-5. Вычислите Δ Gо500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔGоf,800(С3Н6(г)), если ΔGоf,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
|
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л; |
Химическое равновесие – состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно
предлагают похожий вариант, однако говорят о “равенстве концентраций исходных веществ и продуктов” – это грубая ошибка. Химическое равновесие –
равенство скоростей.

Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии
равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать
внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных
задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно
справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие:
равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону.
Если добавляете вещество из левой части (продуктов реакции) – смещается в сторону исходных веществ. Посмотрите на пример ниже.

Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить “пустое”
место, которые мы создали. Наглядно демонстрирую на примере:

Можно подвести итог полученным знаниям таким образом: “Куда добавляем – оттуда смещается, откуда берем – туда смещается”. Воспользуйтесь
этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа.
Твердые вещества и жидкости считать не нужно. Например:
CO2(г) + С(тв) ⇄ 2CO(г) – Q
В приведенном уравнении количество молекул газа в левой части – 1, в правой – 2.
Запомните правило: “При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления – в сторону больших газов”.
Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
H2(г) + I2(г) ⇄ 2HI(г) – Q
Слева – 2 газа, и справа – 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или
эндотермическая.
Следуйте следующему правилу: “При увеличении температуры равновесие смещается в сторону эндотермической реакции, при
уменьшении – в сторону экзотермической реакции”. У любой обратимой реакции есть экзо- и эндотермические части:

Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.

Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа
равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации
веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10-1.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химия . Не пойму как понять когда увеличивается давление в реакции когда нет ((
Знаток
(373),
закрыт
2 года назад
Вячек
Высший разум
(391245)
10 лет назад
Только в тех случаях, когда в реакциях участвуют газы (исходные вещества или продукты) , возможны изменения давления в закрытом сосуде. Поскольку давление в газах прямо пропорционально числу их молекул, то увеличение этого числа в ходе реакции и приведёт к увеличению давления!
Например: 2С (тв.) + О2(газ) = 2СО (газ)
Среди исходных веществ – одна молекула кислорода, после окончания реакции и исчезновения кислорода появляется 2 молекулы угарного газа.
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
|
T |
↑Т — равновесие смещается в сторону эндотермической реакции |
| ↓Т — равновесие смещается в сторону экзотермической реакции | |
|
p |
↑p — равновесие смещается в сторону реакции с меньшей суммой коэффициентов перед газообразными веществами |
| ↓p — равновесие смещается в сторону реакции с большей суммой коэффициентов перед газообразными веществами | |
|
c |
↑c(реагента) – равновесие смещается в сторону прямой реакции (вправо) |
| ↓c(реагента) – равновесие смещается в сторону обратной реакции (влево) | |
| ↑c(продукта) – равновесие смещается в сторону обратной реакции (влево) | |
| ↓c(продукта) – равновесие смещается в сторону прямой реакции (вправо) | |
| Катализатор | На равновесие не влияет!!! |
И.В.ТРИГУБЧАК
Пособие-репетитор по химии
ЗАНЯТИЕ 10
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18/2006
Основы химической кинетики.
Состояние химического равновесия
План

Химическая кинетика и область ее изучения.
2. Скорость гомогенной и гетерогенной реакции.
3. Зависимость скорости реакции от различных
факторов: природы реагирующих веществ,
концентрации реагентов (закон действующих масс),
температуры (правило Вант-Гоффа), катализатора.
4. Обратимые и необратимые химические реакции.
5. Химическое равновесие и условия его смещения.
Принцип Ле Шателье.
Раздел химии, изучающий скорости и механизмы
протекания химических реакций, называется
химической кинетикой. Одним из основных в этом
разделе является понятие скорости химической
реакции. Одни химические реакции протекают
практически мгновенно (например, реакция
нейтрализации в растворе), другие – в течение
тысячелетий (например, превращение графита в
глину при выветривании горных пород).
Скорость гомогенной реакции – это количество
вещества, вступающего в реакцию или
образующегося в результате реакции за единицу
времени в единице объема системы:
Другими словами, скорость гомогенной реакции
равна изменению молярной концентрации
какого-либо из реагирующих веществ за единицу
времени. Скорость реакции – величина
положительная, поэтому в случае выражения ее
через изменение концентрации продукта реакции
ставят знак «+», а при изменении концентрации
реагента знак «–».
Скорость гетерогенной реакции – это
количество вещества, вступающего в реакцию или
образующегося в результате реакции за единицу
времени на единице поверхности фазы:
Важнейшие факторы, влияющие на скорость
химической реакции, – природа и концентрация
реагентов, температура, присутствие
катализатора.
Влияние природы реагентов проявляется в
том, что при одних и тех же условиях различные
вещества взаимодействуют друг с другом с разной
скоростью, например:
При увеличении концентрации реагентов
увеличивается число столкновений между
частицами, что приводит к увеличению скорости
реакции. Количественно зависимость скорости
реакции от концентрации реагентов выражается з а
к о н о м д е й с т в у ю щ и х м а с с
(К.М.Гульдберг и П.Вааге, 1867 г.; Н.И.Бекетов, 1865 г.). Скорость
гомогенной химической реакции при постоянной
температуре прямо пропорциональна произведению
концентрации реагирующих веществ в степенях,
равных их стехиометрическим коэффициентам
(концентрации твердых веществ при этом не
учитываются), например:
где А и В – газы или жидкости, k – константа
скорости реакции, равная скорости реакции при
концентрации реагентов 1 моль/л. Константа k
зависит от свойств реагирующих веществ и
температуры, но не зависит от концентрации
веществ.
Зависимость скорости реакции от температуры
описывается экспериментальным п р а в и л о м
В а н т-Г о ф ф а (1884 г.). При повышении температуры
на 10°, скорость большинства химических реакций
увеличивается в 2–4 раза:
где –
температурный коэффициент.
Катализатором называется вещество,
изменяющее скорость химической реакции, но не
расходующееся в результате этой реакции.
Различают положительные катализаторы
(специфические и универсальные), отрицательные
(ингибиторы) и биологические (ферменты, или
энзимы). Изменение скорости реакции в
присутствии катализаторов называется катализом.
Различают гомогенный и гетерогенный катализ.
Если реагенты и катализатор находятся в одном
агрегатном состоянии, катализ является
гомогенным; в разных – гетерогенным.
Гомогенный катализ:
гетерогенный катализ:
Механизм действия катализаторов является
очень сложным и не изученным до конца. Существует
гипотеза об образовании промежуточных
соединений между реагентом и катализатором:
А + кат. [A кат.],
[A кат.] + В АВ + кат.
Для усиления действия катализаторов применяют
промоторы; существуют также каталитические яды,
ослабляющие действие катализаторов.
На скорость гетерогенной реакции влияют величина
поверхности раздела фаз (степень
измельченности вещества) и скорость подвода
реагентов и отвода продуктов реакции от
поверхности раздела фаз.
Все химические реакции делятся на два типа:
обратимые и необратимые.
Необратимыми называются химические реакции,
протекающие только в одном направлении, т.е.
продукты этих реакций не взаимодействуют друг с
другом с образованием исходных веществ. Условия
необратимости реакции – образование осадка,
газа или слабого электролита. Например:
BaCl2 + H2SO4 = BaSO4 + 2HCl,
K2S + 2HCl = 2KCl + H2S,
HCl + NaOH = NaCl + H2O.
Обратимыми называются реакции, протекающие
одновременно в прямом и обратном направлениях,
например:
При протекании обратимой химической реакции
скорость прямой реакции вначале имеет
максимальное значение, а затем уменьшается
вследствие уменьшения концентрации исходных
веществ. Обратная реакция, наоборот, в начальный
момент времени имеет минимальную скорость,
которая постепенно увеличивается. Таким образом,
в определенный момент времени наступает состояние
химического равновесия, при котором скорость
прямой реакции равна скорости обратной реакции.
Состояние химического равновесия является
динамическим – продолжают протекать как прямая,
так и обратная реакции, но поскольку скорости их
равны, то концентрации всех веществ в
реакционной системе не изменяются. Эти
концентрации называются равновесными.
Отношение констант скоростей прямой и
обратной реакций является постоянной величиной
и называется константой равновесия (Кр).
Концентрации твердых веществ не входят в
выражение константы равновесия. Константа
равновесия реакции зависит от температуры и
давления, но не зависит от концентрации
реагирующих веществ и от присутствия
катализатора, который ускоряет ход как прямой,
так и обратной реакции. Чем больше Кр, тем
выше практический выход продуктов реакции. Если Кр
> 1, то в системе преобладают продукты реакции;
если Кр < 1, в системе преобладают
реагенты.
Химическое равновесие является подвижным, т.е.
при изменении внешних условий может
увеличиваться скорость прямой или обратной
реакции. Направление смещения равновесия
определяется п р и н ц и п о м, сформулированным
французским ученым Ле Шателье в 1884 г. Если на
равновесную систему оказывается внешнее
воздействие, то равновесие смещается в сторону
той реакции, которая противодействует этому
воздействию. На смещение равновесия влияют
изменения концентрации реагентов, температуры и
давления.
Увеличение концентрации реагентов и вывод
продуктов приводят к смещению равновесия в
сторону прямой реакции.
При нагревании системы равновесие смещается в
сторону эндотермической реакции, при охлаждении
– в сторону экзотермической.
Для реакций, в которых принимают участие
газообразные вещества, повышение давления
смещает равновесие в сторону реакции,
протекающей с уменьшением числа молекул газа.
Если реакция протекает без изменения числа
молекул газообразных веществ, то изменение
давления никак не влияет на смещение равновесия.
Тест по теме «Основы химической
кинетики.
Состояние химического равновесия»

В некоторой реакции температурный коэффициент
равен 2. При повышении температуры от 0 до 50 °С
скорость этой реакции увеличится в число раз:
а) 4; б) 16; в) 32; г) 64.
2. При повышении давления в 5 раз скорость
реакции образования йодоводорода из простых
веществ возрастет в число раз:
а) 5; б) 10; в) 25; г) 125.
3. Реакция при температуре 20 °С протекает
за 6 мин 45 с. При температуре 60 °C (коэффициент
Вант-Гоффа для данной реакции равен 3) эта же
реакция закончится через (в с):
а) 5; б) 15; в) 20; г) 25.
4. Реакция при температуре 30 °С протекает
за 2 мин 40 с, а при температуре 70 °С эта же
реакция протекает за 10 с. Температурный
коэффициент данной реакции равен:
а) 1,5; б) 2; в) 2,5; г) 3.
5. Из перечисленных реакций выбрать ту,
которая протекает с максимальной скоростью.
а) Образование хлорида серебра из нитрата
серебра и хлорида натрия в растворе;
б) окисление этанола в организме человека;
в) брожение глюкозы;
г) коррозия железа во влажном воздухе.
6. На смещение равновесия в ходе реакции
восстановления оксида железа(III) водородом
оказывает влияние:
а) изменение давления;
б) введение катализатора;
в) удаление из сферы реакции образующихся
продуктов;
г) изменение температуры.
7. Катализ может быть:
а) окислительно-восстановительным;
б) биологическим;
в) гомогенным;
г) гетерогенным.
8. Ингибитором называют:
а) биологический катализатор;
б) отрицательный катализатор;
в) положительный катализатор;
г) совсем не катализатор.
9. Для какой из перечисленных реакций
давление не влияет на смещение равновесия?
а) Образование воды из простых веществ;
б) образование аммиака из простых веществ;
в) образование метана из простых веществ;
г) образование бромоводорода из простых
веществ.
10. Две реакции протекают с одинаковой
скоростью при 30 °С, коэффициенты Вант-Гоффа
для этих реакций 3 и 5 соответственно. Отношение
скоростей этих реакций, протекающих при 60 °С,
равно:
а) 5,0; б) 4,63; в) 1,67; г) 0,22.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| в | в | а | б | а | в, г | б, в, г | б | г |
г |
Задачи и упражнения по
химической кинетике
Скорость химической реакции. Закон
действующих масс (закон Гульдберга и Вааге)

Как изменится скорость образования диоксида
азота в реакции оксида азота(II) с кислородом, если
давление в системе увеличить в 3 раза, а
температуру оставить неизменной?
Ответ. Возрастет в 27 раз.
2. Как изменится скорость элементарной
реакции А2 + 2В2 = 2АВ2,
протекающей в газовой фазе в закрытом сосуде,
если увеличить давление в 6 раз?
Решение
Для реакции, описываемой уравнением:
А2 + 2В2 = 2АВ2,
скорость реакции:
1 =
k•[A2]•[B2]2.
При увеличении давления в сосуде в 6 раз
концентрации всех веществ также возрастут в 6
раз. Выражение для скорости реакции примет вид:
2 =
k•6[A2]•(6[B2])2 = 216k•[A2]•[B2]2.
Ответ. Возрастет в 216 раз.
3. Определить среднюю скорость химической
реакции восстановления углекислого газа
водородом до угарного газа и воды, если через 80 с
после начала реакции молярная концентрация воды
была равна 0,24 моль/л, а через 2 мин 7 с стала равна
0,28 моль/л.
Ответ. 0,051 моль/(л•мин).
4. Как изменится скорость реакции получения
аммиака из простых веществ, если при неизменной
температуре уменьшить объем газовой смеси в 3
раза?
Ответ. Увеличится в 81 раз.
5. Во сколько раз изменится скорость
химической реакции 2А + В = А2В, если
концентрацию вещества А увеличить в 2 раза, а
концентрацию вещества В уменьшить в 2 раза?
Ответ. Возрастет в 2 раза.
Правило Вант-Гоффа
1. Во сколько раз увеличится скорость
химической реакции образования йодоводорода из
простых веществ при повышении температуры от
20 °С до 170 °С, если при повышении температуры
на каждые 25 °С скорость реакции увеличивается
в 3 раза?
Ответ. Увеличится в 716 раз.
2. Коэффициент Вант-Гоффа для некоторой
реакции равен 2,5. Во сколько раз увеличится
скорость этой реакции при повышении температуры
от 10 °С до 55 °С?
Решение
Выражение для скорости реакции 2 по сравнению со скоростью
реакции 1 при
изменении температуры Т
имеет вид:
Ответ. Возрастет в 61,76 раза.
3. Скорость некоторой реакции возрастает в
3,5 раза при повышении температуры на каждые
20 °C. Как изменится время протекания данной
реакции при повышении температуры от 20 °C до
85 °С?
Ответ. Уменьшится в 58,475 раза.
4. Растворение образца цинка в соляной
кислоте при 20 °С заканчивается через 27 мин, а
при 40 °С такой же образец металла растворяется
за 3 мин. За какое время данный образец цинка
растворится при 55 °С?
Ответ. За 34,6 с.
5. Растворение образца железа в серной
кислоте при 20 °С заканчивается через 15 мин, а
при 30 °С такой же образец металла растворяется
за 6 мин. За какое время данный образец железа
растворится при 35 °С?
Ответ. За 3,8 мин.
Состояние равновесия. Равновесные
концентрации
1. Равновесие реакции образования
йодоводорода из простых веществ установилось
при следующих концентрациях: [H2] = 0,4 моль/л,
[I2] = 0,5 моль/л, [HI] = 0,9 моль/л. Определить
исходные концентрации водорода и йода и
рассчитать константу равновесия данной реакции.
Решение
Для реакции образования йодоводорода:
Равновесные концентрации:
[H2] = 0,4 моль/л, [I2] = 0,5 моль/л,
[HI] = 0,9 моль/л.
Прореагировало в объеме: 0,45 моль/л Н2 и 0,45
моль/л I2, получилось 0,9 моль/л HI.
Исходные концентрации:
с0(H2) = 0,4 + 0,45 = 0,85 моль/л,
с0(I2) = 0,5 + 0,45 = 0,95 моль/л.
Ответ. с0(Н2) = 0,85 моль/л, с0(I2)
= 0,95 моль/л, Кр = 4,05.
2. В реакции А + В = С + D смешали по 1 моль всех
веществ A–D. После установления равновесия в
смеси оказалось 1,5 моль вещества С. Определить
константу равновесия данной реакции.
Ответ. Кр = 9.
3. Равновесие реакции образования аммиака
из простых веществ устанавливается при
следующих концентрациях: [N2] = 0,01 моль/л, [Н2]
= 2 моль/л, [NН3] = 0,4 моль/л. Вычислить
константу равновесия и исходные концентрации
азота и водорода.
Ответ. Кр = 2, с0(N2)
= 0,21 моль/л, с0(Н2) = 2,6 моль/л.
4. Равновесие реакции образования
диоксида азота из монооксида и кислорода
установилось при следующих концентрациях
реагирующих веществ: оксида азота(II) – а
моль/л, кислорода – в моль/л, оксида азота(IV) –
с моль/л. Как изменятся скорости прямой и
обратной реакций, если уменьшить объем,
занимаемый газами, в 2 раза? Сместится ли при этом
равновесие?
Ответ. Возрастут в 8 и 4 раза,
равновесие сместится вправо.
5. Исходные концентрации азота и водорода в
реакционной смеси для получения аммиака
составляли 4 и 10 моль/л соответственно. Вычислить
равновесные концентрации компонентов смеси и
константу равновесия данной реакции, если к
моменту наступления равновесия прореагировало
50% азота.
Ответ. Равновесные концентрации:
[N2] = 2 моль/л,
[Н2] = [NН3] = 4 моль/л,
Кр = 1/8.
Принцип Ле Шателье
1. Какие факторы способствуют смещению
равновесия в эндотермической реакции
восстановления углекислого газа до угарного с
помощью углерода в сторону образования продукта
реакции?
Ответ. Для реакции
СО2 (г.) + С (тв.) 2СО (г.) – Q
смещению равновесия вправо
способствуют:
а) нагревание; б) понижение давления;
в) увеличение концентрации СО2;
г) вывод СО из сферы реакции.
2. Какие факторы способствуют смещению
равновесия в эндотермической реакции
восстановления оксида железа(III) с помощью
водорода в сторону прямой реакции?
Ответ. Для реакции
Fe2О3 (тв.) + 3Н2 (г.) 2Fe (тв.) + 3Н2О
(г.) – Q
смещению равновесия вправо
способствуют:
а) нагревание; б) увеличение концентрации Н2;
в) вывод Н2О из реакции.
3. Какие факторы способствуют смещению
равновесия в экзотермической реакции
образования сероводорода из простых веществ в
сторону образования продукта реакции?
Ответ. Для реакции
Н2 (г.) + S (тв.) Н2S (г.) + Q
смещению равновесия в сторону
образования Н2S способствуют:
а) охлаждение; б) увеличение концентрации Н2;
в) вывод Н2S из реакции.
4. Для каких из указанных реакций повышение
давления приведет к смещению равновесия в том же
направлении, что и понижение температуры?
а) N2 + O2 2NO – Q;
б) CO2 + C 2CO – Q;
в) 2CO + O2 2CO2 + Q;
г) CO + H2O (г.) CO2 + H2 + Q.
Ответ. б, в.
Комбинированные задачи повышенной
сложности
1. Один моль смеси пропена с водородом,
имеющей плотность по водороду 15, нагрели в
замкнутом сосуде с платиновым катализатором при
320 °С, при этом давление в сосуде уменьшилось
на 25%. Рассчитать выход продукта гидрирования в
процентах от теоретического.
Ответ. 83,3%.
2. Пары этаналя смешали с водородом в
молярном отношении 1:2 при давлении 300 кПа и
температуре 400 °С в замкнутом реакторе,
предназначенном для синтеза этанола. После
окончания процесса давление газов в реакторе при
неизменной температуре уменьшилось на 20%.
Определить объемную долю паров этанола в
реакционной смеси и процент превращения
уксусного альдегида в этанол.
Ответ. Объемная доля паров этанола
в конечной реакционной смеси – 25%,
степень превращения альдегида в этанол – 60%.
3. При нагревании до некоторой температуры 36
г уксусной кислоты и 7,36 г безводного этанола в
присутствии серной кислоты получена равновесная
смесь. Эта смесь при действии избытка раствора
хлорида бария образует 4,66 г осадка, а при
действии избытка раствора гидрокарбоната калия
выделяет 12,1 л углекислого газа (н.у.). Найти
количество сложного эфира в равновесной смеси.
Ответ. 0,1 моль.
4. Угарный газ смешали с водородом в
молярном соотношении 1:4 при давлении 10 МПа и
температуре 327 °С в замкнутом реакторе,
предназначенном для синтеза метанола. После
окончания процесса давление газов в реакторе при
неизменной температуре уменьшилось на 10%.
Определить объемную долю паров метанола в
реакционной смеси и процент превращения
угарного газа в метанол.
Ответ. Объемная доля паров метанола
в конечной реакционной смеси – 5,55%,
степень превращения угарного газа в метанол – 25%.