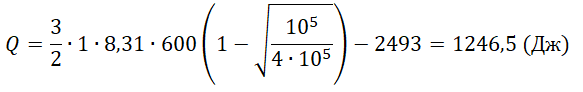Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула |
ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс |
ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение |
ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления |
ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс |
ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
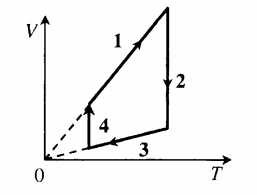
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?
Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
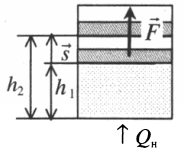
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.
Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
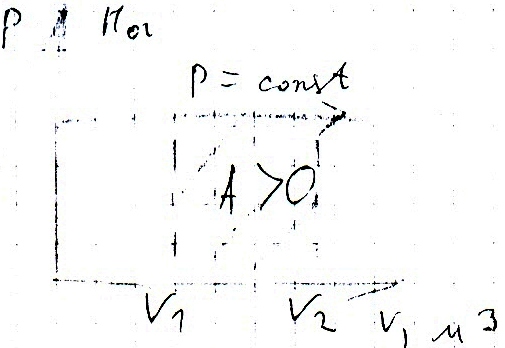
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение:
A‘=p(V2−V1) A‘>0 |
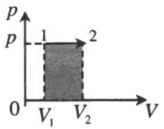 |
| Изобарное сжатие:
A‘=p(V2−V1) A‘<0 |
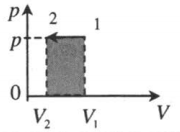 |
| Изохорное охлаждение:
V=const A‘=0 |
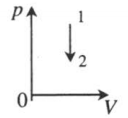 |
|
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
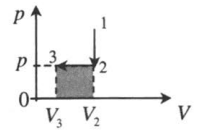 |
| Замкнутый цикл:
1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
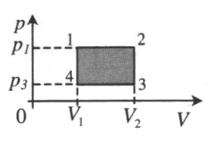 |
| Произвольный процесс:
A‘=p1+p22(V2−V1) |
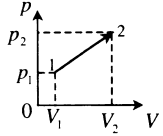 |
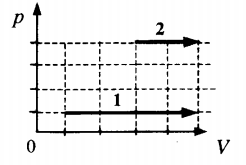
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505
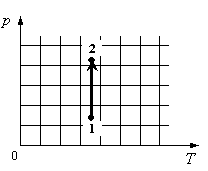
Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
Ответ: 123
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17966
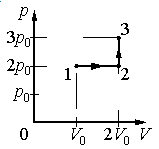
Ответ:
а) р0V0
б) 2р0V0
в) 4р0V0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0 и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 15k
Первый закон термодинамики
-
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
-
Работа газа в изобарном процессе
-
Работа газа в произвольном процессе
-
Работа, совершаемая над газом
-
Применение первого закона термодинамики к изопроцессам
-
Адиабатный процесс
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
Газ, находящийся в сосуде под поршнем, действует на поршень с силой , где
— давление газа,
— площадь поршня. Если при этом поршень перемещается, то газ совершает работу.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
к оглавлению ▴
Работа газа в изобарном процессе
Предположим, что газ расширяется при постоянном давлении . Тогда сила
, с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние
(рис. 1).
Рис. 1.
Работа газа равна:
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
(1)
Если и
— начальный и конечный объём газа, то для работы газа имеем:
. Изобразив данный процесс на
-диаграмме, мы видим, что работа газа равна площади прямоугольника под графиком нашего процесса (рис. 2).
Рис. 2. Работа газа как площадь
Пусть теперь газ изобарно сжимается от объёма до объёма
. С помощью аналогичных рассуждений приходим к формуле:
Но , и снова получается формула (1).
Работа газа опять-таки будет равна площади под графиком процесса на -диаграмме, но теперь со знаком минус.
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
к оглавлению ▴
Работа газа в произвольном процессе
Геометрическая интерпретация работы газа (как площади под графиком процесса на -диаграмме) сохраняется и в общем случае неизобарного процесса.
Действительно, рассмотрим малое изменение объёма газа — настолько малое, что давление
будет оставаться приблизительно постоянным. Газ совершит малую работу
. Тогда работа
газа во всём процессе найдётся суммированием этих малых работ:
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3):
Рис. 3. Работа газа как площадь
к оглавлению ▴
Работа, совершаемая над газом
Наряду с работой , которую совершает газ по передвижению поршня, рассматривают также работу
, которую поршень совершает над газом.
Если газ действует на поршень с силой , то по третьему закону Ньютона поршень действует на газ с силой
, равной силе
по модулю и противоположной по направлению:
(рис. 4).
Рис. 4. Внешняя сила , действующая на газ
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Так, в процессе расширения газ совершает положительную работу ; при этом работа, совершаемая над газом, отрицательна
. Наоборот, при сжатии работа газа отрицательна
, а работа, совершаемая поршнем над газом, положительна
0 right )’ class=’tex’ alt=’left ( {A}’ > 0 right )’ />.
Будьте внимательны: если в задаче просят найти работу, совершённую над газом, то имеется в виду работа .
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Опыт показывает, что эти способы независимы — в том смысле, что их результаты складываются. Если телу в процессе теплообмена передано количество теплоты , и если в то же время над телом совершена работа
, то изменение внутренней энергии тела будет равно:
(2)
Нас больше всего интересует случай, когда тело является газом. Тогда (где
, как всегда, есть работа самого газа). Формула (2) принимает вид:
, или
(3)
Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
к оглавлению ▴
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
1. Изотермический процесс, .
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: . Тогда формула (3) даёт:
Всё подведённое к газу тепло идёт на совершение газом работы.
2. Изохорный процесс, .
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: . Тогда первый закон термодинамики даёт:
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
3. Изобарный процесс, .
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы (для которой справедлива формула (1)). Имеем:
к оглавлению ▴
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе . Из первого закона термодинамики получаем:
, или
.
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет , поэтому
: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
Кривая, изображающая ход адиабатного процесса, называется адиабатой. Интересно сравнить ход адиабаты и изотермы на -диаграмме (рис. 5).
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Первый закон термодинамики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
Внутренняя энергия газа в изобарическом процессе.
Ученик
(95),
закрыт
7 лет назад
Георгий Никулин
Мыслитель
(5008)
13 лет назад
Изменение внутренней энергии газа в ЛЮБОМ процессе можно найти по формулам: дельтаU = (3/2)*vRдельтаТ или дельтаU = (3/2)(P2V2 – P1V1). Коэффициент (3/2) – для одноатомного газа, для двухатомного газа будет (5/2). v – число молей газа. Для изобарного процесса первая формула не претерпит изменений, а во второй можно вынести за скобки постоянное давление Р: дельтаU = (3/2)P*(V2 – V1).
Кроме того, в изобарном процессе можно связать изменение внутренней энергии и работу газа по формулам: дельтаU = (3/2)А – для одноатомного газа; дельтаU = (5/2)А – для двухатомного газа.
Формула же Q = дельтаU + A – математическое выражение 1-го начала термодинамики, позволяет вычислять теплоту ЛЮБОГО процесса.
Внутренняя
энергия и способы ее изменения
U
– внутренняя энергия – это
энергия движения и взаимодействия
частиц, из которых состоит тело.
Внутренняя энергия зависит от температуры
тела, его агрегатного состояния
(газообразное, жидкое, твердое), от
химических, атомных
и ядерных
реакций.
Она не зависит ни от механического
движения тела, ни от положения этого
тела относительно других тел.
U=Ек+Еп
Т.к.
у идеального газа отсутствуют силы
притяжения молекул, то Еп=0, следовательно
U=Ек=3/2*КТ
– для одноатомного газа; U=Ек=5/2*КТ
– для 2х-атомного; U=Ек=7/2*КТ
– для 3х-атомного.
Внутреннюю
энергию идеального газа можно выразить
через термодинамические параметры:
U=3/2*PV
Внутреннюю
энергию газа можно изменить двумя
способами:
1.
Путем теплообмена.
2.
Путем совершения работы.
Работа
газа в изопроцессах.
А=P*ΔV=[Дж]
1.Изотермический.
Т=const
, m=const
Уравнение
изопроцесса: P*V=const
Формула
работы в изопроцессе: A=
а)
изотермическое расширение: V1<V2
б)изотермическое
сжатие: V1>V2
2.Изобарический.P=const,
m=const
Уравнение
изопроцесса:
Формула
работы в изопроцессе: A=P*∆V
При
изобарическом расширении: V2
>V1,
∆V=(V2-V1)>0,
A>0
При
изобарическом сжатии:
V2
<V1,
∆V<0,
A<0
3.Изохорический.V=const,
m=const
Уравнение
изопроцесса:
Формула
работы в изопроцессе:A=p*∆V=0
– газ работу не совершает
23.
-
Первый
закон термодинамики.Первый
закон термодинамики (закон сохранения
энергии для тепловых процессов)
определяет количественное соотношение
между изменением внутренней энергии
системы дельта U, количеством теплоты
Q, подведенным к ней, и суммарной работой
внешних сил A, действующих на систему.Первый
закон термодинамики – количество
теплоты, подведенное к системе, идет
на изменение ее внутренней энергии и
на совершение системой работы над
внешними телами:Q=∆U+A.Применение
первого закона термодинамики к
изопроцессам.При
изохорном процессе
объем газа остается постоянным, поэтому
газ не совершает работу. Изменение
внутренней энергии газа происходит
благодаря теплообмену с окружающими
телами:Q=∆U.При
изотермическом
процессе количество теплоты, переданное
газу от нагревателя, полностью
расходуется на совершение работы:Q=A
При
изобарном процессе кол- во газа
подведенное к нему количество теплоты
расходуется как на увеличение его
внутренней энергии и на совершение
работы газом:Q=∆U+A
Адиабатный
процесс – термодинамический процесс в
теплоизолированной системе. Q=A.Второй
закон термодинамики (необратимость
процессов в природе).Формулировка: Все
процессы в природе необратимы, т.е
самопроизвольно протекают только в
одном направлении.Обратимым называется
процесс, который отвечает следующим
условиям:
1. его
можно провести в двух противоположных
направлениях;
2. в
каждом из этих случаев система и
окружающие ее тела проходят через одни
и те же промежуточные состояния;
3. после
проведения прямого и обратного процессов
система и окружающие ее тела возвращаются
к исходному состоянию.
Необратимым-это
процессы самопроизвольно протекающие
только в одном направлении.
При
изобарном
процессе кол- во газа подведенное к
нему количество теплоты расходуется
как на
24.
Принцип действия теплового двигателя.
КПД теплового двигателя. Цикл Карно.
ДВС–
это машина в которой внутренняя энергия
топлива превращается в механическую
работу.
–ДВС +ДВС
1.Низкий
КПД 1.Топливо содержит гораздо больше
энергии, чем лучшие
2.Сильный
шум электрические аккумуляторы.
3.Токсичные
выбросы
4.Меньший
ресурс
4-х
тактный ДВС
Такты
работы:
1.Впуск(поршень
движется вниз и открывается впускной
клапан)
2.Сжатие(поршень
поднимается вверх, сжимает горючую
смесь, значит давление увеличивается
=> температура увеличивается)
3.Рабочий
цикл(при проскакивании искры смесь
воспламеняется, давление ещё больше
увеличивается и внутренняя энергия
газа превращается в механическую
работу;газы давят на поршень и он
движется вниз)
4.Выпуск(поршень
движется вверх, открывается выпускной
клапан, переработанные газы выбрасываются
в атмосферу(холодильник)).
Любой
тепловой двигатель имеет 3 неотъемлемые
части:
1.Нагреватель
2.Рабочее
тело
3.Газ
или пар
4.Холодильник(атмосфера).
КПД
теплового двигателя.
Отношение
работы к энергии, которое получило
рабочее тело от нагревателя, называют
коэффициентом полезного действия
(КПД):
Паровая или газовая турбина, двигатель
внутреннего сгорания, реактивный
двигатель работают на базе ископаемого
топлива. В процессе работы многочисленных
тепловых машин возникают тепловые
потери, которые в конечном счете приводят
к повышению внутренней энергии атмосферы,
т. е. к повышению ее температуры. Это
может привести к таянию ледников и
катастрофическому повышению уровня
Мирового океана, а вместе с тем к
глобальному изменению природных
условий. При работе тепловых установок
и двигателей в атмосферу выбрасываются
вредные для человека, животных и растений
оксиды азота, углерода и серы. С вредными
последствиями работы тепловых машин
можно бороться путем повышения КПД, их
регулировки и создания новых двигателей,
не выбрасывающих вредные вещества с
отработанными газами.
Цикл
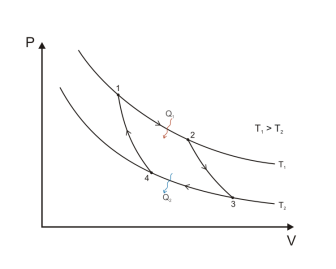
Карно.
–
это замкнутый
цикл который
состоит из 2-х изотерм и 2-х адиобат.
Если
двигатель будет работать, то получается
максимальное КПД
КПД=Smax
=
T1-
это температура нагревания
T2-
это температура холодильника
Smax=
Q1-
это тепло, которое получает рабочее
тело от нагревателя
Q2-
это тепло, которое отдает рабочее тело
холодильнику.
КПД≠100%,
т.к. 100% можно было бы получить тогда,
когда температура холодильника равнялась
0К.
1→2
Изотермическое расширение. Т=const,
m=const,
V1<V2,∆U=0,
U=const,
A>0,
Q
подводим.
2→3
Адиаботическое расширение. Q=0,
V2<V3,
газ отдает часть энергии => ∆U↓
и T1↓
до Т2
3→4
Изотермическое сжатие.Т2=const,
∆U=0,
A<0,
Q
отводится.
4→1
Адиабатическое сжатие. Q=0,
U↑,
T↑
до Т1
25.Адиабат.
называют процесс,
Протекающий,
без теплообмена
с
окружающей средой. Q = 0,
следовательно,
газ при расширении
совершает
работу за счет уменьше-
-ния
его внутренней энергии,
следовательно,
газ охлаждается
,
Кривая,
изображающая
адиабатный
процесс, называется адиабатой.
Есл
воздух насыщен паром,то измен P,V,T
Происход
медленно а в сухом за счёт
Водяного
пара внутри Vвыделят
тепло.
При
насыщенной t,
Растёт
медленнее чем в сухом.
В
атмосфере при подъёме воздуха
Происходит
его расшир.
Адиаб.процесс
применяют при работе
Холод.и
мороз.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
17.05.2015430.93 Кб221.pdf
- #
- #
Задача. Определите приращение внутренней энергии идеального одноатомного газа, количество вещества которого моль, при его нагревании на
оС.
Решение
Думаем: любое изменение можно найти как разность начального и конечного состояния системы
(1)
- где
По определению внутренней энергии:
(3)
Решаем: для начального и конечного состояния газа
(2)
(3)
Тогда, подставляя (2) и (3) в (1), получим:
(4)
Обратим внимание на — изменение температуры газа в Кельвинах. Однако помним, что изменение температуры и в градусах Кельвина и в градусах Цельсия одинаково, тогда
. Тогда исходя из (4):
(5)
Считаем: помним о константах ( м
*кг*с
*К
*Моль
).
Дж
Ответ: Дж.
Ещё задачи на тему «Работа и внутренняя энергия идеального газа«.