Атомное ядро (10-12 – это 10 в минус 12-ой степени и тд)
Большинство ядер имеют форму близкую к сферической и диаметр 10-12 см, что на четыре порядка меньше диаметра атома (10-8 см) . Плотность вещества в ядре – около 230 млн. тонн/см3. Атомное ядро было открыто в 1911 г. в результате серии экспериментов.. .
Размеры атомов (см)
Порядок величины диаметра атома 10-8
Радиус атома водорода0.53 10-8
Радиус атома гелия1.05 10-8
Радиус атома урана1.5 10-8
Порядок величины объема
атома (см3)10-24
Порядок величины диаметра
атомного ядра10-13-10-12
Радиус ядра атома гелия2 10-13
Радиус ядра атома урана8.5 10-13
Порядок величины объема
атомного ядра (см3)10-39-10-36
Порядок величины расстояния
между атомами твердого в-ва10-8
Масса атомов (10-27 кг)
Водород1.67
Гелий6.64
Углерод19.9
Азот23.2
Натрий38.1
Алюминий44.8
Фосфор51.4
Железо92.8
Медь105
Серебро179
Олово197
Золото327
Уран395
Вот казалось бы, радиус атома – штука хорошо известная и кажется уже чем-то очевидным. Значение это приведено даже в таблице Менделеева. Правда ни в каждой, но есть такие “прокаченные” варианты, где отражены основные параметры каждого приведенного элемента. Ну и исходя из таких данных, мы вполне можем выбрать самый большой атом и самый маленький.
В чём сложность?
Однако, тут нужно помнить, что размер атома – величина весьма условная. Одной из главных проблем тут является нестабильность самого атома. Под термином нестабильность тут мы будем понимать не его склонность к постоянному распаду, а ряд сопутствующих проблем.
Например, вроде бы очевидно, что измерять размер следует исходя из радиуса, который является отрезком прямой, соединяющий центр ядра атома и наиболее стабильную электронную орбиталь, где вероятность появления электрона наибольшая. Но это очень красиво, пока мы рисуем планетарную модель. На самом же деле, орбиты электронов, движущихся вокруг атома выглядят примерно так 🙂
Соответственно, уже “с порога” встаёт вопрос точности измерения. При этом нужно понимать, что переход атома в возбужденное состояние при таком раскладе сможет изменить его размер.
Но даже если исходить из усреднения измерений, есть и ещё одна важная проблема. На данный момент не существует объективной методики, которая позволяет измерять размер атома, как мы измеряем гайку штангенциркулем. Все измерения размера атомов косвенные.
Какие методики измерения существуют?
В энциклопедии довольно мудрёно объясняется, что нормальных в нашем понимании измерений пока нет. Существующие методики строятся на логическом предположении, которое позволяет утверждать, что мы измеряем размер атома.
Например, существует методика измерения размера атома, исходя из плотности потока отражения бомбардируемых частиц. По атому стреляют частичкам и там где есть атом, эти частички отлетают в обратном направлении. Пятно, появившееся на сенсоре, фиксирующем такие отраженные частицы, считается соответствующим размеру измеряемого атома.
Есть теоретическая методика, которая исходит из измерения размера атома посредством определения межатомных расстояний. Исходя из принципа плотнейшей упаковки, расстояние между атомами для каждого элемента фиксировано и прямо соотносится с размером самого атома. Это даёт возможность предположить, что реальный размер атома такой-то. Ну а измерить расстояние между самими атомами технически проще, чем измерять радиус атома. Тут достаточно точечных рефлексов.
Наиболее точной методикой измерения размеров атома сегодня считается методика спектроскопии. Спектроскопические методы основаны на взаимодействии электромагнитной волны с веществом. При некоторых условиях, вещество выступает как дифракционная решетка, а параметры решетки могут быть высчитаны. При этом, размер самой решетки прямо соотносится с размерами межатомных пространств. Ну а исходя из знаний о строении вещества, можно прикинуть и размер самого атома.
Есть и ещё одна интересная методика. Она расчётная. Исходя из атомной массы высчитывается размер атома. Плотность можно измерить, массу высчитать. Дальше простая арифметика позволяет рассчитать и радиус атома. Правда тут приближений ещё больше, чем во всех описанных ранее методиках.
Ну и из серии совсем экстравагантных измерений – на одном из конкурсов научной фотографии победила фотография “Одинокий атом стронция в ионной ловушке”. Там на простой фотоаппарат был сфотографирован атом и выглядит он как светящаяся точка. Сопоставляя размеры этой точки и любого объекта, вполне можно прикинуть реальный размер.
Важно отметить, что в основном все методики дают сопоставимые результаты. Казалось бы, это означает, что размер атома определен верно и однозначно. Но, возвращаемся к началу статьи и вспоминаем, что сама по себе однозначная форма атома – это научное приближение и абстракция. В реальных условиях может меняться как реальная форма, так характерный размер.
Так, если измерять атом внутри кристаллической решетки, то мы получим один размер, а если измерять атом того же вещества, свободно путешествующий в пространстве – другой. Логично предположить, что размер свободного атома больше размера связанного атома. Он ведет себя подобно резиновому мячику. Пока мячик сжимается внешними силами, он имеет меньший радиус, нежели мячик, который находится в свободном положении.
Так есть ли точная информация?
В итоге можно сказать, что однозначно определенных значений атомных радиусов не существует. Ведь помимо того, что все методики измерений дают хоть и коррелирующий, но не одинаковый результат, есть ещё и конфигурация самого атома. Отсюда следует очень простой и, отчасти печальный, вывод.
Размер атома, известный нам – это всего лишь научная абстракция, используемая для удобной работы с моделью строения вещества. Радиус атома, приведенный в справочнике подразумевает измерение в одинаковых условиях одинаковым методом. Нельзя сказать, что это полная ахинея, ведь размеры соизмеримы с реальностью, но и нельзя утверждать о высокой точности.
Обязательно подпишитесь на проект, оцените статью лайком и напишите комментарий! Это поможет развитию канала, а вы не пропустите новые интересные статьи
Советую также прочитать на нашем канале:
—–
Смотрите нас на YouTube и присоединяйтесь к телеге!
Атом – уникальная частица мироздания. Эта статья постарается донести до читателя информацию об этом элементе материи. Здесь мы рассмотрим такие вопросы: каков диаметр атома и его размеры, какие он имеет качественные параметры, в чем заключается его роль во Вселенной.
Знакомство с атомом

Атом – составная частица веществ, имеющая микроскопические размер и массу. Это наименьшая часть элементов химической природы с невероятно малыми размерами и массой.
Атомы строятся из двух основных структурных элементов, а именно из электронов и атомного ядра, которое, в свою очередь, образуется протонами и нейтронами. Число протонов может отличаться от количества нейтронов. Как в химии, так и в физике атомы, в которых величина протонов соизмерима с количеством электронов, называют электрически нейтральными. Если число электронов выше или ниже числа протонов, то атом, приобретая положительный или отрицательный заряд, становится ионом.
Атомы и молекулы в физике долгое время считались мельчайшими «кирпичиками», из которых строится Вселенная, и даже после открытия еще меньших составных компонентов остаются среди важнейших открытий в истории человечества. Именно атомы, связанные при помощи межатомных связей, образуют молекулы. Основная масса атома сосредоточена в ядре, а именно, в весе его протонов, которые составляют около 99,9 % от значений общей величины.
Исторические данные

Благодаря достижениям науки в области физики и химии было совершено множество открытий относительно природы атома, его строения и возможностей. Были произведены многочисленные опыты и расчеты, в ходе которых человек смог ответить на такие вопросы: каков диаметр атома, его размер, и многое другое.
Впервые понятие атома было открыто и сформулировано философами древней Греции и Рима. В XVII–XVIII веках химики смогли при помощи экспериментов доказать идею об атоме как наименьшей частице вещества. Они показали, что множество веществ можно расщеплять многократно при помощи химических методов. Однако в дальнейшем открытые физиками субатомные частицы показали, что даже атом можно разделить, а строится он из субатомных компонентов.
Международный съезд ученых по химии в Карлсруэ, расположенном на территории Германии, в 1860 г. принял решение относительно понятия об атомах и молекулах, где атом рассматривается как самая маленькая часть химических элементов. Следовательно, он также входит в состав веществ простого и сложного типа.
Диаметр атома водорода был изучен одним из самых первых. Однако его расчеты были произведены множество раз и последние из них, опубликованные в 2010 г., показали, что он на 4 % меньше, чем предполагалось ранее (10-8). Показатель общего значения величины атомного ядра соответствует числу 10-13-10-12, а порядок величины всего диаметра равен 10-8. Это вызвало множество противоречий и проблем, поскольку сам водород по праву относится к основным составным частям всей обозримой Вселенной, а подобная несостыковка вынуждает совершать множество перерасчетов по отношению к фундаментальным утверждениям.
Атом и его модель
В настоящее время известно пять основных моделей атома, отличающиеся между собой, прежде всего, временными рамками представлениями об его устройстве. Рассмотрим непосредственно модели:
- Кусочки, из которых состоит материя. Демокрит считал, что любое свойство веществ должно определяться его формами, массой и другим рядом практических характеристик. Например, огонь может обжечь, потому что его атомы острые. Согласно мнению Демокрита, даже душа образована атомами.
- Атомная модель Томсона, созданная в 1904 г., самим Дж. Дж. Томсоном. Он предположил, что атом можно принимать в качестве положительно заряженного тела, заключенного внутри электронов.
- Ранняя планетарная атомная модель Нагаоки, созданная в 1904 году, полагала, что устройство атома аналогично системе Сатурна. Ядро маленьких размеров и имеющее положительный показатель заряда окружено электронами, которые двигаются по кольцам.
- Атомная планетарная модель, открытая Бором и Резерфордом. В 1911 г. Э. Резерфорд, после того как провел целый ряд экспериментов, стал полагать, что атом схож с планетарной системой, где у электронов есть орбиты, по которым они двигаются вокруг ядра. Однако это предположение шло в разрез с данными классической электродинамики. Чтобы доказать состоятельность этой теории, Нильс Бор ввел понятие о постулатах, утверждающих и показывающих, что электрону не требуется расходовать энергию, так как он находится в определенном, специальном энергетическом состоянии. Изучение атома в дальнейшем привело к тому, что появилась квантовая механика, которая смогла объяснить множество противоречий, которые можно было наблюдать.
- Квантово-механическая атомная модель утверждает, что центральная основа рассматриваемой частицы состоит из ядра, образующегося из протонов, а также нейтронов и электронов, движущихся вокруг него.
Особенности строения
Размер атома ранее предопределял, что это неделимая частица. Однако множество опытов и экспериментов показали нам, что он строится из субатомных частиц. Любой атом состоит из электронов, протонов и нейтронов, за исключением водорода – 1, который не включает в себя последние.
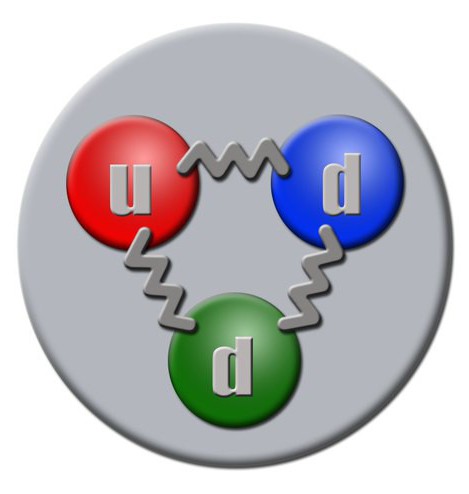
Стандартная модель показывает, что протоны и нейтроны образованы посредством взаимодействия между кварками. Они относятся к фермионам, наряду с лептонами. В настоящее время различают 6 видов кварков. Протоны своим образованием обязаны двум u-кварками и одному d-кварку, а нейтрон – одному u-кварку и двум d-кварками. Ядерное взаимодействие сильного типа, которым связываются кварки, передается при помощи глюонов.
Движение электронов в атомном пространстве предопределяется их «желанием» быть ближе к ядру, другими словами, притягиваться, а также кулоновскими силами взаимодействия между ними. Эти же типы сил удерживают каждый электрон в потенциальном барьере, окружившем ядро. Орбита движения электронов обуславливает величину диаметра атома, равную прямой линии, проходящей от одной точки в окружности к другой, а также через центр.
У атома имеется его спин, который представлен собственным импульсным моментом и лежит вне понимания общей природы материи. Описывается при помощи квантовой механики.
Размеры и масса
Каждое ядро атома с одинаковым показателем числа протонов относится к общему химическому элементу. К изотопам относятся представители атомов одного элемента, но имеющие различие в нейтронном количестве.
Поскольку в физике строение атома указывают на то, что основную их массу составляют протоны и нейтроны, то общую сумму данных частиц имеют массовым числом. Выражение атомной массы в состоянии спокойствия происходит посредством использования атомных единиц массы (а. е. м.), которые по-другому именуются дальтонами (Да).
Размер атома не имеет четко выраженных границ. Потому определяется он при помощи измерения расстояния между ядрами одинакового типа атомов, химически связанных между собой. Другой способ измерения возможен при расчете длительности пути от ядра до дальнейшей из имеющихся электронных орбит стабильного типа. Периодическая система элементов Д. И. Менделеева располагает в себе атомы по размеру, от меньших к большим, в направлении столбца сверху вниз, движение по направлению слева направо также основано на уменьшении их размеров.

Время распада
Все хим. элементы имеют изотопы, от одного и выше. Они содержат в себе нестабильное ядро, подверженное радиоактивному распаду, вследствие чего происходит испускание частиц или электромагнитного излучения. Радиоактивным называют тот изотоп, у которого величина радиуса сильного взаимодействия выходит за пределы дальних точек диаметра. Если рассмотреть на примере аурума, то изотопом будет атом Au, за пределы диаметра которого во всех направлениях “вылетают” излучающиеся частицы. Изначально диаметр атома золота соответствует величине двух радиусов, каждый из которых равен 144 пк, а частицы, выходящие за пределы этого расстояния от ядра, будут считаться изотопами. Существует три типа распада: альфа-, бета- и гамма излучение.
Понятие о валентности и наличии энергетических уровней
Мы уже ознакомились с ответами на такие вопросы: каков диаметр атома, его размер, ознакомились с понятием распада атома и т. д. Однако, помимо этого, существуют и такие характеристики атомов, как величина энергетических уровней и валентность.
Электроны, двигающиеся вокруг атомного ядра, обладают потенциальной энергией и пребывают в связанном состоянии, располагаясь на возбужденном уровне. В соответствии с квантовой моделью, электрон занимает только дискретное количество энергетических уровней.

Валентность – это общая способность атомов, у которых на электронной оболочке имеется свободное место, устанавливать связи химического типа с другими атомными единицами. Посредством установления химических связей атомы стараются заполнить свой слой внешней валентной оболочки.
Ионизация
В результате воздействия высокого значения напряженности на атом он может подвергаться необратимой деформации, которая сопровождается электронным отрывом.
Это приводит к ионизации атомов, в ходе которой они отдают электрон(ы) и претерпевают превращение из стабильного состояния в ионы с положительным зарядом, иначе именуемые катионами. Этот процесс требует определенной энергии, которую называют потенциалом ионизации.
Подводя итоги

Изучение вопросов о строении, особенностях взаимодействия, качественных параметрах, о том, каков же диаметр атома и какие он имеет размеры, все это позволило человеческому разуму совершить невероятный труд, помогающий лучше осознать и понять устройство всей материи вокруг нас. Эти же вопросы позволили открыть человеку понятия об электроотрицательности атома, его дисперсном притяжении, валентных возможностях, определить длительность радиоактивного распада и многое другое.
Обновлено: 23.05.2023
На уроке рассматриваются: понятия атомное ядро, опыты Резерфорда, планетарная модель строения атома; сравниваются модели атома Томсона и Резерфорда, даны некоторые сведения о фактах, подтверждающих сложное строение атома, о работах учёных по созданию модели строения атома.
Атомное ядро — тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
Размеры ядра: диаметр порядка 10 -12 —10 -13 см (у разных ядер диаметры различны).
Размер атома: примерно 10 -8 см, т. е. от 10 до 100 тысяч раз превышает размеры ядра.
Планетарная модель атома Резерфорда: в целом атом нейтрален, в центре атома расположено положительно заряжённое ядро, в котором сосредоточена почти вся масса атома, электроны движутся по орбитам вокруг ядра, заряд ядра, как и число электронов в атоме, равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Ядро атома водорода названо протоном и рассматривается как элементарная частица.
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза больше массы электрона.
Частота излучений атома водорода составляет ряд серий: серия Бальмера, серия Лаймана, серия Пашена и другие, каждая из которых образуется в процессе перехода атома в одно из энергетических состояний.
Обязательная литература по теме урока:
Основное содержание урока
Долгое время, физика накапливала факты о свойстве вещества для полного представления о строении атома. И только в XIX веке изучение атомического строения вещества существенно сдвинулось с точки покоя.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Дмитрий Иванович Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились исследования спектров, излучаемые веществом, которые привели к открытию линейчатых спектров атомов. В начале XIX века в излучении атома водорода были открыты спектральные линии в видимой части спектра.
Идеи электронной структуры атома теоретически и гипотетически формулировались учёными. В 1896 году Хендрик Лоренц создал электронную теорию о том, что электроны являются частью атома. Эту гипотезу в 1897 году подтвердили эксперименты Джозефа Джона Томсона. Им был сформулирован вывод о том, что существуют частицы с наименьшим отрицательным зарядом – электроны и они являются частью атомов.
Таким образом, к началу XX века учёные сделали вывод о том, что атомы материи имеют сложную внутреннюю структуру. Они являются электрически нейтральными системами, а носителями отрицательного заряда атомов являются лёгкие электроны, масса которых составляет лишь малую долю массы атомов. Однако модель атома Томсона находилась в полном противоречии с экспериментами по изучению распределения положительных зарядов.
Электрон – наименьшая электроотрицательная заряжённая элементарная частица
Масса покоя электрона me = 9,1·10 -31 кг;

– отношение заряда электрона к его массе.
Немецкий физик Филипп фон Ленард в 1903 году проводил опыты, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. На основании этого Ленард предположил, что атом состоит из нейтральных частиц или нейтральных дуплетов с совмещённым положительным и отрицательным зарядами, рассредоточенными в атоме, где большая площадь представляет собой пустоту.

В 1904 году японский физик Хентаро Нагаока выдвинул гипотезу о том, что атом состоит из тяжелого положительно заряженного ядра, окруженного кольцами из большого числа электронов, колебания которых и являются причиной испускания атомных спектров, по аналогии с теорией устойчивости колец Сатурна.

Но в физике уже более 200 лет существует главное правило: окончательный выбор между гипотезами может быть сделан только на основе опыта. Эксперименты, проведенные в первый раз Эрнестом Резерфордом, сыграли решающую роль в понимании структуры атома.

30.08.1871 г. – 19.10.1937 г.
Британский физик новозеландского происхождения
Лауреат Нобелевской премии по химии 1908 года
Для экспериментального изучения распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд в 1906 г. предложил применить зондирование атома α-частицами, скорость которых составляет 1/15 скорости света.
Эти частицы возникают при распаде, например, радия и некоторых других радиоактивных элементов. Сами же α-частицы – это ионизированные атомы гелия, положительный заряд гелия в два раза больше заряда электрона +2He. Этими частицами Резерфорд бомбардировал атомы тяжёлых элементов (золото, медь и др.). Если бы электроны были равномерно распределены по всему объёму атома (по модели атома Томсона), электроны не могли бы заметно изменять траекторию α –частиц, так как размеры и масса электронов в 8000 раз меньше массы α-частиц. Точно так же камушек в несколько десятков граммов при столкновении с автомобилем не может изменить его скорость.
Изменение направления движения α-частиц может вызвать только массивная часть атома, при этом положительно заряжённая. Весь прибор размещался в сосуде, из которого был откачан воздух. Радиоактивный препарат, помещался внутри свинцового цилиндра, вдоль которого был высверлен узкий канал. Пучок α -частиц из канала падал на тонкую фольгу из тяжёлого металла. После рассеяния α-частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать в микроскоп.
Чтобы обнаружить отклонение α-частиц на большие углы Резерфорд окружил фольгу экранами. Сотрудники Резерфорда вели счёт α-частиц, попадающих в регистрирующее устройство при отклонении их на от первоначального направления на определённый угол φ (фи). Данные из серии опытов, за определённый период времени, приведены в таблице:
Атомы различных элементов имеют разные размеры и разные массы. Так как атомы имеют форму шара, их размеры характеризуются диаметром или радиусом.
Для выражения малых величин часто используются единицы длины, которые называются ангстренами и нанометрами (нм):

Массы атомов также являются очень малыми величинами. Массы атомов, которые выражены в обычных единицах массы (кг или г), называются абсолютными атомными массами и обозначаются символом mа.


Использовать такие малые величины очень неудобно. Поэтому в химии вместо абсолютных атомных масс обычно используются относительные атомные массы.
За единицу атомных масс принимается 1/12 часть абсолютной массы атома углерода С. Если представить атом углерода в виде шарика и мысленно разделить его на 12 равных частей, то масса одной части и есть атомная единица массы.


Относительная атомная масса элемента – это число, которое показывает, во сколько раз абсолютная масса атома данного элемента больше 1/12 части абсолютной массы атома углерода, т.е. атомной единицы массы.


Таким образом, масса атома водорода приблизительно равна массе 1/12 части атома углерода, а масса атома кислорода приблизительно в 16 раз больше массы 1/12 части атома углерода.
Обратите внимание , что относительные атомные массы элементов, как и любые относительные величины, являются безразмерными.

Решение: Атомная масса кальция составляет Аr (Са)=40 г/моль. Масса одного атома кальция окажется равной:
Решение: Величины абсолютных масс атомов и молекул находятся делением массы 1 моль вещества на число Авогадро.
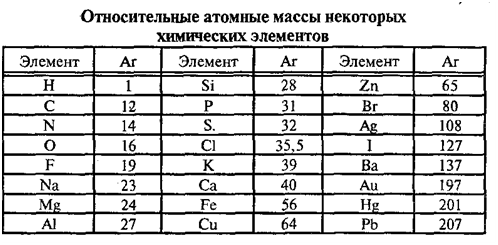
10. Используя относительные атомные массы элементов (см. табл.), рассчитайте, во сколько раз масса атома меди больше массы а) атома серы; б) атома кислорода; в) атома водорода.
Относительная атомная масса или атомная масса химического элемента – это отношение массы атома этого элемента к /” width=”35″ height=”18″ />
массы атома углерода _6″ width=”29″ height=”21″ />
.
В таблице химических элементов Д.И.Менделеева приведены относительные атомные массы элементов.
Относительная молекулярная масса вещества – это отношение массы молекулы этого вещества к /” width=”35″ height=”18″ />
массы атома углерода _6″ width=”29″ height=”21″ />
.
Относительную молекулярную массу можно найти как сумму относительных атомных масс элементов, входящих в химическую формулу вещества.
Относительная атомная масса и относительная молекулярная масса – величины безразмерные.
Размеры и масса атомов и молекул
Можно говорить и просто о массе атома или молекулы. Массу микрочастиц часто измеряют в атомных единицах массы:
![]()
Масса любого атома в кг равна:
![]()
а масса любой молекулы в кг:
![]()
![]()
.
Чтобы нагляднее представить себе размеры атомов молекул и их количество в определенном объеме вещества, приведем один интересный пример: если все атомы, находящиеся в 1 см 3 меди, расположить в одну линию плотно друг к другу, то длина такой цепочки будет примерно 14 миллиардов километров. Это примерно в 90 раз больше, чем расстояние от Земли до Солнца.
Примеры решения задач
| Задание | Определить массы атомов гелия, хлора. |
| Решение | 1. масса атома гелия ; |
По таблице Менделеева определяем относительную атомную массу атома гелия
Далее вычисляем массу атома гелия:
![]()
![]()
2. масса атома хлора ;
По таблице Менделеева определяем относительную атомную массу атома хлора:
Вычисляем массу атома хлора:
![]()
![]()
| Задание | Определить массы молекул кислорода, углекислого газа, водяного пара. |
| Решение | 1) масса молекулы кислорода; |
Запишем химическую формулу для молекулы кислорода — .
Относительная молекулярная масса молекулы кислорода:
Относительную атомную масса кислорода определяем по таблице Менделеева:
Относительная молекулярная масса молекулы кислорода:
![]()
Масса молекулы кислорода:
![]()
2) масса молекулы углекислого газа;
Запишем химическую формулу для молекулы углекислого газа — .
Относительная молекулярная масса молекулы углекислого газа:
![]()
По таблице Менделеева определяем относительные атомные массы:
углерода
кислорода .
![]()
![]()
Масса молекулы углекислого газа:
![]()
3) масса молекулы водяного пара;
Запишем химическую формулу для молекулы водяного пара — .
Относительная молекулярная масса молекулы водяного пара:
![]()
По таблице Менделеева определяем относительные атомные массы:
водорода
кислорода .
![]()
![]()
Масса молекулы водяного пара:
![]()

Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
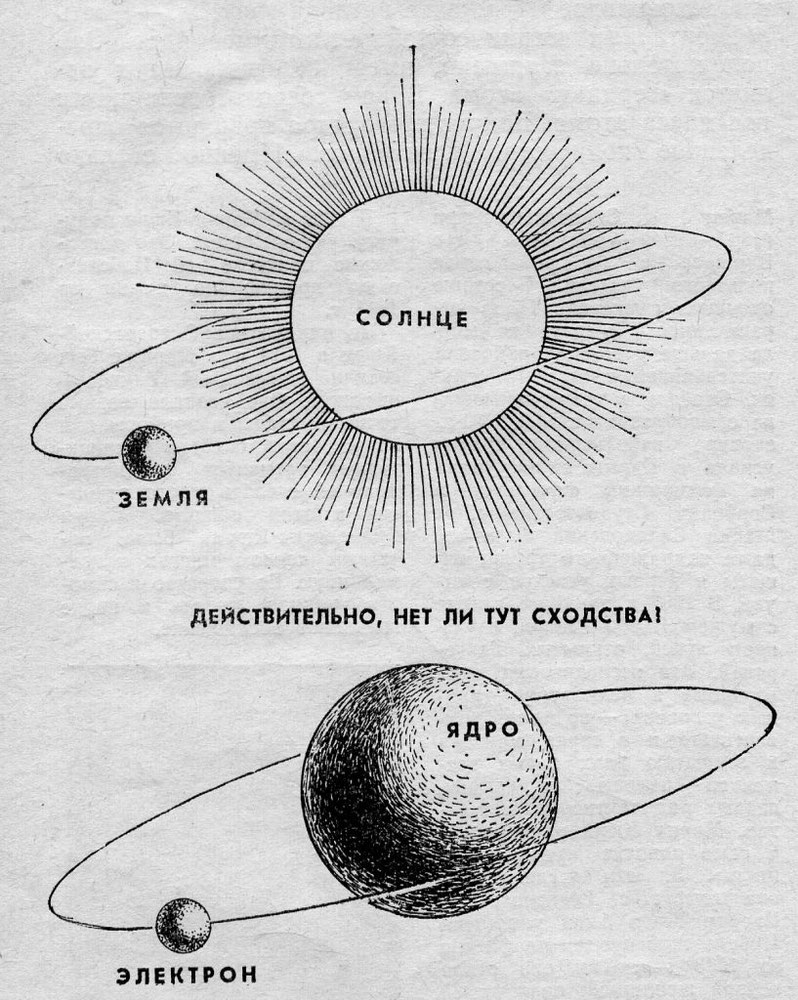
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц – кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.

Схема строения атома
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие “моль”. 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
Размеры атомов чрезвычайно малы. Так, самый маленький атом – это атом Гелия, его радиус – 32 пикометра. Самый большой атом – атом цезия, имеющий радиус 225 пикометров. Приставка пико означает десять в минус двенадцатой степени! То есть , если 32 метра уменьшить в тысячу миллиардов раз, мы получим размер радиус атома гелия.
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?

Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Откуда взялись атомы?
Как известно, сейчас различные атомы сгруппированы в таблицу Менделеева. В ней насчитывается 118 (а если с предсказанными, но еще не открытыми элементами – 126) элементов, не считая изотопов. Но так было далеко не всегда.


Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.

Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Читайте также:
- Стереотипы о белорусах кратко
- По праву памяти отзыв кратко
- Каковы особенности размещения угольной промышленности в россии кратко
- История фамилии попов кратко
- Вернадский начало и вечность жизни кратко
Научная статья
на тему: “Атомный радиус / атомный диаметр с
таблицей”
В этой статье мы будем иметь дело с атомным
радиусом или атомным диаметром. Он объясняет, что имеется в виду под атомным
радиусом, а атомные радиусы и атомные диаметры даны для некоторых элементов.
Эта статья относится к нашему химическому отделу.В математике это все еще
довольно просто: у вас есть круг, и у него есть центральная точка. Если вы
идете от центра к границе круга, у вас есть радиус. А если удвоить радиус,
получится диаметр. И именно это понятие мы сейчас переносим в химию, а именно
на атомный радиус. К сожалению, в химии все не так просто. Потому что где на
самом деле заканчивается атом? По этой причине было придумано другое
определение. Половина расстояния между ядрами двух соседних атомов
называется атомным радиусом элемента.
Радиусы атомов увеличиваются
в периодической таблице элементов (PSE на следующем рисунке) сверху вниз и
слева направо. Однако это правило не распространяется на атомы благородных
газов. По мере увеличения числа протонов силы притяжения атомного ядра к
электронной оболочке увеличиваются, и в результате атомный радиус уменьшается.
В принципе, можно сказать, что диаметр атома порядка 10 -10 м.
Атомные радиусы и атомные диаметры обычно выражаются в пикометрах (1pm = 10 -12
м). Итак, атомы крошечные.
Периодическая таблица
элементов (нажмите на большой формат в новом окне):

Атомные радиусы
разделены в соответствии с различными типами химической связи. Одно отличает.
●
Ионные радиусы : в системах с преимущественно
ионной структурой атомам приписываются ионные радиусы.
●
Ковалентные радиусы : для атомов в молекулярных
соединениях, характеризуемых как ковалентные, указаны ковалентные радиусы.
●
Радиусы атомов металла: в металлах атомы имеют
радиусы атомов металла.
● Радиусы
Ван-дер-Ваальса: силы Ван-дер-Ваальса действуют между молекулами ковалентных
связей; соответственно есть радиусы Ван-дер-Ваальса.
Таблица атомных радиусов и атомных
диаметров
Если вы будете искать в
разных источниках атомный радиус или атомный диаметр для разных элементов, вы
быстро удивитесь. Потому что значения сильно различаются (даже для одной и той
же ссылки). По этой причине я составил таблицу, в которой представлены
различные значения, которые я нашел. Прежде всего, я хотел бы перечислить
несколько важных элементов. Данные в пикометрах (13:00 = 10-12 м).
|
элемент |
символ |
Атомный номер |
Атомный радиус в пм |
|
водород |
ЧАС |
1 |
31–37,7 |
|
литий |
Ли |
3 |
128–152 |
|
углерод |
С. |
6-е |
76-77,2 |
|
азот |
N |
7-е |
70-71 |
|
кислород |
О |
8-е |
60,4-66 |
|
неон |
Нет |
10 |
58 |
|
натрий |
Нет данных |
11-е |
153,7–186 |
|
магний |
Mg |
12-е |
141–160 |
|
алюминий |
Al |
13-е |
121–143 |
|
Кремний |
Si |
14-е |
111-117 |
|
сера |
С. |
16 |
104-105 |
|
железо |
Fe |
26-е |
124–132 |
|
никель |
Ni |
28 год |
124 |
|
медь |
Cu |
29 |
127-132 |
