Характер ионов,
образующихся при диссоциации разных
электролитов, должен быть различен. В
молекулах солей диссоциация всегда
идет с образованием положительных ионов
металла и отрицательно заряженных ионов
кислотного остатка.
Соли
могут быть определены как соединения,
дающие в водном растворе ионы металла
и кислотного остатка
KNO3
↔
K+
+
NO3–;
Na2SO4
↔
2Na+
+
SO42–;
MgCl2
↔
Mg2+
+
2Cl–;
MgSO4
↔
Mg2+
+
SO42–
При растворении
кислых солей
в растворе образуются катионы металла
и сложные анионы кислотного остатка, а
также ионы, являющиеся продуктами
диссоциации этого сложного кислотного
остатка, в том числе H+.
Например:
NaHCO3
↔ Na+
+ HCO3–;
HCO3–
↔ H+
+ CO32–
При диссоциации
основных
солей
образуются анионы кислотного остатка
и сложные катионы, состоящие из металла
и гидроксогрупп. Эти сложные катионы
также способны к диссоциации. Поэтому
в растворе основной соли присутствуют
OH–:
MgOHCl
↔ MgOH+
+ Cl–;
MgOH+
↔ Mg2+
+ OH–
Основания
можно определить как соединения, дающие
в водном растворе анионы гидроксила и
катионы металла:
NaOH ↔
Na+
+
OH–;
Ba(OH)2
↔
Ba2+
+
2 OH–
Кислотами
называются соединения, дающие в водных
растворах ионы водорода (точнее ионы
гидроксония) и анионы кислотного остатка
HNO3
↔
H+
+
NO3–;
H2SO4
↔
2H+
+
SO4–
Характер
электролитической диссоциации той или
иной молекулы в значительной степени
определяется полярностями ее валентных
связей. Полярность связи водорода с
кислородом в соединениях типа ROH
существенно меняется в зависимости от
химической природы радикала R.
Если радикал характеризуется сильно
выраженными металлическими свойствами,
связь между ним и О резко полярна, связь
же О−Н в этом случае малополярна.
Наоборот, если R
обладает резко выраженными неметаллическими
свойствами, связи между ним и О малополярна,
связь же О−Н резко полярна.
Таким образом,
диссоциация соединений типа ROH
может происходить по двум направлениям:
R





O
H
Некоторые соединения,
способные при одних и тех же условиях
отщеплять и ионы водорода и ионы
гидроксила, называются амфотерными.
К амфотерным электролитам относятся
Zn(OH)2,
Al(OH)3,
Cr(OH)3
и др.
Простейшим
амфотерным соединением является вода,
дающая при диссоциации ионы H+
и OH–.
Однако диссоциация воды настолько мала,
что концентрация H+
и ОН–
в чистой воде равна 10-7
г-ион/л. Опыт показывает, что содержание
ионов в воде с течением времени не
изменяется. Следовательно, наряду с
процессом распада (диссоциации) имеет
место и обратный – образование из ионов
недиссоциированных молекул (моляризация).
Таким образом, электролитическая
диссоциация есть процесс
обратимый.
4. Степень диссоциации электролита. Закон разбавления Оствальда
Количественную
характеристику равновесного состояния
электролита дает его степень
диссоциации
(a),
т.е. отношение числа молекул, распавшихся
на ионы, к общему числу растворенных
молекул.
a
= n
/ N
a
измеряется в % (долях). N
– общее число молекул в растворе, n
– число диссоциированных молекул.
Степень диссоциации
электролита зависит от ряда факторов,
среди которых:
-
природа
электролита; -
природа
растворителя; -
температура;
-
концентрация
раствора; -
присутствие
одноименных ионов.
Природа электролита
– главный фактор, определяющий степень
диссоциации. Чем более полярной является
химическая связь между атомами или
группами атомов в молекуле, тем сильнее
растворитель с высоким значением
диэлектрической проницаемости
препятствует электростатическому
взаимодействию ионов противоположного
знака в растворе, тем больше степень
диссоциации.
Природа растворителя
также оказывает существенное влияние
на степень диссоциации растворённого
вещества. Степень диссоциации в
значительной мере зависит от диэлектрической
проницаемости растворителя. Диэлектрическая
проницаемость (ξ) показывает, во сколько
раз сила взаимодействия между двумя
зарядами в данной среде меньше, чем в
вакууме. Чем больше диэлектрическая
проницаемость среды, тем больше степень
электролитической диссоциации. Самое
высокое значение ξ=81 имеет вода. Замена
воды на растворитель с меньшей
диэлектрической проницаемостью,
например, на этиловый спирт (ξ=25), сильно
понижает степень диcсоциации. Сильные
электролиты в спирте становятся
электролитами средней силы, а слабые –
практически не диссоциируют.
В общем случае
степень электролитической диссоциации
сложным образом зависит от температуры.
Для многих электролитов существует
достаточно широкий температурный
интервал, в котором наблюдается простая
зависимость между тепловым эффектом,
степенью диссоциации и температурой.
Если процесс диссоциации экзотермичен,
то с повышением температуры степень
диссоциации падает. При эндотермическом
процессе – повышение температуры ведёт
к увеличению степени диссоциации. Так,
степень диссоциации воды растёт с
увеличением температуры. При 18 °С степень
диссоциации воды равна 1,5∙10–9,
а при 100 °С – 1,5∙10–8.
Для каждого электролита существуют
температурные условия, в которых он
диcсоциирует в большей степени. Так,
степень диссоциации уксусной кислоты
максимальна при 25 °С (Кд
= 1,75∙10–5).
Выше и ниже этой температуры степень
диссоциации уксусной кислоты меньше (
при 0 °С Кд
= 1,65∙10–5,
а при 50 °С Кд
= 1,62∙10–5).
Отсутствие чёткой зависимости степени
диссоциации от температуры объясняется
неравномерным изменением энтальпии
гидратации, состава ионов, свойств
растворителя и других с изменением
температуры.
Изменение
концентрации
раствора будет различно отражаться на
процессах диссоциации и моляризации.
Степень диссоциации электролита при
разбавлении раствора увеличивается.
Все электролиты
в зависимости от степени диссоциации
делятся на сильные, средней силы и
слабые. Электролиты, диссоциированные
при указанных условиях на 30 % и больше,
называют сильными; диссоциированные
на 5÷30%, – электролитами средней силы,
еще менее диссоциированные – слабыми
электролитами.
Все соли являются
сильными электролитами. К сильным
электролитам принадлежат следующие
кислоты: HNO3,
HClO4,
HClO3,
H2SO4,
HCl,
HBr,
HI,
HMnO4.
К слабым кислотам относятся все
органические кислоты, а также H2CO3,
H2S,
HCN,
H2SiO3
и некоторые другие. К сильным основаниям
относятся KOH,
NaOH,
Ca(OH)2,
Ba(OH)2.
К слабым основаниям принадлежат NH4OH,
Al(OH)3,
Zn(OH)2,
Mg(OH)2,
Cu(OH)2
и др.
В растворах слабых
электролитов процесс диссоциации
молекул на ионы обратим. Поэтому к ним,
как к равновесным системам, приложим
закон действия масс. Например, для
диссоциации уксусной кислоты в водном
растворе CH3COOH![]() H++CH3COO–.
H++CH3COO–.
Константа равновесия
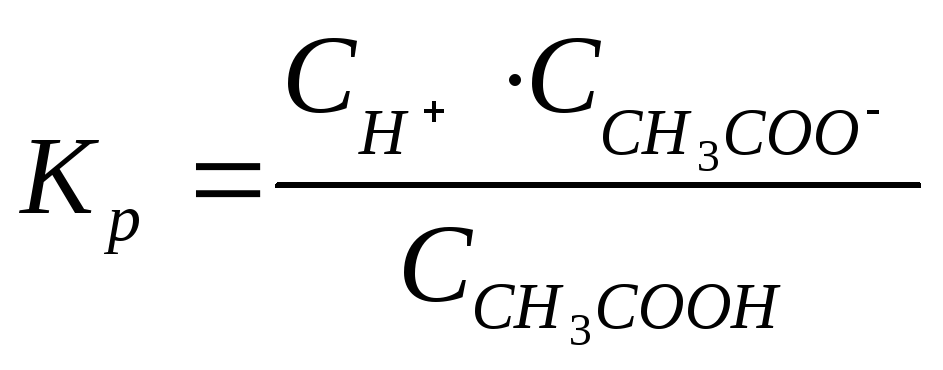 называется
называется
константой диссоциации (Кд).
Чем меньше Кд,
тем слабее электролит проявляет
способность к диссоциации. Если молекула
слабого электролита может диссоциировать
на два и на большее число ионов, то
диссоциация проходит по стадиям
(ступенчатая диссоциация). При этом
каждая стадия характеризуется своей
константой диссоциации. Например, H3PO4
диссоциирует по уравнениям
H3PO4
↔ H+
+ H2PO4– K1
H2PO4–
↔ H+
+ HPO42–
K2
HPO42–
↔ H+
+ PO43–
K3
Значение констант
изменяется в ряду К1
> К2
> К3.
Это положение имеет общее значение,
т.к. отщепление второго и третьего ионов
водорода требует большей энергии
(приложение, табл. 1).
Константа
полной диссоциации слабого электролита
равна произведению констант его
диссоциации по ступеням.
Например, для
H2CO3
Kд
= K1K2
= 4,7∙10–11∙
4,5∙10-7
= 2,1∙10-17
Константа диссоциации
слабого электролита связана со степенью
диссоциации. Обозначим: С – исходная
концентрация электролита, α – степень
диссоциации. Тогда концентрация ионов
в состоянии равновесия для бинарного
электролита Сα.
Концентрация недиссоциированных молекул
будет
(С – С∙α) = С (1–α).
Константу диссоциации
для уксусной кислоты можно представить
следующим образом:
![]() закон разведения
закон разведения
Оствальда.
В слабых электролитах
величина α << 1. Поэтому значением α
можно пренебречь и величину (1-α) принять
равной 1. Тогда K=Cα2,
![]()
т.е. степень диссоциации слабых
электролитов обратно пропорциональна
квадратному корню из концентрации.
Таким образом,
закон
разбавления Оствальда
формулируется следующим образом: степень
диссоциации электролита при разбавлении
раствора увеличивается.
При прибавлении
в раствор слабой кислоты или основания
соли, содержащей одноимённый
анион или катион
для кислоты или основания соответственно,
то согласно принципу Ле-Шателье, следует
ожидать смещения равновесия диссоциации
влево, т.е. в сторону уменьшения степени
диссоциации. Так, если к раствору уксусной
кислоты добавить немного ацетата натрия,
то добавленные ацетат-ионы смещают
равновесие диссоциации кислоты
СН3СООН
↔ CH3COO
– + H+
влево и степень
диссоциации уксусной кислоты уменьшается.
Об этом свидетельствуют приведенные
ниже данные:
[СН3СООNa],
моль/л 0,0 0,001 0,002 0,005 0,010 0,020
α
СН3СООН,
% 4,1 1,5 0,84 0,35 0,18 0,09
Подавление
диссоциации под влиянием одноимённого
иона называется “репрессией ионизации”.
С репрессией ионизации связаны многие
процессы, имеющие практическое значение.
Так, её используют для уменьшения
растворимости тех или иных соединений.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Рассмотрим соли с точки зрения электролитической диссоциации.
Особенностью солей является то, что они имеют ионные химические связи.
При диссоциации в водном растворе легко происходит образование гидратированных ионов. Поэтому соли не диссоциируют по ступеням.
Обрати внимание!
Соли диссоциируют сразу полностью, а не ступенчато.
Проанализируем уравнения диссоциации солей.
- При диссоциации нитрата натрия образуются катион натрия и нитрат-ион:
(=)
Na+
(+)
NO3−
.
- При диссоциации фосфата калия образуются катионы калия и фосфат-ион:
K3PO4
(=)
3K+
(+)
PO43−
.
- При диссоциации хлорида аммония образуются катион аммония и хлорид-ион:
(=)
NH4+
(+)
Cl−
.
Все рассмотренные уравнения сходны в том, что образуются катионы металлов и анионы кислотных остатков.
Соли — электролиты, которые при диссоциации образуют катионы металла (или катион аммония
NH4+
) и анионы кислотных остатков.
Свойства солей обусловлены как катионами металла, так и анионами кислотного остатка.
Пример:
соли аммония имеют как общие свойства, обусловленные катионами аммония
NH4+
, так и специфические, обусловленные различными анионами.
Общие свойства солей серной кислоты (сульфатов) связаны с наличием сульфат-ионов
SO42−
, а различные — с наличием разных катионов.
При
составлении уравнений электролитической диссоциации следует
поступать следующим образом: в левой части уравнения записать
формулу электролита, затем поставить знак равенства или обратимости в
зависимости от силы электролита. В правой части записать формулы
образующихся положительно и отрицательно заряженных ионов, указав значения и
знаки их зарядов. Перед формулами ионов поставить коэффициенты, затем проверить
сумму положительных и отрицательных ионов, она должна быть равна нулю.
Кислоты
–
это электролиты, при диссоциации которых образуются катионы водорода и
анионы кислотного остатка.
Сильные
кислоты диссоциируют полностью по одной ступени:
HCl
= H+ + Cl–
HNO3
= H+ + NO3–
H2SO4
= 2H+
+ SO42-
При
диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых
кислот вместо знака равенства ставится знак обратимости.
HNO2 ⇆ H+
+ NO2–
Многоосновные
слабые кислоты диссоциируют ступенчато. На каждой стадии
отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3
ступени:
1)
H3PO4 ⇆ H+
+ H2PO4–
2)
H2PO4– ⇆ H+
+ HPO42-
3)
HPO42- ⇆ H+
+ PO43-
Следует
учитывать, что диссоциация, в данном случае, по второй ступени протекает намного
слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях
почти не происходит.
Как
видно, все кислоты при диссоциации образуют катионы водорода, поэтому
они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся
красными.
Основания
– это электролиты, при диссоциации которых образуются катионы металла и в
качестве анионов гидроксид-ионы.
Сильные
электролиты – щёлочи – диссоциируют полностью по первой ступени.
NaOH
= Na+
+ OH–
Ca(OH)2
= Ca2+
+ 2OH–
Многоосновные
слабые основания диссоциируют ступенчато и вместо знака
равенства ставится знак обратимости. Например, гидроксид меди (II)
диссоциирует по двум ступеням:
1)
Cu(OH)2
⇆ CuOH+
+ OH–
2)
CuOH+ ⇆ Cu2+
+ OH–
Т.к.
при диссоциации оснований образуются гидроксид-ионы, то они будут иметь схожие
свойства, такие как мыльность на ощупь, изменение окраски индикаторов: лакмус
становится синим, метилоранж – жёлтым, фенолфталеин – малиновым.
Соли
– это электролиты, при диссоциации которых образуются катионы металлов (или
аммония) и анионы кислотного остатка.
Соли
диссоциируют по одной ступени, в отличие от кислот и
оснований.
NaCl
= Na+ + Cl–
NH4NO3
= NH4+ + NO3–
Al2(SO4)3
= 2Al3+
+ 3SO42-
Свойства
солей определяются как катионами металла, так и анионами кислотного остатка.
Например, соли аммония имеют общие свойства, обусловленные наличием иона
аммония (NH4+),
так и различные, обусловленные анионами кислотного остатка. Общие свойства
сульфатов – солей серной кислоты – обусловлены наличием сульфат-ионов, а
специфические свойства обусловлены различными катионами.
Кислые
соли, в отличие от средних, диссоциируют ступенчато:
первая ступень сопровождается диссоциацией катиона металла и аниона кислотного
остатка, содержащего ион водорода, вторая ступень – это отщепление иона
водорода и кислотного остатка.
NaHCO3
= Na+ + HCO3–
HCO3–
⇆
H+ + CO32-
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A – (анион)

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

Электролиты – жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.

Неэлектролиты – вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике – остается только то, что сократить нельзя.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Урок №8. Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
Многоосновные кислоты диссоциируют ступенчато:
Н 3 РО 4 ↔ Н + + Н 2 РО – 4 (первая ступень) – дигидроортофосфат ион
Н 2 РО – 4 ↔ Н + + НРO 2- 4 (вторая ступень) – гидроортофосфат ион
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени – по третьей.
Диссоциация оснований
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH – )
Щёлочи – это основания, растворимые в воде (основания щелочных и щелочноземельных металлов) : LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН) 2 , Sr(ОН) 2 , Ва(ОН) 2 , Rа(ОН) 2 , а также NН 4 ОН
Примеры уравнений диссоциации щелочей:
NH 4 OH ↔ NH + 4 + OH –
Многокислотные основания диссоциируют ступенчато:
Ba(ОН) 2 → Bа(ОН) + + OH – (первая ступень)
Ba(OH) + ↔ Ba 2+ +OH – (вторая ступень)
Диссоциация амфотерных оснований (амфолитов)
Амфолиты – это электролиты, которые при диссоциации одновременно образуют катионы водорода (H + ) и гидроксид-ионы (OH – )
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением:
2ОН – + Zn 2+ + 2Н 2 О ↔ Zn(ОН) 2 + 2Н 2 О ↔ [Zn(ОН) 4 ] 2- + 2Н +
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH + 4 ) и анионы кислотных остатков.
Диссоциация средних солей
Na 3 PO 4 →3Na + + PO 3- 4
Кислые и основные соли диссоциируют ступенчато.
Диссоциация кислых солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
KHSO 4 → K + + HSO – 4
HSO – 4 ↔ H + + SO 2- 4
Диссоциация основных солей
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
MgOHCl → MgOH + + Cl –
MgOH + ↔ Mg 2+ + OH –
ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: HF, Mg(OH) 2 , CaCl 2 , Zn(NO 3 ) 2 , Ba(OH) 2 , K 2 SO 4 , H 2 SiO 3 , FeI 3 , NiCl 2 , H 3 PO 4 , Ca(OH) 2 , Na 2 CO 3 , Na 3 PO 4 , HNO 3 , KOH, Ba(OH) 2 , H 2 SO 3 , Ca(NO 3 ) 2 , Ca 3 (PO 4 ) 2 , H 2 S, NaOH, HBr
Диссоциация кислот
При диссоциации кислот роль катионов играют ионы водорода (H + ), других катионов при диссоциации кислот не образуется:
Именно ионы водорода придают кислотам их характерные свойства: кислый вкус, окрашивание индикатора в красный цвет и проч.
Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляеют кислотный остаток.
Одной из характеристик диссоциации кислот является их оснОвность – число ионов водорода, содержащихся в молекуле кислоты, которые могут образоываваться при диссоциации:
Процесс отщепления катионов водорода в многоосновных кислотах происходит ступенчато: сначала отщепляется один ион водорода, затем другой (третий).
Ступенчатая диссоциация двухосновной кислоты:
Ступенчатая диссоциация трехосновной кислоты:
При диссоциации многоосновных кислот самая высокая степень диссоциации приходится на первую ступень. Например, при диссоциации фосфорной кислоты степень диссоциации первой ступени равняется 27%; второй – 0,15%; третьей – 0,005%.
Диссоциация оснований
При диссоциации оснований роль анионов играют гидроксид-ионы (ОH – ), других анионов при диссоциации оснований не образуется:
Кислотность основания определяется кол-вом гидроксид-ионов, образующихся при диссоциации одной молекулы основания:
- однокислотные основания – KOH, NaOH;
- двухкислотные основания – Ca(OH)2;
- трехкислотные основания – Al(OH)3.
Многокислотные основания диссоциируют, по аналогии с кислотами, также ступенчато – на каждом этапе отщепляется по одному гидроксид-иону:
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот (диссоциировать с отщеплением катионов водорода), так и в роли оснований (диссоциировать с отщеплением гидроксид-ионов). Такие вещества называются амфотерными (см. Кислотно-основные реакции).
Диссоциация Zn(OH)2, как основания:
Диссоциация Zn(OH)2, как кислоты:
Диссоциация солей
Соли диссоциируют в воде на анионы кислотных остатков и катионы металлов (или других соединений).
Классификация диссоциации солей:
- Нормальные (средние) соли получаются полным одновременным замещением всех атомов водорода в кислоте на атомы металла – это сильные электролиты, полностью диссоциируют в воде с образованием катоинов металла и однокислотного остатка: NaNO3, Fe2(SO4)3, K3PO4.
- Кислые соли содержат в своем составе кроме атомов металла и кислотного остатка, еще один (несколько) атомов водорода – диссоциируют ступенчато с образованием катионов металла, анионов кислотного остатка и катиона водорода: NaHCO3, KH2PO4, NaH2PO4.
- Основные соли содержат в своем составе кроме атомов металла и кислотного остатка, еще одну (несколько) гидроксильных групп – диссоциируют с образованием катионов металла, анионов кислотного остатка и гидроксид-иона: (CuOH)2CO3, Mg(OH)Cl.
- Двойные соли получаются одновременным замещением атомов водорода в кислоте на атомы различных металлов: KAl(SO4)2.
- Смешанные соли диссоциируют на катионы металла и анионы нескольких кислотных остатков: CaClBr.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе
[spoiler title=”источники:”]
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/9-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B2%D1%82%D0%BE%D1%80%D0%BE%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-8-%D0%B4%D0%B8%D1%81%D1%81%D0%BE%D1%86%D0%B8%D0%B0%D1%86%D0%B8%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82-%D0%BE%D1%81%D0%BD%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B9-%D0%B8-%D1%81%D0%BE%D0%BB%D0%B5%D0%B9
http://prosto-o-slognom.ru/chimia/04_dissotsiatsiya_kislot_osnovanij.html
[/spoiler]
Электролитическая диссоциация кислот, щелочей и солей
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
I. Электролитическая диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H +)
1. Электролитическая диссоциация одноосновных кислот
Кислоты состоят не из ионов, а из молекул.
Возникает вопрос – как же тогда кислота диссоциирует, т. е как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в растворах кислот именно при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде, но для этого запишем строение молекул хлороводорода и воды.
Обе молекулы образованы ковалентной полярной связью. Электронная плотность в молекуле хлороводорода смещена к атому хлора, а в молекуле воды – к атому кислорода. Молекула воды способна оторвать катион водорода от молекулы хлороводорода, при этом образуется катион гидроксония Н3О+.
В уравнении реакции электролитической диссоциации не всегда учитывают образование катиона гидроксония – обычно говорят, что образуется катион водорода.
Тогда уравнение диссоциации хлороводорода выглядит так:
HCl⇄H+ + Cl–
При диссоциации одного моля хлороводорода образуются один моль катиона водорода и один моль хлорид – анионов.
2. Электролитическя диссоциация многоосновных кислот
Многоосновные кислоты диссоциируют ступенчато.
Рассмотри процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две стадии.
I–я стадия диссоциации
На первой стадии отрывается один катион водорода и образуется гидросульфат-анион.
H2SO4⇄H+ + HSO4–
гидросульфат-анион
II – я стадия диссоциации
На второй стадии происходит дальнейшая диссоциация гидросульфат – анионов.
HSO4–⇄H+ + SO42-
Эта стадия является обратимой, то есть, образующиеся сульфат – ионы могут присоединять к себе катионы водорода и превращаться в гидросульфат – анионы. Это показано знаком обратимости.
Существуют кислоты, которые даже на первой стадии диссоциируют не полностью – такие кислоты являются слабыми. Например, угольная кислота Н2СО3.
Н3РО4 ↔ Н+ + Н2РО4–(первая ступень) – дигидроортофосфат ион
Н2РО–4 ↔ Н+ + НРO42-(вторая ступень) – гидроортофосфат ион
НРО2-4 ↔ Н+ + PО4З- (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени – по третьей.
II. Электролитическая диссоциация оснований
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH –)
|
Диссоциация щелочей |
Диссоциация амфотерных оснований (амфолитов) |
|
Вспомните! Щёлочи – это основания, растворимые в воде Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также NН4ОН |
Амфолиты – это электролиты, которые при диссоциации одновременно образуют катионы водорода (H +) и гидроксид-ионы ( OH –) |
|
Примеры уравнений диссоциации щелочей KOH -> K+ + OH–; NH4OH ↔ NH4+ + OH– Многокислотные основания диссоциируют ступенчато: Ba(ОН)2 -> Bа(ОН)+ + OH– (первая ступень) Ba(OH)+ ↔ Ba2++OH– (вторая ступень) |
Примеры уравнений диссоциации амфолитов Н2O ↔ Н+ + ОН– Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением: 2ОН– + Zn2+ + 2Н2О ↔ Zn(ОН)2 + 2Н2О ↔ [Zn(ОН)4]2-+ 2Н+ |
Нерастворимые в воде основания практически не подвергаются электролитической диссоциации, так как в воде они практически нерастворимы, а при нагревании – разлагаются, так что расплав их получить не удается.
III. Электролитическая диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH4++ SO42-
Na3PO 4 -> 3Na+ + PO43-
Кислые же и основные соли диссоциируют ступенчато:
Например,
|
Диссоциация кислых солей |
Диссоциация основных солей |
|
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. KHSO4 -> K+ + HSO4– HSO4– ↔ H+ + SO42- |
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Mg(OH)Cl -> Mg(OH)++ Cl– Mg (OH)+↔ Mg2+ + OH– |
IV. Тренажеры
Тренажёр №1 – Уравнения диссоциации электролитов
Тренажёр №2 – Катионы и анионы
Тренажёр №3 – Электролитическая диссоциация оснований
Тренажёр №4 – Электролитическая диссоциация кислот
Тренажёр №5 – Электролитическая диссоциация солей
Проверь себя: “Вставьте в пропуски слова, которые соответствуют конкретному тексту”
Интерактивное задание LearningApps.org по теме: “Химические свойства растворов кислот”
V. Памятки
Памятка – Определение солей
Памятка – Определение кислот
Памятка – Определение оснований
Памятка – Схема диссоциации кислот
Памятка – Диссоциация многоосновных кислот (серная кислота)
Интерактивная таблица – Анионы некоторых кислот
VI. Задания для закрепления
Задание №1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
HF, Mg(OH)2, CaCl2, Zn(NO3)2, Ba(OH)2, K2SO4, H2SiO3, FeI3, NiCl2, H3PO4
Задание №2. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: Ca(OH)2, Na2CO3, Na3PO4, HNO3, KOH, Ba(OH)2, H2SO3, Ca(NO3)2, Ca3(PO4)2, H2S, NaOH, HBr
ЦОРы
Памятка – Определение солей
Памятка – Определение кислот
Памятка – Определение оснований
Памятка – Схема диссоциации кислот
Памятка – Диссоциация многоосновных кислот (серная кислота)
Интерактивная таблица – Анионы некоторых кислот
