Подобно митохондриям, хлоропласты имеют собственную генетическую систему, обеспечивающую синтез ряда белков внутри самих пластид. В матриксе хлоропластов обнаруживаются ДНК, разные РНК и рибосомы. Оказалось, что ДНК хлоропластов резко отличается от ДНК ядра. Она представлена циклическими молекулами длиной до 40-60 мкм, имеющими молекулярный вес 0,8-1,3х108 дальтон. В одном хлоропласте может быть множество копий ДНК. Так, в индивидуальном хлоропласте кукурузы присутствует 20-40 копий молекул ДНК. Длительность цикла и скорость репликации ядерной и хлоропластной ДНК, как было показано на клетках зеленых водорослей, не совпадают. ДНК хлоропластов не состоит в комплексе с гистонами. Все эти характеристики ДНК хлоропластов лизки к характеристикам ДНК прокариотических клеток. Более того, сходство ДНК хлоропластов и бактерий подкрепляется еще и тем, что основные регуляторные последовательности транскрипции (промоторы, терминаторы) у них одинаковы. На ДНК хлоропластов синтезируются все виды РНК (информационная, трансферная, рибосомная). ДНК хлоропластов кодирует рРНК, входящую в состав рибосом этих пластид, которые относятся к прокариотическому 70S типу (содержат 16S и 23S рРНК). Рибосомы хлоропластов чувствительны к антибиотику хлорамфениколу, подавляющему синтез белка у прокариотических клеток.

Образование шпилек в ДНК некоторых хлоропластов.
Так же как в случае хлоропластов мы вновь сталкиваемся с
существованием особой системы синтеза белка, отличной от
таковой в клетке.
Эти открытия вновь пробудили интерес к теории симбиотического
происхождения хлоропластов. Идея о том, что хлоропласты
возникли за счет объединения клеток-гетеротрофов с прокариотическими
синезелеными водорослями, высказанная на рубеже XIX и XX
вв. (А.С. Фоминцин, К.С.Мережковский) вновь находит свое
подтверждение. В пользу этой теории говорит удивительное
сходство в строении хлоропластов и синезеленых водорослей,
сходство с основными их функциональными особенностями, и
в первую очередь со способностью к фотосинтетическим процессам.
рис. Состав генома пластид у арабидопсиса.
Известны многочисленные факты истинного эндосимбиоза синезеленых
водорослей с клетками низших растений и простейших, где
они функционируют и снабжают клетку-хозяина продуктами фотосинтеза.
Оказалось, что выделенные хлоропласты могут также отбираться
некоторыми клетками и использоваться ими как эндосимбионты.
У многих беспозвоночных (коловратки, моллюски), питающихся
высшими водорослями, которые они переваривают, интактные
хлоропласты оказываются внутри клеток пищеварительных желез.
Так, у некоторых растительноядных моллюсков в клетках найдены
интактные хлоропласты с функционирующими фотосинтетическими
системами, за активностью которых следили по включению С14О2.
Как оказалось, хлоропласты могут быть введены в цитоплазму
клеток культуры фибробластов мыши путем пиноцитоза. Однако
они не подвергались атаке гидролаз. Такие клетки, включившие
зеленые хлоропласты, могли делиться в течение пяти генераций,
а хлоропласты при этом оставались интактными и проводили
фотосинтетические реакции. Были предприняты попытки культивировать
хлоропласты в искусственных средах: хлоропласты могли фотосинтезировать,
в них шел синтез РНК, они оставались интактными 100 ч, у
них даже в течение 24 ч наблюдались деления. Но затем происходило
падение активности хлоропластов, и они погибали.
Эти наблюдения и целый ряд биохимических работ показали,
что те черты автономии, которыми обладают хлоропласты, еще
недостаточны для длительного поддержания их функций и тем
более для их воспроизведения.
В последнее время удалось полностью расшифровать всю последовательность
нуклеотидов в составе циклической молекулы ДНК хлоропластов
высших растений. Эта ДНК может кодировать до 120 генов,
среди них: гены 4 рибосомных РНК, 20 рибосомных белков хлоропластов,
гены некоторых субъединиц РНК-полимеразы хлоропластов, несколько
белков I и II фотосистем, 9 из 12 субъединиц АТФ-синтетазы,
части белков комплексов цепи переноса электронов, одной
из субъединиц рибулозодифосфат-карбоксилазы (ключевой фермент
связывания СО2), 30 молекул тРНК и еще 40 пока неизвестных
белков. Интересно, что сходный набор генов в ДНК хлоропластов
обнаружен у таких далеко отстоящих представителей высших
растений как табак и печеночный мох.
Основная же масса белков хлоропластов контролируется ядерным
геномом. Оказалось, что ряд важнейших белков, ферментов,
а соответственно и метаболические процессы хлоропластов
находятся под генетическим контролем ядра. Так, клеточное
ядро контролирует отдельные этапы синтеза хлорофилла, каротиноидов,
липидов, крахмала. Под ядерным контролем находятся многие
энзимы темновой стадии фотосинтеза и другие ферменты, в
том числе некоторые компоненты цепи транспорта электронов.
Ядерные гены кодируют ДНК-полимеразу и аминоацил-тРНК-синтетазу
хлоропластов. Под контролем ядерных генов находится большая
часть рибосомных белков. Все эти данные заставляют говорить
о хлоропластах, так же как и о митохондриях, как о структурах
с ограниченной автономией.
Транспорт белков из цитоплазмы в пластиды происходит в принципе
сходно с таковым у митохондрий. Здесь также в местах сближения
внешней и внутренней мембран хлоропласта располагаются каналообразующие
интегральные белки, которые узнают сигнальные последовательности
хлоропластных белков, синтезированных в цитоплазме, и транспортируют
их в матрикс-строму. Из стромы импортируемые белки согласно
дополнительным сигнальным последовательностям могут включаться
в мембраны пластиды (тилакоиды, ламеллы стромы, внешняя
и внутренняя мембраны) или локализоваться в строме, входя
в состав рибосом, ферментных комплексов цикла Кальвина и
др.
Удивительное сходство структуры и энергетических процессов
у бактерий и митохондрий, с одной стороны, и у синезеленых
водорослей и хлоропластов – с другой, служит веским аргументом
в пользу теории симбиотического происхождения этих органелл.
Согласно этой теории, возникновение эукариотической клетки
прошло через несколько этапов симбиоза с другими клетками.
На первой стадии клетки типа анаэробных гетеротрофных бактерий
включили в себя аэробные бактерии, превратившиеся в митохондрии.
Параллельно этому в клетке-хозяине прокариотический генофор
формируется в обособленное от цитоплазмы ядро. Так могли
возникнуть гетеротрофные эукариотические клетки. Повторные
эндосимбиотические взаимоотношения между первичными эукариотическими
клетками и синезелеными водорослями привели к появлению
в них структур типа хлоропластов, позволяющих клеткам осуществлять
автосинтетические процессы и не зависеть от наличия органических
субстратов (рис. 236). В процессе становления такой составной
живой системы часть генетической информации митохондрий
и пластид могла изменяться, перенестись в ядро. Так, например
две трети из 60 рибосомных белков хлоропластов кодируется
в ядре и синтезируются в цитоплазме, а потом встраивается
в рибосомы хлоропластов, имеющие все свойства прокариотических
рибосом. Такое перемещение большой части прокариотических
генов в ядро привело к тому, что эти клеточные органеллы,
сохранив часть былой автономии, попали под контроль клеточного
ядра, определяющего в большей степени все главные клеточные
функции.
From Wikipedia, the free encyclopedia
Genome size ranges (in base pairs) of various life forms
Genome size is the total amount of DNA contained within one copy of a single complete genome. It is typically measured in terms of mass in picograms (trillionths (10−12) of a gram, abbreviated pg) or less frequently in daltons, or as the total number of nucleotide base pairs, usually in megabases (millions of base pairs, abbreviated Mb or Mbp). One picogram is equal to 978 megabases.[1] In diploid organisms, genome size is often used interchangeably with the term C-value.
An organism’s complexity is not directly proportional to its genome size; total DNA content is widely variable between biological taxa. Some single-celled organisms have much more DNA than humans, for reasons that remain unclear (see non-coding DNA and C-value enigma).
Origin of the term[edit]
Tree of life with genome sizes as outer bars (in number of genes, not the total quantity of DNA)
The term “genome size” is often erroneously attributed to a 1976 paper by Ralph Hinegardner,[2] even in discussions dealing specifically with terminology in this area of research (e.g., Greilhuber 2005[3]). Notably, Hinegardner[2] used the term only once: in the title. The term actually seems to have first appeared in 1968, when Hinegardner wondered, in the last paragraph of another article, whether “cellular DNA content does, in fact, reflect genome size”.[4] In this context, “genome size” was being used in the sense of genotype to mean the number of genes.
In a paper submitted only two months later, Wolf et al. (1969)[5] used the term “genome size” throughout and in its present usage; therefore these authors should probably be credited with originating the term in its modern sense. By the early 1970s, “genome size” was in common usage with its present definition, probably as a result of its inclusion in Susumu Ohno’s influential book Evolution by Gene Duplication, published in 1970.[6]
Variation in genome size and gene content[edit]
With the emergence of various molecular techniques in the past 50 years, the genome sizes of thousands of eukaryotes have been analyzed, and these data are available in online databases for animals, plants, and fungi (see external links). Nuclear genome size is typically measured in eukaryotes using either densitometric measurements of Feulgen-stained nuclei (previously using specialized densitometers, now more commonly using computerized image analysis[7]) or flow cytometry. In prokaryotes, pulsed field gel electrophoresis and complete genome sequencing are the predominant methods of genome size determination.
Nuclear genome sizes are well known to vary enormously among eukaryotic species. In animals they range more than 3,300-fold, and in land plants they differ by a factor of about 1,000.[8][9] Protist genomes have been reported to vary more than 300,000-fold in size, but the high end of this range (Amoeba) has been called into question.[by whom?] In eukaryotes (but not prokaryotes), genome size is not proportional to the number of genes present in the genome, an observation that was deemed wholly counter-intuitive before the discovery of non-coding DNA and which became known as the “C-value paradox” as a result. However, although there is no longer any paradoxical aspect to the discrepancy between genome size and gene number, the term remains in common usage. For reasons of conceptual clarification, the various puzzles that remain with regard to genome size variation instead have been suggested by one author to more accurately comprise a puzzle or an enigma (the so-called “C-value enigma”).
Genome size correlates with a range of measurable characteristics at the cell and organism levels, including cell size, cell division rate, and, depending on the taxon, body size, metabolic rate, developmental rate, organ complexity, geographical distribution, or extinction risk.[8][9] Based on currently available completely sequenced genome data (as of April 2009), log-transformed gene number forms a linear correlation with log-transformed genome size in bacteria, archaea, viruses, and organelles combined, whereas a nonlinear (semi-natural logarithm) correlation is seen for eukaryotes.[10] Although the latter contrasts with the previous view that no correlation exists for the eukaryotes, the observed nonlinear correlation for eukaryotes may reflect disproportionately fast-increasing non-coding DNA in increasingly large eukaryotic genomes. Although sequenced genome data are practically biased toward small genomes, which may compromise the accuracy of the empirically derived correlation, and ultimate proof of the correlation remains to be obtained by sequencing some of the largest eukaryotic genomes, current data do not seem to rule out a possible correlation.
Human genome size[edit]
In humans, the total female diploid nuclear genome per cell extends for 6.37 Gigabase pairs (Gbp), is 208.23 cm long and weighs 6.51 picograms (pg).[11] Male values are 6.27 Gbp, 205.00 cm, 6.41 pg.[11] Each DNA polymer can contain hundreds of millions of nucleotides, such as in chromosome 1. Chromosome 1 is the largest human chromosome with approximately 220 million base pairs, and would be 85 mm long if straightened.[12]
In eukaryotes, in addition to nuclear DNA, there is also mitochondrial DNA (mtDNA) which encodes certain proteins used by the mitochondria. The mtDNA is usually relatively small in comparison to the nuclear DNA. For example, the human mitochondrial DNA forms closed circular molecules, each of which contains 16,569[13][14] DNA base pairs,[15] with each such molecule normally containing a full set of the mitochondrial genes. Each human mitochondrion contains, on average, approximately 5 such mtDNA molecules.[15] Each human cell contains approximately 100 mitochondria, giving a total number of mtDNA molecules per human cell of approximately 500.[15] However, the amount of mitochondria per cell also varies by cell type, and an egg cell can contain 100,000 mitochondria, corresponding to up to 1,500,000 copies of the mitochondrial genome (constituting up to 90% of the DNA of the cell).[16]
Genome reduction[edit]
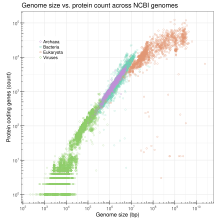
Genome size compared to number of genes. Log-log plot of the total number of annotated proteins in genomes submitted to GenBank as a function of genome size. Based on data from NCBI genome reports.
Genome reduction, also known as genome degradation, is the process by which an organism’s genome shrinks relative to that of its ancestors. Genomes fluctuate in size regularly, and genome size reduction is most significant in bacteria.
The most evolutionarily significant cases of genome reduction may be observed in the eukaryotic organelles known to be derived from bacteria: mitochondria and plastids. These organelles are descended from primordial endosymbionts, which were capable of surviving within the host cell and which the host cell likewise needed for survival. Many present-day mitochondria have less than 20 genes in their entire genome, whereas a modern free-living bacterium generally has at least 1,000 genes. Many genes have apparently been transferred to the host nucleus, while others have simply been lost and their function replaced by host processes.
Other bacteria have become endosymbionts or obligate intracellular pathogens and experienced extensive genome reduction as a result. This process seems to be dominated by genetic drift resulting from small population size, low recombination rates, and high mutation rates, as opposed to selection for smaller genomes.[citation needed] Some free-living marine bacterioplanktons also shows signs of genome reduction, which are hypothesized to be driven by natural selection.[17][18][19]
In obligate endosymbiotic species[edit]
Obligate endosymbiotic species are characterized by a complete inability to survive external to their host environment. These species have become a considerable threat to human health, as they are often capable of evading human immune systems and manipulating the host environment to acquire nutrients. A common explanation for these manipulative abilities is their consistently compact and efficient genomic structure. These small genomes are the result of massive losses of extraneous DNA, an occurrence that is exclusively associated with the loss of a free-living stage. As much as 90% of the genetic material can be lost when a species makes the evolutionary transition from a free-living to an obligate intracellular lifestyle. During this process the future parasite subjected to an environment rich of metabolite where somehow needs to hide within the host cell, those factors reduce the retention and increase the genetic drift leading to an acceleration of the loss of non-essential genes.[20][21][22] Common examples of species with reduced genomes include Buchnera aphidicola, Rickettsia prowazekii, and Mycobacterium leprae. One obligate endosymbiont of leafhoppers, Nasuia deltocephalinicola, has the smallest genome currently known among cellular organisms at 112 kb.[23] Despite the pathogenicity of most endosymbionts, some obligate intracellular species have positive fitness effects on their hosts.
The reductive evolution model has been proposed as an effort to define the genomic commonalities seen in all obligate endosymbionts.[24] This model illustrates four general features of reduced genomes and obligate intracellular species:
- “genome streamlining” resulting from relaxed selection on genes that are superfluous in the intracellular environment;
- a bias towards deletions (rather than insertions), which heavily affects genes that have been disrupted by accumulation of mutations (pseudogenes);[25]
- very little or no capability for acquiring new DNA; and
- considerable reduction of effective population size in endosymbiotic populations, particularly in species that rely on vertical transmission of genetic material.
Based on this model, it is clear that endosymbionts face different adaptive challenges than free-living species and, as emerged from the analysis between different parasites, their genes inventories are extremely different, leading us to the conclusion that the genome miniaturization follows a different pattern for the different symbionts.[26][27][28]
Conversion from picograms (pg) to base pairs (bp)[edit]
or simply:
[1]
Drake’s rule[edit]
In 1991, John W. Drake proposed a general rule: that the mutation rate within a genome and its size are inversely correlated.[29] This rule has been found to be approximately correct for simple genomes such as those in DNA viruses and unicellular organisms. Its basis is unknown.
It has been proposed that the small size of RNA viruses is locked into a three-part relation between replication fidelity, genome size, and genetic complexity. The majority of RNA viruses lack an RNA proofreading facility, which limits their replication fidelity and hence their genome size. This has also been described as the “Eigen paradox”.[30] An exception to the rule of small genome sizes in RNA viruses is found in the Nidoviruses. These viruses appear to have acquired a 3′-to-5′ exoribonuclease (ExoN) which has allowed for an increase in genome size.[31]
Genome miniaturization and optimal size[edit]
In 1972 Michael David Bennett[32] hypothesized that there was a correlation with the DNA content and the nuclear volume while Commoner and van’t Hof and Sparrow before him postulated that even cell size and cell-cycle length were controlled by the amount of DNA.[33][34] More recent theories have brought us to discuss about the possibility of the presence of a mechanism that constrains physically the development of the genome to an optimal size.[35]
Those explanations have been disputed by Cavalier-Smith’s article[36] where the author pointed that the way to understand the relation between genome size and cell volume was related to the skeletal theory. The nucleus of this theory is related to the cell volume, determined by an adaptation balance between advantages and disadvantages of bigger cell size, the optimization of the ratio nucleus:cytoplasm (karyoplasmatic ratio)[37][38] and the concept that larger genomes provides are more prone to the accumulation of duplicative transposons as consequences of higher content of non-coding skeletal DNA.[36] Cavalier-Smith also proposed that, as consequent reaction of a cell reduction, the nucleus will be more prone to a selection in favor for the deletion compared to the duplication.[36]
From the economic way of thinking, since phosphorus and energy are scarce, a reduction in the DNA should be always the focus of the evolution, unless a benefit is acquired. The random deletion will be then mainly deleterious and not selected due to the reduction of the gained fitness but occasionally the elimination will be advantageous as well. This trade-off between economy and accumulation of non-coding DNA is the key to the maintenance of the karyoplasmatic ratio.
Mechanisms of genome miniaturization[edit]
The base question behind the process of genome miniaturization is whether it occurs through large steps or due to a constant erosion of the gene content. In order to assess the evolution of this process is necessary to compare an ancestral genome with the one where the shrinkage is supposed to be occurred. Thanks to the similarity among the gene content of Buchnera aphidicola and the enteric bacteria Escherichia coli, 89% identity for the 16S rDNA and 62% for orthologous genes was possible to shed light on the mechanism of genome miniaturization.[39] The genome of the endosymbiont B. aphidicola is characterized by a genome size that is seven times smaller than E. coli (643 kb compared to 4.6 Mb)[40][41] and can be view as a subset of the enteric bacteria gene inventory.[41] From the confrontation of the two genomes emerged that some genes persist as partially degraded.[41] indicating that the function was lost during the process and that consequent events of erosion shortened the length as documented in Rickettsia.[42][43][44] This hypothesis is confirmed by the analysis of the pseudogenes of Buchnera where the number of deletions was more than ten times higher compared to the insertion.[44]
In Rickettsia prowazekii, as with other small genome bacteria, this mutualistic endosymbiont has experienced a vast reduction of functional activity with a major exception compared to other parasites still retain the bio-synthetic ability of production of amino acid needed by its host.[45][46][41] The common effects of the genome shrinking between this endosymbiont and the other parasites are the reduction of the ability to produce phospholipids, repair and recombination and an overall conversion of the composition of the gene to a richer A-T[47] content due to mutation and substitutions.[20][45] Evidence of the deletion of the function of repair and recombination is the loss of the gene recA, gene involved in the recombinase pathway. This event happened during the removal of a larger region containing ten genes for a total of almost 10 kb.[41][45] Same faith occurred uvrA, uvrB and uvrC, genes encoding for excision enzymes involved in the repair damaged DNA due to UV exposure.[39]
One of the most plausible mechanisms for the explanation of the genome shrinking is the chromosomal rearrangement because insertion/deletion of larger portion of sequence are more easily to be seen in during homologous recombination compared to the illegitimate, therefore the spread of the transposable elements will positively affect the rate of deletion.[36] The loss of those genes in the early stages of miniaturization not only this function but must played a role in the evolution of the consequent deletions. Evidences of the fact that larger event of removal occurred before smaller deletion emerged from the comparison of the genome of Bucknera and a reconstructed ancestor, where the gene that have been lost are in fact not randomly dispersed in the ancestor gene but aggregated and the negative relation between number of lost genes and length of the spacers.[39] The event of small local indels plays a marginal role on the genome reduction[48] especially in the early stages where a larger number of genes became superfluous.[49][39]
Single events instead occurred due to the lack of selection pressure for the retention of genes especially if part of a pathway that lost its function during a previous deletion. An example for this is the deletion of recF, gene required for the function of recA, and its flanking genes.[50] One of the consequences of the elimination of such amount of sequences affected even the regulation of the remaining genes. The loss of large section of genomes could in fact lead to a loss in promotor sequences. This could in fact pushed the selection for the evolution of polycistronic regions with a positive effect for both size reduction[51] and transcription efficiency.[52]
Evidence of genome miniaturization[edit]
One example of the miniaturization of the genome occurred in the microsporidia, an anaerobic intracellular parasite of arthropods evolved from aerobic fungi.
During this process the mitosomes[53] was formed consequent to the reduction of the mitochondria to a relic voided of genomes and metabolic activity except to the production of iron sulfur centers and the capacity to enter into the host cells.[54][55] Except for the ribosomes, miniaturized as well, many other organelles have been almost lost during the process of the formation of the smallest genome found in the eukaryotes.[36] From their possible ancestor, a zygomycotine fungi, the microsporidia shrunk its genome eliminating almost 1000 genes and reduced even the size of protein and protein-coding genes.[56] This extreme process was possible thanks to the advantageous selection for a smaller cell size imposed by the parasitism.
Another example of miniaturization is represented by the presence of nucleomorphs, enslaved nuclei, inside of the cell of two different algae, cryptophytes and chlorarachneans.[57]
Nucleomorphs are characterized by one of the smallest genomes known (551 and 380 kb) and as noticed for microsporidia, some genomes are noticeable reduced in length compared to other eukaryotes due to a virtual lack of non-coding DNA.[36] The most interesting factor is represented by the coexistence of those small nuclei inside of a cell that contains another nucleus that never experienced such genome reduction. Moreover, even if the host cells have different volumes from species to species and a consequent variability in genome size, the nucleomorph remain invariant denoting a double effect of selection within the same cell.
See also[edit]
- Animal Genome Size Database
- Bacterial genome
- C-value
- Cell nucleus
- Comparative genomics
- Comparison of different genome sizes
- Human genome
- Junk DNA
- List of sequenced eukaryotic genomes
- Non-coding DNA
- Plant DNA C-values Database
- Selfish genetic element
- Transposable element
References[edit]
- ^ a b Dolezel J, Bartoš J, Voglmayr H, Greilhuber J (2003). “Nuclear DNA content and genome size of trout and human”. Cytometry Part A. 51 (2): 127–128. doi:10.1002/cyto.a.10013. PMID 12541287.
- ^ a b Hinegardner R (1976). “Evolution of genome size”. In F.J. Ayala (ed.). Molecular Evolution. Sinauer Associates, Inc., Sunderland. pp. 179–199.
- ^ Greilhuber J, Doležel J, Lysák M, Bennett MD (2005). “The origin, evolution and proposed stabilization of the terms ‘genome size’ and ‘C-value’ to describe nuclear DNA contents”. Annals of Botany. 95 (1): 255–260. doi:10.1093/aob/mci019. PMC 4246724. PMID 15596473.
- ^ Hinegardner R (1968). “Evolution of cellular DNA content in teleost fishes”. American Naturalist. 102 (928): 517–523. doi:10.1086/282564. S2CID 84409620.
- ^ Wolf U, Ritter H, Atkin NB, Ohno S (1969). “Polyploidization in the fish family Cyprinidae, Order Cypriniformes. I. DNA-content and chromosome sets in various species of Cyprinidae”. Humangenetik. 7 (3): 240–244. doi:10.1007/BF00273173. PMID 5800705. S2CID 42045008.
- ^ Ohno S (1970). Evolution by Gene Duplication. New York: Springer-Verlag. ISBN 0-04-575015-7.
- ^ Hardie DC, Gregory TR, Hebert PD (2002). “From pixels to picograms: a beginners’ guide to genome quantification by Feulgen image analysis densitometry”. Journal of Histochemistry and Cytochemistry. 50 (6): 735–749. doi:10.1177/002215540205000601. PMID 12019291.
- ^ a b Bennett MD, Leitch IJ (2005). “Genome size evolution in plants”. In T.R. Gregory (ed.). The Evolution of the Genome. San Diego: Elsevier. pp. 89–162.
- ^ a b Gregory TR (2005). “Genome size evolution in animals”. In T.R. Gregory (ed.). The Evolution of the Genome. San Diego: Elsevier. pp. 3–87.
- ^ Hou Y, Lin S (2009). Redfield RJ (ed.). “Distinct Gene Number- Genome Size Relationships for Eukaryotes and Non-Eukaryotes: Gene Content Estimation for Dinoflagellate Genomes”. PLOS ONE. 4 (9): e6978. Bibcode:2009PLoSO…4.6978H. doi:10.1371/journal.pone.0006978. PMC 2737104. PMID 19750009.
- ^ a b Piovesan A, Pelleri MC, Antonaros F, Strippoli P, Caracausi M, Vitale L (2019). “On the length, weight and GC content of the human genome”. BMC Res Notes. 12 (1): 106. doi:10.1186/s13104-019-4137-z. PMC 6391780. PMID 30813969.
- ^ Gregory SG, Barlow KF, McLay KE, Kaul R, Swarbreck D, Dunham A, et al. (May 2006). “The DNA sequence and biological annotation of human chromosome 1”. Nature. 441 (7091): 315–21. Bibcode:2006Natur.441..315G. doi:10.1038/nature04727. PMID 16710414.
- ^ Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R.; Drouin, J.; Eperon, I. C.; Nierlich, D. P.; Roe, B. A.; Sanger, F.; Schreier, P. H.; Smith, A. J. H.; Staden, R.; Young, I. G. (April 1981). “Sequence and organization of the human mitochondrial genome”. Nature. 290 (5806): 457–465. Bibcode:1981Natur.290..457A. doi:10.1038/290457a0. PMID 7219534. S2CID 4355527.
- ^ “Untitled”. Archived from the original on 2011-08-13. Retrieved 2012-06-13.
- ^ a b c Satoh, M; Kuroiwa, T (September 1991). “Organization of multiple nucleoids and DNA molecules in mitochondria of a human cell”. Experimental Cell Research. 196 (1): 137–140. doi:10.1016/0014-4827(91)90467-9. PMID 1715276.
- ^ Zhang D, Keilty D, Zhang ZF, Chian RC (2017). “Mitochondria in oocyte aging: current understanding”. Facts Views Vis Obgyn. 9 (1): 29–38. PMC 5506767. PMID 28721182.
- ^ Dufresne A, Garczarek L, Partensky F (2005). “Accelerated evolution associated with genome reduction in a free-living prokaryote”. Genome Biol. 6 (2): R14. doi:10.1186/gb-2005-6-2-r14. PMC 551534. PMID 15693943.
- ^ Giovannoni SJ; et al. (2005). “Genome streamlining in a cosmopolitan oceanic bacterium”. Science. 309 (5738): 1242–1245. Bibcode:2005Sci…309.1242G. doi:10.1126/science.1114057. PMID 16109880. S2CID 16221415.
- ^ Giovannoni SJ; et al. (2008). “The small genome of an abundant coastal ocean methylotroph”. Environmental Microbiology. 10 (7): 1771–1782. doi:10.1111/j.1462-2920.2008.01598.x. PMID 18393994.
- ^ a b Moran, N. A. (1996-04-02). “Accelerated evolution and Muller’s rachet in endosymbiotic bacteria”. Proceedings of the National Academy of Sciences. 93 (7): 2873–2878. Bibcode:1996PNAS…93.2873M. doi:10.1073/pnas.93.7.2873. ISSN 0027-8424. PMC 39726. PMID 8610134.
- ^ Wernegreen, J. J.; Moran, N. A. (1999-01-01). “Evidence for genetic drift in endosymbionts (Buchnera): analyses of protein-coding genes”. Molecular Biology and Evolution. 16 (1): 83–97. doi:10.1093/oxfordjournals.molbev.a026040. ISSN 0737-4038. PMID 10331254.
- ^ Spaulding, Allen W.; Dohlen, Carol D. von (2001). “Psyllid endosymbionts exhibit patterns of co-speciation with hosts and destabilizing substitutions in ribosomal RNA”. Insect Molecular Biology. 10 (1): 57–67. doi:10.1046/j.1365-2583.2001.00231.x. ISSN 1365-2583. PMID 11240637. S2CID 46186732.
- ^ And the Genomes Keep Shrinking…
- ^ Wernegreen J (2005). “For better or worse: Genomic consequences of genomic mutualism and parasitism” (PDF). Current Opinion in Genetics & Development. 15 (6): 1–12. doi:10.1016/j.gde.2005.09.013. PMID 16230003. Archived from the original (PDF) on 2011-07-22.
- ^ Moran NA, Plague GR (2004). “Genomic changes following host restriction in bacteria”. Current Opinion in Genetics & Development. 14 (6): 627–633. doi:10.1016/j.gde.2004.09.003. PMID 15531157.
- ^ Mushegian, A. R.; Koonin, E. V. (1996-09-17). “A minimal gene set for cellular life derived by comparison of complete bacterial genomes”. Proceedings of the National Academy of Sciences. 93 (19): 10268–10273. Bibcode:1996PNAS…9310268M. doi:10.1073/pnas.93.19.10268. ISSN 0027-8424. PMC 38373. PMID 8816789.
- ^ Huynen, Martijn A.; Bork, Peer (1998-05-26). “Measuring genome evolution”. Proceedings of the National Academy of Sciences. 95 (11): 5849–5856. Bibcode:1998PNAS…95.5849H. doi:10.1073/pnas.95.11.5849. ISSN 0027-8424. PMC 34486. PMID 9600883.
- ^ Maniloff, J (1996-09-17). “The minimal cell genome: “on being the right size”“. Proceedings of the National Academy of Sciences of the United States of America. 93 (19): 10004–10006. Bibcode:1996PNAS…9310004M. doi:10.1073/pnas.93.19.10004. ISSN 0027-8424. PMC 38325. PMID 8816738.
- ^ Drake, J W (1991). “A constant rate of spontaneous mutation in DNA-based microbes”. Proc Natl Acad Sci USA. 88 (16): 7160–7164. Bibcode:1991PNAS…88.7160D. doi:10.1073/pnas.88.16.7160. PMC 52253. PMID 1831267.
- ^ Kun, A; Santos, M; Szathmary, E (2005). “Real ribozymes suggest a relaxed error threshold”. Nat Genet. 37 (9): 1008–1011. doi:10.1038/ng1621. PMID 16127452. S2CID 30582475.
- ^ Lauber, C; Goeman, JJ; Parquet Mdel, C; Thi Nga, P; Snijder, EJ; Morita, K; Gorbalenya, AE (Jul 2013). “The footprint of genome architecture in the largest genome expansion in RNA viruses”. PLOS Pathog. 9 (7): e1003500. doi:10.1371/journal.ppat.1003500. PMC 3715407. PMID 23874204.
- ^ Bennett, Michael David; Riley, Ralph (1972-06-06). “Nuclear DNA content and minimum generation time in herbaceous plants”. Proceedings of the Royal Society of London. Series B. Biological Sciences. 181 (1063): 109–135. Bibcode:1972RSPSB.181..109B. doi:10.1098/rspb.1972.0042. PMID 4403285. S2CID 26642634.
- ^ Hof, J. Van’t; Sparrow, A. H. (June 1963). “A relationship between DNA content, nuclear volume, and minimum mitotic cycle time”. Proceedings of the National Academy of Sciences of the United States of America. 49 (6): 897–902. Bibcode:1963PNAS…49..897V. doi:10.1073/pnas.49.6.897. ISSN 0027-8424. PMC 300029. PMID 13996145.
- ^ Commoner, Barry (June 1964). “Roles Of Deoxyribonucleic Acid in Inheritance”. Nature. 202 (4936): 960–968. Bibcode:1964Natur.202..960C. doi:10.1038/202960a0. ISSN 1476-4687. PMID 14197326. S2CID 4166234.
- ^ Orgel, L. E.; Crick, F. H. C. (April 1980). “Selfish DNA: the ultimate parasite”. Nature. 284 (5757): 604–607. Bibcode:1980Natur.284..604O. doi:10.1038/284604a0. ISSN 1476-4687. PMID 7366731. S2CID 4233826.
- ^ a b c d e f Cavalier-Smith, Thomas (2005-01-01). “Economy, Speed and Size Matter: Evolutionary Forces Driving Nuclear Genome Miniaturization and Expansion”. Annals of Botany. 95 (1): 147–175. doi:10.1093/aob/mci010. ISSN 0305-7364. PMC 4246715. PMID 15596464.
- ^ Strasburger, Eduard (1893). Ueber die wirkungssphäre der Kerne und die Zellgrösse (in German). OCLC 80359142.
- ^ Huxley, J. S. (May 1925). “The Cell in Development and Heredity”. Nature. 115 (2897): 669–671. Bibcode:1925Natur.115..669H. doi:10.1038/115669a0. ISSN 1476-4687. S2CID 26264738.
- ^ a b c d Moran, Nancy A.; Mira, Alex (2001-11-14). “The process of genome shrinkage in the obligate symbiont Buchnera aphidicola”. Genome Biology. 2 (12): research0054.1. doi:10.1186/gb-2001-2-12-research0054. ISSN 1474-760X. PMC 64839. PMID 11790257.
- ^ Blattner, Frederick R.; Plunkett, Guy; Bloch, Craig A.; Perna, Nicole T.; Burland, Valerie; Riley, Monica; Collado-Vides, Julio; Glasner, Jeremy D.; Rode, Christopher K.; Mayhew, George F.; Gregor, Jason (1997-09-05). “The Complete Genome Sequence of Escherichia coli K-12”. Science. 277 (5331): 1453–1462. doi:10.1126/science.277.5331.1453. ISSN 0036-8075. PMID 9278503.
- ^ a b c d e Shigenobu, Shuji; Watanabe, Hidemi; Hattori, Masahira; Sakaki, Yoshiyuki; Ishikawa, Hajime (September 2000). “Genome sequence of the endocellular bacterial symbiont of aphids Buchnera sp. APS”. Nature. 407 (6800): 81–86. Bibcode:2000Natur.407…81S. doi:10.1038/35024074. ISSN 1476-4687. PMID 10993077.
- ^ Andersson, J. O.; Andersson, S. G. (1999-09-01). “Genome degradation is an ongoing process in Rickettsia”. Molecular Biology and Evolution. 16 (9): 1178–1191. doi:10.1093/oxfordjournals.molbev.a026208. ISSN 0737-4038. PMID 10486973.
- ^ Andersson, Jan O.; Andersson, Siv G. E. (2001-05-01). “Pseudogenes, Junk DNA, and the Dynamics of Rickettsia Genomes”. Molecular Biology and Evolution. 18 (5): 829–839. doi:10.1093/oxfordjournals.molbev.a003864. ISSN 0737-4038. PMID 11319266.
- ^ a b Mira, Alex; Ochman, Howard; Moran, Nancy A. (2001-10-01). “Deletional bias and the evolution of bacterial genomes”. Trends in Genetics. 17 (10): 589–596. doi:10.1016/S0168-9525(01)02447-7. ISSN 0168-9525. PMID 11585665.
- ^ a b c Andersson, Siv G. E.; Zomorodipour, Alireza; Andersson, Jan O.; Sicheritz-Pontén, Thomas; Alsmark, U. Cecilia M.; Podowski, Raf M.; Näslund, A. Kristina; Eriksson, Ann-Sofie; Winkler, Herbert H.; Kurland, Charles G. (November 1998). “The genome sequence of Rickettsia prowazekii and the origin of mitochondria”. Nature. 396 (6707): 133–140. Bibcode:1998Natur.396..133A. doi:10.1038/24094. ISSN 1476-4687. PMID 9823893.
- ^ Tamas, Ivica; Klasson, Lisa M.; Sandström, Jonas P.; Andersson, Siv G. E. (2001). “Mutualists and parasites: how to paint yourself into a (metabolic) corner”. FEBS Letters. 498 (2–3): 135–139. doi:10.1016/S0014-5793(01)02459-0. ISSN 1873-3468. PMID 11412844. S2CID 40955247.
- ^ Wernegreen, J. J.; Moran, N. A. (2000-07-22). “Decay of mutualistic potential in aphid endosymbionts through silencing of biosynthetic loci: Buchnera of Diuraphis”. Proceedings of the Royal Society of London. Series B: Biological Sciences. 267 (1451): 1423–1431. doi:10.1098/rspb.2000.1159. PMC 1690690. PMID 10983826.
- ^ Petrov, Dmitri A. (2002-06-01). “Mutational Equilibrium Model of Genome Size Evolution”. Theoretical Population Biology. 61 (4): 531–544. doi:10.1006/tpbi.2002.1605. ISSN 0040-5809. PMID 12167373.
- ^ Gregory, T. Ryan (2003-09-01). “Is small indel bias a determinant of genome size?”. Trends in Genetics. 19 (9): 485–488. doi:10.1016/S0168-9525(03)00192-6. ISSN 0168-9525. PMID 12957541.
- ^ Gasior, Stephen L.; Olivares, Heidi; Ear, Uy; Hari, Danielle M.; Weichselbaum, Ralph; Bishop, Douglas K. (2001-07-17). “Assembly of RecA-like recombinases: Distinct roles for mediator proteins in mitosis and meiosis”. Proceedings of the National Academy of Sciences. 98 (15): 8411–8418. Bibcode:2001PNAS…98.8411G. doi:10.1073/pnas.121046198. ISSN 0027-8424. PMC 37451. PMID 11459983.
- ^ Selosse, M.-A.; Albert, B.; Godelle, B. (2001-03-01). “Reducing the genome size of organelles favours gene transfer to the nucleus”. Trends in Ecology & Evolution. 16 (3): 135–141. doi:10.1016/s0169-5347(00)02084-x. ISSN 1872-8383. PMID 11179577.
- ^ Scherbakov, D. V.; Garber, M. B. (2000-07-01). “Overlapping genes in bacterial and phage genomes”. Molecular Biology. 34 (4): 485–495. doi:10.1007/BF02759558. ISSN 1608-3245. S2CID 24144602.
- ^ Williams, Bryony A. P.; Hirt, Robert P.; Lucocq, John M.; Embley, T. Martin (August 2002). “A mitochondrial remnant in the microsporidian Trachipleistophora hominis”. Nature. 418 (6900): 865–869. Bibcode:2002Natur.418..865W. doi:10.1038/nature00949. ISSN 1476-4687. PMID 12192407. S2CID 4358253.
- ^ Keeling, Patrick J.; Fast, Naomi M. (2002). “Microsporidia: Biology and Evolution of Highly Reduced Intracellular Parasites”. Annual Review of Microbiology. 56 (1): 93–116. doi:10.1146/annurev.micro.56.012302.160854. PMID 12142484. S2CID 22943269.
- ^ Cavalier-Smith, T. (2001). “What are Fungi?”. In McLaughlin, David J.; McLaughlin, Esther G.; Lemke, Paul A. (eds.). Systematics and Evolution. Systematics and Evolution: Part A. The Mycota. Springer Berlin Heidelberg. pp. 3–37. doi:10.1007/978-3-662-10376-0_1. ISBN 978-3-662-10376-0.
- ^ Vivarès, Christian P; Gouy, Manolo; Thomarat, Fabienne; Méténier, Guy (2002-10-01). “Functional and evolutionary analysis of a eukaryotic parasitic genome”. Current Opinion in Microbiology. 5 (5): 499–505. doi:10.1016/S1369-5274(02)00356-9. ISSN 1369-5274. PMID 12354558.
- ^ Douglas, Susan; Zauner, Stefan; Fraunholz, Martin; Beaton, Margaret; Penny, Susanne; Deng, Lang-Tuo; Wu, Xiaonan; Reith, Michael; Cavalier-Smith, Thomas; Maier, Uwe-G. (April 2001). “The highly reduced genome of an enslaved algal nucleus”. Nature. 410 (6832): 1091–1096. Bibcode:2001Natur.410.1091D. doi:10.1038/35074092. ISSN 1476-4687. PMID 11323671.
Further reading[edit]
- Evolution of Chlamydiaceae
- Andersson JO Andersson SG; Andersson (1999). “Genome degradation is an ongoing process in Rickettsia”. Molecular Biology and Evolution. 16 (9): 1178–1191. doi:10.1093/oxfordjournals.molbev.a026208. PMID 10486973. Archived from the original on 2005-04-17. Retrieved 2006-10-18.
External links[edit]
- Animal Genome Size Database
- Plant DNA C-values Database
- Fungal Genome Size Database
- Fungal Database Archived 2008-03-10 at the Wayback Machine — by CBS
Размер генома
|
Объект |
Размер |
|
Микоплазмы |
104-106 |
|
Эубактерии |
105-107 |
|
Грибы |
(2-5)х107 |
|
Водоросли |
(5-7)х107 |
|
Черви |
~108 |
|
Моллюски |
5х108-5х109 |
|
Насекомые |
108-5х109 |
|
Ракообразные |
~ |
|
Иглокожие |
2х108-2х109 |
|
Рыбы |
3х108-1010 |
|
Амфибии |
7х108-7х1010 |
|
Рептилии |
(2-3)х109 |
|
Птицы |
109 |
|
Млекопитающие |
3х109 |
|
Цветковые |
2х108-1011 |
Прямой
корреляции между количеством ДНК и
эволюционной продвинутостью организма
нет.
Так, например, у
малярийного плазмодия 0.06 пг ДНК в ядре,
а у амебы 490 пг. Большое количество ДНК
не обязательно приносит качественно
новую информацию. Амеба пошла на
увеличение количества ДНК для увеличения
размеров ядра и самой клетки. Генов у
нее меньше, чем у плазмодия, но они
копированы много раз. У малярийного
плазмодия генов больше, чем у амебы, а
ДНК меньше для максимальной компактности.
Малые размеры ядра и самого одноклеточного
организма позволяют ему быть внутриклеточным
паразитом.
У
африканской двоякодышащей рыбы ДНК в
15 раз, а у амебы в 70 раз больше, чем у
человека.
“Избыточность” эукариотического генома
На
~ 106 пар нуклеотидов у бактерий
приходится ~5 тыс. генов. На ~109
пар нуклеотидов у млекопитающих ~50 тыс.
генов.
Минусы
“избыточной” ДНК:
– увеличение
времени синтеза ДНК;
– cложнее
организовывать удвоение ДНК;
– высокая
энергоемкость – на 1 нуклеотид для
включения в цепь ДНК нужно затратить
~60 молекул АТФ.
Неопределенное
следствие:
– благодаря
зависимости размера ядра от количества
ДНК происходит увеличение размеров
клетки.
Плюсы “избыточной”
ДНК:
– возникает
возможность создания сложного
регуляторного аппарата, позволяющего
поднять организм на более высокий
эволюционный уровень.
Причины
избыточности:
1. Большой размер генов (за счет наличия интронов).
2. Присутствие повторенных последовательностей. Повторяются и гены, и некодирующие участки. У эукариот некоторые последовательности повторены сотни и тысячи раз.
3. Наличие большого
числа некодирующих последовательностей,
часть из которых выполняет регуляторную
функцию при транскрипции, а часть –
необходима для компактизации генома.
Компактность
генома эукариот
Компактность
– другое принципиальное отличие генома
эукариот от прокариотического генома.
При средней
разнице размеров геномов на 3 порядка,
линейные размеры эукариотических
хромосом соизмеримы с длиной ДНК
прокариот.
Выделяют, по
крайней мере, 4 уровня компактизации
ДНК. При этом нить ДНК “укорачивается”
в 10000 раз.
Это
все равно, что нить, длиной с Останкинскую
башню (500 м), уложить в спичечный коробок
(5см).
Два первых уровня
компактизации эукариотического генома
обеспечиваются гистонами.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Диапазоны размеров генома (в парах оснований) различных форм жизни
Размер генома это общая сумма ДНК содержится в одной копии единого полного геном. Обычно это измеряется в масса в пикограммах (триллионные доли (10−12) из грамм, сокращенно pg) или реже в дальтон, или как общее количество нуклеотид пар оснований обычно в мегабазах (миллионы пар оснований, сокращенно Mb или Mbp). Одна пикограмма равна 978 мегабазам.[1] В диплоид организмы, размер генома часто используется как синоним C-значение.
Сложность организма не прямо пропорциональна размеру его генома; Общее содержание ДНК широко варьирует между биологическими таксонами. Некоторые одноклеточные организмы имеют гораздо больше ДНК, чем люди, по причинам, которые остаются неясными (см. некодирующая ДНК и Загадка ценности C ).
Происхождение термина
Древо жизни с размерами генома в качестве внешних столбцов
Термин «размер генома» часто ошибочно приписывается статье Ральфа Хинегарднера 1976 г.[2] даже в дискуссиях, посвященных терминологии в этой области исследований (например, Greilhuber 2005[3]). Примечательно, что Hinegardner[2] использовал термин только один раз: в заголовке. На самом деле этот термин, кажется, впервые появился в 1968 году, когда Хинегарднер задался вопросом в последнем абзаце другой статьи, “Сотовая связь Фактически, содержание ДНК отражает размер генома “.[4] В этом контексте «размер генома» использовался в смысле генотип означать количество гены.
В статье, представленной всего два месяца спустя, Wolf et al. (1969)[5] использовал термин «размер генома» повсюду и в его нынешнем использовании; поэтому, вероятно, следует отнести этих авторов к авторам этого термина в его современном смысле. К началу 1970-х годов термин «размер генома» широко использовался в его нынешнем определении, вероятно, в результате его включения в Сусуму Оно влиятельная книга Эволюция путем дублирования генов, опубликовано в 1970 году.[6]
Вариация размера генома и содержания генов
С появлением различных молекулярных методов за последние 50 лет размер генома в тысячи эукариоты были проанализированы, и эти данные доступны в онлайн-базах данных по животным, растениям и грибам (см. внешние ссылки). Размер ядерного генома у эукариот обычно измеряется с использованием либо денситометрический измерения Feulgen -окрашенные ядра (ранее использовались специализированные денситометры, теперь чаще используются компьютеризированные анализ изображений[7]) или проточной цитометрии. В прокариоты, гель-электрофорез в импульсном поле и завершить секвенирование генома являются преобладающими методами определения размера генома.
Хорошо известно, что размеры ядерного генома сильно различаются у разных видов эукариот. У животных они различаются более чем в 3300 раз, а у наземных растений они различаются примерно в 1000 раз.[8][9] Протист сообщалось, что размер геномов различается более чем в 300000 раз, но верхний предел этого диапазона (Амеба ) был поставлен под сомнение.[кем? ] У эукариот (но не прокариот) размер генома не пропорционален количеству гены присутствуют в геноме, наблюдение, которое считалось полностью противоречащим интуиции до открытия некодирующая ДНК и который стал известен как “Парадокс C-ценности “в результате. Однако, хотя больше нет никакого парадоксального аспекта несоответствия между размером генома и номером гена, этот термин остается широко используемым. По причинам концептуального пояснения, различные загадки, которые остаются в отношении вариации размера генома, вместо этого были предложены одним автором, чтобы более точно составить головоломку или загадку (так называемое “Загадка ценности C “).
Размер генома коррелирует с рядом измеряемых характеристик на ячейка и уровни организма, включая размер клеток, деление клеток ставка, и, в зависимости от таксон, размер тела, скорость метаболизма, скорость развития, орган сложность, географическое распространение или вымирание риск.[8][9] Основываясь на доступных в настоящее время полностью секвенированных данных генома (по состоянию на апрель 2009 г.), логарифмически трансформированное количество генов формирует линейную корреляцию с логарифмически трансформированным размером генома у бактерий, архей, вирусов и органелл вместе взятых, тогда как нелинейное (полунатуральный логарифм) корреляция видна для эукариот.[10] Хотя последнее противоречит предыдущему мнению о том, что для эукариот не существует корреляции, наблюдаемая нелинейная корреляция для эукариот может отражать непропорционально быстрорастущий некодирующая ДНК во все более и более крупных эукариотических геномах. Хотя данные секвенирования генома практически смещены в сторону небольших геномов, что может поставить под угрозу точность полученной эмпирическим путем корреляции, и окончательное доказательство корреляции еще предстоит получить путем секвенирования некоторых из крупнейших геномов эукариот, текущие данные, похоже, не исключают возможная корреляция.
Редукция генома
Размер генома по сравнению с количеством генов. Бревенчатый график от общего числа аннотированных белков в геномах, представленных GenBank как функция размера генома. На основании данных NCBI отчеты о геноме.
Редукция генома, также известен как деградация генома, это процесс сокращения генома организма по сравнению с геномом его предков. Размер генома регулярно меняется, и уменьшение размера генома наиболее важно в бактерии.
Наиболее эволюционно значимые случаи редукции генома могут наблюдаться у эукариот. органеллы известно, что они получены из бактерий: митохондрии и пластиды. Эти органеллы произошли от первобытных эндосимбионты, которые были способны выживать в клетке-хозяине и которые также необходимы клетке-хозяину для выживания. Многие современные митохондрии имеют менее 20 генов во всем геноме, тогда как современная свободноживущая бактерия обычно имеет не менее 1000 генов. Очевидно, многие гены были переданы хозяину ядро, в то время как другие просто потеряны, а их функции заменены хост-процессами.
Другие бактерии превратились в эндосимбионтов или облигатных внутриклеточных патогены и в результате испытали значительное сокращение генома. Кажется, что в этом процессе доминируют генетический дрейф в результате небольшого Население размер, низкий рекомбинация ставки, и высокие мутация ставки, в отличие от отбор для меньших геномов.[нужна цитата ] Некоторые свободноживущие морские бактериопланктоны также демонстрируют признаки сокращения генома, которые, как предполагается, вызваны естественным отбором.[11][12][13]
У облигатных эндосимбиотических видов
Облигатные эндосимбиотические виды характеризуются полной неспособностью к выживанию вне их хозяин Окружающая среда. Эти виды стали серьезной угрозой для здоровья человека, поскольку они часто способны уклоняться от иммунной системы человека и манипулировать окружающей средой хозяина для получения питательных веществ. Распространенным объяснением этих способностей к манипуляциям является их стабильно компактная и эффективная геномная структура. Эти маленькие геномы являются результатом огромной потери посторонней ДНК, что связано исключительно с потерей стадии свободного существования. До 90% генетического материала может быть потеряно, когда вид совершает эволюционный переход от свободно живущего к облигатному внутриклеточному образу жизни. Во время этого процесса будущий паразит подвергается воздействию среды, богатой метаболитами, где каким-то образом необходимо спрятаться в клетке-хозяине, эти факторы уменьшают удержание и увеличивают генетический дрейф, что приводит к ускорению потери несущественных генов.[14][15][16] Общие примеры видов с уменьшенным геномом включают: Buchnera aphidicola, Риккетсия Prowazekii, и Mycobacterium leprae. Один облигатный эндосимбионт цикадки, Nasuia deltocephalinicola, имеет самый маленький геном, известный в настоящее время среди клеточных организмов, размером 112 т.п.н.[17] Несмотря на патогенность большинства эндосимбионтов, некоторые облигатные внутриклеточные виды оказывают положительное влияние на приспособленность своих хозяев.
В модель редуктивной эволюции был предложен как попытка определить геномные общие черты, наблюдаемые у всех облигатных эндосимбионтов.[18] Эта модель иллюстрирует четыре общие особенности редуцированных геномов и облигатных внутриклеточных видов:
- «оптимизация генома» в результате ослабления отбора генов, которые являются лишними во внутриклеточной среде;
- склонность к удаления (а не вставки), что сильно влияет на гены, которые были нарушены в результате накопления мутаций (псевдогены );[19]
- очень мало или совсем нет возможности для получения новой ДНК; и
- значительное сокращение эффективная численность населения в эндосимбиотических популяциях, особенно у видов, которые полагаются на вертикальная передача генетического материала.
Основываясь на этой модели, становится ясно, что эндосимбионты сталкиваются с другими проблемами адаптации, чем свободноживущие виды, и, как следует из анализа между разными паразитами, их запасы генов сильно различаются, что приводит нас к выводу, что миниатюризация генома происходит по другому шаблону. для разных симбионтов.[20][21][22]
Преобразование пикограмм (пг) в пары оснований (п.о.)
или просто:
[1]
Правило Дрейка
В 1991 г. Джон В. Дрейк предложил общее правило: частота мутаций в геноме и его размер обратно коррелированы.[23] Было обнаружено, что это правило приблизительно верно для простых геномов, таких как геномы в ДНК-вирусы и одноклеточные организмы. Его основа неизвестна.
Было высказано предположение, что небольшой размер РНК-вирусы заключен в трехчастную взаимосвязь между точностью репликации, размером генома и генетической сложностью. У большинства РНК-вирусов отсутствует средство проверки РНК, что ограничивает точность их репликации и, следовательно, размер их генома. Это также было описано как «парадокс Эйгена».[24] Исключение из правила малых размеров генома у РНК-вирусов находится в Нидовирусы. Эти вирусы, похоже, приобрели 3′-к-5 ‘экзорибонуклеаза (ExoN), что позволило увеличить размер генома.[25]
Миниатюризация генома и оптимальный размер
В 1972 году Майкл Дэвид Беннетт[26] предположили, что существует корреляция с содержанием ДНК и объемом ядра, в то время как Простолюдин и Ван’т Хоф а до него Воробей постулировал, что даже размер клетки и длина клеточного цикла контролируются количеством ДНК.[27][28] Более свежие теории заставили нас обсудить возможность наличия механизма, который физически ограничивает развитие генома до оптимального размера.[29]
Эти объяснения были оспорены Кавалер-Смит Статья[30] где автор указал, что способ понять взаимосвязь между размером генома и объемом клетки был связан с теорией скелета. Ядро этой теории связано с объемом клетки, определяемым адаптационным балансом между преимуществами и недостатками большего размера клетки, оптимизацией соотношения ядро: цитоплазма (кариоплазматическое соотношение).[31][32] и концепция, что более крупные геномы более склонны к накоплению дублирующих транспозонов как следствие более высокого содержания некодирующей скелетной ДНК.[30] Кавалье-Смит также предположил, что в результате реакции редукции клетки ядро будет более склонно к отбору в пользу делеции по сравнению с дупликацией.[30]
С экономической точки зрения, поскольку фосфора и энергии мало, сокращение ДНК всегда должно быть в центре внимания эволюции, если только не будет получена выгода. В этом случае случайное удаление будет в основном вредным и не будет выбрано из-за снижения полученной пригодности, но иногда исключение также будет полезным. Этот компромисс между экономией и накоплением некодирующей ДНК является ключом к поддержанию кариоплазматического соотношения.
Механизмы миниатюризации генома
Основной вопрос, стоящий за процессом миниатюризации генома, заключается в том, происходит ли он большими шагами или из-за постоянной эрозии содержимого гена. Чтобы оценить эволюцию этого процесса, необходимо сравнить наследственный геном с геномом, в котором предположительно произошло сжатие. Благодаря сходству генного содержания Buchnera aphidicola и кишечные бактерии кишечная палочка, 89% идентичности для 16S рДНК и 62% для ортологичный генов удалось пролить свет на механизм миниатюризации генома.[33] Геном эндосимбионт Б. афидикола характеризуется размером генома в семь раз меньше, чем Кишечная палочка (643 кб против 4,6 мб)[34][35] и может рассматриваться как часть реестра генов кишечных бактерий.[35] В результате противостояния двух геномов выяснилось, что некоторые гены сохраняются как частично деградированные.[35] что указывает на то, что функция была потеряна во время процесса, и что последующие события эрозии сократили длину, как указано в Риккетсия.[36][37][38] Эта гипотеза подтверждается анализом псевдогены из Бухнера где количество делеций было более чем в десять раз выше по сравнению со вставкой.[38]
В Риккетсия prowazekiiКак и в случае с другими бактериями с малым геномом, этот мутуалистический эндосимбионт испытал значительное снижение функциональной активности, за большим исключением, по сравнению с другими паразитами, по-прежнему сохраняющими биосинтетическую способность продуцировать аминокислоты, необходимые его хозяину.[39][40][35] Общие эффекты сжатия генома между этим эндосимбионтом и другими паразитами заключаются в снижении способности продуцировать фосфолипиды, репарации и рекомбинации, а также в общем преобразовании состава гена в более богатый A-T[41] контент из-за мутаций и замен.[14][39] Свидетельством удаления функции репарации и рекомбинации является потеря гена recA, ген, участвующий в рекомбиназа путь. Это событие произошло во время удаления более крупного региона, содержащего десять генов, всего почти 10 т.п.н.[35][39] Такая же вера произошла уврА, уврГруппа уврC, гены, кодирующие эксцизионные ферменты, участвующие в репарации поврежденной ДНК из-за воздействия ультрафиолета.[33]
Одним из наиболее вероятных механизмов для объяснения сокращения генома является хромосомная перестройка, потому что вставку / удаление большей части последовательности легче увидеть во время гомологичной рекомбинации по сравнению с незаконной рекомбинацией, поэтому распространение сменные элементы положительно повлияет на скорость удаления.[30] Потеря этих генов на ранних стадиях миниатюризации не только эта функция, но и должна сыграть роль в эволюции последующих делеций. Доказательства того факта, что более крупное событие удаления произошло до более мелкой делеции, появились из сравнения генома Bucknera и реконструированный предок, где утраченные гены фактически не распределены случайным образом в гене предка, а агрегированы, и существует отрицательная связь между количеством потерянных генов и длиной спейсеров.[33] Событие небольших локальных инделей играет маргинальную роль в редукции генома.[42] особенно на ранних стадиях, когда большее количество генов становилось ненужным.[43][33]
Вместо этого произошли единичные события из-за отсутствия давления отбора для удержания генов, особенно если часть пути потеряла свою функцию во время предыдущей делеции. Примером этого является удаление recF, ген, необходимый для функции recA и его фланкирующие гены.[44] Одно из последствий удаления такого количества последовательностей сказалось даже на регуляции остальных генов. Потеря большого участка генома может фактически привести к потере промоторных последовательностей. Фактически это могло подтолкнуть к выбору эволюции полицистронные области с положительным эффектом как для уменьшения размера[45] и эффективность транскрипции.[46]
Свидетельства миниатюризации генома
Один из примеров миниатюризации генома произошел в микроспоридии, анаэробный внутриклеточный паразит членистоногих произошел от аэробных грибов.
Во время этого процесса митосомы[47] был сформирован в результате восстановления митохондрий до реликта, лишенного геномов и метаболической активности, за исключением производства центров железа и серы и способности проникать в клетки-хозяева.[48][49] За исключением рибосомы Кроме того, миниатюризированные, многие другие органеллы были почти потеряны в процессе формирования самого маленького генома, обнаруженного у эукариот.[30] От своего возможного предка зигомикотин грибов, микроспоридии уменьшили свой геном, устранив почти 1000 генов и уменьшив даже размер белков и генов, кодирующих белок.[50] Этот экстремальный процесс стал возможен благодаря предпочтительному отбору меньшего размера клеток, вызванному паразитизмом.
Еще один пример миниатюризации – наличие нуклеоморфы, порабощенные ядра, внутри клетки двух разных водорослей, криптофиты и хлорарахнейцы.[51]
Нуклеоморфы характеризуются одним из самых маленьких известных геномов (551 и 380 т.п.н.), и, как отмечено для микроспоридий, некоторые геномы заметно уменьшены в длине по сравнению с другими эукариотами из-за фактического отсутствия некодирующей ДНК.[30] Наиболее интересным фактором является сосуществование этих небольших ядер внутри клетки, содержащей другое ядро, которое никогда не подвергалось подобной редукции генома. Более того, даже если клетки-хозяева имеют разные объемы от вида к виду и, как следствие, изменчивость размера генома, нуклеоморф остается инвариантным, что означает двойной эффект отбора внутри одной и той же клетки.
Смотрите также
- База данных размеров генома животных
- Размер бактериального генома
- C-значение
- Ядро клетки
- Сравнительная геномика
- Сравнение разных размеров генома
- Человеческий геном
- Мусорная ДНК
- Список секвенированных эукариотических геномов
- Некодирующая ДНК
- База данных C-значений ДНК растений
- Эгоистичная ДНК
- Переносные элементы
использованная литература
- ^ а б Долезел Дж, Бартош Дж, Фогльмайр Х, Грейлхубер Дж (2003). «Содержание ядерной ДНК и размер генома форели и человека». Цитометрия Часть А. 51 (2): 127–128. Дои:10.1002 / cyto.a.10013. PMID 12541287.
- ^ а б Hinegardner R (1976). «Эволюция размера генома». В Ф.Дж. Аяла (ред.). Молекулярная эволюция. Sinauer Associates, Inc., Сандерленд. С. 179–199.
- ^ Greilhuber J, Doležel J, Lysák M, Bennett MD (2005). «Происхождение, эволюция и предлагаемая стабилизация терминов« размер генома »и« C-значение »для описания содержимого ядерной ДНК». Анналы ботаники. 95 (1): 255–260. Дои:10.1093 / aob / mci019. ЧВК 4246724. PMID 15596473.
- ^ Hinegardner R (1968). «Эволюция содержания клеточной ДНК костистых рыб». Американский натуралист. 102 (928): 517–523. Дои:10.1086/282564. S2CID 84409620.
- ^ Вольф У., Риттер Х, Аткин Н.Б., Оно S (1969). «Полиплоидизация в семействе рыб Cyprinidae, отряд Cypriniformes. I. Содержание ДНК и хромосомные наборы у различных видов Cyprinidae». Humangenetik. 7 (3): 240–244. Дои:10.1007 / BF00273173. PMID 5800705. S2CID 42045008.
- ^ Оно С (1970). Эволюция путем дублирования генов. Нью-Йорк: Springer-Verlag. ISBN 0-04-575015-7.
- ^ Харди Д.К., Грегори Т.Р., Хеберт П.Д. (2002). «От пикселей к пикограммам: руководство для начинающих по количественной оценке генома с помощью денситометрии анализа изображений Фельгена». Журнал гистохимии и цитохимии. 50 (6): 735–749. Дои:10.1177/002215540205000601. PMID 12019291.
- ^ а б Беннетт, доктор медицины, Лейтч И.Дж. (2005). «Эволюция размера генома у растений». В T.R. Григорий (ред.). Эволюция генома. Сан-Диего: Эльзевьер. стр.89 –162.
- ^ а б Грегори Т.Р. (2005). «Эволюция размера генома у животных». В T.R. Григорий (ред.). Эволюция генома. Сан-Диего: Эльзевьер. стр.3 –87.
- ^ Хоу Y, Лин S (2009). Редфилд RJ (ред.). «Определенное соотношение между числом генов и размером генома для эукариот и неэукариот: оценка содержания генов для геномов динофлагеллат». PLOS ONE. 4 (9): e6978. Bibcode:2009PLoSO … 4.6978H. Дои:10.1371 / journal.pone.0006978. ЧВК 2737104. PMID 19750009.
- ^ Дюфресн А, Гарцарек Л, Партенский Ф (2005). «Ускоренная эволюция, связанная с сокращением генома у свободноживущих прокариот». Геном Биол. 6 (2): R14. Дои:10.1186 / gb-2005-6-2-r14. ЧВК 551534. PMID 15693943.
- ^ Giovannoni SJ; и другие. (2005). «Оптимизация генома космополитической океанической бактерии». Наука. 309 (5738): 1242–1245. Bibcode:2005Sci … 309.1242G. Дои:10.1126 / science.1114057. PMID 16109880. S2CID 16221415.
- ^ Giovannoni SJ; и другие. (2008). «Небольшой геном обильного метилотрофа прибрежных океанов». Экологическая микробиология. 10 (7): 1771–1782. Дои:10.1111 / j.1462-2920.2008.01598.x. PMID 18393994.
- ^ а б Моран, Н. А. (1996-04-02). «Ускоренная эволюция и храповик Мюллера у эндосимбиотических бактерий». Труды Национальной академии наук. 93 (7): 2873–2878. Bibcode:1996ПНАС … 93.2873М. Дои:10.1073 / пнас.93.7.2873. ISSN 0027-8424. ЧВК 39726. PMID 8610134.
- ^ Wernegreen, J. J .; Моран, Н. А. (1999-01-01). «Доказательства генетического дрейфа у эндосимбионтов (Buchnera): анализ генов, кодирующих белок». Молекулярная биология и эволюция. 16 (1): 83–97. Дои:10.1093 / oxfordjournals.molbev.a026040. ISSN 0737-4038. PMID 10331254.
- ^ Сполдинг, Аллен В .; Долен, Кэрол Д. фон (2001). «Эндосимбионты псиллид демонстрируют модели совместного видообразования с хозяевами и дестабилизирующие замены в рибосомной РНК». Молекулярная биология насекомых. 10 (1): 57–67. Дои:10.1046 / j.1365-2583.2001.00231.x. ISSN 1365-2583. PMID 11240637. S2CID 46186732.
- ^ И геномы продолжают сокращаться …
- ^ Вернегрин Дж (2005). «Хорошо это или плохо: геномные последствия геномного мутуализма и паразитизма» (PDF). Текущее мнение в области генетики и развития. 15 (6): 1–12. Дои:10.1016 / j.gde.2005.09.013. PMID 16230003. Архивировано из оригинал (PDF) на 22.07.2011.
- ^ Моран Н.А., Чума Г.Р. (2004). «Геномные изменения после ограничения хозяина в бактериях». Текущее мнение в области генетики и развития. 14 (6): 627–633. Дои:10.1016 / j.gde.2004.09.003. PMID 15531157.
- ^ Мушегян, А.Р .; Кунин, Э. В. (1996-09-17). «Минимальный набор генов для клеточной жизни, полученный путем сравнения полных бактериальных геномов». Труды Национальной академии наук. 93 (19): 10268–10273. Bibcode:1996ПНАС … 9310268М. Дои:10.1073 / пнас.93.19.10268. ISSN 0027-8424. ЧВК 38373. PMID 8816789.
- ^ Huynen, Martijn A .; Борк, Пер (1998-05-26). «Измерение эволюции генома». Труды Национальной академии наук. 95 (11): 5849–5856. Bibcode:1998PNAS … 95.5849H. Дои:10.1073 / пнас.95.11.5849. ISSN 0027-8424. ЧВК 34486. PMID 9600883.
- ^ Манилов, Дж (1996-09-17). «Минимальный клеточный геном»: правильный размер““. Труды Национальной академии наук Соединенных Штатов Америки. 93 (19): 10004–10006. Bibcode:1996ПНАС … 9310004М. Дои:10.1073 / пнас.93.19.10004. ISSN 0027-8424. ЧВК 38325. PMID 8816738.
- ^ Дрейк, Дж. В (1991). «Постоянная скорость спонтанной мутации у микробов на основе ДНК». Proc Natl Acad Sci USA. 88 (16): 7160–7164. Bibcode:1991PNAS … 88.7160D. Дои:10.1073 / пнас.88.16.7160. ЧВК 52253. PMID 1831267.
- ^ Кун, А; Сантос, М; Szathmary, E (2005). «Настоящие рибозимы предполагают более низкий порог ошибки». Нат Жене. 37 (9): 1008–1011. Дои:10,1038 / ng1621. PMID 16127452. S2CID 30582475.
- ^ Лаубер, К; Goeman, JJ; Паркет Mdel, C; Thi Nga, P; Snijder, EJ; Морита, К; Горбаленя А.Е. (июль 2013 г.). «След архитектуры генома в крупнейшем расширении генома РНК-вирусов». PLOS Pathog. 9 (7): e1003500. Дои:10.1371 / journal.ppat.1003500. ЧВК 3715407. PMID 23874204.
- ^ Беннетт, Майкл Дэвид; Райли, Ральф (1972-06-06). «Содержание ядерной ДНК и минимальное время генерации у травянистых растений». Труды Лондонского королевского общества. Серия Б. Биологические науки. 181 (1063): 109–135. Bibcode:1972РСПСБ.181..109Б. Дои:10.1098 / rspb.1972.0042. PMID 4403285. S2CID 26642634.
- ^ Хоф, Дж. Вант; Воробей, А. Х. (июнь 1963 г.). «Взаимосвязь между содержанием ДНК, объемом ядра и минимальным временем митотического цикла». Труды Национальной академии наук Соединенных Штатов Америки. 49 (6): 897–902. Bibcode:1963ПНАС … 49..897В. Дои:10.1073 / пнас.49.6.897. ISSN 0027-8424. ЧВК 300029. PMID 13996145.
- ^ Простолюдин, Барри (июнь 1964). «Роли дезоксирибонуклеиновой кислоты в наследовании». Природа. 202 (4936): 960–968. Bibcode:1964Натура.202..960C. Дои:10.1038 / 202960a0. ISSN 1476-4687. PMID 14197326. S2CID 4166234.
- ^ Orgel, L.E .; Крик, Ф. Х. С. (апрель 1980 г.). «Эгоистичная ДНК: абсолютный паразит». Природа. 284 (5757): 604–607. Bibcode:1980Натура.284..604O. Дои:10.1038 / 284604a0. ISSN 1476-4687. PMID 7366731. S2CID 4233826.
- ^ а б c d е ж Кавальер-Смит, Томас (01.01.2005). «Экономика, скорость и размер имеют значение: эволюционные силы, движущие миниатюризацией и расширением ядерного генома». Анналы ботаники. 95 (1): 147–175. Дои:10.1093 / aob / mci010. ISSN 0305-7364. ЧВК 4246715. PMID 15596464.
- ^ Страсбургер, Эдуард (1893). Ueber die wirkungssphäre der Kerne und die Zellgrösse (на немецком). OCLC 80359142.
- ^ Хаксли, Дж. С. (май 1925 г.). «Клетка в развитии и наследственности». Природа. 115 (2897): 669–671. Bibcode:1925 г.Натура.115..669H. Дои:10.1038 / 115669a0. ISSN 1476-4687. S2CID 26264738.
- ^ а б c d Moran, Nancy A .; Мира, Алекс (14 ноября 2001). «Процесс сжатия генома у облигатного симбионта Buchnera aphidicola». Геномная биология. 2 (12): research0054.1. Дои:10.1186 / gb-2001-2-12-research0054. ISSN 1474-760X. ЧВК 64839. PMID 11790257.
- ^ Блаттнер, Фредерик Р .; Планкетт, Гай; Блох, Крейг А .; Перна, Николь Т .; Берланд, Валери; Райли, Моника; Колладо-Видес, Хулио; Гласнер, Джереми Д .; Роде, Кристофер К .; Мэйхью, Джордж Ф .; Грегор, Джейсон (1997-09-05). «Полная последовательность генома Escherichia coli K-12». Наука. 277 (5331): 1453–1462. Дои:10.1126 / science.277.5331.1453. ISSN 0036-8075. PMID 9278503.
- ^ а б c d е Сигенобу, Сюдзи; Ватанабэ, Хидеми; Хаттори, Масахира; Сакаки, Ёсиюки; Исикава, Хадзиме (сентябрь 2000 г.). «Последовательность генома внутриклеточного бактериального симбионта тлей Buchnera sp. APS». Природа. 407 (6800): 81–86. Bibcode:2000Натура 407 … 81С. Дои:10.1038/35024074. ISSN 1476-4687. PMID 10993077.
- ^ Андерссон, Дж. О .; Андерссон, С. Г. (1999-09-01). «Деградация генома – это постоянный процесс в Риккетсии». Молекулярная биология и эволюция. 16 (9): 1178–1191. Дои:10.1093 / oxfordjournals.molbev.a026208. ISSN 0737-4038. PMID 10486973.
- ^ Андерссон, Ян О .; Андерссон, Сив Г. Э. (01.05.2001). «Псевдогены, мусорная ДНК и динамика геномов риккетсий». Молекулярная биология и эволюция. 18 (5): 829–839. Дои:10.1093 / oxfordjournals.molbev.a003864. ISSN 0737-4038. PMID 11319266.
- ^ а б Мира, Алекс; Охман, Ховард; Моран, Нэнси А. (2001-10-01). «Делеционное смещение и эволюция бактериальных геномов». Тенденции в генетике. 17 (10): 589–596. Дои:10.1016 / S0168-9525 (01) 02447-7. ISSN 0168-9525. PMID 11585665.
- ^ а б c Андерссон, Сив Г. Э .; Зомородипур, Алиреза; Андерссон, Ян О .; Зихериц-Понтен, Томас; Alsmark, U. Cecilia M .; Podowski, Raf M .; Нэслунд, А. Кристина; Эрикссон, Анн-Софи; Винклер, Герберт Х .; Курланд, Чарльз Г. (ноябрь 1998 г.). «Последовательность генома Rickettsia prowazekii и происхождение митохондрий». Природа. 396 (6707): 133–140. Bibcode:1998Натура.396..133А. Дои:10.1038/24094. ISSN 1476-4687. PMID 9823893.
- ^ Тамаш, Ивица; Klasson, Lisa M .; Sandström, Jonas P .; Андерссон, Сив Г. Э. (2001). «Мутуалисты и паразиты: как загнать себя в (метаболический) угол». Письма FEBS. 498 (2–3): 135–139. Дои:10.1016 / S0014-5793 (01) 02459-0. ISSN 1873-3468. PMID 11412844. S2CID 40955247.
- ^ Wernegreen, J. J .; Моран, Н. А. (22 июля 2000 г.). «Распад мутуалистического потенциала у эндосимбионтов тли через замалчивание биосинтетических локусов: Buchnera of Diuraphis». Труды Лондонского королевского общества. Серия B: Биологические науки. 267 (1451): 1423–1431. Дои:10.1098 / rspb.2000.1159. ЧВК 1690690. PMID 10983826.
- ^ Петров, Дмитрий А. (2002-06-01). “Модель мутационного равновесия эволюции размера генома”. Теоретическая популяционная биология. 61 (4): 531–544. Дои:10.1006 / tpbi.2002.1605. ISSN 0040-5809. PMID 12167373.
- ^ Грегори, Т. Райан (01.09.2003). «Является ли небольшое смещение инделя определяющим фактором размера генома?». Тенденции в генетике. 19 (9): 485–488. Дои:10.1016 / S0168-9525 (03) 00192-6. ISSN 0168-9525. PMID 12957541.
- ^ Гасиор, Стивен Л .; Оливарес, Хайди; Ухо, уй; Hari, Danielle M .; Вайксельбаум, Ральф; Бишоп, Дуглас К. (17 июля 2001 г.). «Сборка RecA-подобных рекомбиназ: различные роли медиаторных белков в митозе и мейозе». Труды Национальной академии наук. 98 (15): 8411–8418. Bibcode:2001PNAS … 98.8411G. Дои:10.1073 / pnas.121046198. ISSN 0027-8424. ЧВК 37451. PMID 11459983.
- ^ Selosse, M.-A .; Альберт, B .; Годель, Б. (2001-03-01). «Уменьшение размера генома органелл способствует переносу гена в ядро». Тенденции в экологии и эволюции. 16 (3): 135–141. Дои:10.1016 / s0169-5347 (00) 02084-x. ISSN 1872-8383. PMID 11179577.
- ^ Щербаков, Д. В .; Гарбер, М. Б. (2000-07-01). «Перекрывающиеся гены в геномах бактерий и фагов». Молекулярная биология. 34 (4): 485–495. Дои:10.1007 / BF02759558. ISSN 1608-3245. S2CID 24144602.
- ^ Уильямс, Брайони А. П .; Хирт, Роберт П .; Lucocq, John M .; Эмбли, Т. Мартин (август 2002 г.). «Остаток митохондрий в микроспоридии Trachipleistophora hominis». Природа. 418 (6900): 865–869. Bibcode:2002 Натур 418..865 Вт. Дои:10.1038 / природа00949. ISSN 1476-4687. PMID 12192407. S2CID 4358253.
- ^ Килинг, Патрик Дж .; Быстро, Наоми М. (2002). «Микроспоридии: биология и эволюция сильно редуцированных внутриклеточных паразитов». Ежегодный обзор микробиологии. 56 (1): 93–116. Дои:10.1146 / annurev.micro.56.012302.160854. PMID 12142484. S2CID 22943269.
- ^ Кавальер-Смит, Т. (2001). «Что такое грибы?». В McLaughlin, David J .; Маклафлин, Эстер G .; Лемке, Пол А. (ред.). Систематика и эволюция. Систематика и эволюция: Часть A. Mycota. Springer Berlin Heidelberg. С. 3–37. Дои:10.1007/978-3-662-10376-0_1. ISBN 978-3-662-10376-0.
- ^ Виварес, Кристиан П.; Гуи, Маноло; Томарат, Фабьен; Метенье, Гай (01.10.2002). «Функциональный и эволюционный анализ генома эукариотических паразитов». Текущее мнение в микробиологии. 5 (5): 499–505. Дои:10.1016 / S1369-5274 (02) 00356-9. ISSN 1369-5274. PMID 12354558.
- ^ Дуглас, Сьюзен; Заунер, Стефан; Фраунхольц, Мартин; Битон, Маргарет; Пенни, Сюзанна; Дэн, Ланг-То; У, Сяонань; Рейт, Майкл; Кавальер-Смит, Томас; Майер, Уве-Дж. (Апрель 2001 г.). «Сильно восстановленный геном порабощенного ядра водорослей». Природа. 410 (6832): 1091–1096. Bibcode:2001 Натур.410.1091D. Дои:10.1038/35074092. ISSN 1476-4687. PMID 11323671.
дальнейшее чтение
- Эволюция хламидийных
- Андерссон Й.О. Андерссон С.Г .; Андерссон (1999). «Деградация генома – это постоянный процесс в Риккетсии». Молекулярная биология и эволюция. 16 (9): 1178–1191. Дои:10.1093 / oxfordjournals.molbev.a026208. PMID 10486973.
внешние ссылки
- База данных размеров генома животных
- База данных C-значений ДНК растений
- База данных о размерах генома грибов
- База данных грибов – по CBS
Диапазоны размеров генома (в парах оснований) различных форм жизни
Размер генома – это общее количество ДНК, содержащееся в одной копии одного полного генома . Обычно он измеряется в единицах массы в пикограммах (триллионные доли ( 10-12 ) грамма , сокращенно пг) или, реже, в дальтонах , или как общее количество пар нуклеотидных оснований , обычно в мегабазах (миллионы пар оснований, сокращенно Мб или Мбп). Одна пикограмма равна 978 мегабазам. У диплоидных организмов размер генома часто используется взаимозаменяемо с термином C-значение .
Сложность организма не прямо пропорциональна размеру его генома; Общее содержание ДНК широко варьирует между биологическими таксонами. Некоторые одноклеточные организмы имеют гораздо больше ДНК, чем люди, по причинам, которые остаются неясными (см. Некодирующую ДНК и загадку значения С ).
Происхождение термина
Древо жизни с размерами генома в качестве внешних столбцов
Термин «размер генома» часто ошибочно приписывается статье Ральфа Хинегарднера 1976 года, даже в дискуссиях, касающихся конкретно терминологии в этой области исследований (например, Greilhuber 2005). Примечательно, что Хинегарднер использовал этот термин только один раз: в названии. На самом деле этот термин, кажется, впервые появился в 1968 году, когда Хинегарднер задался вопросом в последнем абзаце другой статьи, действительно ли « содержание клеточной ДНК отражает размер генома». В этом контексте «размер генома» использовался в смысле генотипа для обозначения количества генов .
В статье, представленной всего два месяца спустя, Wolf et al. (1969) использовали термин «размер генома» повсюду и в его нынешнем использовании; поэтому, вероятно, следует отнести этих авторов к авторам этого термина в его современном смысле. К началу 1970-х годов термин «размер генома» стал обычным явлением с его нынешним определением, вероятно, в результате его включения во влиятельную книгу Сусуму Оно « Эволюция путем дублирования генов» , опубликованную в 1970 году.
Различия в размере генома и составе генов
С появлением различных молекулярных методов за последние 50 лет были проанализированы размеры геномов тысяч эукариот , и эти данные доступны в онлайн-базах данных для животных, растений и грибов (см. Внешние ссылки). Размер ядерного генома обычно измеряется у эукариот либо с помощью денситометрических измерений ядер, окрашенных по Фельгену (ранее с использованием специализированных денситометров, а теперь чаще с использованием компьютерного анализа изображений ), либо с помощью проточной цитометрии . В прокариот , импульсное поле гель – электрофореза и полное секвенирование генома являются преобладающими методы определения генома размера.
Хорошо известно, что размеры ядерного генома сильно различаются у разных видов эукариот. У животных они различаются более чем в 3300 раз, а у наземных растений они различаются примерно в 1000 раз. Сообщалось , что размер геномов протистов различается более чем в 300000 раз, но верхний предел этого диапазона ( амеба ) был поставлен под сомнение. У эукариот (но не прокариот) размер генома не пропорционален количеству генов, присутствующих в геноме, – наблюдение, которое считалось полностью противоречащим интуиции до открытия некодирующей ДНК и которое стало известно как ” C-значение”. парадокс »в результате. Однако, хотя больше нет парадоксального аспекта несоответствия между размером генома и числом генов, этот термин остается в общепринятом смысле. По причинам концептуального пояснения, различные загадки, которые остаются в отношении вариации размера генома, вместо этого были предложены одним автором, чтобы более точно составить загадку или загадку (так называемую « загадку C-значения »).
Размер генома коррелирует с рядом измеряемых характеристик на уровне клетки и организма, включая размер клеток, скорость деления клеток и, в зависимости от таксона , размер тела, скорость метаболизма, скорость развития, сложность органа , географическое распространение или риск исчезновения . Основываясь на доступных в настоящее время полностью секвенированных данных генома (по состоянию на апрель 2009 г.), логарифмически преобразованное число генов формирует линейную корреляцию с логарифмически преобразованным размером генома у бактерий, архей, вирусов и органелл вместе взятых, тогда как нелинейное (полунатуральный логарифм) корреляция видна для эукариот. Хотя последнее противоречит предыдущему мнению о том, что для эукариот не существует корреляции, наблюдаемая нелинейная корреляция для эукариот может отражать непропорционально быстро растущую некодирующую ДНК во все более крупных эукариотических геномах. Хотя данные секвенирования генома практически смещены в сторону небольших геномов, что может поставить под угрозу точность эмпирически полученной корреляции, а окончательное доказательство корреляции еще предстоит получить путем секвенирования некоторых из крупнейших геномов эукариот, текущие данные, похоже, не исключают возможная корреляция.
Редукция генома
Размер генома по сравнению с количеством генов. Логарифмический график общего количества аннотированных белков в геномах, представленных в GenBank, в зависимости от размера генома. На основании данных из отчетов о геноме NCBI .
Уменьшение генома , также известное как деградация генома , – это процесс, при котором геном организма сужается по сравнению с геномом его предков. Размер генома регулярно колеблется, и уменьшение размера генома наиболее важно у бактерий .
Наиболее эволюционно значимые случаи редукции генома могут наблюдаться в органеллах эукариот, которые, как известно, происходят от бактерий: митохондриях и пластидах . Эти органеллы произошли от примордиальных эндосимбионтов , которые были способны выживать в клетке-хозяине и которые также необходимы клетке-хозяину для выживания. Многие современные митохондрии имеют менее 20 генов во всем геноме, тогда как современная свободноживущая бактерия обычно имеет не менее 1000 генов. Многие гены, по-видимому, были перенесены в ядро хозяина , в то время как другие были просто потеряны, а их функции были заменены процессами хозяина.
Другие бактерии стали эндосимбионтами или облигатными внутриклеточными патогенами и в результате испытали значительное сокращение генома. В этом процессе, по-видимому, преобладает генетический дрейф, возникающий из-за небольшого размера популяции , низкой скорости рекомбинации и высокой скорости мутаций , в отличие от отбора для меньших геномов. Некоторые свободноживущие морские бактериопланктоны также демонстрируют признаки сокращения генома, которые, как предполагается, вызваны естественным отбором.
У облигатных эндосимбиотических видов
Облигатные эндосимбиотические виды характеризуются полной неспособностью к выживанию вне среды своего хозяина . Эти виды стали серьезной угрозой для здоровья человека, поскольку они часто способны уклоняться от иммунной системы человека и манипулировать окружающей средой хозяина для получения питательных веществ. Распространенным объяснением этих способностей к манипуляциям является их стабильно компактная и эффективная геномная структура. Эти небольшие геномы являются результатом огромных потерь посторонней ДНК, что связано исключительно с потерей свободно живущей стадии. До 90% генетического материала может быть потеряно, когда вид совершает эволюционный переход от свободно живущего к облигатному внутриклеточному образу жизни. Во время этого процесса будущий паразит подвергается воздействию среды, богатой метаболитами, где каким-то образом необходимо прятаться внутри клетки-хозяина, эти факторы уменьшают удержание и увеличивают генетический дрейф, что приводит к ускорению потери несущественных генов. Общие примеры видов с сокращенным геномом включают Buchnera aphidicola , Rickettsia prowazekii и Mycobacterium leprae . Один облигатный эндосимбионт цикадок , Nasuia deltocephalinicola , имеет самый маленький геном, известный в настоящее время среди клеточных организмов, – 112 т.п.н. Несмотря на патогенность большинства эндосимбионтов, некоторые облигатные внутриклеточные виды оказывают положительное влияние на приспособленность своих хозяев.
Модель редуктивной эволюции была предложена как попытка определить общие черты генома, наблюдаемые у всех облигатных эндосимбионтов. Эта модель иллюстрирует четыре общие особенности редуцированных геномов и облигатных внутриклеточных видов:
- «оптимизация генома» в результате ослабления отбора генов, которые являются избыточными во внутриклеточной среде;
- склонность к делециям (а не вставкам), что сильно влияет на гены, которые были нарушены в результате накопления мутаций ( псевдогенов );
- очень мало или совсем нет возможности для получения новой ДНК; а также
- значительное сокращение эффективной численности популяций эндосимбиотиков, особенно видов, которые зависят от вертикальной передачи генетического материала.
Основываясь на этой модели, становится ясно, что эндосимбионты сталкиваются с иными проблемами адаптации, чем свободноживущие виды, и, как следует из анализа между разными паразитами, их запасы генов сильно различаются, что приводит нас к выводу, что миниатюризация генома происходит по другому шаблону. для разных симбионтов.
Преобразование пикограмм (пг) в пары оснований (п.о.)
или просто:
Правило Дрейка
В 1991 году Джон В. Дрейк предложил общее правило: частота мутаций в геноме и его размер обратно коррелированы. Было обнаружено, что это правило приблизительно верно для простых геномов, таких как ДНК-вирусы и одноклеточные организмы. Его основа неизвестна.
Было высказано предположение, что небольшой размер РНК-вирусов заключен в трехчастную взаимосвязь между точностью репликации, размером генома и генетической сложностью. У большинства РНК-вирусов отсутствует средство проверки РНК, что ограничивает точность их репликации и, следовательно, размер их генома. Это также было описано как «парадокс Эйгена». Исключение из правила малых размеров генома в РНК-вирусах обнаружено у нидовирусов . Эти вирусы, по-видимому, приобрели экзорибонуклеазу 3′-к-5 ‘ (ExoN), которая позволила увеличить размер генома.
Миниатюризация генома и оптимальный размер
В 1972 году Майкл Дэвид Беннет предположил , что существует корреляция с содержанием ДНК и объемом ядра в то время как обыватель и Вантами Хофа и воробьем перед ним постулировал , что даже размер ячейки и клеточный цикл длина контролировалась количеством ДНК. Более поздние теории заставили нас обсудить возможность наличия механизма, который физически ограничивает развитие генома до оптимального размера.
Эти объяснения были оспорены статьей Кавалье-Смита , в которой автор указал, что способ понимания взаимосвязи между размером генома и объемом клеток был связан с теорией скелета. Ядро этой теории связано с объемом клетки, определяемым адаптационным балансом между преимуществами и недостатками большего размера клетки, оптимизацией соотношения ядро: цитоплазма (кариоплазматическое соотношение) и концепцией, что более крупные геномы более подвержены влиянию накопление дублирующих транспозонов как следствие более высокого содержания некодирующей скелетной ДНК. Кавалье-Смит также предположил, что в результате реакции сокращения клеток ядро будет более склонным к отбору в пользу делеции по сравнению с дупликацией.
С экономической точки зрения, поскольку фосфор и энергия недостаточны, сокращение ДНК всегда должно быть в центре внимания эволюции, если только не будет получена выгода. Тогда случайное удаление будет в основном вредным и не будет выбрано из-за снижения полученной пригодности, но иногда исключение также будет выгодным. Этот компромисс между экономией и накоплением некодирующей ДНК является ключом к поддержанию кариоплазматического соотношения.
Механизмы миниатюризации генома
Основной вопрос, стоящий за процессом миниатюризации генома, заключается в том, происходит ли он большими шагами или из-за постоянной эрозии содержания гена. Чтобы оценить эволюцию этого процесса, необходимо сравнить наследственный геном с геномом, в котором предполагается сокращение. Благодаря сходству между содержанием генов Buchnera aphidicola и кишечных бактерий Escherichia coli , 89% идентичности для 16S рДНК и 62% для ортологичных генов стало возможным пролить свет на механизм миниатюризации генома. Геном эндосимбионта B. aphidicola характеризуется размером генома, который в семь раз меньше, чем у E. coli (643 т.п.н. по сравнению с 4,6 МБ), и может рассматриваться как подмножество реестра генов кишечных бактерий. В результате противостояния двух геномов выяснилось, что некоторые гены сохраняются как частично деградированные. это указывает на то, что функция была потеряна во время процесса, и что последующие события эрозии укорачивали длину, как зарегистрировано в Rickettsia . Эта гипотеза подтверждается анализом псевдогенов из Buchnera , где число удалений было больше , чем в десять раз выше по сравнению с вставкой.
У Rickettsia prowazekii , как и у других бактерий с малым геномом, этот мутуалистический эндосимбионт испытал значительное снижение функциональной активности, за большим исключением по сравнению с другими паразитами, по-прежнему сохраняющими биосинтетическую способность продуцировать аминокислоты, необходимые его хозяину. Общие эффекты сжатия генома между этим эндосимбионтом и другими паразитами заключаются в снижении способности продуцировать фосфолипиды, репарации и рекомбинации, а также в общем преобразовании состава гена в более богатое содержание AT из-за мутаций и замен. Свидетельством удаления функции репарации и рекомбинации является потеря гена rec A, гена, участвующего в пути рекомбиназы . Это событие произошло во время удаления более крупного региона, содержащего десять генов, всего почти 10 т.п.н. Так же произошли гены uvr A, uvr B и uvr C, кодирующие эксцизионные ферменты, участвующие в репарации поврежденной ДНК из-за воздействия ультрафиолета.
Одним из наиболее вероятных механизмов объяснения сокращения генома является хромосомная перестройка, потому что вставку / удаление большей части последовательности легче увидеть во время гомологичной рекомбинации по сравнению с нелегитимной, поэтому распространение мобильных элементов будет положительно влияют на скорость удаления. Потеря этих генов на ранних стадиях миниатюризации не только эта функция, но и должна играть роль в эволюции последующих делеций. Доказательства того факта, что более крупное событие удаления произошло до меньшей делеции, были получены из сравнения генома Bucknera и реконструированного предка, где утраченный ген фактически не рассредоточен случайным образом в гене предка, а агрегирован, и отрицательная связь между количеством потерянных генов и длиной спейсеров. Событие небольших локальных инделей играет незначительную роль в редукции генома, особенно на ранних стадиях, когда большее количество генов становится лишним.
Вместо этого произошли единичные события из-за отсутствия давления отбора для удержания генов, особенно если часть пути потеряла свою функцию во время предыдущей делеции. Примером этого является делеция rec F, гена, необходимого для функции rec A, и его фланкирующих генов. Одно из последствий удаления такого количества последовательностей сказалось даже на регуляции остальных генов. Потеря большого участка генома может фактически привести к потере промоторных последовательностей. Фактически это могло подтолкнуть отбор к эволюции полицистронных регионов с положительным эффектом как для уменьшения размера, так и для эффективности транскрипции.
Свидетельства миниатюризации генома
Один из примеров миниатюризации генома произошел в микроспоридиях , анаэробных внутриклеточных паразитах членистоногих, произошедших от аэробных грибов.
Во время этого процесса митосомы были сформированы в результате восстановления митохондрий до реликта, лишенного геномов и метаболической активности, за исключением производства центров железа и серы и способности проникать в клетки-хозяева. За исключением миниатюрных рибосом , многие другие органеллы были почти потеряны в процессе формирования наименьшего генома, обнаруженного у эукариот. От своего возможного предка, зигомикотиновых грибов, микроспоридии уменьшили свой геном, уничтожив почти 1000 генов и уменьшив даже размер белков и генов, кодирующих белок. Этот экстремальный процесс стал возможен благодаря предпочтительному отбору меньшего размера клеток, вызванному паразитизмом.
Другой пример миниатюризации представлен наличием нуклеоморфов , порабощенных ядер, внутри клетки двух разных водорослей, криптофитов и хлорахнеев .
Нуклеоморфы характеризуются одним из самых маленьких известных геномов (551 и 380 т.п.н.), и, как было замечено для микроспоридий, некоторые геномы заметно уменьшены в длине по сравнению с другими эукариотами из-за фактического отсутствия некодирующей ДНК. Наиболее интересным фактором является сосуществование этих небольших ядер внутри клетки, содержащей другое ядро, которое никогда не подвергалось подобной редукции генома. Более того, даже если клетки-хозяева имеют разные объемы от вида к виду и, как следствие, вариабельность размера генома, нуклеоморф остается инвариантным, что означает двойной эффект отбора внутри одной и той же клетки.
Смотрите также
- База данных размеров генома животных
- Размер бактериального генома
- C-значение
- Ядро клетки
- Сравнительная геномика
- Сравнение разных размеров генома
- Человеческий геном
- Мусорная ДНК
- Список секвенированных эукариотических геномов
- Некодирующая ДНК
- База данных C-значений ДНК растений
- Эгоистичная ДНК
- Переносные элементы
использованная литература
дальнейшее чтение
- Эволюция хламидийных
- Андерссон Й.О. Андерссон С.Г .; Андерссон (1999). «Деградация генома – это постоянный процесс в Риккетсии» . Молекулярная биология и эволюция . 16 (9): 1178–1191. DOI : 10.1093 / oxfordjournals.molbev.a026208 . PMID 10486973 .
внешние ссылки
- База данных размеров генома животных
- База данных C-значений ДНК растений
- База данных о размерах генома грибов
- База данных по грибам – CBS