Э.Д.С. гальванического элемента определяется по формуле, применение которой рассмотрим в данной статье.
Содержание:
1.Что такое Э.Д.С. и от чего она зависит
2. Стандартные электродные потенциалы
2.1.Как устроен и как работает гальванический элемент с водородным электродом
2.2. Э.Д.С. гальванического элемента с водородным электродом
2.3. Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
2.4. Ряд напряжений металлов. Что это такое и каково его значение
3.Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Гальванический элемент является прибором, который позволяет при посредстве химической реакции получить электрическую энергию. А происходит это потому, что один металл готов отдать свои электроны другому, тот же, в свою очередь, их принять.
Но что обеспечивает такую готовность, какая сила заставляет эти электроны перемещаться?
Для сравнения способности одного металла отдавать свои электроны другому измеряют и рассчитывают электродвижущую силу (обозначим ее как Э.Д.С.)
Что такое Э.Д.С. и от чего она зависит
Сила, позволяющая перемещаться электронам по цепи в гальваническом элементе, называется электродвижущей силой (E), которая в данном случае означает то же, что и напряжение, и потенциал. Поэтому Э.Д.С. измеряется в вольтах.
Вспомним, что 1 вольт (В) представляет собой электродвижущую силу, которая позволяет заряду в 1 кулон (Кл) приобрести энергию в 1 джоуль (Дж).
ЭДС гальванического элемента определяется многими факторами:
— проводимым в элементе химическим процессом;
— концентрацией участников процесса (как реагентов, так и продуктов);
— температурой.
Если гальванический элемент работает в стандартных условиях, то его Э.Д.С. называется стандартной и обозначается Е°.
Стандартные электродные потенциалы
Еще со времен Галилея известно, что все в мире относительно. С тех пор любые события, процессы и явления мы можем рассматривать относительно других событий, процессов или явлений.
Чтобы понять, какова же Э.Д.С. конкретного металла, нужно сравнить ее с такой Э.Д.С., величина которой нам наверняка известна. Для этого был составлен гальванический элемент с газообразным водородом в качестве электрода.
Как устроен и как работает гальванический элемент с водородным электродом
Значение потенциала водородного электрода, с которым будут сравниваться величины измеряемых потенциалов электродов гальванического элемента, условно принимается на ноль.
Конечно же сам водород подключить к цепи мы не можем, так как это газообразное вещество.

Итак, в цепь включена тонкая платиновая Pt пластинка, имеющая дополнительное покрытие из платины, осажденной на ее поверхности электролитическим путем. Здесь адсорбируется газообразный водород, который дополнительно удерживается стеклянной колбой. Последняя же заполнена электролитом: 2н. раствором серной кислоты H2SO4. Кроме того, сюда из баллона подается водород H2.
Вторая часть гальванического элемента, как обычно, представлена цинковой пластинкой (анод), погруженной в раствор соли этого же металла, например, сульфата цинка ZnSO4 . Электроны анода после замыкания цепи переходят в катодное пространство и обеспечивают там восстановление ионов водорода H+:

Схематично рассмотренный гальванический элемент записывают так:

После замыкания цепи стрелка прибора покажет величину потенциала 0,76 В.
ЭДС гальванического элемента с водородным электродом
Итак. Стрелка вольтметра остановилась на значении 0,76 В. Это и есть величина Э.Д.С. гальванического элемента, устройство которого мы рассмотрели.
Поскольку в гальваническом элементе всегда одновременно протекают два противоположных процесса: окисление и восстановление, то Э.Д.С. элемента будет представлена суммой двух потенциалов: окислительного и восстановительного соответственно

Тогда посчитаем:

Поскольку в ходе процесса окисляется цинк, посчитанное (и измеренное) значение Э.Д.С. будет относиться не столько ко всему элементу, сколько к цинковому аноду.
Именно таким же образом, имея в распоряжении стандартный водородный электрод, были получены значения других стандартных электродных потенциалов.
Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
Возможны случаи, когда электрод в одном гальваническом элементе является анодом, а в другом (в паре с другим металлом) катодом. Иными словами, в зависимости от ситуации он может как окисляться, так и восстанавливаться. Какой же электродный потенциал будет иметь металл?
В таких ситуациях работает правило:
потенциалы окислительного и восстановительного процессов имеют одинаковое численное значение и противоположны по знаку
Например, для цинка:

Важно отметить, что в справочных таблицах стандартных электродных потенциалов принято отображать только восстановительные процессы. Поэтому, если электрод, значение Э.Д.С. которого вам надо взять из такой таблицы, является участником окислительного процесса, вы находите в ней значение Э.Д.С. для него, как для участника восстановительного процесса, и меняете знак на противоположный.
Итак, в самом общем случае Э.Д.С. гальванического элемента определяется по формуле:

Необходимо учесть, что
Э.Д.С. гальванического элемента всегда положительна
Определим Э.Д.С. гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их солей:

Для вычисления воспользуемся справочной таблицей стандартных электродных потенциалов металлов и формулой для расчета Э.Д.С., учитывая, что из двух значений потенциалов, меньшее будет соответствовать окислительным процессам на аноде, а большее – восстановительным процессам на катоде.
По данным таблицы восстановительный потенциал цинка равен -0,763 В. В данном процессе цинк окисляется, значит, его окислительный потенциал составляет +0,763 В. Медь восстанавливается, ее потенциал равен +0,337 В.

Ряд напряжений металлов. Что это такое и каково его значение
Если измерить указанным выше образом значения стандартных электродных потенциалов металлов и расположить их в порядке возрастания, то получится знаменитый ряд напряжений металлов (не совсем верный термин). Лучше его называть рядом стандартных электродных потенциалов металлов. Он имеет еще несколько названий: электрохимический ряд активности металлов, ряд Бекетова. В нем кроме металлов присутствует единственный неметалл водород. Надеемся, теперь понятно, почему.
Вот этот ряд:
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Hg Ag Pt Au
Каково же значение данного ряда?
По величинам стандартных электродных потенциалов можно предположить, насколько ярко выражены те или иные свойства соответствующих металлов:
1) Чем меньше величина потенциала, тем более активным является металл. Так, ряд начинается литием. Величина его потенциала Е°=-3,045 В. Это самое маленькое значение среди всех остальных. И действительно, литий очень активный металл. Он легко окисляется и трудно восстанавливается из своего иона.
2) Все металлы, стоящие в данном ряду левее водорода (т.е. имеющие отрицательное значение потенциала) вытесняют его из разбавленных кислот (кислот, подобных соляной, серной).

3) Каждый предыдущий металл ряда вытесняет все последующие из растворов их солей. Например:

Этот вывод можно подтвердить расчетами:

А вот такая реакция не возможна:

И это также легко подтверждается вычислением Э.Д.С. предполагаемого окислительно-восстановительного процесса:

Полученное отрицательное значение Э.Д.С. говорит о том, что переход электронов с меди на железо не возможен.
4) Если построить из металлов данного ряда гальванический элемент, то его Э.Д.С. будет тем больше, чем больше разность стандартных электродных потенциалов этих металлов.
Например, какой окислительно-восстановительный процесс будет идти эффективнее: вытеснение железа из его соли магнием или цинком? Для ответа на этот вопрос необходимо посчитать Э.Д.С. обоих процессов и сравнить полученные значения:

В обоих случаях Э.Д.С. положительна. Значит, процессы возможны. Однако, взаимодействие сульфата железа (II) с магнием более эффективно, чем с цинком почти в 6 раз.

Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Разберем еще несколько примеров, в которых применяется формула, по которой определяется Э.Д.С. гальванического элемента.
Задача 1. Рассчитайте, будет ли протекать реакция при погружении пластинки железа в 1М раствор сульфата никеля.
Решение:

Так как значение Э.Д.С. предполагаемой окислительно-восстановительной реакции положительное, то такая реакция возможна.
Задача 2. Рассчитайте Э.Д.С., укажите направление движения электронов в имеющейся комбинации электродов:

Решение:

Окисляется свинцовый Pb анод, его электроны будут переходить на серебряный Ag катод.
Задача 3. Подтвердите расчетом, будет ли металлический никель растворяться: а) в 2М растворе серной кислоты; б) в растворе сульфата калия с той же активностью ионов.
Решение:

Задача 4. Определите возможность протекания в водном растворе реакции между хлором и хлоридом железа (II).
Решение:

Задача 5. Вычислите стандартную Э.Д.С. гальванического элемента, в котором протекает реакция:

Решение:

Важный вывод из этой задачи:
значение Э.Д.С. гальванического элемента зависит от концентраций участников окислительно-восстановительного процесса, но не зависит от их количеств.
Количество вещества йода, которое мы умножили в окислительной полуреакции на три для соблюдения электронного баланса, не имеет значения, и поэтому величину стандартного электродного потенциала этой полуреакции на три умножать не нужно. Так же поступают во всех подобных случаях.
Таким образом, ЭДС гальванического элемента определяется по формуле, учитывающей значения стандартных электродных потенциалов. Она позволяет определить эффективность окислительно-восстановительного процесса, как в гальваническом элементе, так и при взаимодействии металла с раствором соли другого металла.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Электрической
характеристикой электрода является
потенциал,
а гальванического элемента (электрохимической
цепи) ‑ электродвижущая
сила (ЭДС),
равная алгебраической
сумме скачков потенциала, возникающих
на границе раздела фаз, входящих в состав
цепи. ЭДС
электрохимической цепи соответствует
разности потенциалов правого
(положительного) и левого (отрицательного)
электродов и всегда положительна.
ЭДС
гальванического элемента (I) равна:
 (3.8)
(3.8)
где
![]() и
и![]() – активности ионов Ag+
– активности ионов Ag+
и Cu2+
в растворах их солей. Обозначим
![]() , (3.9)
, (3.9)
где
Ео
– стандартная ЭДС гальванического
элемента. Тогда
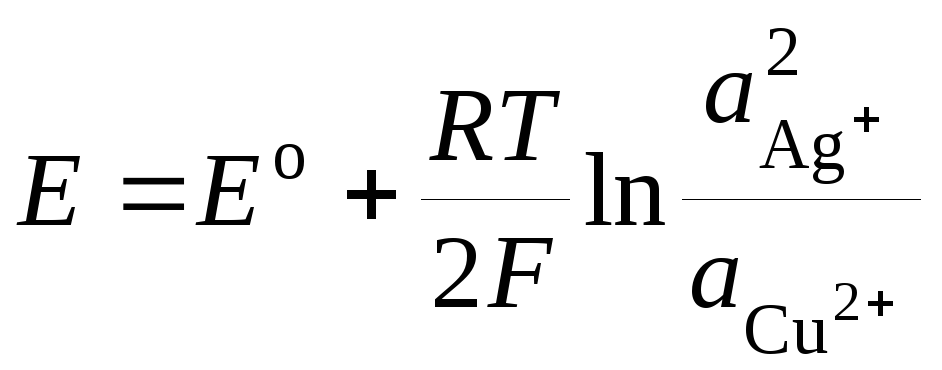 . (3.10)
. (3.10)
Следует
помнить, что активность чистого твердого
вещества принимается равной единице.
Уравнение (3.8)
носит название уравнения
Нернста для ЭДС гальванического элемента.
Пусть в
гальваническом элементе протекает
обратимая химическая реакция
![]() .
.
Максимальная
полезная работа гальванического элемента
при стандартных условиях равна
![]() , (3.11)
, (3.11)
где
z
– число электронов, участвующих в
элетродных реакциях (одинаковое для
обоих электродов), F
– постоянная Фарадея.
По
уравнению изотермы
Вант-Гоффа
 , (3.12)
, (3.12)
или
![]() . (3.13)
. (3.13)
Следовательно,
![]() . (3.14)
. (3.14)
Уравнение
Нернста в форме (3.14)
применимо для расчета ЭДС любого
гальванического элемента (по суммарной
химической реакции) и потенциала любого
электрода (по электродной реакции
3.3. Стандартный водородный электрод.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ.
Можно
с высокой точностью измерить ЭДС цепи,
составленной из двух электродов. Однако
нельзя ни измерить, ни вычислить
абсолютную разность потенциалов φ на
границе металл–раствор. Для практических
целей достаточно иметь условные величины,
характеризующие потенциалы различных
электродов, отнесенные к потенциалу
некоторого электрода, выбранного за
стандартный.
В
качестве условно-нулевого
потенциала выбран потенциал
стандартного водородного электрода:
![]() ,
,
в
котором давление продуваемого водорода
равно 1 атм, а активность ионов водорода
в растворе равна 1 (рис. 7).
Электродная реакция
![]() .
.

Рис. 7. Общий вид
водородного электрода.
Потенциал
стандартного водородного электрода
равен
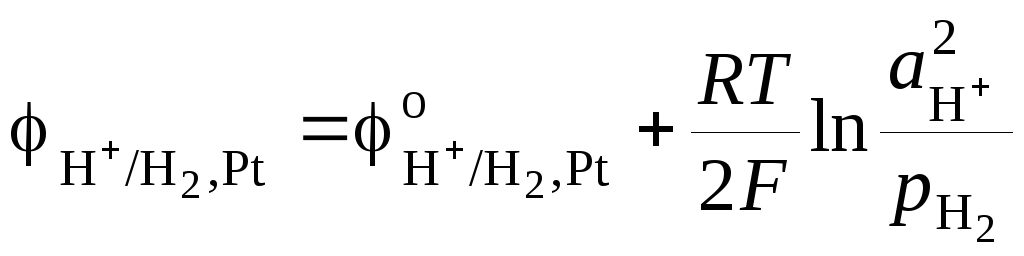 ,
,
С учетом
того, что ![]() ,
,
R
= 8.314 Дж·моль-1·К-1,
F
= 96485 Кл·моль-экв-1,и
заменяя натуральный логарифм десятичным,
получаем
![]() .
.
Электродным
потенциалом любого
другого электрода называют его потенциал
по отношению к стандартному водородному.
Другими словами, за электродный потенциал
принимают ЭДС цепи, составленной из
рассматриваемого электрода и стандартного
водородного электрода. При этом справа
в цепи расположен рассматриваемый
электрод, а слева – стандартный
водородный электрод. ЭДС положительна
(электродный потенциал положителен),
если электрический ток внутри цепи
течёт слева направо, и отрицательна –
если наоборот.
Пример
3.1.
1) Составим
гальванический элемент из платинового
и медного электродов:
![]() .
.
Суммарная
токообразующая реакция:
![]() ,
,
т.е. перенос электронов в цепи происходит
слева направо (от левого электрода к
правому). При стандартных условиях (![]() )
)
![]() .
.
2) Составим
гальванический элемент из платинового
и цинкового эдектродов:
![]() .
.
Суммарная
реакция:
![]() ,
,
т.е. перенос электронов в цепи происходит
справа налево. При стандартных условиях
(![]() )
)
![]() .
.
Следует
помнить, что ЭДС цепи всегда положительна,
поэтому рассматриваемый гальванический
элемент следует записать в следующем
виде:
![]() ,
,
при
стандартных условиях
![]() .
.
3.4.
ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА.
Гальванический
элемент при работе в условиях тепловой
изоляции нагревается или охлаждается.
Поэтому можно предположить, что источником
совершаемой электрической работы
являются тепловой эффект химической
реакции и энергия окружающей среды.
Рассмотрим уравнение Гиббса-Гельмгольца
в следующей форме:
![]() , (3.15)
, (3.15)
где
ΔН
и ΔS
– тепловой эффект и энтропия химической
реакции, протекающей в гальваническом
элементе. Максимальная полезная работа
электрохимической цепи равна убыли
энергии Гиббса:
![]() , (3.16)
, (3.16)
![]() . (3.17)
. (3.17)
Тогда:
![]() , (3.18)
, (3.18)
![]() , (3.19)
, (3.19)
![]() , (3.20)
, (3.20)
![]() , (3.21)
, (3.21)
Следовательно,
![]() ,
,
если
![]() ,
,
т.е. в
этом случае вся электрическая работа
цепи производится за счет теплового
эффекта химической реакции. Если
![]() ,
,
то
![]() ,
,
т. е.
электрическая работа меньше теплового
эффекта реакции. Гальванический элемент
при изотермических условиях отдает
теплоту в окружающую среду или нагревается
в условиях тепловой изоляции. Если
![]() ,
,
то
![]() ,
,
т. е.
электрическая работа больше теплового
эффекта реакции. Гальванический элемент
при изотермических условиях поглощает
теплоту из окружающей среды или
охлаждается в условиях тепловой изоляции.
Измерение
ЭДС обратимых гальванических элементов
при различных температурах позволяет
определить термодинамические
характеристики химических реакций,
протекающих в них, по уравнениям (3.16),
(3.18)
и (3.20).
3.5.
КЛАССИФИКАЦИЯ ЭЛЕКТРОХИМИЧЕСКИХ ЦЕПЕЙ.
Гальванические элементы классифицируют
по двум признакам:
1. По
характеру суммарного процесса, лежащего
в основе действия гальванического
элемента. Это или химическая реакция,
или процесс выравнивания концентраций
двух растворов одного и того же
электролита. По этому признаку элементы
делятся на химические и концентрационные.
1.1. Концентрационные
цепи.
Концентрационные электрохимические
цепи состоят из электродов с одинаковыми
потенциалопределяющими реакциями.
Физические и химические свойства
материала электродов одинаковы, но
активности одного (или нескольких)
участников реакции на каждом из электродов
различны. ЭДС цепи определяется отношением
активностей (по уравнению Нернста):
![]() ,
,
![]() .
.
В
уравнение Нернста для ЭДС цепи не входят
стандартные электродные потенциалы,
так как они одинаковы. По результатам
измерений ЭДС такой цепи и известной
активности компонента в одном электроде
можно рассчитать активность компонента
в другом электроде. Примером концентрационной
цепи может служить следующий гальванический
элемент (а2
> a1):
![]() .
.
1.2. Химические
цепи.
Химические цепи состоят из электродов,
потенциалопределяющие реакции которых
различны. Электроды в таких системах
отличаются и по физическим, и по химическим
свойствам. Электрическая энергия
возникает за счет энергии суммарной
химической реакции, для которой
справедливы ранее установленные
соотношения между ЭДС и тепловым эффектом
реакции, а также между стандартной ЭДС
и константой равновесия реакции.
Химические цепи разнообразны по природе
и свойствам электродов, из которых они
состоят. Примером такой цепи может
служить серебряно-цинковый элемент:
![]() .
.
Чтобы
решить вопрос о направлении суммарной
химической реакции, протекающей в
элементе, прежде всего следует определить
полярности электродов. Катодом
(положительно заряженным, правым) всегда
является электрод с более положительным
потенциалом. Так как
![]() ,
,
то
в стандартных условиях серебряный
электрод будет катодом, а цинковый
электрод ‑ анодом. Стандартная ЭДС
элемента равна
![]() .
.
Уравнения
потенциалопределяющих реакций:
![]() ,
,
![]() .
.
Суммарная
реакция в цепи
![]()
электронейтральна
(электродные реакции уравнены по числу
электронов и участвующих в них веществ).
ЭДС элемента по уравнению Нернста равна
 .
.
Важным
частным случаем химических цепей
являются цепи, в которых хотя бы один
из электродов является
окислительно–восстановительным.
Электрический ток в таких цепях возникает
за счет реакций окисления и восстановления,
протекающих в растворе. Примером такой
цепи является цепь, составленная из
стандартного водородного электрода и
железного окислительно–восстановительного
(редокс) электрода:
![]() .
.
2. По
наличию или отсутствию жидкостного
соединения между двумя растворами
гальванического элемента. По этому
признаку элементы делят на цепи с
переносом и цепи без переноса ионов.
2.1. Цепь
с переносом – это
цепь с жидкостной границей. Например,
цепь вида
![]() .
.
В
состав цинкового и медного электродов
входят растворы различной природы.
Контакт между двумя растворами
обеспечивается с помощью специальных
приспособлений, например, солевым
мостиком, состоящим из трубки, заполненной
смесью влажного желеобразного вещества
агар-агара с солью сильного электролита
(КСl). Диффузионный потенциал на границе
раздела раствор-раствор элиминирован.
2.2. Цепь
без переноса –
это цепь без жидкостной границы. Например,
цепь вида
![]() ,
,
в
которой оба электрода погружены в один
и тот же раствор.
3.6.
КЛАССИФИКАЦИЯ Обратимых
ЭЛЕКТРОДОВ.
Классификация
обратимых электродов основана на
свойствах веществ, участвующих в
потенциалопределяющих процессах.
3.6.1. Электроды
первого рода.
Это
металлические электроды, обратимые
относительно катионов (в том числе
амальгамные) и металлоидные, обратимые
относительно анионов (например, Se2-/Se).
В таких электродах восстановленной
формой является металл, а окисленной –
ион этого металла.
Если
электрод обратим относительно катиона,
то
![]() ,
,
 .
.
Если
электрод обратим относительно аниона,
то
![]() ,
,
 .
.
К
электродам первого рода относятся также
газовые
электроды
(водородный, кислородный, хлорный). Они
могут быть обратимы по отношению к
катиону или аниону. Металл в газовых
электродах необходим для создания
электронопроводящего контакта между
газом и раствором, должен быть инертен
по отношению к веществам, находящимся
в растворе, и способен катализировать
только один потенциалопределяющий
процесс. Например, водородный электрод
обратим по отношению к катиону. Уравнение
электродного процесса в кислой среде
![]()
может
быть записано в упрощенном виде:
![]() .
.
Потенциал
водородного электрода определяется
выражением
 .
.
Примером
газового электрода, обратимым по
отношению к аниону, может быть хлорный
электрод с потенциалопределяющей
реакцией
![]() .
.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg 0 -2e — = Mg 2+
К : Cu 2+ +2e — = Cu
Mg 0 + Cu 2+ = Mg 2+ + Cu
Вычислим ЭДС гальванического элемента:
ЭДС =0,337 + 2,37 = 2,71 В
ΔG 0 298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb 0 -2e — = Pb 2+
К: 2 H + +2 e — = H 2
Pb 0 + 2H + = Pb 2+ + H2
Определим электродный потенциал свинца:
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Ni2+/Ni и E 0 Cu2+/Cu
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg 2+ ] = 0,001 моль/л, [Pb 2+ ] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg и E 0 Pb2+/Pb
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg 0 -2e — = Mg 2+
К: Pb 2+ +2 e — = Pb 0
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Составим схему гальванического элемента:
(-) Mg 0 |Mg 2+ || Pb 2+ |Pb 0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
Рассчитаем стандартную ЭДС реакции
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg, E 0 Co2+/Co, E 0 Fe2+/Fe, E 0 Ag+/Ag
Протекание реакции возможно при условии, когда E 0 восст 0 ок.
В нашем случае восстановителем является кобальт и условие E 0 восст 0 ок соблюдается только для пары
Co 0 + Ag + = Co 2+ + Ag 0
Молекулярное уравнение, например:
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции
КАК РАССЧИТАТЬ ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Э.Д.С. гальванического элемента определяется по формуле, применение которой рассмотрим в данной статье.
Гальванический элемент является прибором, который позволяет при посредстве химической реакции получить электрическую энергию. А происходит это потому, что один металл готов отдать свои электроны другому, тот же, в свою очередь, их принять.
Но что обеспечивает такую готовность, какая сила заставляет эти электроны перемещаться?
Для сравнения способности одного металла отдавать свои электроны другому измеряют и рассчитывают электродвижущую силу (обозначим ее как Э.Д.С.)
Что такое Э.Д.С. и от чего она зависит
Сила, позволяющая перемещаться электронам по цепи в гальваническом элементе, называется электродвижущей силой (E) , которая в данном случае означает то же, что и напряжение, и потенциал. Поэтому Э.Д.С. измеряется в вольтах.
Вспомним, что 1 вольт (В) представляет собой электродвижущую силу, которая позволяет заряду в 1 кулон (Кл) приобрести энергию в 1 джоуль (Дж).
ЭДС гальванического элемента определяется многими факторами:
— проводимым в элементе химическим процессом;
— концентрацией участников процесса (как реагентов, так и продуктов);
Если гальванический элемент работает в стандартных условиях, то его Э.Д.С. называется стандартной и обозначается Е°.
Стандартные электродные потенциалы
Еще со времен Галилея известно, что все в мире относительно. С тех пор любые события, процессы и явления мы можем рассматривать относительно других событий, процессов или явлений.
Чтобы понять, какова же Э.Д.С. конкретного металла, нужно сравнить ее с такой Э.Д.С., величина которой нам наверняка известна. Для этого был составлен гальванический элемент с газообразным водородом в качестве электрода.
Как устроен и как работает гальванический элемент с водородным электродом
Значение потенциала водородного электрода, с которым будут сравниваться величины измеряемых потенциалов электродов гальванического элемента, условно принимается на ноль.
Конечно же сам водород подключить к цепи мы не можем, так как это газообразное вещество.
Итак, в цепь включена тонкая платиновая Pt пластинка, имеющая дополнительное покрытие из платины, осажденной на ее поверхности электролитическим путем. Здесь адсорбируется газообразный водород, который дополнительно удерживается стеклянной колбой. Последняя же заполнена электролитом: 2н. раствором серной кислоты H2SO4. Кроме того, сюда из баллона подается водород H2.
Вторая часть гальванического элемента, как обычно, представлена цинковой пластинкой (анод), погруженной в раствор соли этого же металла, например, сульфата цинка ZnSO4 . Электроны анода после замыкания цепи переходят в катодное пространство и обеспечивают там восстановление ионов водорода H + :
Схематично рассмотренный гальванический элемент записывают так:
После замыкания цепи стрелка прибора покажет величину потенциала 0,76 В.
ЭДС гальванического элемента с водородным электродом
Итак. Стрелка вольтметра остановилась на значении 0,76 В. Это и есть величина Э.Д.С. гальванического элемента, устройство которого мы рассмотрели.
Поскольку в гальваническом элементе всегда одновременно протекают два противоположных процесса: окисление и восстановление, то Э.Д.С. элемента будет представлена суммой двух потенциалов: окислительного и восстановительного соответственно
Поскольку в ходе процесса окисляется цинк, посчитанное (и измеренное) значение Э.Д.С. будет относиться не столько ко всему элементу, сколько к цинковому аноду.
Именно таким же образом, имея в распоряжении стандартный водородный электрод, были получены значения других стандартных электродных потенциалов.
Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
Возможны случаи, когда электрод в одном гальваническом элементе является анодом, а в другом (в паре с другим металлом) катодом. Иными словами, в зависимости от ситуации он может как окисляться, так и восстанавливаться. Какой же электродный потенциал будет иметь металл?
В таких ситуациях работает правило:
потенциалы окислительного и восстановительного процессов имеют одинаковое численное значение и противоположны по знаку
Например, для цинка:
Важно отметить, что в справочных таблицах стандартных электродных потенциалов принято отображать только восстановительные процессы. Поэтому, если электрод, значение Э.Д.С. которого вам надо взять из такой таблицы, является участником окислительного процесса, вы находите в ней значение Э.Д.С. для него, как для участника восстановительного процесса, и меняете знак на противоположный.
Итак, в самом общем случае Э.Д.С. гальванического элемента определяется по формуле:
Необходимо учесть, что
Э.Д.С. гальванического элемента всегда положительна
Определим Э.Д.С. гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их солей:
Для вычисления воспользуемся справочной таблицей стандартных электродных потенциалов металлов и формулой для расчета Э.Д.С., учитывая, что из двух значений потенциалов, меньшее будет соответствовать окислительным процессам на аноде, а большее – восстановительным процессам на катоде.
По данным таблицы восстановительный потенциал цинка равен -0,763 В. В данном процессе цинк окисляется, значит, его окислительный потенциал составляет +0,763 В. Медь восстанавливается, ее потенциал равен +0,337 В.
Ряд напряжений металлов. Что это такое и каково его значение
Если измерить указанным выше образом значения стандартных электродных потенциалов металлов и расположить их в порядке возрастания, то получится знаменитый ряд напряжений металлов (не совсем верный термин). Лучше его называть рядом стандартных электродных потенциалов металлов. Он имеет еще несколько названий: электрохимический ряд активности металлов, ряд Бекетова. В нем кроме металлов присутствует единственный неметалл водород. Надеемся, теперь понятно, почему.
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Hg Ag Pt Au
Каково же значение данного ряда?
По величинам стандартных электродных потенциалов можно предположить, насколько ярко выражены те или иные свойства соответствующих металлов:
1) Чем меньше величина потенциала, тем более активным является металл . Так, ряд начинается литием. Величина его потенциала Е°=-3,045 В. Это самое маленькое значение среди всех остальных. И действительно, литий очень активный металл. Он легко окисляется и трудно восстанавливается из своего иона.
2) Все металлы, стоящие в данном ряду левее водорода (т.е. имеющие отрицательное значение потенциала) вытесняют его из разбавленных кислот (кислот, подобных соляной, серной).
3) Каждый предыдущий металл ряда вытесняет все последующие из растворов их солей. Например:
Этот вывод можно подтвердить расчетами:
А вот такая реакция не возможна:
И это также легко подтверждается вычислением Э.Д.С. предполагаемого окислительно-восстановительного процесса:
Полученное отрицательное значение Э.Д.С. говорит о том, что переход электронов с меди на железо не возможен.
4) Если построить из металлов данного ряда гальванический элемент, то его Э.Д.С. будет тем больше, чем больше разность стандартных электродных потенциалов этих металлов.
Например, какой окислительно-восстановительный процесс будет идти эффективнее: вытеснение железа из его соли магнием или цинком? Для ответа на этот вопрос необходимо посчитать Э.Д.С. обоих процессов и сравнить полученные значения:
В обоих случаях Э.Д.С. положительна. Значит, процессы возможны. Однако, взаимодействие сульфата железа (II) с магнием более эффективно, чем с цинком почти в 6 раз.
Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Разберем еще несколько примеров, в которых применяется формула, по которой определяется Э.Д.С. гальванического элемента.
Задача 1. Рассчитайте, будет ли протекать реакция при погружении пластинки железа в 1М раствор сульфата никеля.
Так как значение Э.Д.С. предполагаемой окислительно-восстановительной реакции положительное, то такая реакция возможна.
Задача 2. Рассчитайте Э.Д.С., укажите направление движения электронов в имеющейся комбинации электродов:
Окисляется свинцовый Pb анод, его электроны будут переходить на серебряный Ag катод.
Задача 3. Подтвердите расчетом, будет ли металлический никель растворяться: а) в 2М растворе серной кислоты; б) в растворе сульфата калия с той же активностью ионов.
Задача 4. Определите возможность протекания в водном растворе реакции между хлором и хлоридом железа (II).
Задача 5. Вычислите стандартную Э.Д.С. гальванического элемента, в котором протекает реакция:
Важный вывод из этой задачи:
значение Э.Д.С. гальванического элемента зависит от концентраций участников окислительно-восстановительного процесса, но не зависит от их количеств.
Количество вещества йода, которое мы умножили в окислительной полуреакции на три для соблюдения электронного баланса, не имеет значения, и поэтому величину стандартного электродного потенциала этой полуреакции на три умножать не нужно. Так же поступают во всех подобных случаях.
Таким образом, ЭДС гальванического элемента определяется по формуле, учитывающей значения стандартных электродных потенциалов. Она позволяет определить эффективность окислительно-восстановительного процесса, как в гальваническом элементе, так и при взаимодействии металла с раствором соли другого металла.
Как рассчитать ЭДС гальванического элемента
Решение задач на составление схемы гальванического элемента
Задание 251.
При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
Решение:
Гальванический элемент, электроды которого сделаны из одного и того же металла будет работать при условии, что электроды будут опущены в растворы солей с разной концентрацией. Схема гальванического элемента, в котором один никелевый электрод находится в 0,001М растворе, а другой – в 0,01М растворе сульфата никеля имеет вид:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность).
Определим электродные потенциалы никелевых электродов при разных концентрациях ионов серебра Ni 2+ , получим:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Ответ: 0,0295 В.
Задание 252.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb 2+ ] = [Мg 2+ ] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
Решение:
Схема гальванического элемента
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (—2,37 В) и является анодом, на котором протекает окислительный процесс:
Мg 0 – 2 = Mg 2+ (1)
Свинец, потенциал которой -0,127 В – катод, т.е. электрод, на котором протекает восстановительный процесс:
Pb 2+ + 2 = Pb 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Если концентрацию каждого из ионов Mg 2+ и Pb 2+ увеличить в одинаковое число раз, то ЭДС гальванического элемента не изменится, так как при этом соответственно будут уменьшаться численные значения потенциалов металлов, а разница между значениями их не изменится. Например, при увеличении концентрации ионов в 100 раз концентрация их примет значения 1 моль/л, а потенциалы электродов станут равными стандартным потенциалам металлов, то ЭДС = -0,127 – (-2,37) = 2,243 В.
Ответ: 2,243 В.
Задание 253.
Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором никель является катодом:
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 – 2 = Mg 2+ (1)
Никель, потенциал которой -0,25 В – катод, т.е. электрод, на котором протекает восстановительный процесс:
Ni 2+ + 2 = Ni 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg 0 + Ni 2+ = Mg 2+ + Ni 0
б) Схема гальванического элемента, в котором никель является анодом:
Никель имеет меньший потенциал (-0,25 В) и является анодом, на котором протекает окислительный процесс:
Ni 0 – 2 = Ni 2+ (1)
Медь, потенциал которой (+0,34 В) – катод, т.е. электрод, на котором протекает восстановительный процесс:
Сu 2+ + 2 = Сu 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Задание 254.
Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
Решение:
Стандартные электродные потенциалы железа и серебра соответственно равны -0,44 В и +0,80 В. Исходя из того, что железо имеет более электроотрицательный потенциал, чем водород 0,00 В, то между железом и раствором серной кислоты проходит реакция (железо вытесняет водород из кислоты), и железная пластинка при этом будет уменьшаться по массе:
Исходя из того, что серебро имеет более электроположительный потенциал, чем водород, то между серебром и раствором серной кислоты реакция не проходит. Но так как железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты, то между ними будет проходить окислительно-восстановительный процесс, в котором железная пластина будет анодом, а серебряная – катодом.
На аноде протекает процесс:
Fe 0 → Fe 2+ + 2
На катоде серебряной пластинке будут разряжаться ионы водорода:
2Н + + 2 → Н20
(-) Fe | Fe 2+ || 2H + | H2, Ag ( + )
Задание 255.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg 2+ ] = [Cd 2+ ] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
Решение:
Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg 0 – 2 = Mg 2+ (1)
Кадмий, потенциал которой (-0,403 В) – катод, т.е. электрод, на котором протекает восстановительный процесс:
Cd 2+ + 2 = Cd 0 (2)
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
Рассчитаем электродные потенциалы магния и кадмия при концентрации их ионов в растворе равной 0,01 моль/л:
Таким образом, ЭДС гальванического элемента при равном уменьшении концентрации ионов металлов в их растворах не изменяется.
[spoiler title=”источники:”]
http://himzadacha.ru/eds-galvanicheskogo-elementa-kak-poschitat/
http://buzani.ru/zadachi/khimiya-shimanovich/940-eds-galvanicheskogo-elementa-zadaniya-21
[/spoiler]
