Электрической
характеристикой электрода является
потенциал,
а гальванического элемента (электрохимической
цепи) ‑ электродвижущая
сила (ЭДС),
равная алгебраической
сумме скачков потенциала, возникающих
на границе раздела фаз, входящих в состав
цепи. ЭДС
электрохимической цепи соответствует
разности потенциалов правого
(положительного) и левого (отрицательного)
электродов и всегда положительна.
ЭДС
гальванического элемента (I) равна:
 (3.8)
(3.8)
где
![]() и
и![]() – активности ионов Ag+
– активности ионов Ag+
и Cu2+
в растворах их солей. Обозначим
![]() , (3.9)
, (3.9)
где
Ео
– стандартная ЭДС гальванического
элемента. Тогда
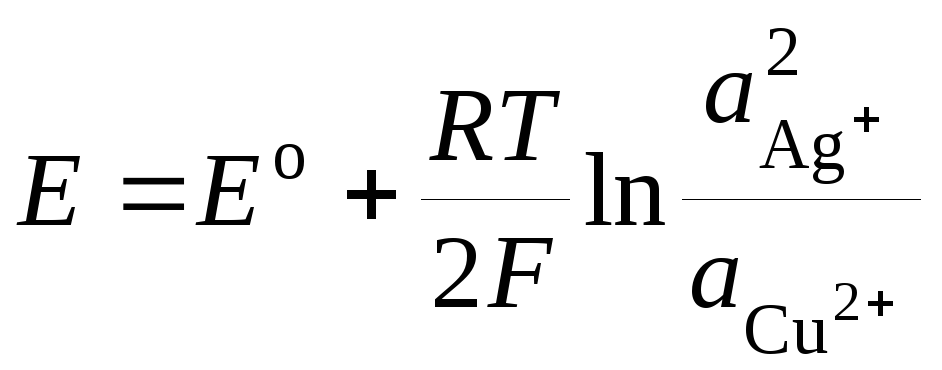 . (3.10)
. (3.10)
Следует
помнить, что активность чистого твердого
вещества принимается равной единице.
Уравнение (3.8)
носит название уравнения
Нернста для ЭДС гальванического элемента.
Пусть в
гальваническом элементе протекает
обратимая химическая реакция
![]() .
.
Максимальная
полезная работа гальванического элемента
при стандартных условиях равна
![]() , (3.11)
, (3.11)
где
z
– число электронов, участвующих в
элетродных реакциях (одинаковое для
обоих электродов), F
– постоянная Фарадея.
По
уравнению изотермы
Вант-Гоффа
 , (3.12)
, (3.12)
или
![]() . (3.13)
. (3.13)
Следовательно,
![]() . (3.14)
. (3.14)
Уравнение
Нернста в форме (3.14)
применимо для расчета ЭДС любого
гальванического элемента (по суммарной
химической реакции) и потенциала любого
электрода (по электродной реакции
3.3. Стандартный водородный электрод.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ.
Можно
с высокой точностью измерить ЭДС цепи,
составленной из двух электродов. Однако
нельзя ни измерить, ни вычислить
абсолютную разность потенциалов φ на
границе металл–раствор. Для практических
целей достаточно иметь условные величины,
характеризующие потенциалы различных
электродов, отнесенные к потенциалу
некоторого электрода, выбранного за
стандартный.
В
качестве условно-нулевого
потенциала выбран потенциал
стандартного водородного электрода:
![]() ,
,
в
котором давление продуваемого водорода
равно 1 атм, а активность ионов водорода
в растворе равна 1 (рис. 7).
Электродная реакция
![]() .
.

Рис. 7. Общий вид
водородного электрода.
Потенциал
стандартного водородного электрода
равен
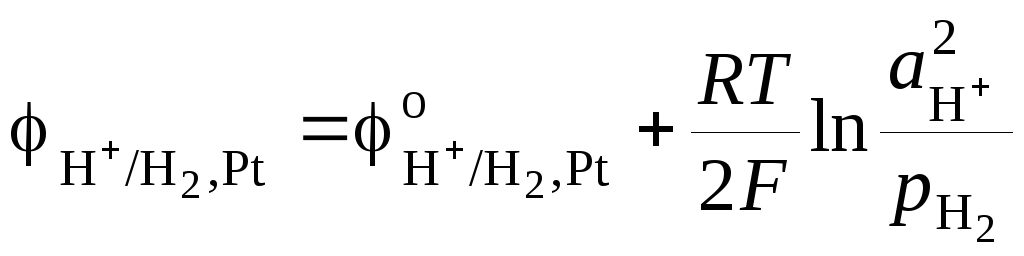 ,
,
С учетом
того, что ![]() ,
,
R
= 8.314 Дж·моль-1·К-1,
F
= 96485 Кл·моль-экв-1,и
заменяя натуральный логарифм десятичным,
получаем
![]() .
.
Электродным
потенциалом любого
другого электрода называют его потенциал
по отношению к стандартному водородному.
Другими словами, за электродный потенциал
принимают ЭДС цепи, составленной из
рассматриваемого электрода и стандартного
водородного электрода. При этом справа
в цепи расположен рассматриваемый
электрод, а слева – стандартный
водородный электрод. ЭДС положительна
(электродный потенциал положителен),
если электрический ток внутри цепи
течёт слева направо, и отрицательна –
если наоборот.
Пример
3.1.
1) Составим
гальванический элемент из платинового
и медного электродов:
![]() .
.
Суммарная
токообразующая реакция:
![]() ,
,
т.е. перенос электронов в цепи происходит
слева направо (от левого электрода к
правому). При стандартных условиях (![]() )
)
![]() .
.
2) Составим
гальванический элемент из платинового
и цинкового эдектродов:
![]() .
.
Суммарная
реакция:
![]() ,
,
т.е. перенос электронов в цепи происходит
справа налево. При стандартных условиях
(![]() )
)
![]() .
.
Следует
помнить, что ЭДС цепи всегда положительна,
поэтому рассматриваемый гальванический
элемент следует записать в следующем
виде:
![]() ,
,
при
стандартных условиях
![]() .
.
3.4.
ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА.
Гальванический
элемент при работе в условиях тепловой
изоляции нагревается или охлаждается.
Поэтому можно предположить, что источником
совершаемой электрической работы
являются тепловой эффект химической
реакции и энергия окружающей среды.
Рассмотрим уравнение Гиббса-Гельмгольца
в следующей форме:
![]() , (3.15)
, (3.15)
где
ΔН
и ΔS
– тепловой эффект и энтропия химической
реакции, протекающей в гальваническом
элементе. Максимальная полезная работа
электрохимической цепи равна убыли
энергии Гиббса:
![]() , (3.16)
, (3.16)
![]() . (3.17)
. (3.17)
Тогда:
![]() , (3.18)
, (3.18)
![]() , (3.19)
, (3.19)
![]() , (3.20)
, (3.20)
![]() , (3.21)
, (3.21)
Следовательно,
![]() ,
,
если
![]() ,
,
т.е. в
этом случае вся электрическая работа
цепи производится за счет теплового
эффекта химической реакции. Если
![]() ,
,
то
![]() ,
,
т. е.
электрическая работа меньше теплового
эффекта реакции. Гальванический элемент
при изотермических условиях отдает
теплоту в окружающую среду или нагревается
в условиях тепловой изоляции. Если
![]() ,
,
то
![]() ,
,
т. е.
электрическая работа больше теплового
эффекта реакции. Гальванический элемент
при изотермических условиях поглощает
теплоту из окружающей среды или
охлаждается в условиях тепловой изоляции.
Измерение
ЭДС обратимых гальванических элементов
при различных температурах позволяет
определить термодинамические
характеристики химических реакций,
протекающих в них, по уравнениям (3.16),
(3.18)
и (3.20).
3.5.
КЛАССИФИКАЦИЯ ЭЛЕКТРОХИМИЧЕСКИХ ЦЕПЕЙ.
Гальванические элементы классифицируют
по двум признакам:
1. По
характеру суммарного процесса, лежащего
в основе действия гальванического
элемента. Это или химическая реакция,
или процесс выравнивания концентраций
двух растворов одного и того же
электролита. По этому признаку элементы
делятся на химические и концентрационные.
1.1. Концентрационные
цепи.
Концентрационные электрохимические
цепи состоят из электродов с одинаковыми
потенциалопределяющими реакциями.
Физические и химические свойства
материала электродов одинаковы, но
активности одного (или нескольких)
участников реакции на каждом из электродов
различны. ЭДС цепи определяется отношением
активностей (по уравнению Нернста):
![]() ,
,
![]() .
.
В
уравнение Нернста для ЭДС цепи не входят
стандартные электродные потенциалы,
так как они одинаковы. По результатам
измерений ЭДС такой цепи и известной
активности компонента в одном электроде
можно рассчитать активность компонента
в другом электроде. Примером концентрационной
цепи может служить следующий гальванический
элемент (а2
> a1):
![]() .
.
1.2. Химические
цепи.
Химические цепи состоят из электродов,
потенциалопределяющие реакции которых
различны. Электроды в таких системах
отличаются и по физическим, и по химическим
свойствам. Электрическая энергия
возникает за счет энергии суммарной
химической реакции, для которой
справедливы ранее установленные
соотношения между ЭДС и тепловым эффектом
реакции, а также между стандартной ЭДС
и константой равновесия реакции.
Химические цепи разнообразны по природе
и свойствам электродов, из которых они
состоят. Примером такой цепи может
служить серебряно-цинковый элемент:
![]() .
.
Чтобы
решить вопрос о направлении суммарной
химической реакции, протекающей в
элементе, прежде всего следует определить
полярности электродов. Катодом
(положительно заряженным, правым) всегда
является электрод с более положительным
потенциалом. Так как
![]() ,
,
то
в стандартных условиях серебряный
электрод будет катодом, а цинковый
электрод ‑ анодом. Стандартная ЭДС
элемента равна
![]() .
.
Уравнения
потенциалопределяющих реакций:
![]() ,
,
![]() .
.
Суммарная
реакция в цепи
![]()
электронейтральна
(электродные реакции уравнены по числу
электронов и участвующих в них веществ).
ЭДС элемента по уравнению Нернста равна
 .
.
Важным
частным случаем химических цепей
являются цепи, в которых хотя бы один
из электродов является
окислительно–восстановительным.
Электрический ток в таких цепях возникает
за счет реакций окисления и восстановления,
протекающих в растворе. Примером такой
цепи является цепь, составленная из
стандартного водородного электрода и
железного окислительно–восстановительного
(редокс) электрода:
![]() .
.
2. По
наличию или отсутствию жидкостного
соединения между двумя растворами
гальванического элемента. По этому
признаку элементы делят на цепи с
переносом и цепи без переноса ионов.
2.1. Цепь
с переносом – это
цепь с жидкостной границей. Например,
цепь вида
![]() .
.
В
состав цинкового и медного электродов
входят растворы различной природы.
Контакт между двумя растворами
обеспечивается с помощью специальных
приспособлений, например, солевым
мостиком, состоящим из трубки, заполненной
смесью влажного желеобразного вещества
агар-агара с солью сильного электролита
(КСl). Диффузионный потенциал на границе
раздела раствор-раствор элиминирован.
2.2. Цепь
без переноса –
это цепь без жидкостной границы. Например,
цепь вида
![]() ,
,
в
которой оба электрода погружены в один
и тот же раствор.
3.6.
КЛАССИФИКАЦИЯ Обратимых
ЭЛЕКТРОДОВ.
Классификация
обратимых электродов основана на
свойствах веществ, участвующих в
потенциалопределяющих процессах.
3.6.1. Электроды
первого рода.
Это
металлические электроды, обратимые
относительно катионов (в том числе
амальгамные) и металлоидные, обратимые
относительно анионов (например, Se2-/Se).
В таких электродах восстановленной
формой является металл, а окисленной –
ион этого металла.
Если
электрод обратим относительно катиона,
то
![]() ,
,
 .
.
Если
электрод обратим относительно аниона,
то
![]() ,
,
 .
.
К
электродам первого рода относятся также
газовые
электроды
(водородный, кислородный, хлорный). Они
могут быть обратимы по отношению к
катиону или аниону. Металл в газовых
электродах необходим для создания
электронопроводящего контакта между
газом и раствором, должен быть инертен
по отношению к веществам, находящимся
в растворе, и способен катализировать
только один потенциалопределяющий
процесс. Например, водородный электрод
обратим по отношению к катиону. Уравнение
электродного процесса в кислой среде
![]()
может
быть записано в упрощенном виде:
![]() .
.
Потенциал
водородного электрода определяется
выражением
 .
.
Примером
газового электрода, обратимым по
отношению к аниону, может быть хлорный
электрод с потенциалопределяющей
реакцией
![]() .
.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Что такое ЭДС гальванического элемента
Содержание
- 1 Что такое ЭДС в химии
- 2 От чего зависит ЭДС гальванического элемента
- 3 Как определяется ЭДС
- 4 Методы измерения электродвижущей силы
- 5 Видео по теме
ЭДС означает «электродвижущая сила». Этот термин используется для обозначения разницы потенциалов, возникающих между двумя электродами в вольтовой ячейке. Проще говоря, это движущая сила химических реакций, в результате которых возникает электричество. ЭДС гальванических элементов измеряется в вольтах и может быть использована для определения термодинамической целесообразности реакции или стандартного потенциала гальванической ячейки. ЭДС используется в электрохимии для описания поведения многих веществ.

Гальванический элемент
Что такое ЭДС в химии
Электрохимические ячейки — это системы, в которых происходит реакция окисления-восстановления, способствующая возникновению электричества, что может быть использовано для питания устройств или выполнения работы. Состоят такие ячейки или элементы из двух электродов. Одни из них принимает электроны (катод), а другой (анод) — выделяет.
ЭДС возникает в результате движения отрицательно заряженных частиц. Они могут перемещаться между атомами, что приводит к образованию либо разрыву химических связей. В гальванических материалах электроны перемещаются между электродами. Этот процесс порождает электричество. ЭДС или электродвижущая сила гальванического элемента определяется разностью восстановительных потенциалов между двумя электродами. Эта разность связана со стандартным изменением свободной энергии Гиббса общей реакции в ячейке.

Электрохимические цепи
От чего зависит ЭДС гальванического элемента
Основным фактором является разница в потенциалах восстановления двух электродов, участвующих в работе гальванического элемента. Восстановительный потенциал — это мера склонности химического вещества к обновлению или получению электронов. Чем больше разница в потенциалах восстановления между двумя электродами, тем больше электродвижущая сила ячейки. Эта разница также известна как напряжение ячейки.
Другим фактором, влияющим на ЭДС любого гальванического элемента, является концентрация ионов в веществах, участвующих в окислительно-восстановительном взаимодействии. Изменение концентрации реагентов влечет за собой изменение электродвижущей силы.
Температура — еще один важный фактор. Электродвижущая сила связана с изменением свободной энергии Гиббса общей реакции элемента, которая зависит от температуры. Если гальванический элемент нагревать, то ЭДС может уменьшаться из-за изменения энтальпии и энтропии системы. Поэтому важно учитывать температуру, выполняя расчет ЭДС.

Энергия Гиббса
Как определяется ЭДС
В гальваническом веществе главную роль при генерации электричества играют электроды. В ходе химической реакции на аноде скапливаются электроны, а при реакции на катоде они расходуются. Разница в скорости этих реакций приводит к возникновению электричества. Поэтому ЭДС между электродами гальванического элемента равна разнице потенциалов между ними.

Возникновение ЭДС в гальваническом элементе
Важно также понимать факторы, влияющие на поведение гальванического элемента. Одним из них является электронная емкость электродов, то есть, их способность накапливать заряд. Емкость можно определить путем измерения ЭДС гальванического элемента и тока при различных условиях. Она зависит от таких факторов, как площадь поверхности, тип используемого материала и электродный потенциал. Последний отображает склонность электрода терять или набирать электроны. Он зависит от количества ионов в веществе, температуры и других факторов. Понимая эти факторы, можно управлять поведением гальванического элемента и оптимизировать его работу для конкретного применения.
ЭДС гальванического элемента является разностью электродных потенциалов:

Разница потенциалов
Один из электродов (анод) является окислителем, а другой (катод) восстановителем. Поэтому можно записать:

Формула ЭДС
Если ЭДС имеет знак плюс, то окислительно-восстановительная реакция протекает самопроизвольно. В противном случае самопроизвольной является обратная реакция.
Когда электрохимическая ячейка находится в стандартных условиях, рассчитать ЭДС на электродах гальванического элемента, можно с помощью стандартных электродных потенциалов. Чтобы узнать их значение, понадобится специальная таблица, которую можно найти в справочной литературе.

Таблица стандартных потенциалов
Разница стандартных электродных потенциалов — это стандартная ЭДС гальванического элемента.

Стандартная ЭДС
Чтобы определить стандартную ЭДС, например, для ячейки, состоящей из свинцового и никелевого электродов, следует сначала в таблице найти значения потенциалов, а потом рассчитываем разницу.
![]()
Определение ЭДС
На потенциал электрода оказывает влияние не только химический состав материала из которого изготовлен электрод, но также температура и концентрация ионов в растворе. Когда эти условия отличаются от стандартных, для расчета ЭДС используется формула Нернста.

Формула Нернста
Методы измерения электродвижущей силы
ЭДС гальванического элемента представляют в виде двух скачков потенциала, присутствующего на границе между металлом и раствором. Но нельзя измерить скачок потенциала на каждом из электродов, а вот сумму скачков на обоих электродах можно измерить. Поэтому, если один из электродов заменить так называемым электродом сравнения, то на другом электроде будет наблюдаться скачок потенциала отличный от ЭДС на некоторую постоянную величину, соответствующую величине скачка потенциала в эталонном электроде.
Как электрод сравнения принято использовать стандартный водородный электрод с концентрацией ионов водорода 1 моль/литр при давлении водорода 101 кПа и температуре 25 градусов.

Стандартный электродный потенциал
Измерение ЭДС гальванического элемента должно выполняться при отсутствии тока, поскольку в противном случае в исследуемой электрохимической системе будут происходить необратимые процессы, связанные с изменением концентрации реагентов. К тому же наличие тока в ячейке способствует поляризации электродов. Поэтому используются катодные вольтметры с большим внутренним сопротивлением, потребляющие очень незначительный ток. Но чаще применяют метод, заключающийся в том, что ЭДС элемента уравновешивают внешней калиброванной разностью потенциалов. Он называется компенсационным. Самая простая схема измерения ЭДС таким методом представлена на рисунке ниже.

Схема измерения ЭДС компенсационным методом
Гальванический элемент, ЭДС которого надо измерить (Ех), подключается последовательно к гальванометру Г. Измеряемый параметр компенсируется ЭДС вспомогательного элемента Е. Величина этой силы известна, а знак должен быть противоположным по отношению к тому, что есть у ЭДС исследуемого элемента. При выполнении измерений следует изменять положение точки С, то есть, соотношение сопротивлений участков АС и АВ (сопротивления обозначаются как n и n+m). Таким образом, отношение электродвижущих сил соответствует отношению сопротивлений:

Расчет ЭДС
С помощью компенсационного метода можно определить ЭДС с довольно высокой точностью. Следует отметить, что на результат измерения не влияет сопротивление гальванометра и соединительных проводов. Рабочий ток вспомогательного элемента Е устанавливают, пользуясь эталонным элементом, значение ЭДС которого известно с точностью до 0.001%.
Еще одним способом измерения является использование потенциометра — прибора, с помощью которого с высокой точностью можно измерить разность потенциалов между двумя точками в цепи. В этом случае стандартный элемент с известной ЭДС подключается к одному концу потенциометра, а гальванический элемент к другому. Потенциометр регулируется до тех пор, пока разность потенциалов между двумя точками не станет равной нулю, после чего можно вычислить ЭДС исследуемого гальванического элемента.

Схема с потенциометром
При манипуляциях, связанных с определением ЭДС, используют также мост Кельвина, который представляет собой устройство, измеряющее сопротивление проводника с высокой точностью. Гальванический элемент подключается к мосту, а затем измеряется его сопротивление. Сравнивая результат измерений с известным сопротивлением эталонного элемента, и основываясь на законе Ома, найдем ЭДС.

Схема моста Кельвина
ЭДС гальванического элемента определяется еще одним не очень распространенным методом, который основывается на измерении изменения свободной энергии общей реакции электрохимической ячейки. Это можно сделать, измерив изменение энтальпии и энтропии системы и используя уравнение свободной энергии Гиббса. Когда изменение свободной энергии известно, потенциал находят по формуле:

Уравнение свободной энергии Гиббса
При измерении потенциала ячейки важно убедиться, что она находится в стандартных условиях. К таким относятся температура +25 градусов, давление 1 атм и концентрация 1 моль/л для всех реагентов. Если ячейка находится не в стандартных условиях, можно использовать уравнение Нернста для вычисления потенциала в нестандартных условиях.
Видео по теме
Решение. В данном гальваническом элементе
протекает реакция Cd+2 + Zn
= Zn+2 + Cd. Между
константой равновесия реакции, протекающей в гальваническом элементе, и ЭДС
гальванического элемента существует зависимость E =
(0.059/n)×lgK;
E = (0.059/2)×lg2.022×105 = 0.157 В.
![]() ;
;
![]() = E +
= E +![]() = 0.157 – 0.789 = -0.632 В.
= 0.157 – 0.789 = -0.632 В.
Пример 4. Определите ЭДС
гальванической цепи:
Fe /0.1 м. FeSO4
// 0.01 н. NaOH /H2,
Pt. Cтепени электролитической
диссоциации FeSO4 и NaOH соответственно равны 60 и 100%.
Решение. Для определения ЭДС этого
гальванического элемента необходимо определить концентрацию ионов Fe+2
в 0.1 м FeSO4 и концентрацию ионов Н+ в 0.01 н. NaOH:
Сиона = Сэлектр.×n×a,
![]() = 0.1×1×0.6
= 0.1×1×0.6
= 0.06 моль/л.
Концентрация ионов OH– и Н+ в 0.01 н.
NaOH:
![]() =
=
0.01×1×1 = 0.01 моль/л., ![]() = 10-14/10-2
= 10-14/10-2
= 10-12 моль/л.
Электродный потенциал железа:
![]() =
=
-0.44 + (0.059/2)×lg
6×10-2 = -0.476
В.
Электродный потенциал водородного электрода:
![]() =
=
0 + 0.059×lg 10-12 = -0.708
В.
В соответствии с величинами электродных потенциалов работает
следующая гальваническая цепь:
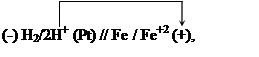 |
Ее электродвижущая сила равна:
![]() = -0.476 – (-0.708) = 0.232 В.
= -0.476 – (-0.708) = 0.232 В.
Пример 5. Определение ЭДС
гальванической цепи с учетом активности ионов. Вычислите ЭДС газоводородной
цепи:
Pt, H2 /0.008 н. NaOH // 0.006 н. HCl/ H2, Pt,
если коэффициенты активности ионов равны: ![]() = 0.944;
= 0.944; ![]() = 0.916. Степень
= 0.916. Степень
диссоциации приведенных электролитов принять равной 100%.
Решение. Сначала определяем
концентрации ионов Н+ и ОН- в растворах НС1 и NaOH: ![]() = 0.006 моль/л;
= 0.006 моль/л; ![]() =
=
0.008 моль/л. Активности ионов равны: a = f×C, следовательно, ![]() =0.008×0.916 = 7.33×10-3
=0.008×0.916 = 7.33×10-3
моль/л.., ![]() = 0.006×0.944 = 5.66×10-3
= 0.006×0.944 = 5.66×10-3
моль/л.
По активности ионов OH– определяем активность
ионов Н+ в растворе NaOH:
![]() =
=
10-14/ 7.33×10-3 = 1.36×10-12 моль/л.
По уравнению
Нернста вычисляем потенциал водородного электрода в растворе NaOH: ![]() = 0.059×lg1.36×10-12
= 0.059×lg1.36×10-12
= -0.700 В,
и в растворе НСl: ![]() = 0.059×lg5.66×10-3
= 0.059×lg5.66×10-3
= -0.133 В.
Анодом является электрод в растворе NaOH, а катодом – в
растворе НСl.
Гальваническая цепь работает по следующей схеме:
(-) Pt, H2/ 0.008 н. NaOH // 0.006 н. HCl/ H2, Pt
(+),
Электродвижущая сила, возникающая при работе этой
гальванической цепи, равна:
E = -0.133 – (-0.700) = 0.567 В.
![]() Пример 6. Определение ЭДС
Пример 6. Определение ЭДС
гальванического элемента с учетом поляризации электродов. Как изменится при
работе ЭДС гальванического элемента:
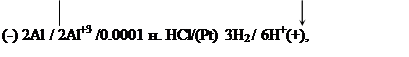 |
если в процессе работы элемента концентрация ионов Al+3
меняется от 0.003 до 0.1, а перенапряжение h
водорода на платине равно 0.09 В. Чему равна концентрационная поляризация
анода?
Решение. Сначала нужно определить начальные
электродные потенциалы анода и катода гальванического элемента:
![]() = -1.66 +(0.059/3)×lg3×10-3 = -1.71 В.
= -1.66 +(0.059/3)×lg3×10-3 = -1.71 В.
![]() = 0.059×lg10-4 = -0.236 В.
= 0.059×lg10-4 = -0.236 В.
Начальная ЭДС гальванического элемента равна:
![]() = -0.236 – (-1.71) = 1.48 В.
= -0.236 – (-1.71) = 1.48 В.
Концентрационная поляризация определяется следующим образом:
Eполяр = (0.059/n)×lg (C2/C1),
где C1 – меньшая
концентрация иона, моль/л; C2 –
большая концентрация иона, моль/л.
Для алюминиевого электрода концентрационная поляризация
равна:
Eполяр = (0.059/3)×lg
(0.1/0.003) = 0.029 В.
С учетом концентрационной поляризации потенциал алюминиевого
электрода равен.
![]() = -1.71 + 0.029 = -1.68 В.
= -1.71 + 0.029 = -1.68 В.
Потенциал катода с учетом величины перенапряжения выделения
водорода на платине равен: ![]() = -0.23 – 0.09 = -0.32
= -0.23 – 0.09 = -0.32
В.
Конечная ЭДС гальванического элемента равна: E2 = -0.32 – (-1.68) = 1.36 В, а ЭДС
гальванического элемента в процессе работы уменьшилась на разность:
1.48 – 1.36 = 0.12 В.
Перенапряжением h
называют повышение потенциала разрядки ионов по cравнению
с величиной стандартного потенциала в равновесных условиях.
Пример 7. Рассмотрите коррозию изделия
из алюминиевой бронзы:
а) в дистиллированной воде; б) в сильнощелочной аэрированной среде (раствор
NaOH). Приведите уравнения электродных процессов. Какие вещества являются
продуктами коррозии?
Э.Д.С. гальванического элемента определяется по формуле, применение которой рассмотрим в данной статье.
Содержание:
1.Что такое Э.Д.С. и от чего она зависит
2. Стандартные электродные потенциалы
2.1.Как устроен и как работает гальванический элемент с водородным электродом
2.2. Э.Д.С. гальванического элемента с водородным электродом
2.3. Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
2.4. Ряд напряжений металлов. Что это такое и каково его значение
3.Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Гальванический элемент является прибором, который позволяет при посредстве химической реакции получить электрическую энергию. А происходит это потому, что один металл готов отдать свои электроны другому, тот же, в свою очередь, их принять.
Но что обеспечивает такую готовность, какая сила заставляет эти электроны перемещаться?
Для сравнения способности одного металла отдавать свои электроны другому измеряют и рассчитывают электродвижущую силу (обозначим ее как Э.Д.С.)
Что такое Э.Д.С. и от чего она зависит
Сила, позволяющая перемещаться электронам по цепи в гальваническом элементе, называется электродвижущей силой (E), которая в данном случае означает то же, что и напряжение, и потенциал. Поэтому Э.Д.С. измеряется в вольтах.
Вспомним, что 1 вольт (В) представляет собой электродвижущую силу, которая позволяет заряду в 1 кулон (Кл) приобрести энергию в 1 джоуль (Дж).
ЭДС гальванического элемента определяется многими факторами:
— проводимым в элементе химическим процессом;
— концентрацией участников процесса (как реагентов, так и продуктов);
— температурой.
Если гальванический элемент работает в стандартных условиях, то его Э.Д.С. называется стандартной и обозначается Е°.
Стандартные электродные потенциалы
Еще со времен Галилея известно, что все в мире относительно. С тех пор любые события, процессы и явления мы можем рассматривать относительно других событий, процессов или явлений.
Чтобы понять, какова же Э.Д.С. конкретного металла, нужно сравнить ее с такой Э.Д.С., величина которой нам наверняка известна. Для этого был составлен гальванический элемент с газообразным водородом в качестве электрода.
Как устроен и как работает гальванический элемент с водородным электродом
Значение потенциала водородного электрода, с которым будут сравниваться величины измеряемых потенциалов электродов гальванического элемента, условно принимается на ноль.
Конечно же сам водород подключить к цепи мы не можем, так как это газообразное вещество.

Итак, в цепь включена тонкая платиновая Pt пластинка, имеющая дополнительное покрытие из платины, осажденной на ее поверхности электролитическим путем. Здесь адсорбируется газообразный водород, который дополнительно удерживается стеклянной колбой. Последняя же заполнена электролитом: 2н. раствором серной кислоты H2SO4. Кроме того, сюда из баллона подается водород H2.
Вторая часть гальванического элемента, как обычно, представлена цинковой пластинкой (анод), погруженной в раствор соли этого же металла, например, сульфата цинка ZnSO4 . Электроны анода после замыкания цепи переходят в катодное пространство и обеспечивают там восстановление ионов водорода H+:

Схематично рассмотренный гальванический элемент записывают так:

После замыкания цепи стрелка прибора покажет величину потенциала 0,76 В.
ЭДС гальванического элемента с водородным электродом
Итак. Стрелка вольтметра остановилась на значении 0,76 В. Это и есть величина Э.Д.С. гальванического элемента, устройство которого мы рассмотрели.
Поскольку в гальваническом элементе всегда одновременно протекают два противоположных процесса: окисление и восстановление, то Э.Д.С. элемента будет представлена суммой двух потенциалов: окислительного и восстановительного соответственно

Тогда посчитаем:

Поскольку в ходе процесса окисляется цинк, посчитанное (и измеренное) значение Э.Д.С. будет относиться не столько ко всему элементу, сколько к цинковому аноду.
Именно таким же образом, имея в распоряжении стандартный водородный электрод, были получены значения других стандартных электродных потенциалов.
Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
Возможны случаи, когда электрод в одном гальваническом элементе является анодом, а в другом (в паре с другим металлом) катодом. Иными словами, в зависимости от ситуации он может как окисляться, так и восстанавливаться. Какой же электродный потенциал будет иметь металл?
В таких ситуациях работает правило:
потенциалы окислительного и восстановительного процессов имеют одинаковое численное значение и противоположны по знаку
Например, для цинка:

Важно отметить, что в справочных таблицах стандартных электродных потенциалов принято отображать только восстановительные процессы. Поэтому, если электрод, значение Э.Д.С. которого вам надо взять из такой таблицы, является участником окислительного процесса, вы находите в ней значение Э.Д.С. для него, как для участника восстановительного процесса, и меняете знак на противоположный.
Итак, в самом общем случае Э.Д.С. гальванического элемента определяется по формуле:

Необходимо учесть, что
Э.Д.С. гальванического элемента всегда положительна
Определим Э.Д.С. гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их солей:

Для вычисления воспользуемся справочной таблицей стандартных электродных потенциалов металлов и формулой для расчета Э.Д.С., учитывая, что из двух значений потенциалов, меньшее будет соответствовать окислительным процессам на аноде, а большее – восстановительным процессам на катоде.
По данным таблицы восстановительный потенциал цинка равен -0,763 В. В данном процессе цинк окисляется, значит, его окислительный потенциал составляет +0,763 В. Медь восстанавливается, ее потенциал равен +0,337 В.

Ряд напряжений металлов. Что это такое и каково его значение
Если измерить указанным выше образом значения стандартных электродных потенциалов металлов и расположить их в порядке возрастания, то получится знаменитый ряд напряжений металлов (не совсем верный термин). Лучше его называть рядом стандартных электродных потенциалов металлов. Он имеет еще несколько названий: электрохимический ряд активности металлов, ряд Бекетова. В нем кроме металлов присутствует единственный неметалл водород. Надеемся, теперь понятно, почему.
Вот этот ряд:
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Hg Ag Pt Au
Каково же значение данного ряда?
По величинам стандартных электродных потенциалов можно предположить, насколько ярко выражены те или иные свойства соответствующих металлов:
1) Чем меньше величина потенциала, тем более активным является металл. Так, ряд начинается литием. Величина его потенциала Е°=-3,045 В. Это самое маленькое значение среди всех остальных. И действительно, литий очень активный металл. Он легко окисляется и трудно восстанавливается из своего иона.
2) Все металлы, стоящие в данном ряду левее водорода (т.е. имеющие отрицательное значение потенциала) вытесняют его из разбавленных кислот (кислот, подобных соляной, серной).

3) Каждый предыдущий металл ряда вытесняет все последующие из растворов их солей. Например:

Этот вывод можно подтвердить расчетами:

А вот такая реакция не возможна:

И это также легко подтверждается вычислением Э.Д.С. предполагаемого окислительно-восстановительного процесса:

Полученное отрицательное значение Э.Д.С. говорит о том, что переход электронов с меди на железо не возможен.
4) Если построить из металлов данного ряда гальванический элемент, то его Э.Д.С. будет тем больше, чем больше разность стандартных электродных потенциалов этих металлов.
Например, какой окислительно-восстановительный процесс будет идти эффективнее: вытеснение железа из его соли магнием или цинком? Для ответа на этот вопрос необходимо посчитать Э.Д.С. обоих процессов и сравнить полученные значения:

В обоих случаях Э.Д.С. положительна. Значит, процессы возможны. Однако, взаимодействие сульфата железа (II) с магнием более эффективно, чем с цинком почти в 6 раз.

Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Разберем еще несколько примеров, в которых применяется формула, по которой определяется Э.Д.С. гальванического элемента.
Задача 1. Рассчитайте, будет ли протекать реакция при погружении пластинки железа в 1М раствор сульфата никеля.
Решение:

Так как значение Э.Д.С. предполагаемой окислительно-восстановительной реакции положительное, то такая реакция возможна.
Задача 2. Рассчитайте Э.Д.С., укажите направление движения электронов в имеющейся комбинации электродов:

Решение:

Окисляется свинцовый Pb анод, его электроны будут переходить на серебряный Ag катод.
Задача 3. Подтвердите расчетом, будет ли металлический никель растворяться: а) в 2М растворе серной кислоты; б) в растворе сульфата калия с той же активностью ионов.
Решение:

Задача 4. Определите возможность протекания в водном растворе реакции между хлором и хлоридом железа (II).
Решение:

Задача 5. Вычислите стандартную Э.Д.С. гальванического элемента, в котором протекает реакция:

Решение:

Важный вывод из этой задачи:
значение Э.Д.С. гальванического элемента зависит от концентраций участников окислительно-восстановительного процесса, но не зависит от их количеств.
Количество вещества йода, которое мы умножили в окислительной полуреакции на три для соблюдения электронного баланса, не имеет значения, и поэтому величину стандартного электродного потенциала этой полуреакции на три умножать не нужно. Так же поступают во всех подобных случаях.
Таким образом, ЭДС гальванического элемента определяется по формуле, учитывающей значения стандартных электродных потенциалов. Она позволяет определить эффективность окислительно-восстановительного процесса, как в гальваническом элементе, так и при взаимодействии металла с раствором соли другого металла.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Калькулятор ЭДС гальванического элемента — это простой инструмент, который предоставляет вам значение электродвижущей силы (EMF) для любой гальванической ячейки с заданным потенциалом электродов. Если вы немного запутались со всеми этими терминами, не волнуйтесь!
В статье ниже вы найдете краткое описание того, что такое ЭДС, как рассчитать ЭДС и примеры источников электродвижущей силы. Более того, мы подготовили объяснение окислительно-восстановительной реакции и гальванического элемента. Краткое пошаговое руководство демонстрирует использование калькулятора.
Что такое ЭДС?
ЭДС — это сокращение от электродвижущей силы. По определению, ЭДС — это сила или электрическое давление, которое генерирует ток в цепи. Единицы измерения ЭДС в вольтах [В].
Чтобы лучше понять это определение, рассмотрим типичную гальваническую ячейку, состоящую из двух электродов. Электродвижущая сила — это разность потенциалов между ними.
Кроме того, электродвижущая сила гальванического элемента определяет способность электрохимического элемента вызывать поток электронов через электрическую цепь.
Уравнение ЭДС
Электродвижущая сила электрохимической ячейки может быть рассчитана с использованием уравнения:
EMFcell [V] = Ecathode [V] — Eanode [V]
где Ecathode — это потенциал катода (в вольтах), а Eanode — это потенциал анода (в вольтах). Помните, что в ячейке потенциал катода выше, чем потенциал анода.
Электропотенциал анода и катода
Если вы хотите найти потенциал металлического электрода, один из способов — проверить гальванический ряд и найти конкретный металл в таблице. Второй способ — рассчитать его, используя уравнение Нерста, также известное как уравнение потенциала ячейки. Эта формула позволяет рассчитать восстановительный потенциал полуклеточной или полной клеточной реакции.
Как рассчитать ЭДС?
Взгляните на пример расчета ЭДС ниже.
Давайте рассмотрим ячейку Даниэля — простую электрохимическую ячейку, изобретенную в 1836 году Джоном Фредериком Даниэлем (британский химик и метеоролог). В этой ячейке медь погружается в раствор сульфата меди (II), а цинк — в раствор сульфата цинка.
Схема ячейки: (-) Zn | Zn2 + || Cu2 + | Cu (+)
Проверьте потенциал металла: электродный потенциал цинка составляет -0,76 В, а меди — +0,34 В ⇒ из-за более низкого потенциала цинк является анодом, а медь — катодом. Введите эти значения в наш калькулятор.
Рассчитайте значение ЭДС электрохимической ячейки, используя уравнение:
EMFcell = +0,34 В — (-0,76 В) = 1,10 В
Электродвижущая сила ячейки Даниэля равна 1,10 вольт.
Источники электродвижущей силы
Ниже вы можете найти несколько примеров источников ЭМП:
- батареи
- генераторы переменного тока
- гальванические элементы
- солнечные батареи
- топливные элементы
- термопары
- некоторые живые организмы (например, электрический угорь)
Каждый из перечисленных выше источников ЭДС содержит источник энергии, который вызывает поток электрических зарядов. Этими источниками могут быть химические процессы (в батареях, топливе и гальванических элементах), механические силы (в генераторах), электромагнитное излучение, излучаемое Солнцем (в солнечных элементах) и разность температур (в термопарах).
Типы электрохимических ячеек
Электрохимическая ячейка является одним из видов источников энергии. Его можно создать, поместив металлические электроды в электролит, где химическая реакция генерирует или использует электрический ток.
Электрохимические элементы, которые генерируют электрический ток, называются гальваническими элементами (названными в честь их изобретателя, итальянского физика Алессандро Вольта) или гальваническими элементами (названными в честь итальянского физика и врача Луиджи Гальвани).
Обычные батареи состоят из одного или нескольких таких элементов. В других электрохимических элементах электрический ток, подаваемый извне, используется для запуска химической реакции (которая не должна происходить самопроизвольно).
Окислительно-восстановительная реакция
Процессы восстановления и окисления происходят только вместе (невозможно, чтобы эти реакции происходили отдельно). Вот почему окислительно-восстановительные реакции могут быть описаны как две полуреакции, одна представляет процесс окисления, а другая — процесс восстановления. Давайте посмотрим на это на примере ячейки Даниэля.
В ячейке Даниэля медь погружается в раствор сульфата меди (II), а цинк — в раствор сульфата цинка. В этой ячейке цинк действует как анод (из-за более низкого электрического потенциала), а медь действует как катод (из-за более высокого электропотенциала):
E⁰ цинкового электрода = -0,76 В
E⁰ медного электрода = +0,34 В
Общая химическая реакция клетки Даниэля: Zn (s) + Cu2⁺ (aq) → Zn²⁺ (aq) + Cu (s)
Окисление (на аноде): Zn (s) → Zn²⁺ (aq) + 2e⁻
Восстановление (на катоде): Cu2⁺ (aq) + 2e⁻ → Cu (s)
Количество электронов, потерянных восстановителем, равно числу электронов, полученных окислителем (для любой окислительно-восстановительной реакции).
