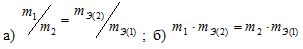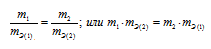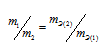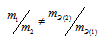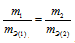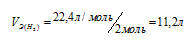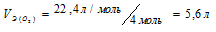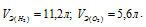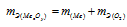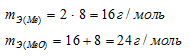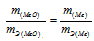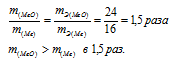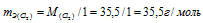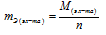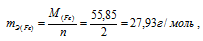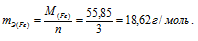Светило науки – 217 ответов – 0 раз оказано помощи
Ответ:
54 (г/моль).
Объяснение:
Молярная масса эквивалента вещества равна произведению фактора эквивалентности fэк(В-ва) на молярную массу вещества М(В-ва)
Мэкв(В-ва) = fэкв(В-ва)* М(В-ва).
Эквивалентом называют реальную или условную частицу вещества, соответствующую в реакциях обмена одному атому или катиону водорода , а в окислительно-восстановительных реакциях – одному электрону.
Фактор эквивалентности – это число, показывающее, какую часть от реальной частицы (молекулы, атома, иона и т.д.) вещества составляет эквивалент этого вещества.
Молярная масса хлорида железа (III) равна:
M(FeCl3) = 162 (г/моль).
Фактор эквивалентности его равен:
fэкв = 1/3.
Тогда молярная масса эквивалента составит:
Mэкв(FeCl3) = fэкв(FeCl3)*M(FeCl3) = 162 • (1/3) = 54 (г/моль).
а) С+2О-2
– оксид углерода (II),
Н+12S+4O-23
–
сернистая
кислота,
К+1Н+1S-2
–
гидросульфид
калия,
Fe+3O-2H+1(N+5O-23)2
–
нитрат
гидроксожелеза (III).
хлорид гидроксоцинка
– ZnOHCl;
дигидроортофосфат
алюминия – Al(H2PO4)3.
1. Трехвалентный элемент образует оксид, содержащий 68,90 % мас. Кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.
|
Дано:
В |
Решение Чтобы
вычислить атома Мэ |
|
Мэк(Э) Э |
где Мэк(Э)·–
молярная масса эквивалента элемента;
В – валентность
элемента.
По закону
эквивалентов nэк(Э)
= nэк(О),
т.е.
,
откуда
Мэк(Э)
=
.
Мэк(О)
= 8 г/моль.
mокс
= mэ
+;
= 68,9 г.
mэ
= 100 –
= 100 – 68,9 = 31,1 г.
Мэк(Э)
=
= 3,61 г/моль
Мэк(Э)
=
,
Мэ
= Мэк(Э)
∙ В = 3,61∙3 = 10,83 г/моль, что соответствует
молекулярной массе атома бора.
Ответ: Мэк(Э)
= 3,61 г/моль; элемент – В.
2. На восстановление 7,2 г оксида потребовалось 2,24 л водорода, измеренного при н.У. Рассчитать молярные массы эквивалентов оксида и металла.
|
Дано: mокс.
|
Решение
По закону
nэк(окс)
|
|
Мэк(окс.) Мэк(Ме) |
где
= 11,2 л/моль.
Мэк(окс)
=
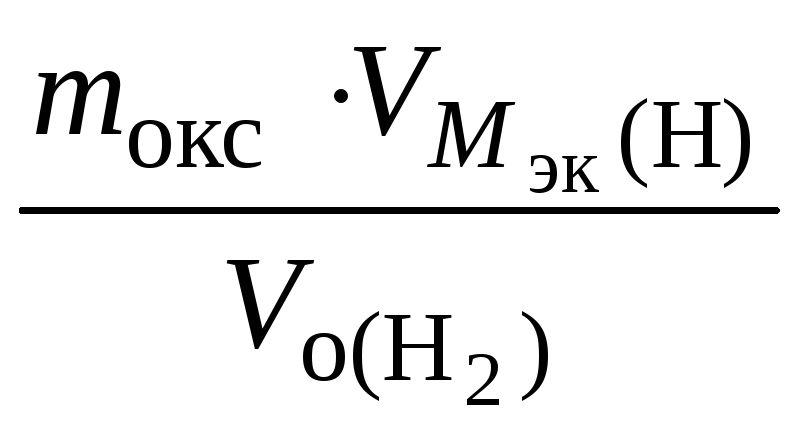
=
36 г/моль;
Мэк(окс)
= Мэк(Ме)
+ Мэк(О);
Мэк(Ме)
= Мэк(окс)
– Мэк(О)
= 36 – 8 = 28 г/моль.
Ответ: Мэк(окс)
= 36 г/моль;
Мэк(Ме)
= 28 г/моль.
3. Хлорид некоторого
металла (MeClх)
массой 0,493 г обработали избытком раствора
AgNO3.
При этом образовалось 0,86 г AgCl.
Вычислить молярную массу эквивалента
металла.
|
Дано:
|
Решение
По закону
|
|
Mэк(Me) |
=
143,5
г/моль.
где – молярная массаAgCl;
В
– валентность серебра;
n
– число атомов серебра в молекуле соли.
=
,
откуда
=
= 82,3 г/моль.
=
+
;
г/моль.
=
–
,
= 82,3 –35,5 = 46,8
г/моль.
Ответ:
= 46,8 г/моль.
3. СПОСОБЫ ВЫРАЖЕНИЯ
СОСТАВА РАСТВОРОВ
УРОВЕНЬ В
1. Сколько
граммов хлорида железа (III)
содержится в 500 см3
0,1 н
раствора?
|
Дано: сэк(FeCl3) Vр-ра |
Решение Молярную |
|
|
.
откуда
,
где
– молярная
масса эквивалента хлорида железа (III).
– молярная масса хлорида железа (III),
г/моль:
= 56 + 3∙35,5 = 162,5 г/моль,
В = 3 – валентность
железа,
n
= 1 – число
атомов железа в молекуле соли.
Тогда
где
=
54,17
г/моль;
10-3
– пересчет кубических сантиметров в
литры.
Ответ:
2. Сколько граммов
хлорида магния потребуется для
приготовления 800 см3
25 %-го
раствора плотностью 1,2 г/см3?
|
Дано:
|
Решение Массовая
откуда |
|
|
mр-ра
= Vр-ра·ρр-ра
= 800·1,2 = 960 г.
Откуда
Ответ:
3. Определить
молярную концентрацию вещества в
растворе, содержащем 40 г сульфата меди
(II)
в 800 см3
раствора.
|
Дано:
Vр-ра
|
Решение
Молярную
|
|
|
где молярная масса сульфата меди (II),
г/моль.
=
64 + 32 + 64 = 160 г/моль.
Тогда
где 10-3
– пересчет
кубических сантиметров в литры.
Ответ:
=
0,31 моль/л.
4. Определить
моляльность вещества в растворе, если
в 100 г
раствора содержится 5,3 г карбоната
натрия.
|
Дано:
mр-ра |
Решение
Моляльность
|
|
|
Массу воды
определяем из условия
.
Тогда
Следовательно,
,
где
1000 – коэффициент пересчета граммов в
килограммы.
Ответ:
моль/кг.
5. Определить титр
раствора вещества, если в 200 см3
раствора содержится 0,1 моль гидроксида
калия.
|
Дано:
Vр-ра |
Решение
Титр раствора
|
|
|
Согласно условию
задачи
= 0,1 моль,
откуда mKOH
= 0,1·MKOH
= 0,1·56 = 5,6 г,
где МКОН
– молярная
масса гидроксида калия:
МКОН
= 39 + 16 + 1 = 56 г/моль.
Следовательно,
.
Ответ:
=
0,028 г/см3.
5.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
И ХИМИЧЕСКОЕ
РАВНОВЕСИЕ
УРОВЕНЬ В
-
Реакция
между веществами А и В описывается
уравнением
А(г)
+ 2В(г)
= 2С(г).
Константа
скорости этой реакции равна 0,1. Начальные
концентрации реагирующих веществ со(А)
= 0,4 моль/л, со(В)
= 0,8 моль/л.
Вычислить начальную скорость реакции
и определить во сколько раз она изменится,
если концентрация вещества А уменьшится
на 0,1 моль/л.
|
Дано: Уравнение К с с с на |
Решение В
= 0,1∙0,4·0,82 |
|
Vнач |
Исходные вещества
реагируют между собой согласно
стехиометрическим коэффициентам в
уравнении реакции.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- Главная
- Химия
- Определить экви…
-
Предмет:
Химия
-
Автор:
bluegriffin
-
Создано:
4 года назад
Ответы 1
т.к. Fe не имеет постоянной степени окисления, но мы знаем, что степень окисления этого элемента всегда положительна (в таблице Менделеева степень окисления Fe всегда положительна), будем отталкиваться от Cl3 (в этом случае степень окисления = -1 (умноженное на 3 – количество атомов). Значит степень окисления Fe будет равняться трем. Молярная масса, если быть точным составляет 162.204 г/моль. Это значение надо делить на 3(степень окисления Fe), умноженное на 1(число атомов Fe), получается 54,068 г/моль, (FeCl3)
-
Автор:
yasminevgiu
-
Оценить ответ:
0
Знаешь ответ? Добавь его сюда!
Последние вопросы
-
Музыка5 часов назад
9) Распределите определения по жанрам: кантата, марш, концерт, этюд, песня, опера, балет, прелюдия, вокализ, романс, оратория, баркарола, оперетта
1.ВОКАЛЬНЫЕ ЖАНРЫ:
2.ИНСТРУМЕНТАЛЬНЫЕ ЖАНРЫ:
3.СИНТЕТИЧЕСКИЕ ЖАНРЫ:
Заранее спасибо если поможете
-
Физика8 часов назад
Оценить число молекул воздуха в земной атмосфере, если давление воздуха вблизи поверхности Земли на уровне моря равно 760 мм рт.ст., молярная масса воздуха 29 г/моль. Радиус Земли 6400 км. Ускорение свободного падения считать постоянным и равным 9,8 м/с2 .
-
Математика9 часов назад
умоляю помогите
-
Математика11 часов назад
Помогите пожалуйста от этой оценки зависит годовая оценка
-
Информатика19 часов назад
3 вариант
-
Информатика19 часов назад
Помогите
-
Физика22 часов назад
Реохорд. какая электрическая величина меняется в цепи при изменении длины включенного реохорда
-
Математика23 часов назад
Представить в виде степенного ряда решение дифференциального уравнения, удовлетворяющее данным начальным условиям (для уравнения пер- вого порядка найти четыре ненулевых члена ряда, для уравнения второго по- рядка – пять членов).
y”=ye^x+1 y(0)=2; y'(0)=1.
-
Математика23 часов назад
1. Случайная величина распределена равномерно на отрезке [−2; 5]. Найти математическое ожидание и дисперсию. Что вероятнее: в результате ис- пытания случайная величина окажется в интервале (2,5; 3) или вне его?
-
Математика23 часов назад
1. В цехе работают 8 мужчин и 12 женщин. По табельным номерам отбира- ют 6 человек. Какова вероятность того, что среди них будут только 2 женщины?
-
Физика23 часов назад
определи фокусное расстояние лупы с точностью до сантиметра если её оптическая сила равна d 5.3 дптр.
-
Алгебра1 день назад
-6x^2+x+2>0.Решение квадратных неравенств
-
Физика1 день назад
2.3. Блок укреплен на вершине двух наклонных плоскостей, составляющих с горизонтом углы а = 30° и (3 = 45°. Гири равной массы
(т
х = т2 = 2 кг) соединены нитью, перекинутой через блок. Считая нить и блок невесомыми, принимая коэффициенты трения гирь о наклонные плоскости равными f1= f2= =0,1 и пренебрегая трением в блоке, определите: 1) ускорение, с которым движутся гири; 2) силу натяжения нити. [1) 0,24 м/с2; 2) 12 Н]
-
История1 день назад
ПЖ помогите КТО ЭТО Я НЕЗНАЮ
-
Алгебра1 день назад
Негр и мексиканец падают с небоскрёба. Кто упадёт первым?
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Закон зквивалентов. Определение эквивалентной массы вещества
Задача № 19.
От чего зависит эквивалент химического элемента: а) от валентности элемента; б) всегда является постоянной величиной?
Решение:
Эквивалентом химического элемента называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает тоже количество атомов водорода в химических реакциях. Эквивалентной массой элемента называется масса одного эквивалента элемента. Эквивалент химического элемента (эквивалентная масса элемента) можно вычислить по составу соединения данного элемента с любым другим, эквивалент которого известен. Так, например, в оксиде меди(I) Cu2O и в оксиде меди(II) CuO эквивалентные массы меди будут различны: в CuO эквивалент меди рассчитывается из того, что 1моль кислорода соединяется с одним молем меди, а в соединении Cu2O – один моль кислорода соединяется с двумя молями меди. Отсюда, учитывая, что эквивалентная масса кислорода известна (8г/моль) и, зная, что валентность кислорода равна двум, можно рассчитать эквивалентную массу меди её валентность в оксидах CuO и Cu2O. Значит, в CuO валентность меди равна 2, а в Cu2O – 1. Тогда в CuO эквивалентная масса меди равна:
mЭ(Cu) = M/2 = 63,54/2 = 31,77г/моль, а в Cu2O – mЭ(Cu) = M/1 = 63,54/1 = 63,54г/моль
Таким образом, эквивалентная масса элемента зависит от его валентности в данном химическом соединении.
Ответ: а).
Задача № 20.
Какая формула правильно выражает закон эквивалентов:
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Формула
не соответствует пропорциональности, т.е.
Формула
соответствует пропорциональности, т.е.
Таким образом, формула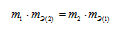
Ответ: б)
Задача № 21.
Фосфор образует два различных по составу хлорида. Эквивалент какого элемента сохраняется в этих соединениях постоянным: а) хлора; б) фосфора?
Решение:
Атом хлора на внешнем электронном слое содержит семь электронов, а атом фосфора – пять. Хлор наиболее электроотрицательный элемент, чем фосфор. Поэтому атом хлора способен оттягивать электронную плотность от атома фосфора на себя. Распределение электронов внешнего энергетического уровня хлора …3s23p5, а атома фосфора …3s23p3 (учитывая правило Хунда, соответственно +17Cl 3s23p2x3p2y3p1z; +15P3s23p1x3p1y3p1z. В одном хлориде фосфор отдаёт три неспаренных p –электрона, а в другом – все пять электронов внешнего энергетического уровня. В случае отдачи трёх электронов фосфор проявляет валентность равную I, тогда mЭ(P) =M(P)/3 = 31/3 = 10,33г/моль. В случае отдачи пяти электронов фосфор проявляет валентность равную V, тогда mЭ(P) =M(P)/5 = 31/5 = 6,2г/моль. Хлор в обоих хлоридах фосфора, присоединяя один электрон проявляет валентность равную I т. е. mЭ(Cl) = M(Cl)/1 = 35,5/ = 35,5г/моль.
Таким образом, эквивалентная масса хлора в обоих соединениях будет иметь одно и тоже значение, а фосфора – два.
Ответ: а).
Задача № 22.
Выбрать правильные значения эквивалентных объемов кислорода и водорода при нормальных условиях: а) 11,2л O2 и 22,4л H2 б) 11,2л O2 и 11,2л H2 в.) 5,6л O2 и 11,2л H2.
Решение:
Эквивалентным объёмом называется объём, занимаемый при данных условиях одним эквивалентом вещества. Значение эквивалентного объёма вещества, находящегося в газообразном состоянии, зная, что в мольном объёме любого газа, состоящего из одноатомных молекул, содержится 1 моль атомов, а состоящего из двухатомных молекул – 2 моля атомов и т.д. Так, в 22,4л водорода содержится 2моля атомов, то
Кислород является двухвалентным элементом, поэтому его молекула будет присоединять или замещать четыре атома водорода т.е.
Ответ:
Задача № 23.
Эквивалентная масса металла равна 12 г/моль. Чему равна эквивалентная масса его оксида: а) 24 г/моль; б) нельзя определить; в) 20 г/моль?
Решение:
Оксид любого металла состоит из атома (атомов) металла, соединённых с атомом (атома-ми) кислорода согласно их валентности. Отсюда, учитывая, что эквивалентная масса оксида равна молярной массе оксида делённой на произведение числа атомов металла и числа его валентности в данном оксиде. Согласно закону эквивалентов эквивалентная масса оксида металла равна сумме эквивалентных масс металла и кислорода:
Учитывая, что 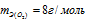
Ответ: а).
Задача № 24.
Эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кислорода. Во сколько раз масса оксида больше массы металла: а) в 1,5 раза; б) в 2 раза; в) в 3 раза?
Решение:
Согласно закону эквивалентов эквивалентная масса оксида металла равна сумме эквивалентных масс металла и кислорода:
Эквивалентная масса кислорода известная величина, она равна 8г/моль. По условию зада-чи эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кислорода. Ис-ходя из этого, рассчитаем эквивалентную массу металла:
Согласно закону эквивалентов, массы оксида металла и металла пропорциональны их эквивалентным массам:
Отношение массы оксида металла к массе металла равно отношению их эквивалентных масс:
Ответ: а).
Задача № 25.
Сера образует хлориды S2Cl2 и SCl2, эквивалентная масса серы в SCl2 равна 16г/моль. Выбрать правильное значение эквивалентной массы серы в S2Cl2: а) 8 г/моль; б) 16 г/моль; в) 32 г/моль.
Решение:
В соединениях S2Cl2 и SCl2 хлор проявляет степень окисления равную -1, т.е. валентность хлора в обоих соединениях равна 1, следовательно
Так как в SCl2 на один атом серы приходится 2 моля хлора, то
mЭ(S) = M(S)/2 = 32/2 = 16г/моль.
то в соединении S2Cl2
mЭ(S) = M(S)/1 = 32/1 = 32г/моль. .
Ответ: в).
Задача № 26.
Одинаков ли эквивалент хрома в соединениях CrCl3 и Cr2(SO4)2: а) да; б) нет?
Решение:
Эквивалент элемента (Э) – это такое количество элемента, которое соединяется с 1 молем атома водорода или замещает то же количество атомов водорода в химических реакциях. Масса одного эквивалента элемента называется его эквивалентной массой (mЭ). Эквиваленты (Э) выражаются в молях, эквивалентные массы (mЭ) в г/моль. Эквивалентная масса элемента равна мольной массе элемента делённой на его валентность:
где М – мольная (атомная) масса элемента; n – валентность или степень окисления элемента. Эквивалент элемента равен 1/n моль, где n – валентность или степень окисления элемента.
Хлор в соединениях CrCl3 и Cr2(SO4)2 имеет степень окисления (-1), значит, его эквивалент равен 1моль. Определим валентность хрома в соединениях CrCl3 и Cr2(SO4)2:
а) CrCl3 Валентность хрома равна III, так как хлор имеет степень окисления (-1), соответственно, хром – (-3);
б) Cr2(SO4)2 Заряд иона SO42- равен (2-). Поскольку в молекуле Cr2(SO4)2 имеется три иона SO42-, то заряд иона хрома составляет (3+). Следовательно, в обоих соединениях CrCl3 и Cr2(SO4)2 хром имеет валентность равную 3, т. е. в этих веществах хром имеет одинаковое значение эквивалента, а именно 1/3 моль.
Ответ: а) да.
Задача № 27.
Одинакова ли эквивалентная масса железа в соединениях FeCl2 и FeCl3: а) да; б) нет?
Решение:
Эквивалент элемента (Э) – это такое количество элемента, которое соединяется с 1 моль атома водорода или замещает то же количество атомов водорода в химических реакциях. Масса одного эквивалента элемента называется его эквивалентной массой (mЭ). Эквиваленты (Э) выражаются в молях, эквивалентные массы (mЭ) в г/моль. Эквивалентная масса элемента равна мольной массе элемента делённой на его валентность:
где М – мольная (атомная) масса элемента; n – валентность или степень окисления эле-мента. Эквивалент элемента равен 1/n моль, где n – валентность или степень окисления элемента.
Хлор в соединениях FeCl2 и FeCl3 имеет степень окисления (-1), а железо, соответственно, (+2) и (+3). Следовательно, эквивалентная масса железа в FeCl2 равна:
<
а в соединении FeCl3 –
Ответ: б) нет.
Задача № 27.
Одинакова ли эквивалентная масса железа в соединениях FeCl2 и FeCl3: а) да; б) нет?
Решение:
Эквивалент элемента (Э) – это такое количество элемента, которое соединяется с 1 моль атома водорода или замещает то же количество атомов водорода в химических реакциях. Масса одного эквивалента элемента называется его эквивалентной массой (mЭ). Эквиваленты (Э) выражаются в молях, эквивалентные массы (mЭ) в г/моль. Эквивалентная масса элемента равна мольной массе элемента делённой на его валентность:
где М – мольная (атомная) масса элемента; n – валентность или степень окисления эле-мента. Эквивалент элемента равен 1/n моль, где n – валентность или степень окисления элемента.
Хлор в соединениях FeCl2 и FeCl3 имеет степень окисления (-1), а железо, соответственно, (+2) и (+3). Следовательно, эквивалентная масса железа в FeCl2 равна:
<
а в соединении FeCl3 –
Ответ: б) нет.
Определить эквивалентную массу FeCl3.
Помогите с решением пожалуйста, у меня 161 не делится на 6 и 8 = ((я не знаю как(.
На этой странице сайта размещен вопрос Определить эквивалентную массу FeCl3? из категории
Химия с правильным ответом на него. Уровень сложности вопроса
соответствует знаниям учеников 5 – 9 классов. Здесь же находятся ответы по
заданному поиску, которые вы найдете с помощью автоматической системы.
Одновременно с ответом на ваш вопрос показаны другие, похожие варианты по
заданной теме. На этой странице можно обсудить все варианты ответов с другими
пользователями сайта и получить от них наиболее полную подсказку.
 ,
,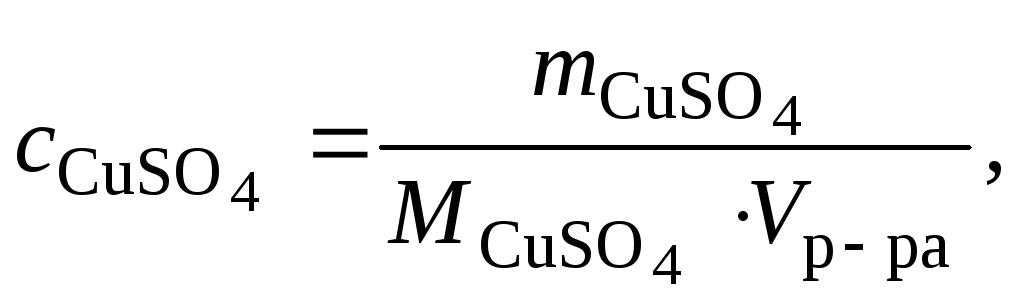 моль/л,
моль/л,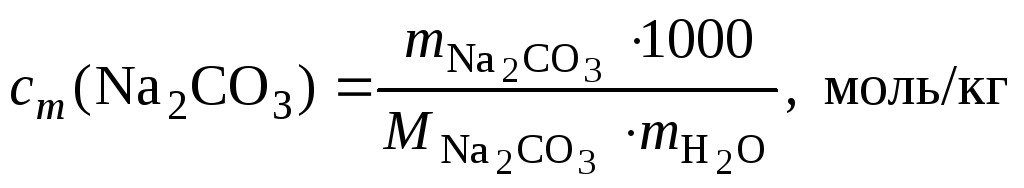 .
.