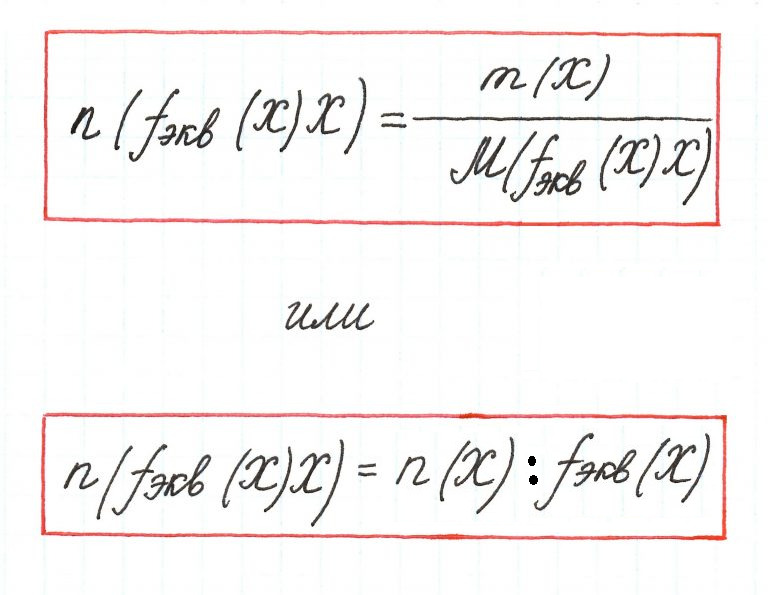Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.
Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:
Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.
В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.
А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.
Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.
Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:
Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:
Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.
Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.
Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:
В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:
И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.
В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:
В другой реакции гидроксида калия и фосфорной кислоты:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:
И в третьем случае:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:
Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:
Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.
Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?
Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?
Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:
Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.
Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:
У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:
Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:
Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:
Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:
Например:
Для оснований:
Например:
Для кислот:
Например:
Для солей:
Например:
Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Как определить эквивалент вещества
Эквивалент вещества – это условная или реальная частица, которая может высвобождать, присоединять или любым другим способом быть эквивалентна катиону водорода, участвующему в ионно-обменных реакциях, или электрону в окислительно-восстановительных реакциях. При решении задач под эквивалентом вещества подразумевают эквивалентную молярную массу вещества.

Вам понадобится
- – молярная масса;
- – валентность;
- – кислотность;
- – основность.
Инструкция
Эквивалентная масса является одной из важнейших характеристик веществ. При решении задач она обозначается как M экв. Определяется молярная масса эквивалента какого-либо соединения, исходя из химической формулы исследуемого вещества и его принадлежности к определенному классу химических соединений.
Для того чтобы успешно находить молярные массы эквивалентов, вам потребуется знать такие показатели, как молярная масса – масса одного моля вещества. Основность кислоты – количество атомов водорода, которое кислота может присоединить. Кислотность основания определяется количеством ионов OH-. Валентность – количество химических связей, которое образует атом с другими элементами в соединении.
Формула нахождения эквивалентной массы вещества зависит от того, к какому классу относится исследуемое соединение. К примеру, для нахождения эквивалента вещества у оксидов, вам будет необходимо разделить молярную массу соединения на число атомов кислорода, предварительно умноженное на два. К примеру, для оксида железа Fe2O3 эквивалентная масса будет равняться 56*2 + 16*3/3*2 = 26,7 г/моль.
Для нахождения молярной массы эквивалента вещества у основания, разделите молярную массу основания на его кислотность. Так, для основания Ca(OH)2 эквивалент будет равняться 40 + (16+2)*2/2 = 37 г/моль.
Чтобы найти эквивалент вещества для кислоты, вам будет необходимо сделать следующее действие: поделите молярную массу кислоты на ее основность. Для нахождения молярной массы эквивалента вещества серной кислоты H2SO4 разделите 1*2 + 32 + 16*4/2 = 49 г/моль.
Наконец, для нахождения эквивалента вещества соли разделите молярную массу вещества на число атомов металла, помноженное на его валентность. К примеру, молярная масса эквивалента вещества соли Al2(SO4)3 = 27*2 + (32 + 16*4)*3/1*2 = 171 г/моль.
Источники:
- определение эквивалента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как определить эквивалент вещества?
Ученик
(45),
закрыт
11 лет назад
NN
Мастер
(1513)
12 лет назад
Эквивалентная масса (молярная масса эквивалента вещества) mэкв также является одной из важнейших характеристик вещества. По определению эквивалент вещества – это такое количество химического вещества, которая реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений. Величина mэкв определяется или экспериментально, или, чаще всего, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений (мы будем рассматривать только неорганические соединения)
mэкв (оксида) = Моксида/(число атомов кислорода·2);
mэкв (основания) = Моснования/кислотность основания;
mэкв (кислоты) = Мкислоты/основность кислоты;
mэкв (соли) = Мсоли/(число атомов металла·валентность металла) .
Можно отметить, что в большинстве случаев кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты.
Например: mэкв (Fe2O3) = М (Fe2O3)/(3·2) = 160/6 = 26,7 г/моль;
mэкв (H2SO4) = M(H2SO4)/2 = 98/2 = 49 г/моль;
mэкв (Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль;
mэкв (Al2(SO4)3) = M(Al2(SO4)3) = 342/2 = 171 г/моль;
Эквивалентные массы веществ используют для количественных расчетов при химических взаимодействиях между веществами. Огромным преимуществом при этом является то, что для этого не нужно использовать уравнение химической реакции (которое во многих случаях написать затруднительно) , нужно только знать, что данные химические вещества взаимодействуют между собой или вещество является продуктом химической реакции.
Для количественных расчетов используется закон эквивалентов: массы реагирующих и образующихся веществ относятся друг к другу, как их эквивалентные массы.
Математическое выражение закона эквивалентов имеет следующий вид:
m1/m2 = mэкв (1)/mэкв (2)(1.2)
где: m 1 и m 2 – массы реагирующих или образующихся веществ,
mэкв (1) и mэкв (2) – эквивалентные массы этих веществ.
Пример: определить массу соды (карбоната натрия) Na2CO3, необходимую для полной нейтрализации 1,96 кг серной кислоты H2SO4.
Решение:
Воспользуемся законом эквивалентов
m(Na2CO3)/m(H2SO4) = mэкв (Na2CO3)/mэкв ( H2SO4)
Определяем эквивалентные массы веществ, исходя из их химических формул:
m (Na2CO3) = 106 /(2·1) = 53 г/моль;
mэкв (H2SO4) = 98/2·1 = 49 г/моль.
Тогда:
Х / 1,96кг = 53 г/моль / 49 г/моль
Х = 2,12 кг.
Ирина Миняшина
Мудрец
(12270)
12 лет назад
Для щёлочи молярная масса поделить на количество ОН, для кислоты – она же на количество Н, для соли – она же делить на произведение кол-ва атомов металла и валентоности этого металла.
ТНТ-ЭКВИВАЛЕНТЫ ОРГАНИЧЕСКИХ ВЕЩЕСТВ IV. . КОММЕРЧЕСКИЙ АСПЕКТ [c.622]
Вычисление грамм-эквивалентов органических веществ затруднительно вследствие того, что не всегда ясно число электронов, которое отдают или присоединяют их молекулы в данном окислительно-вос-становительном процессе. [c.392]
Для нахождения грамм-эквивалента органического вещества в окислительно-восстановительных процессах необходимо писать электронные формулы строения соответствующих органических веществ. [c.507]
Очень важно правильное вычисление эквивалента определяемого компонента. Особенно это относится к эквивалентам органических веществ. Эквивалент любого вещества можно легко найти, применяя закон эквивалентов. Из этого закона ясно, что если известен эквивалент вещества, содержащегося в титрованном растворе, то по нему легко вычислить и эквивалент определяемого компонента. Необходимо лишь знать отношение, в котором находятся числа молекул определяемого компонента и вещества, содержащегося в титрованном растворе при системе реакций, используемых для анализа. [c.476]
Исходя из этих предположений, Жерар предложил разделить на два эквиваленты органических веществ и соответственно исправить их формулы. Жерар принимал, так же, как и Берцелиус, что вода состоит из двух атомов водорода и одного атома кислорода. Поэтому он полагал, что атомный вес кислорода, как и других элементов, входящих в состав органических веществ, должен быть увеличен вдвое, сравнительно с принятым в то время значением. [c.241]
Расчет грамм-эквивалентов органических веществ в окислительно-восстановительных реакциях. Величина грамм-эквивалента вещества, подвергшегося окислению, может быть рассчитана при сопоставлении количества реагирующих веществ. [c.44]
ОЦЕНКА МЕТОДОВ УСТАНОВЛЕНИЯ ЭНЕРГЕТИЧЕСКИХ ЭКВИВАЛЕНТОВ ОРГАНИЧЕСКОГО ВЕЩЕСТВА ПРИРОДНЫХ ВОД И ПОЧВ [c.114]
Поскольку перманганатом калия обычно пользуются для титрования в кислой среде, то и растворы его готовят, исходя из грамм-эквивалента, равного 31,607 г. Для приготовления 1 л 0,1 раствора перманганата требуется растворить 31,607-0,1 =3,1607 г КМпО в 1 л воды. Кристаллический перманганат калия обычно содержит ряд примесей, особенно двуокись марганца. Кроме того, в первые дни после приготовления раствора происходит окисление случайных органических веществ, содержащихся в дистиллированной воде, вследствие чего концентрация раствора перманганата калия постепенно изменяется. Поэтому сначала готовят раствор перманганата калия приблизительно требуемой концентрации. [c.130]
Емкость экстрагента, измеряемая в миллиграмм-эквивалентах извлекаемого вещества, приходящегося на единицу объема или массы органической фазы, должна быть достаточно большой, так как в противном случае применение экстрагента, даже обладающего высокой селективностью, может оказаться неэкономичным из-за необходимости иметь в системе большое количество экстрагента. [c.167]
Активная щелочь черного щелока включает массовые доли гидроксида и всего сульфида натрия и определяется методом потенциометрического титрования с применением стеклянного и каломельного электродов. К раствору щелока, освобожденному от карбоната и органических веществ, добавляют формальдегид и титруют до pH 3,5 соляной кислотой, которую приливают порциями. После прибавления каждой новой порции отмечают количество прибавленной кислоты и показания рН-метра. По окончании строят кривую потенциометрического титрования и определяют расход соляной кислоты на титрование щелока до pH 8,3. Из этого значения вычитают кислотный эквивалент формальдегида, который определяют в отдельной пробе титрованием раствора формальдегида соляной кислотой в присутствии фенолфталеина. Разность представляет количество кислоты, пошедшее на титрование активной щелочи. [c.185]
Ш. Жерар предложил принять половинные эквиваленты для органических веществ и соответственно исправить их формулы, а также уточнить атомные массы углерода, кислорода и серы (при Н = 1 он принял 0 = 16 и S = 32). Ш. Жерар исправил также эквиваленты серебра, свинца и щелочных металлов, но для щелочноземельных и некоторых других металлов ой оставил вдвое меньшие эквиваленты. Такая непоследовательность усугублялась и тем обстоятельством, что Ш. Жерар считал равнозначными термины атом , эквивалент и объем . Он предпочитал терминам атомный вес и молекулярный вес термины эквивалент или пропорциональное число . [c.125]
В табл. 2 приведены данные, показывающие, сколько окислительных эквивалентов перманганата расходуется на 1 моль того или иного органического вещества при применении этого метода. В таблице приведены также вычисленные значения, рассчитанные в предположении, что органическое вещество окис- [c.41]
Контрольную пробу дистиллированной воды анализируют на ХПК таким же образом, как и пробу сточной воды. Цель анализа контрольной пробы — исправить ошибку, которая может возникнуть вследствие присутствия посторонних органических веществ в реагентах. Значение ХПК вычисляют по формуле (2.31) разницу между количеством стандартного раствора, расходуемого для контрольной и испытуемой проб, делят на объем последней и умножают на нормальность стандартного раствора. Множитель 8000 вводят для представления результатов в мг кислорода на 1 л, так как 1 л равен 1000 мл, а эквивалент кислорода равен 8 [c.45]
Ш. Ф. Жерар опубликовал работу Опыт химической классификации органических веществ , в которой а) не будучи знаком с исследованиями А. Авогадро, развил сходные идеи и методы б) предложил применять величины молекулярного объема веществ, находящихся в газообразном состоянии, в качестве основного критерия установления формул химических соединений, в) ввел новую систему эквивалентов (И=1, 0=16, С=12, 5 = 32, С1=35,5, N=14). [c.641]
Биохимическая потребность в кислороде представляет собой кислородный эквивалент степени загрязненности сточной воды органическими веществами. [c.141]
Кроме недооценки значения причин, вызывающих химические реакции, что можно объяснить сильной компрометацией электрохимической теории в органической химии середины XIX в., при рассмотрении цикла работ Бертло и Пеан де Сен-Жиля нетрудно заметить наличие субъективизма авторов в подходе к вопросу о влиянии строения реагентов на протекание этерификации. Стремление опровергнуть тезис Бертолле о сильном влиянии индивидуального сродства в реакции привело к тому, что Бертло и Пеан де Сен-Жиль, зачастую игнорируя расхождения в найденных величинах пределов реакций (табл. 1 и рис. 1), сделали свой основной вывод …предел реакции почти исключительно зависит от соотношений эквивалентов… различных веществ, но почти не зависит от их специфической природы (подчеркнуто мной.— В. К.) [56, нем. перев., стр. 225—226]. [c.17]
В табл. 2 (стр. 40) приведены данные, показывающие, сколько окислительных эквивалентов перманганата расходуется на 1 моль того или иного органического вещества при применении этого метода, В таблице приведены также вычисленные значения, рассчитанные в предположении, что органическое вещество окисляется полностью до углекислого газа и воды (если нет специального указания на иной путь окисления). [c.39]
В чем сущность определения нитрогруппы органических веществ методом восстановлепия с последующим диазотированием Вычислите грамм-эквивалент нитробензола при определении его данным методом. [c.155]
Вычисление грамм-эквивалента для органических веществ представляет некоторые затруднения вследствие того, что не всегда ясно число электронов, которое отдает или присоединяет молекула органического соединения в данном окислительно-восстановительном процессе. [c.507]
Зная число эквивалентов кислорода, поглощенных 1 см раствора при радиационном окислении органических веществ, и выход убыли кислорода, можно рассчитать дозу, необходимую для окисления. Она букет равна [c.126]
Каждый моль воды выделяет 2 эквивалента титруемой кислоты каждый моль спирта выделяет 1 эквивалент кислоты. Это различие дает возможность определять в органических веществах отдельно воду и отдельно спирты. [c.264]
Биологические пруды (осветлители) используются для слабо концентрированных сточных вод, содержащих легко разлагаемые бактериями органические вещества. Они применяются также в качестве вторичных осветлителей для химически обработанных или неполностью биологически очищенных сточных вод. Размеры их должны быть подобраны таким образом, чтобы сточные воды в них ни в какое время не подвергались процессу гниения. Эти размеры рассчитываются на основании биохимической потребности кислорода, покрытие которого должно происходить за счет воздуха, а иногда и за счет разбавления богатыми кислородом водами. Если эти естественные пополнения кислорода оказываются недостаточными, то его недостаток устраняют добавкой нитратов. В основу расчета можно класть эквивалент населенности, причем на каждого жителя нужно считать 20 площади пруда. Для того чтобы ассимиляция под влиянием света могла полностью протекать, необходимо, чтобы глубина пруда не превышала 1,20 ж. [c.120]
В своем докладе Жерар обратил внимание на тот факт, что вода и углекислота, выделяемая при взаимодействии многих органических веществ, образуются всегда в количестве двух (или кратного двум числа) эквивалентов. Так, вместо одного эквивалента воды — НгО обычно выделяется Н4О2, а вместо СО2 — соответственно С2О4. Установив этот факт экспериментально, Жерар пришел к выводу, что он может быть объяснен либо ошибкой в принятых величинах эквивалентов органических веществ, либо ошибками в определениях эквивалентов воды и углекислоты и, наконец, что наиболее вероятно, в результате принятия ошибочных эквивалентов углерода и кислорода. [c.241]
В своей второй статье 117, т. 8, стр. 238—245], опубликованной в июне 1843 г., Жерар дает обоснованное и развернутое изложение своей системы в новом виде, т. е. исходя из двухобъемных формул. В начале статьи он указывает, что иэ двух возможных выводов, вытекавших из его исследований 1) удвоить формулы неорганических соединений, или 2) уменьшить вдвое формулы органических соединений, он считает теперь более правильным второй вывод. Далее он указывает, что основной причиной, приведшей к удвоению формул органических соединений, является дуалистический подход к составу солей органических кислот, в которых оки”слам металлов и, в частности, окислу серебра приписывалась формула КО Если бы рассматривали атомы и эквиваленты в качестве синонимов и если бы не старались (искусственно.- М. Ф.) изображать окислы в формулах органических солей, то они бы не стали удвоенными на самом деле, если бы считали формулу воды и, формулу окислов металлов К О, а не НО, то наиболее естественный путь, по которому надо было следовать, например, в случае уксусной кислоты — это счи тать в качестве эквивалента органического вещества то количество соли, которое содержит один эквивалент металла (половину — М. Ф.) [c.229]
После окисления избыток бихромата определяется титрованным раствором соли Мора при устранении мешающего влияния неорганических восстановленных соединений бихроматная окисляемость дает почти полное представление о содержании органического вещества в -исследуемой воде. Если имеются данные по со- держанию в исследуемой воде валового органического углерода, то по отношению кислорода бихроматной окисляемости к органическому углероду можно судить о кислородном эквиваленте органического вещества и, в частности, об его юкисленности или воостановленности (при сравнении с кислородным эквивалентом углеводов). По величине отношения перманганатной окисляемости к бихроматной можно получить примерную качественную оценку природы о рганического вещества. В случае преобладания окрашенных гумусовых соединений величина этого отношения 40% и при наличии значительного количества нестойкого органического вещества это отношение< 40%. [c.70]
Так, при определении карбоксильной группы 5 мл 0,01 н. раствора щелочи соответствуют при нейтрализации 3,0 мг СН3СООН (м. р. 60,05) соответствующее количество стеариновой кислоты (м. в. 284,47) равно уже 14,2 мг. При определении гидроксильной группы на 9,3 мг додеканола (м. в. 186,33) израсходуется 5 мл титрованного раствора уксусного ангидрида, а на равную массу сорбита (м. в. 182,17) пойдет уже 30 мл того же раствора. Поэтому гораздо рациональнее судить о необходимом количестве исследуемого образца по эквивалентной, а не по абсолютной массе. Поскольку грамм-эквивалент органического вещества слишком велик для химического анализа, в качестве аналитической единицы был принят2 миллиграмм-эквивалент мг-экв). [c.35]
В результате Жерар иришел к следующему выводу Эти аномалии можно легко устранить, если выразить эквиваленты органических веществ двумя объемами пара, причем следует поэтому основываться на формулах неорганической химии, в которых кислород равен 100. Это преобразование следует предпочесть тому, которое я предложил сначала и которое состояло в том, чтобы удвоить большинство неорганических формул, принимая эквиваленты С4О4 и Н4О2, выведенные из органических веществ [29, стр. 7]. [c.122]
Для оценки способности сульфитного щелока поглощать кислород применяются два показателя. Расход сильного окислителя (бихромата калия) на окисление всех органических веществ, выраженный в эквиваленте кислорода (в мг О2 на 1 л щелока), называется химическим потреблением кислорода (ХПК). Расход кислорода на окисление легкоокисляемых органических веществ в относительно мягких условиях различными развивающимися в воде микроорганизмами, потребляющими для своей жизнедеятельности растворенный в воде молекулярный кислород, называется биохимическим потреблением кислорода (БПК). Оно выражается в мг О2 на 1л щелока. Определяя концентрацию О2 в испытуемой пробе до и после биохимического окисления, находят количество израсходованного кислорода, т. е. БПК, при соответствующем времени инкубации, например 5 или 20 сут, которое пишут как индекс (БПК5 и БПК20). [c.332]
Так, 23 г (0,17 моля) цикло-олефяна постепенно прибавляли к раствору, содержавшему 27 г (0,17 моля) перманганата калия к 0,35 моля едкого кали. Смесь кипятили с обратным холодильником до исчезновения органического вещества. После обычной обработки получили чистую перфторянтарную кислоту с выходом в 70%. Эквивалент нейтрализации равен 94,8 (вычислено 95). [c.261]
В обстановке такой путаницы Ш. Жерар выступил в Парижской академии с сообщением Исследование о химической классификации органических веществ . В этом докладе был поставлен вопрос о величине эквивалентов водорода, углерода и кислорода. Он указал на тот факт, что вода и углекислый газ, выделяемые при органических реакциях, образуются всегда в количестве двух и вообще четного, числа эквивалентов. Так, вместо Н2О выделяется обычно Н4О2 и т. д. Согласно Ш. Же-рару, это объясняется либо ошибками в величине эквивалентов воды и углекислого газа, либа, что наиболее вероятно, ошибками в принятых эквивалентах углерода и кислорода. [c.125]
О. Лоран критиковал классификацию Ш. Жерара. Он советовал ему придерживаться гомологии и теории типов. Критике подвергся и объемный принцип сравнения органических, веществ. Очевидно мысль о связи между атомами и объемами занимала О. Лорана и раньше. В начале 1845 г. он предложил при изображении химических реакций уравнениями пользоваться обозначениями половинных объемов эквивалентов простых тел (например, V2H, V2 I, /гЗНО и т. д.). В сентябре 1845 г. он пришел к выводу о существовании молекул простых тел. Водород, хлор, азот, металлы, по его мнению, имеют двухатомные молекулы. [c.128]
Помимо молекулярной формулы вещества одной из наиболее полезных величин при определении структуры органических веществ является молекулярная масса. По величине молекулярной массы вещества во многих случаях можно сделать вполне квалифицированные заключения о его молекулярной формуле. Классическим способом определения молекулярной массы в течение длительного времени был метод Раста (понижение температуры замерзания растворов). Однако в настоящем издании описание Метода Раста опущено, так как этот метод не дает точных результатов для довольно широкого круга органических соединений. Для очень большого числа органических веществ удобно получать молекулярные массы с помощью метода масс-спектрометрии (разд. 3.5.2). Однако этот метод может оказаться доступным да-, леко не во всех учебных лабораториях. Простым методом, позволяющим получить сведения о молекулярной массе веществ, является осмометрия (разд. 3.5.1). Однако следует опасаться получения ошибочных слишком высоких значений молекулярной массы вследствие склонности определяемого вещества к образованию молекулярных агрегатов. Молекулярные массы или величины, находящиеся с ними в простых кратных отношениях, можно определить на основе эквивалентов нейтрализации или чисел омыления. Ввиду того что эти показатели связаны с наличием специфических функциональных групп (кислотных или аминогрупп и сложноэфирных групп соответственно), их определение описано в гл. 6. Для некоторых классов органических соединений применение масс-спектрального анализа затруднительно, и поэтому более целесообразно применять другие методы определения молекулярной массы. [c.31]
Основное направление научных работ — изучение состава органических соединений. Под влиянием Либиха занимался (с 1835) исследованием органических соединений. Впервые получил (1835) ви-нилхлорид присоединением хлористого водорода к ацетилену, синтезировал (1838) поливинилиден-хлорид. Открыл (1838) явление фотохимической полимеризации. Определил (1838) элементный состав хинина и цинхонина. Исследовал (1839) тиоэфиры и получил хлорированные метаны от моно-до тетрахлорметана. Изучал (1836—1837) действие серного ангидрида на органические вещества, Разработал (1840) способ получения меркаптанов действием гидросульфита калия на алкилгалогениды в спиртовом растворе. Провел точное определение теплоемкостей, теплового расширения и теплот испарения жидкостей и твердых тел. Наиболее точно для своего времени определил механический эквивалент теплоты составил таблицы упругости паров. Установил (1846) образование аммиака при действии электрической искры на смесь азота и водорода. Сконструировал ряд приборов воздушный термометр, пирометр, гигрометр. Занимался усовершенствованием газового освещения в Париже, Автор учебника Нача.ть-ный курс химии (1847—1849). [c.424]
Зеленые ткани растений своей окраской обязаны фотосинтетическому пигменту хлорофиллу, который в высоких концентрациях содержится в хлоропла-стах. Поглощение света хлорофиллом запускает в хлоропластах процессы переноса электронов, которые сопряжены с переносом протонов через мембраны тилакоидов и, как следствие, с запасанием энергии в биологически полезной форме (в виде молекул АТР) и восстановительных эквивалентов (в виде NADPH). Полученные таким путем АТР и ШОРН в свою очередь используются хлоропластами для превращения СО2 в сахара (см. гл. 9). При этом синтетическая активность хлоропластов такова, что позволяет фотосинтезирующим тканям экспортировать большие количества органических веществ во все остальные части растения. Эти вещества в основном представлены дисахаридом сахарозой, поэтому жидкость, заполняющая ситовидные трубки (флоэмный сок) содержит обычно от 10 до 25% сахарозы [c.178]
Когда органическое вещество обладает таким составом, что его элементы не могут удовлетворять указанному закону, 2, 3 или больше эквивалентов этого вещества объединяются, образуя С4О4, Н4О2 или КаНв или же кратное этих количеств, а остальные элементы продолжают оставаться соединенными. [c.235]
Гексозы после ряда предварительных этапов расщепляются пополам . Продукты расщепления превращаются в пировиноградную кислоту (пируват), которая занимает ключевое положение в промежуточном метаболизме, так как служит исходным соединением во многих процессах синтеза и распада. В результате декарбоксилирования пирувата образуются С 2-соединения, которые связываются сначала с подходящей акцепторной молекулой (оксалоацетатом), а затем в цикле трикарбоновых кислот, называемом также циклом лимонной кислоты, постепенно окисляются до СО2 Оксалоацетат (щавелевоуксусная кислота) в этом циклическом процессе регенерируется. Атомы водорода (или восстановительные эквиваленты), отщепивщиеся на разных этапах окисления органических веществ, поступают в АТР-регенерирующую систему дыхательной цепи (окислительное фосфорилирование). При каждом обороте цикла трикарбоновых кислот из одного Сг-соединения (ацетил-кофермента А) образуются две молекулы СО2 и четыре раза по 2[Н]. Эти реакции выравнивают баланс цикла трикарбоновых кислот. [c.216]
Увеличение массы ила равно общей массе загрязнений, снятых в процессе очистки, за вычетом той его части, которая окислена до конца, т. е. до выделения углекислого газа и воды, и части ила, распавшегося в процессе его отмирания. Ориентировочно увеличение массы ила может быть определено по разности снятых ХПК и БПКполн (т. е. за счет не-окисленных органических веществ, накапливаемых в иле в качестве инертного балласта), затем части веществ, определяемых БПКполн и израсходованных на синтез биомассы, а также части взвешенных веществ, сорбированных илом, но не определяемых ни БПК, ни ХПК-При расчете массы ила по единицам ХПК и БПК последние переводят в массовые единицы ила делением ХПК и БПК на кислородный эквивалент ила. Нетрудно подсчитать, что по реакции (4.142) ХПК ила состава С5Н7ЫОг равна 1,42. Экспериментальные исследования илов московских канализационных очистных станций дали результаты по ХПК ила [c.373]
Бутлеров определил органическую химию как химию углерода и углеродистых соединений, и в наше время именно это определение предмета органической химии является наиболее правильным. Изучение органических веществ привело Бутлерова к убеждению, что свойства углеродистых веществ и веществ, не содержащих углерода, подчиняются одним и тем же законам. Бут.леров дал понятие об эквиваленте, пае и химической частице и др. Он утверждал, что только тогда, когда является понимание явлений, обобщение, теория, когда более и более постигаются законы, управляющие явлениями, только тогда начинается истинное человеческое знание, возникает наука (А. М. Бутлеров. Избр. работы по органической химии . Изд. АН СССР, 1951, стр. 520). Таким образом, Бутлеров превратил органическую химию в настоящую науку, и в этом его величие. [c.403]
Проблема полного окисления органических веществ изучалась также Виллиамсом Он и его сотрудники разработали хороший метод определения эквивалента окисления органических веществ бихроматом калия в примерно 30 н. растворе серной кислоты без добавления солей серебра. [c.281]
В. Энергия и бактериальный рост. Коэффициенты урожайности бактериального роста различны для автотрофных и гетеротрофных организмов в условиях аэро- или анаэробиоза. M arty получил зависимость между свободной энергией реакции и максимальным урожаем клеток, применяемую как для гетеротрофных, так и для хемо-синтетических автотрофных бактерий [1, 11]. При гетеротрофном росте часть органического вещества используется в виде энергии, другая часть синтезируется в клеточное вещество. Для оценки соотношения превращения для каждого случая был разработан метод электрон-эквивалентов [1]. Электрон-эквиваленты данной массы клеток могут быть определены прежде всего с помощью промежуточной реакции окисления эмпирического клеточного вещества, например 5H7O2N [c.99]
The use of “equivalents” as used in titrations/chemical analysis is an obsolete concept except in some countries. The original meaning of equivalent weights is the weight of a compound that combines with 16 g O or 1 g H and it was developed during the time when electrons did not “exist”. With this definition it is easy to determine the equivalent weights, hence equivalents can be calculated directly or indirectly for most of inorganic simple compounds provided a chemical equation is available.
I still occassionally see equivalents in organic synthesis works. For example, one abstract has
“Deprotonation of pyrazine, pyridazine, pyrimidine, and quinoxaline using an in situ mixture of ZnCl$_2$·TMEDA (0.5 equiv) and LiTMP (1.5 equiv) was studied.“
This is another paper title
“Why Do Catalytic Quantities of Lewis Acid Generally Yield More Product than 1.1 Equiv in the Intramolecular Diels−Alder Reaction with a Furan Diene? “
It appears that the organic chemist’s equivalent is quite different from old-shool’s analytical chemist’s equivalent. I see this has been asked before, but the answers are not relevant to organic synthesis and it is hard to find a relevant definition in any chemical dictionary or even textbooks with reference to organic compounds. Is there a solid reference which defines how equivalents are defined/used in organic chemistry?