Фактор эквивалентности и эквивалентная масса вещества определяются реакцией, в которой принимает участие вещество. У одного и того же вещества фактор эквивалентности и эквивалентная масса в различных реакциях могут быть различны.
Молярная масса эквивалента кислоты зависит от числа замещаемых атомов водорода.
Запишем уравнения реакций образования:
– дигидрофосфата калия:
H3PO4 + КOH = КH2PO4+H2O
Так как в молекуле ортофосфорной кислоты H3PO4 замещается 1 атом водорода, фактор эквивалентности fэкв H3PO4 в этой реакции равен 1:
f экв. (H3PO4) = 1.
Молярная масса ортофосфорной кислоты H3PO4 равна 97,995 г/моль. Определяем эквивалентную массу ортофосфорной кислоты H3PO4 для этой реакции:
Мэ (Н3РО4) = 97,995/1 = 97,995 г-э/моль.
– гидрофосфата калия:
H3PO4 + 2КOH = К2HPO4 + 2H2O
В этой реакции в молекуле ортофосфорной кислоты H3PO4 замещается 2 атома водорода, фактор эквивалентности fэкв H3PO4 в этой реакции равен 1/2:
f экв. (H3PO4) = 1/2.
Определяем эквивалентную массу ортофосфорной кислоты H3PO4 для этой реакции:
Mэ = 97,995/2 = 48,998 г-экв/моль
— ортофосфата калия:
H3PO4 + 3КOH = К3PO4 + 3H2O
В этой реакции в молекуле ортофосфорной кислоты H3PO4 замещается 3 атома водорода, фактор эквивалентности fэкв H3PO4 в этой реакции равен 1/3:
f экв. (H3PO4) = 1/3
Определяем эквивалентную массу ортофосфорной кислоты H3PO4 для этой реакции:
Мэ = 97,995/3 = 32,665 г-экв/моль
Ответ:
фактор эквивалентности ортофосфорной кислоты в реакции образования дигидрофосфата равен 1, молярная масса эквивалента равна 97,995 г-э/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования гидрофосфата равен 1/2, молярная масса эквивалента равна 48,998 г-экв/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования ортофосфата равен 1/3, молярная масса эквивалента равна 32,665 г-экв/моль.
Определить эквивалентную массу
Вычислить фактор эквивалентности и определить эквивалентную массу ортофосфорной кислоты (H3PO4) в реакциях образования гидрофосфата, дигидрофосфата и ортофосфата.
Решение задачи
Напомню, фактор эквивалентности (fэкв) (эквивалент) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Фактор эквивалентности и эквивалентная масса вещества определяются той реакцией в которой данное вещество принимает участие, так как у одного и того же вещества в различных реакциях различны фактор эквивалентности и эквивалентная масса.
Запишем уравнения реакций образования:
А. гидрофосфата
![]()
Так как в одной молекуле ортофосфорной кислоты (H3PO4) замещается 2 атома водорода (H), следовательно, фактор эквивалентности (fэкв) ортофосфорной кислоты (H3PO4) равен 1/2:
f экв. (H3PO4) = 1/2
Учитывая, что молярная масса ортофосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Менделеева), определим эквивалентную массу ортофосфорной кислоты (H3PO4):
![]()
Б. дигидрофосфата
![]()
Так как в одной молекуле ортофосфорной кислоты (H3PO4) замещается 1 атом водорода (H), следовательно, фактор эквивалентности (fэкв) ортофосфорной кислоты (H3PO4) равен 1:
f экв. (H3PO4) = 1
Учитывая, что молярная масса ортофосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Менделеева), определим эквивалентную массу ортофосфорной кислоты (H3PO4):
![]()
В. ортофосфата
![]()
Так как в одной молекуле ортофосфорной кислоты (H3PO4) замещается 3 атома водорода (H), следовательно фактор эквивалентности (fэкв) ортофосфорной кислоты (H3PO4) равен 1/3:
f экв. (H3PO4) = 1/3
Учитывая, что молярная масса ортофосфорной кислоты (H3PO4) равна 98 г/моль (смотри таблицу Менделеева), определим эквивалентную массу ортофосфорной кислоты (H3PO4):
![]()
Ответ:
фактор эквивалентности ортофосфорной кислоты в реакции образования гидрофосфата равен 1/2, молярная масса эквивалента равна 49 г/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования дигидрофосфата равен 1, молярная масса эквивалента равна 98 г/моль;
фактор эквивалентности ортофосфорной кислоты в реакции образования ортофосфата равен 1/3, молярная масса эквивалента равна 32,667 г/моль.
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение объема водорода
Задача № 11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
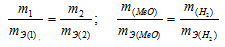
Та как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 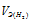 , молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
Тогда можно записать:
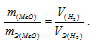
Отсюда:
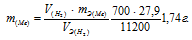
Ответ: 1,74г.
Определение эквивалентной массы вещества
Задача № 12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
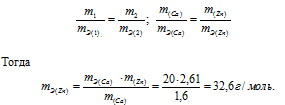
Ответ: 32,6г/моль.
Определение отношения масс реагирующих веществ
Задача № 13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Формула сульфата имеет вид MeSO4, а дигидроортофосфата – MeH2PO4. Таким образом, на образование сульфата затрачивается две эквивалентные массы щёлочи, а на образование дигидроортофосфата – одна эквивалентная масса щёлочи. Так как H2SO4 с двумя эквивалентными массами щёлочи, то её эквивалентная масса в реакции нейтрализации равна М/2 г/моль, а фосфорная кислота реагирует с одной эквивалентной массой щёлочи, то её эквивалентная масса равна М/1г/моль. Отсюда, отношение мас этих кислот, с учётом, что их молекулярные массы равны будет иметь вид:
mH2SO4 : mH3PO4 = ½M : 1M = 1 : 2
Это можно подтвердить уравнениями реакций нейтрализации этих кислот с гидроксидом натрия:
H2SO4 +2NaOH = Na2SO4 + 2H2O;
H3PO4 + NaOH = NaH2PO4 +H2O.
Ответ: mH2SO4 : mH3PO4 = 1 : 2.
Задача № 14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Согласно закону эквивалентов 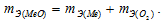 По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
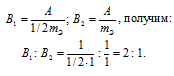
Таким образом, валентность меди в первом оксиде равна II, а во втором – I.
Ответ: 2 : 1.
Определение значения эквивалентной массы вещества
Задача № 15
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты.
Решение:
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Эквивалент (эквивалентная масса) кислоты равна мольной массе (М) делённой на число атомов водорода, замещённых в данной реакции на металл (на число вступающих в реакцию атомов водорода). Так как при взаимодействии ортофосфорной кислоты со щёлочью образовалась соль Na2HPO4, т.е. на натрий заместилось два атома водорода в кислоте H3PO4. Следовательно, эквивалентная масса ортофосфорной кислоты в реакции со щёлочью при образовании гидрофосфата натрия равна М/2 = М(H3PO4)/2 = 98/ 2 = 49г/моль.
Ответ: 49г/моль.
Задача № 16
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
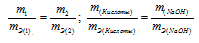
Эквивалентная масса гидроксида натрия равна М(NaOH)0/1 = 40г/моль.
Тогда
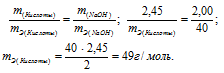
Ответ: 49г/моль.
Задача № 17
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
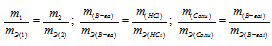
Эквивалентная масса хлороводорода равна М(HCl) = 36,5/1 = 36,5г/моль.
Тогда
а) Находим эквивалентную массу вещества:
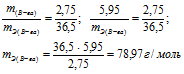
б) Находим эквивалентную массу соли:
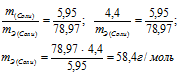
Ответ: а) 58,4г/моль; б) 78,97 г/моль.
Определение эквивалентного объема водорода
Задача № 18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Если одно из веществ находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
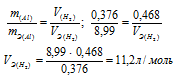
Ответ: 11,2л/моль.
Люди, подскажите, пожалуйста, чему равен химический эквивалент фосфорной кислоты и как его можно вычислить? Очень нужн
Мастер
(1943),
закрыт
10 лет назад
Geselle
Гений
(63461)
10 лет назад
Если речь идет об ортофосфорной кислоте H3PO4 (безотносительно какой-либо реакции) , то молярная масса эквивалента (которую часто имеют в виду, говоря об эквиваленте) равна молярной массе кислоты, деленной на 3 (или молярной массе, умноженной на фактор эквивалентности, равный здесь 1/3).
98/3 = 32,67 (г/моль экв)
Вычислить молярную концентрацию и молярную концентрацию эквивалента раствора ортофосфорной кислоты с массовой долей H3PO4 10% (r = 1,05).
Решение:
Определяем массу одного литра раствора:
m(р-ра) = 1000×1,05 = 1050 г.
Определяем массу H3PO4, которая содержится в 1050 г раствора:
В 100 г р-ра содержится 10 гH3PO4
1050 г р-ра х г
m(H3PO4) = х = 1050×10/100 = 105 г
Определяем молярную концентрацию раствора
с(H3PO4) = ![]() =
= ![]() = 1,07 моль/л
= 1,07 моль/л
Определяем молярную концентрацию эквивалента раствора
с(![]() H3PO4) =
H3PO4) =  =
=  = 3,21 моль/л
= 3,21 моль/л
