Понятие эквивалент элемента часто подменяют понятием эквивалентная масса, хотя это разные понятия.
Эквивалент химический – это реальная или условная ЧАСТИЦА, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
Нам необходимо найти эквивалент химического элемента.
Эквивалентом химического элемента называют такую его ЧАСТЬ, которая соединяется с одним АТОМОМ водорода или замещает один атом водорода в химических реакциях
Эквивалент атома водорода всегда равен единице, а эквивалент химического элемента может быть меньше или равен единице. Эквивалент химического элемента численно равен фактору эквивалентности элемента.
Пусть оксид серы в общем виде имеет формулу SOх, где х – число атомов кислорода в оксиде.
ПЕРВЫЙ ОКСИД
Массовая доля серы в первом оксиде w1(S) = 0,4, тогда массовая доля кислорода в первом оксиде
w1(O) = 1 – w1(S) = 1 – 0,4 = 0,6
Отношение массовых долей в первом оксиде
w1(O)/w1(S) = 0,6/0,4 = 1,5
С другой стороны отношение массовых долей в оксиде равно отношению масс элементов в оксиде
w1(O)/w1(S) = m(O)/m(S) = x*A(O)/A(S) = 16x/32 = 0,5x
Получаем
0,5x = 1,5
Отсюда
х = 3
Следовательно, первый оксид имеет формулу SO3, в котором сера шестивалентна.
Тогда
z(S) = 6 – эквивалентное число серы, равное ее валентности в оксиде SO3
Фактор эквивалентности серы в первом оксиде
fэкв (S) = 1/z(S) = 1/6
Следовательно, эквивалент серы в первом оксиде равен 1/6
Если под понятием эквивалент ты подразумевал эквивалентную массу серы в оксиде, то эквивалентная масса серы в оксиде может быть найдена по формуле
Мэкв (S) = M(S)*fэкв (S) = 32*(1/6) ≈ 5,33 г/моль
ВТОРОЙ ОКСИД
Массовая доля серы в втором оксиде w2(S) = 0,5, тогда массовая доля кислорода во втором оксиде
w2(O) = 1 – w1(S) = 1 – 0,5 = 0,5
Отношение массовых долей во втором оксиде
w2(O)/w2(S) = 0,5/0,5 = 1
w2(O)/w2(S) = m(O)/m(S) = x*A(O)/A(S) = 16x/32 = 0,5x
Получаем
0,5x = 1
Отсюда
х = 2
Следовательно, второй оксид имеет формулу SO2, в котором сера четырехвалентна.
Тогда
z(S) = 4 – эквивалентное число серы, равное ее валентности в оксиде SO2
Фактор эквивалентности серы во втором оксиде
fэкв (S) = 1/z(S) = 1/4
Следовательно, эквивалент серы во втором оксиде равен 1/4
Эквивалентная масса серы во втором оксиде
Мэкв (S) = M(S)*fэкв (S) = 32*(1/4) = 8 г/моль
Какова эквивалентная масса серы (S), если 4 грамма ее окисляются 2,8 литрами кислорода (O) (нормальные условия)?
Решение задачи
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
Учитывая, что кислород – газ, вычислим массу кислорода, по формуле перерасчета, устанавливающей связь между объемом газа и массой:
![]()
Получаем:
m (O2) = 32 ∙ 2,8 / 22,4 = 4 (г).
Учитывая, что молярная масса эквивалентов кислорода (O) равна 8 г/моль, определим эквивалентную массу серы (S) по закону эквивалентов:
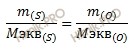
Откуда выразим эквивалентную массу серы (S):
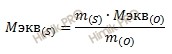
Получаем:
M экв (S) = 4 ∙ 8 / 4 = 8 (г/моль).
Ответ:
эквивалентная масса серы (S) равна 8 г/ моль.
Эквивалентом
называют
реальную или условную частицу, которая
может замещать, присоединять, высвобождать
или быть каким-либо другим способом
эквивалента одному иону водорода в
кислотно-основных или ионообменных
реакциях или одному электрону в
окислительно-восстановительных реакциях.
Масса
1 эквивалента вещества (элемента)
называется его молярной (атомной) массой
эквивалента (Мэкв),
выражается в г/моль∙экв. В отличие от
относительной атомной массы Аr
атомная масса эквивалента элемента Э
в его различных соединениях – величина
переменная. Рассчитать ее можно по
формуле: Мэкв
= Аr/В,
где В – валентность или степень окисления
элемента в данном соединении. Так,
молярная масса эквивалента железа в
его дихлориде и трихлориде составляет
соответственно 56/2= 28 и 56/3 ≈ 19 соответственно.
Эквивалентом
соединения
называют такое его количество, которое
взаимодействует без остатка с одним
эквивалентом водорода или вообще с
одним эквивалентом любого другого
вещества.
Фактор
эквивалентности
– число,
показывающее, какая доля реальной
частицы Х эквивалентна одному иону
водорода в данной кислотно-основной
реакции или одному электрону в данной
окислительно-восстановительной реакции,
обозначается как fэкв(Х).
Рассчитывается, как
fэкв(кислоты)=1/основность;
fэкв(основания)=1/кислотность;
fэкв(соли)=1/число
катионов∙валентность Ме;
fэкв(окислителя)=1/число
принятых ē;
fэкв(восстановителя)=1/число
отданных ē.
Молярная
масса эквивалента вещества Х равна
произведению
фактора эквивалентности вещества Х на
его молярную массу.
Мэкв(Х)=fэкв(Х)·М(f).
Значит,
Мэкв(NaOH)=1∙40
= 40 г/моль∙экв;
Мэкв(Н2SO4)=1/2·98
= 49 г/моль∙экв;
Мэкв(Al(NO3)3)=1/3∙213=
71 г/моль∙экв.
Как
для элементов, так и для сложных веществ
применим закон
эквивалентов:
«Вещества взаимодействуют друг с другом
в эквивалентных количествах», или «массы
реагирующих веществ пропорциональны
их эквивалентам или молярным массам
эквивалентов (объемов): m1/m2
= Mэкв1/Мэкв2.
Пример
1. Определите
молярные массы эквивалента серы в
сероводороде, диоксиде серы и триоксиде
серы.
Решение.
Исходя
из состава сероводорода H2S
и оксидов серы SO2
и SO3
находим, что степень окисления серы в
них равна -2, +4, +6 соответственно. Тогда
из соотношения Мэкв
= Аr/В
находим, что молярная
масса эквивалента серы равна: 32/2 = 16;
32/4 = 8; 32/6 = 5,33 соответственно.
Пример
2. На
восстановление 7,09 г оксида двухвалентного
металла требуется 2,24 л водорода,
измеренного при нормальных условиях
(н.у.). Вычислить молярные массы эквивалента
оксида и металла. Чему равна атомная
масса металла?
Решение.
Согласно
закону эквивалентов массы (объемы)
реагирующих друг с другом веществ m(А)
и m(В) пропорциональны их молярным массам
эквивалентов (объемам):
![]() (1)
(1)
![]() .
.
(2)
Если
одно из веществ находится в газообразном
состоянии, то его количество измеряется
в объемных единицах (см3,
л, м3,
мл).
Объем,
занимаемый при данных условиях молярной
или молярной массой эквивалента
газообразного вещества, называется
молярным или соответственно эквивалентным
объемом этого вещества. Молярный объем
любого газа при н.у. равен 22,4 дм3.
Отсюда эквивалентный объем водорода,
молекула которого состоит из двух
атомов, т.е. содержит два моля атомов
водорода, равен 22,4:2 = 11,2 дм3.
В формуле (2) отношение mН2/Мэкв(Н2)заменяем
равным ему отношением VH2/Vэкв(H2),
где VH2
– объем
водорода,
Vэкв(H2)
– эквивалентный объем водорода:
![]() (3)
(3)
Из
уравнения (3) находим молярную массу
эквивалента оксида металла
![]()
Согласно
закону эквивалентов
Mэкв(MeO)
= Mэкв(Me)
+ Mэкв(O),
отсюда
Mэкв(Me)
= Mэкв(MeO)
– Mэкв(O)
= 35,45 – 8 = 27,45 г/моль·экв.
Молярная
масса металла определяется из соотношения
Мэкв(Ме)
= М(Ме)/В, где Мэкв(Ме)
– молярная масса эквивалента металла,
М(Ме) – молярная масса металла, В –
стехиометрическая валентность элемента;
М(Ме) = Мэкв(Ме)∙В
= 27,45·2 = 54,9 г/моль. Так как атомная масса
в а.е.м. численно равна молярной массе,
выражаемой в г/моль, то искомая масса
металла 54,9 а.е.м.
Пример
3. Вычислить
молярные массы эквивалентов Н2SO4
и Аl(ОН)3
в реакциях, выраженных уравнениями:
1)
Н2SO4
+ КОН = КНSO4
+ Н2О,
2)
Аl(OH)3
+ HCl
= Al(OH)2Cl
+ Н2О,
3)
Аl(OH)3
+ 3HNO3
= Al(NO3)3
+ 3H2O.
Решение.
Молярная
масса эквивалента сложного вещества,
так же как и молярная масса эквивалента
элемента, может иметь различные значения
и зависит от того, в какую реакцию обмена
вступает это вещество.
В
реакции (1) в молекуле кислоты замещается
1 ион водорода, следовательно, fэкв(Н2SO4)
= 1, поэтому Мэкв(Н2SO4)
= М(Н2SO4)
∙1 = =98·1 = 98 г/моль∙экв.
В
реакции (2) происходит замещение одной
гидроксильной группы, поэтому fэкв(Аl(OH)3)
=1, Мэкв(Аl(OH)3)
= 78·1= 78 г/моль∙экв.
В
реакции (3) происходит замещение трех
гидроксильных групп, следовательно,
fэкв(Аl(OH)3)
=1/3, а
Мэкв(Аl(OH)3)
= 78·1/3 = 26 г/моль∙экв.
Пример
4. При
восстановлении 1,6 г монооксида некоторого
металла водородом образовалось 0,36 г
воды. Определите молярную массу
эквивалента металла и формулу оксида.
Решение.
Определим
молярную массу эквивалента оксида,
используя математическое выражение
закона эквивалентов и учитывая, что
молярная масса эквивалента воды равна
сумме молярных масс эквивалентов
водорода и кислорода, т.е. 9:
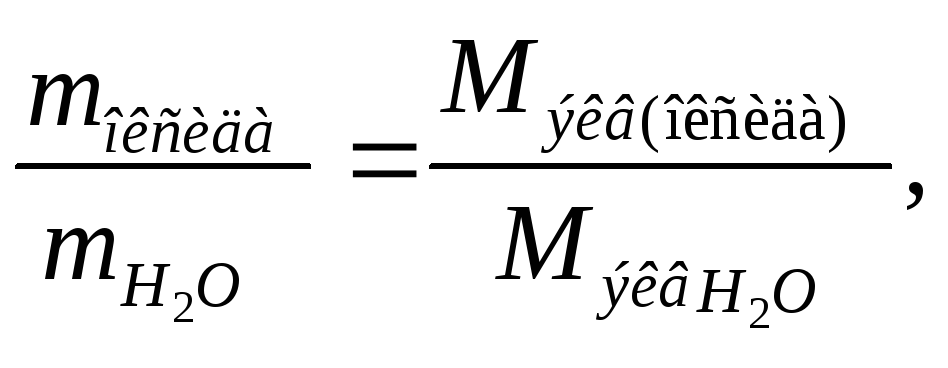 откуда
откуда

Молярная
масса эквивалента металла равна разности
между молярной массой эквивалента
оксида и молярной массой эквивалента
кислорода:
Мэкв(Ме)
= Мэкв
(оксида) –
Мэкв (О)
= 40 – 8 = 32.
Исходя
из состава оксида (МеО), степень окисления
металла в нем равна двум. Тогда из
соотношения Мэкв
= Аr/В
находим атомную массу металла:
Аr
= Мэкв
∙В = 32·2 = 64. Это – медь (АCu
= 63,5 ≈ 64).
Следовательно,
формула оксида CuO.
Соседние файлы в папке пособие общ химия
- #
- #
Найди верный ответ на вопрос ✅ «11. Найдите эквивалент и эквивалентные массы серы в соединениях: Н2S; SO3; FeSO4; CuSO3. …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » 11. Найдите эквивалент и эквивалентные массы серы в соединениях: Н2S; SO3; FeSO4; CuSO3.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
