Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
§ 2.1.2. Эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 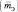 – это масса одного эквивалента.
– это масса одного эквивалента.
Например, если серная кислота (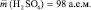 ;
;
М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
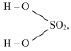
взаимодействует с NaOH по реакции:
Н2SO4 + 2NaOH = Na2SO4 + 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
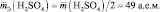
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
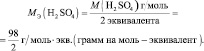
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl + NaOH = NaСl + Н2О;
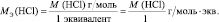
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
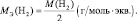
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
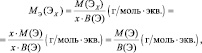
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
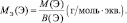
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
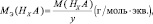
где y – основность кислоты, т. е. количество ионов H+, принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 + NaOH = NaНSO4 + Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н+, принимающих участие в процессе.
Для оснований (Э(ОН)Х):
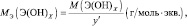
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 + 2НСl = СаСl2 + 2Н2О;
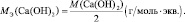
А для процесса:
Са(ОН)2 + НСl = СаОНСl + Н2О;
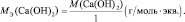
Для солей (МеХАу, где Ме – металл):
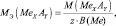
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
Для оксидов (ЭХОY):
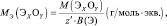
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 + 6HCl = 2АlCl3 + 3H2O;
Э ≡ Al; 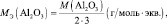
а для реакции:
UO3 + 2HCl = UO2Cl2 + H2O;
Э ≡ UO2; 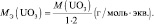
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 + 3 K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH;
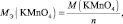
где n – количество электронов, получаемых перманганатом калия
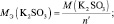
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
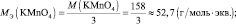
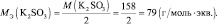
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):
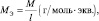 (2.2)
(2.2)
где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
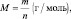
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
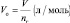
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
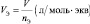
из последних двух равенств вытекает соотношение
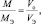
в котором все величины являются параметрами одного и того же газа.
Действительно:
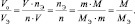
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 + 3КОН = К3РО4 + 3Н2О;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4 + КОН = КН2РО4 + Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 + ВаСl2 = ВаSO4 + 2NaСl;
Na2SO4 + H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O + 2НСl = 2NaСl + Н2О;
Na2O + Н2О = 2NaOН.
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 + 3H2SO4 = Аl2(SO4)3 + 6Н2О;
Аl(OH)3 + H2SO4 = АlOHSO4 + 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
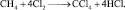
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.
Эквивалентом
называют
реальную или условную частицу, которая
может замещать, присоединять, высвобождать
или быть каким-либо другим способом
эквивалента одному иону водорода в
кислотно-основных или ионообменных
реакциях или одному электрону в
окислительно-восстановительных реакциях.
Масса
1 эквивалента вещества (элемента)
называется его молярной (атомной) массой
эквивалента (Мэкв),
выражается в г/моль∙экв. В отличие от
относительной атомной массы Аr
атомная масса эквивалента элемента Э
в его различных соединениях – величина
переменная. Рассчитать ее можно по
формуле: Мэкв
= Аr/В,
где В – валентность или степень окисления
элемента в данном соединении. Так,
молярная масса эквивалента железа в
его дихлориде и трихлориде составляет
соответственно 56/2= 28 и 56/3 ≈ 19 соответственно.
Эквивалентом
соединения
называют такое его количество, которое
взаимодействует без остатка с одним
эквивалентом водорода или вообще с
одним эквивалентом любого другого
вещества.
Фактор
эквивалентности
– число,
показывающее, какая доля реальной
частицы Х эквивалентна одному иону
водорода в данной кислотно-основной
реакции или одному электрону в данной
окислительно-восстановительной реакции,
обозначается как fэкв(Х).
Рассчитывается, как
fэкв(кислоты)=1/основность;
fэкв(основания)=1/кислотность;
fэкв(соли)=1/число
катионов∙валентность Ме;
fэкв(окислителя)=1/число
принятых ē;
fэкв(восстановителя)=1/число
отданных ē.
Молярная
масса эквивалента вещества Х равна
произведению
фактора эквивалентности вещества Х на
его молярную массу.
Мэкв(Х)=fэкв(Х)·М(f).
Значит,
Мэкв(NaOH)=1∙40
= 40 г/моль∙экв;
Мэкв(Н2SO4)=1/2·98
= 49 г/моль∙экв;
Мэкв(Al(NO3)3)=1/3∙213=
71 г/моль∙экв.
Как
для элементов, так и для сложных веществ
применим закон
эквивалентов:
«Вещества взаимодействуют друг с другом
в эквивалентных количествах», или «массы
реагирующих веществ пропорциональны
их эквивалентам или молярным массам
эквивалентов (объемов): m1/m2
= Mэкв1/Мэкв2.
Пример
1. Определите
молярные массы эквивалента серы в
сероводороде, диоксиде серы и триоксиде
серы.
Решение.
Исходя
из состава сероводорода H2S
и оксидов серы SO2
и SO3
находим, что степень окисления серы в
них равна -2, +4, +6 соответственно. Тогда
из соотношения Мэкв
= Аr/В
находим, что молярная
масса эквивалента серы равна: 32/2 = 16;
32/4 = 8; 32/6 = 5,33 соответственно.
Пример
2. На
восстановление 7,09 г оксида двухвалентного
металла требуется 2,24 л водорода,
измеренного при нормальных условиях
(н.у.). Вычислить молярные массы эквивалента
оксида и металла. Чему равна атомная
масса металла?
Решение.
Согласно
закону эквивалентов массы (объемы)
реагирующих друг с другом веществ m(А)
и m(В) пропорциональны их молярным массам
эквивалентов (объемам):
![]() (1)
(1)
![]() .
.
(2)
Если
одно из веществ находится в газообразном
состоянии, то его количество измеряется
в объемных единицах (см3,
л, м3,
мл).
Объем,
занимаемый при данных условиях молярной
или молярной массой эквивалента
газообразного вещества, называется
молярным или соответственно эквивалентным
объемом этого вещества. Молярный объем
любого газа при н.у. равен 22,4 дм3.
Отсюда эквивалентный объем водорода,
молекула которого состоит из двух
атомов, т.е. содержит два моля атомов
водорода, равен 22,4:2 = 11,2 дм3.
В формуле (2) отношение mН2/Мэкв(Н2)заменяем
равным ему отношением VH2/Vэкв(H2),
где VH2
– объем
водорода,
Vэкв(H2)
– эквивалентный объем водорода:
![]() (3)
(3)
Из
уравнения (3) находим молярную массу
эквивалента оксида металла
![]()
Согласно
закону эквивалентов
Mэкв(MeO)
= Mэкв(Me)
+ Mэкв(O),
отсюда
Mэкв(Me)
= Mэкв(MeO)
– Mэкв(O)
= 35,45 – 8 = 27,45 г/моль·экв.
Молярная
масса металла определяется из соотношения
Мэкв(Ме)
= М(Ме)/В, где Мэкв(Ме)
– молярная масса эквивалента металла,
М(Ме) – молярная масса металла, В –
стехиометрическая валентность элемента;
М(Ме) = Мэкв(Ме)∙В
= 27,45·2 = 54,9 г/моль. Так как атомная масса
в а.е.м. численно равна молярной массе,
выражаемой в г/моль, то искомая масса
металла 54,9 а.е.м.
Пример
3. Вычислить
молярные массы эквивалентов Н2SO4
и Аl(ОН)3
в реакциях, выраженных уравнениями:
1)
Н2SO4
+ КОН = КНSO4
+ Н2О,
2)
Аl(OH)3
+ HCl
= Al(OH)2Cl
+ Н2О,
3)
Аl(OH)3
+ 3HNO3
= Al(NO3)3
+ 3H2O.
Решение.
Молярная
масса эквивалента сложного вещества,
так же как и молярная масса эквивалента
элемента, может иметь различные значения
и зависит от того, в какую реакцию обмена
вступает это вещество.
В
реакции (1) в молекуле кислоты замещается
1 ион водорода, следовательно, fэкв(Н2SO4)
= 1, поэтому Мэкв(Н2SO4)
= М(Н2SO4)
∙1 = =98·1 = 98 г/моль∙экв.
В
реакции (2) происходит замещение одной
гидроксильной группы, поэтому fэкв(Аl(OH)3)
=1, Мэкв(Аl(OH)3)
= 78·1= 78 г/моль∙экв.
В
реакции (3) происходит замещение трех
гидроксильных групп, следовательно,
fэкв(Аl(OH)3)
=1/3, а
Мэкв(Аl(OH)3)
= 78·1/3 = 26 г/моль∙экв.
Пример
4. При
восстановлении 1,6 г монооксида некоторого
металла водородом образовалось 0,36 г
воды. Определите молярную массу
эквивалента металла и формулу оксида.
Решение.
Определим
молярную массу эквивалента оксида,
используя математическое выражение
закона эквивалентов и учитывая, что
молярная масса эквивалента воды равна
сумме молярных масс эквивалентов
водорода и кислорода, т.е. 9:
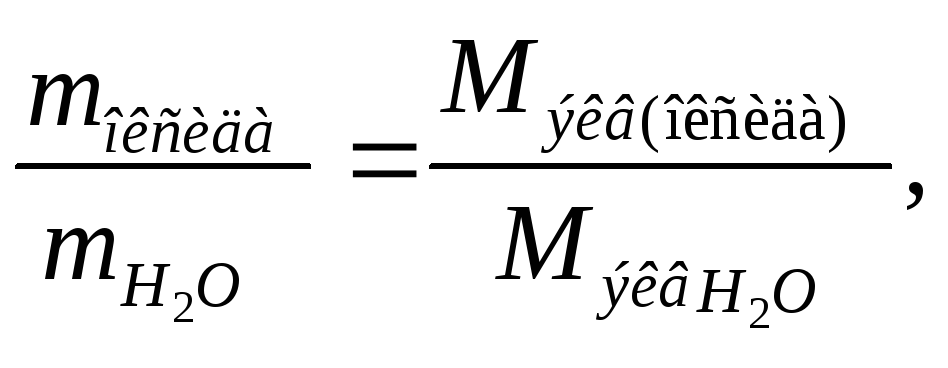 откуда
откуда

Молярная
масса эквивалента металла равна разности
между молярной массой эквивалента
оксида и молярной массой эквивалента
кислорода:
Мэкв(Ме)
= Мэкв
(оксида) –
Мэкв (О)
= 40 – 8 = 32.
Исходя
из состава оксида (МеО), степень окисления
металла в нем равна двум. Тогда из
соотношения Мэкв
= Аr/В
находим атомную массу металла:
Аr
= Мэкв
∙В = 32·2 = 64. Это – медь (АCu
= 63,5 ≈ 64).
Следовательно,
формула оксида CuO.
Соседние файлы в папке пособие общ химия
- #
- #
Эквивалент – это реальная или условная
частица, которая в кислотно-основных реакциях присоединяет
(или отдает) один ион Н+ или ОН–, в
окислительно-восстановительных реакциях принимает (или отдает) один
электрон, реагирует с одним атомом водорода или с одним эквивалентом
другого вещества. Например, рассмотрим следующую
реакцию:
H3PO4 + 2KOH
®
K2HPO4 + 2H2O.
В
ходе этой реакции только два атома водорода замещаются на атомы
калия, иначе, в реакцию вступают два иона Н+ (кислота
проявляет основность 2). Тогда по определению эквивалентом
H3PO4
будет являться условная частица 1/2H3PO4,
т.к. если одна молекула H3PO4
предоставляет два иона Н+, то один ион Н+ дает
половина молекулы H3PO4.
С
другой стороны, на реакцию с одной молекулой ортофосфорной кислотой
щелочь отдает два иона ОН–, следовательно, один ион ОН–
потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом
кислоты является условная частица 1/2Н3РО4, а
эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы
или другой частицы вещества соответствует эквиваленту, называется
фактором эквивалентности (fЭ).
Фактор эквивалентности – это безразмерная величина, которая меньше,
либо равна 1. Формулы расчета фактора эквивалентности приведены в
таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу
вещества, можно составить формулу эквивалента какой-либо частицы,
где фактор эквивалентности записывается как химический коэффициент
перед формулой частицы:
fЭ
(формульная единица вещества)
º
эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты,
соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4
и КОН также могут происходить и другие реакции. При этом кислота
будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH
®
K3PO4 + 3H2O
fЭ(H3PO4)
= 1/3
H3PO4 + KOH
®
KН2PO4
+ H2O fЭ(H3PO4)
= 1.
Следует учитывать, что эквивалент одного
и того же вещества может меняться в зависимости от того, в какую
реакцию оно вступает. Эквивалент элемента также может быть
различным в зависимости от вида соединения, в состав которого он
входит. Эквивалентом может являться как сама молекула или
какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 –
Расчет фактора эквивалентности
|
Частица |
Фактор |
Примеры |
|
Элемент |
где В(Э) – |
|
|
Простое вещество |
где |
fЭ(H2)
fЭ(O2)
fЭ(Cl2)
fЭ(O3) |
|
Оксид |
где |
|
|
Кислота |
где |
fЭ(H2SO4) или
fЭ(H2SO4) (основность равна 2) |
|
Основание |
где |
fЭ(Cu(OH)2)
fЭ(Cu(OH)2)
|
|
Соль |
где |
|
|
Частица в |
где |
Fe2+
fЭ(Fe2+)
MnO4–
fЭ(MnO4–) |
|
Ион |
где |
fЭ(SO42–) |
Пример.
Определите фактор эквивалентности и эквивалент у солей: а)
ZnCl2, б) КНСО3, в)
(MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в
таблице 1.1.
а)
ZnCl2 (средняя соль):
![]() .
.
fЭ(ZnCl2)
= 1/2, поэтому эквивалентом ZnCl2
является частица 1/2ZnCl2.
б) КНСО3
(кислая соль):
![]() .
.
fЭ(КНСО3) = 1,
поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4
(основная соль):
![]() .
.
fЭ(
(MgOH)2SO4
) = 1/2, поэтому эквивалентом
(MgOH)2SO4
является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой
(молярным объемом) и определенным
количеством вещества
nэ.
Молярная масса эквивалента (МЭ)
– это масса одного моль эквивалента. Она равна
произведению молярной массы вещества на фактор эквивалентности:
Молярная масса
эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного
вещества равна сумме молярных масс эквивалентов образующих его
составных частей, например:
МЭ(оксида) = МЭ(элемента)
+ МЭ(О) = МЭ(элемента)
+ 8
МЭ(кислоты) = МЭ(Н)
+ МЭ(кислотного остатка) = 1 + МЭ(кислотного
остатка)
МЭ(основания) = МЭ(Ме)
+ МЭ(ОН) = МЭ(Ме) +
17
МЭ(соли) = МЭ(Ме)
+ МЭ(кислотного остатка).
Газообразные вещества помимо молярной массы эквивалента имеют
молярный объем эквивалента (![]()
или VЭ)
– объем, занимаемый молярной массой эквивалента или объем одного
моль эквивалента. Размерность «л/моль».
При н.у. получаем:
![]()
Закон
эквивалентов был открыт в 1792 г. И. Рихтером.
Современная формулировка закона:
вещества реагируют и образуются согласно их эквивалентам.
Все вещества в уравнении реакции связаны законом эквивалентов,
поэтому:
nэ(реагента1)
= … = nэ(реагентаn)
=
nэ(продукта1)
= … =
nэ(продуктаn)
Из закона эквивалентов следует, что массы (или объемы)
реагирующих и образующихся веществ пропорциональны молярным массам
(молярным объемам) их эквивалентов. Для любых двух веществ,
связанных законом эквивалентов, можно записать:
где m1 и
m2 – массы реагентов и
(или) продуктов реакции, г;
![]() ,
, ![]() –
–
молярные массы эквивалентов реагентов и (или) продуктов реакции,
г/моль;
V1, V2
– объемы реагентов и (или) продуктов реакции, л;
![]() ,
,![]() –
–
молярные объемы эквивалентов реагентов и (или) продуктов реакции,
л/моль.
Л.А. Яковишин
Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.

Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:

Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.

В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.

А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.

Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.

Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:

Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:

Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.

Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.

Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:

В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:

И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.

В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:

В другой реакции гидроксида калия и фосфорной кислоты:

Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:

И в третьем случае:

Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:

Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:

Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
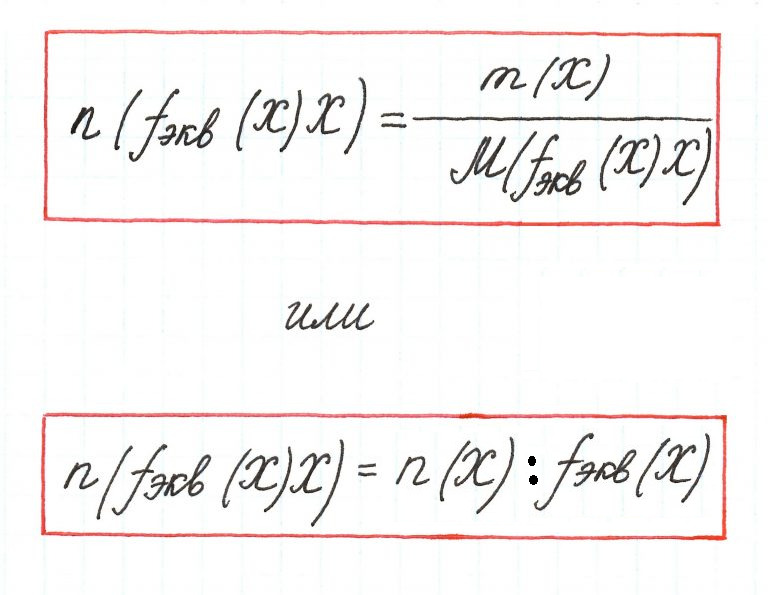
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.

Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?

Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?

Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:

Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.

Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:

У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:

Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:

Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:

Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:

Например:

Для оснований:

Например:

Для кислот:

Например:

Для солей:

Например:

Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

