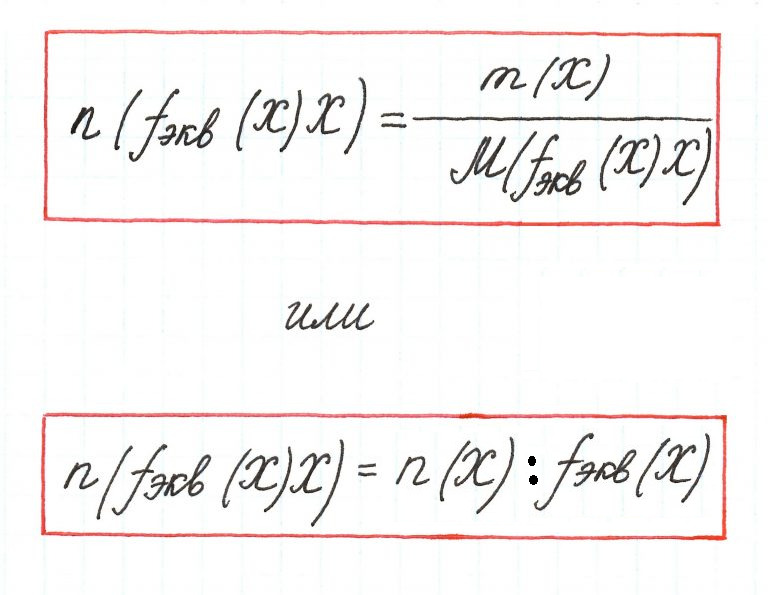Эквивалент – это реальная или условная
частица, которая в кислотно-основных реакциях присоединяет
(или отдает) один ион Н+ или ОН–, в
окислительно-восстановительных реакциях принимает (или отдает) один
электрон, реагирует с одним атомом водорода или с одним эквивалентом
другого вещества. Например, рассмотрим следующую
реакцию:
H3PO4 + 2KOH
®
K2HPO4 + 2H2O.
В
ходе этой реакции только два атома водорода замещаются на атомы
калия, иначе, в реакцию вступают два иона Н+ (кислота
проявляет основность 2). Тогда по определению эквивалентом
H3PO4
будет являться условная частица 1/2H3PO4,
т.к. если одна молекула H3PO4
предоставляет два иона Н+, то один ион Н+ дает
половина молекулы H3PO4.
С
другой стороны, на реакцию с одной молекулой ортофосфорной кислотой
щелочь отдает два иона ОН–, следовательно, один ион ОН–
потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом
кислоты является условная частица 1/2Н3РО4, а
эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы
или другой частицы вещества соответствует эквиваленту, называется
фактором эквивалентности (fЭ).
Фактор эквивалентности – это безразмерная величина, которая меньше,
либо равна 1. Формулы расчета фактора эквивалентности приведены в
таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу
вещества, можно составить формулу эквивалента какой-либо частицы,
где фактор эквивалентности записывается как химический коэффициент
перед формулой частицы:
fЭ
(формульная единица вещества)
º
эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты,
соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4
и КОН также могут происходить и другие реакции. При этом кислота
будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH
®
K3PO4 + 3H2O
fЭ(H3PO4)
= 1/3
H3PO4 + KOH
®
KН2PO4
+ H2O fЭ(H3PO4)
= 1.
Следует учитывать, что эквивалент одного
и того же вещества может меняться в зависимости от того, в какую
реакцию оно вступает. Эквивалент элемента также может быть
различным в зависимости от вида соединения, в состав которого он
входит. Эквивалентом может являться как сама молекула или
какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 –
Расчет фактора эквивалентности
|
Частица |
Фактор |
Примеры |
|
Элемент |
где В(Э) – |
|
|
Простое вещество |
где |
fЭ(H2)
fЭ(O2)
fЭ(Cl2)
fЭ(O3) |
|
Оксид |
где |
|
|
Кислота |
где |
fЭ(H2SO4) или
fЭ(H2SO4) (основность равна 2) |
|
Основание |
где |
fЭ(Cu(OH)2)
fЭ(Cu(OH)2)
|
|
Соль |
где |
|
|
Частица в |
где |
Fe2+
fЭ(Fe2+)
MnO4–
fЭ(MnO4–) |
|
Ион |
где |
fЭ(SO42–) |
Пример.
Определите фактор эквивалентности и эквивалент у солей: а)
ZnCl2, б) КНСО3, в)
(MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в
таблице 1.1.
а)
ZnCl2 (средняя соль):
.
fЭ(ZnCl2)
= 1/2, поэтому эквивалентом ZnCl2
является частица 1/2ZnCl2.
б) КНСО3
(кислая соль):
.
fЭ(КНСО3) = 1,
поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4
(основная соль):
.
fЭ(
(MgOH)2SO4
) = 1/2, поэтому эквивалентом
(MgOH)2SO4
является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой
(молярным объемом) и определенным
количеством вещества
nэ.
Молярная масса эквивалента (МЭ)
– это масса одного моль эквивалента. Она равна
произведению молярной массы вещества на фактор эквивалентности:
Молярная масса
эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного
вещества равна сумме молярных масс эквивалентов образующих его
составных частей, например:
МЭ(оксида) = МЭ(элемента)
+ МЭ(О) = МЭ(элемента)
+ 8
МЭ(кислоты) = МЭ(Н)
+ МЭ(кислотного остатка) = 1 + МЭ(кислотного
остатка)
МЭ(основания) = МЭ(Ме)
+ МЭ(ОН) = МЭ(Ме) +
17
МЭ(соли) = МЭ(Ме)
+ МЭ(кислотного остатка).
Газообразные вещества помимо молярной массы эквивалента имеют
молярный объем эквивалента (
или VЭ)
– объем, занимаемый молярной массой эквивалента или объем одного
моль эквивалента. Размерность «л/моль».
При н.у. получаем:
Закон
эквивалентов был открыт в 1792 г. И. Рихтером.
Современная формулировка закона:
вещества реагируют и образуются согласно их эквивалентам.
Все вещества в уравнении реакции связаны законом эквивалентов,
поэтому:
nэ(реагента1)
= … = nэ(реагентаn)
=
nэ(продукта1)
= … =
nэ(продуктаn)
Из закона эквивалентов следует, что массы (или объемы)
реагирующих и образующихся веществ пропорциональны молярным массам
(молярным объемам) их эквивалентов. Для любых двух веществ,
связанных законом эквивалентов, можно записать:
где m1 и
m2 – массы реагентов и
(или) продуктов реакции, г;
,
–
молярные массы эквивалентов реагентов и (или) продуктов реакции,
г/моль;
V1, V2
– объемы реагентов и (или) продуктов реакции, л;
,
–
молярные объемы эквивалентов реагентов и (или) продуктов реакции,
л/моль.
Л.А. Яковишин
1.
Молярная
масса эквивалента кислоты
есть отношение молярной массы данной
кислоты к числу ионов водорода, участвующих
в реакции:
М(1/Z)кислоты=M(кислоты)/число
H+.
2.
Молярная
масса эквивалента основания
есть отношение молярной массы основания
к числу ионов гидроксида, участвующих
в реакции: М(1/Z)основания=M(основания)/число
ОH–.
3.
Молярная
масса эквивалента соли
есть отношение массы соли к произведению
числа атомов данной соли на его степень
окисления.
M(1/Z)соли=M(соли)/(число
атомов Ме·степень окисленияМе).
4.
Молярная
масса эквивалента окислителя или
восстановителя есть
отношение молярной массы окислителя
или восстановителя к числу электронов,
отданных или принятых в данной реакции:
М(1/Z)
ок-ля, вос-ля)=Мок-ля, вос-ля)/число е.
Аналитическая химия.
Аналитическая
химия –
наука о методах анализа химического
состава веществ или их смесей.
Она
делится на качественный
и количественный
анализ.
Качественный
анализ
позволяет определить, какие элементы,
группы атомов, ионов, молекул, радикалов
входят в состав анализируемого вещества
или смеси вещества.
Количественный
анализ
позволяет установить количественные
соотношения компонентов данного
соединения или смеси веществ.
Различают:
физические, физико-химические и химические
методы количественного анализа.
Химические
методы, в свою очередь, делятся на:
-
гравиметрию
(весовой анализ); -
титриметрию
(объемный анализ).
В
клинических лабораториях широкое
распространение получил титриметрический
метод анализа, т.к. для его проведения
требуется простое лабораторное
оборудование, незначительные затраты
труда и времени. Для него характерны
высокая точность и высокая универсальность.
Данный
анализ основан на измерении объема
титранта (с известной концентрацией),
израсходованного на реакцию с определяемым
веществом, при этом вещества должны
реагировать в строго эквивалентных
количествах.
Процесс
постепенного добавления титранта к
анализируемому веществу называется
титрованием,
а момент завершения реакции – моментом
эквивалентности.
Расчеты
в титриметрическом анализе подчиняются
закону эквивалентности.
C(1/z)Т
– молярная концентрация эквивалента
титранта, моль·дм-3;
VТ
– объем раствора титранта, см3;
VХ
– объем раствора исследуемого вещества,
см3;
C(1/z)Т·VТ=
C(1/z)Х·VХ
Т.о.
в момент эквивалентности число
миллиэквивалентов титранта и анализируемого
вещества должны быть одинаковыми.
Для
проведения титриметрического анализа
необходимо:
-
знать
точную концентрацию титранта; -
точно
измерить объемы растворов титранта и
анализируемого вещества; -
точно
фиксировать момент эквивалентности;
Для
точного измерения объемов растворов
реагирующих веществ используют мерную
посуду – бюретки, пипетки, мерные колбы
и пр.
Момент
эквивалентности определяют:
-
с
помощью индикаторов (Ind); -
по
изменению окраски раствора одного из
реагирующих веществ; -
по
прекращению выпадения осадка или
изменению цвета осадка; -
с
помощью приборов, например, потенциометров,
кондуктометров и пр.
Зная
точную концентрацию титранта, объемы
растворов титранта и исследуемого
вещества, можно легко рассчитать
концентрацию исследуемого вещества в
растворе:
C(1/z)Х=(C(1/z)Т·VТ)/VХ
Из
вышеприведенного уравнения можно
определить титр раствора исследуемого
вещества:
t(x)=(C(1/z)Х·M(1/z)Х)/1000
В
титриметрическом анализе могут
использоваться не все химические
реакции, а только те, которые отвечают
определенным требованиям:
-
реакция
должна быть необратима; -
реакция
должна протекать быстро, в строгом
соответствии с законом эквивалентов,
без побочных процессов; -
необходимо
точно фиксировать момент эквивалентности.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить эквивалент вещества
Эквивалент вещества – это условная или реальная частица, которая может высвобождать, присоединять или любым другим способом быть эквивалентна катиону водорода, участвующему в ионно-обменных реакциях, или электрону в окислительно-восстановительных реакциях. При решении задач под эквивалентом вещества подразумевают эквивалентную молярную массу вещества.

Вам понадобится
- – молярная масса;
- – валентность;
- – кислотность;
- – основность.
Инструкция
Эквивалентная масса является одной из важнейших характеристик веществ. При решении задач она обозначается как M экв. Определяется молярная масса эквивалента какого-либо соединения, исходя из химической формулы исследуемого вещества и его принадлежности к определенному классу химических соединений.
Для того чтобы успешно находить молярные массы эквивалентов, вам потребуется знать такие показатели, как молярная масса – масса одного моля вещества. Основность кислоты – количество атомов водорода, которое кислота может присоединить. Кислотность основания определяется количеством ионов OH-. Валентность – количество химических связей, которое образует атом с другими элементами в соединении.
Формула нахождения эквивалентной массы вещества зависит от того, к какому классу относится исследуемое соединение. К примеру, для нахождения эквивалента вещества у оксидов, вам будет необходимо разделить молярную массу соединения на число атомов кислорода, предварительно умноженное на два. К примеру, для оксида железа Fe2O3 эквивалентная масса будет равняться 56*2 + 16*3/3*2 = 26,7 г/моль.
Для нахождения молярной массы эквивалента вещества у основания, разделите молярную массу основания на его кислотность. Так, для основания Ca(OH)2 эквивалент будет равняться 40 + (16+2)*2/2 = 37 г/моль.
Чтобы найти эквивалент вещества для кислоты, вам будет необходимо сделать следующее действие: поделите молярную массу кислоты на ее основность. Для нахождения молярной массы эквивалента вещества серной кислоты H2SO4 разделите 1*2 + 32 + 16*4/2 = 49 г/моль.
Наконец, для нахождения эквивалента вещества соли разделите молярную массу вещества на число атомов металла, помноженное на его валентность. К примеру, молярная масса эквивалента вещества соли Al2(SO4)3 = 27*2 + (32 + 16*4)*3/1*2 = 171 г/моль.
Источники:
- определение эквивалента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Оглавление
- Определение эквивалента кислой соли, образованной однокислотным основанием и двухосновной кислотой, на основании стехиометрии реакции ионного обмена (на примере гидросульфата натрия NaHSO4)
- Определение эквивалента кислой соли, образованной однокислотным основанием и трехосновной кислотой, на основании стехиометрии реакции ионного обмена (на примерах гидроортофосфата натрия Na2HPO4 и дигидроортофосфата натрия NaH2PO4)
1. Определение эквивалента кислой соли, образованной однокислотным основанием и двухосновной кислотой, на основании стехиометрии реакции ионного обмена (на примере гидросульфата натрия NaHSO4)
Однокислотное основание и двухосновная кислота образуют одну кислую соль. Рассмотрим в качестве примера кислую соль – гидросульфат натрия NaHSO4.
Молекула NaHSO4 в реакциях ионного обмена может использовать один ион водорода, один однозарядный ион Na+, который эквивалентен одному иону водорода, либо двухзарядный ион SO42-, который эквивалентен двум ионам водорода. Таким образом, для данной соли максимальное число эквивалентов в реакциях ионного обмена равно двум.
В зависимости от конкретной реакции, молекула NaHSO4 может содержать один или два эквивалента. А эквивалент данной соли может составлять соответственно одну молекулу NaHSO4 или ½ молекулы NaHSO4.
Приведем примеры таких реакций.
1.
NaHSO4+NaOH=Na2SO4+H2O
2NaHSO4+Na2CO3=2Na2SO4+H2O+CO2
В данных реакциях NaHSO4 превращается в Na2SO4. При этом один ион водорода H+ замещается на ион натрия Na+, т.е. молекула NaHSO4 содержит один эквивалент. Эквивалент NaHSO4 в данных реакциях составляет одна молекула NaHSO4:
Э={NaHSO4}
2.
NaHSO4+Ba(NO3)2=BaSO4↓+NaNO3+HNO3
В данной реакции NaHSO4 превращается в BaSO4. При этом ион водорода H+ и ион Na+, который эквивалентен одному иону водорода, замещаются на ион Ba2+, т.е. молекула NaHSO4 содержит два эквивалента. Эквивалент NaHSO4 в данной реакции составляет ½ молекулы NaHSO4:
Э=½{NaHSO4}
2. Определение эквивалента кислой соли, образованной однокислотным основанием и трехосновной кислотой, на основании стехиометрии реакции ионного обмена (на примерах гидроортофосфата натрия Na2HPO4 и дигидроортофосфата натрия NaH2PO4)
Однокислотное основание и трехосновная кислота образуют две кислые соли. Рассмотрим в качестве примеров кислые соли – гидроортофосфат натрия Na2HPO4 и дигидроортофосфат натрия NaH2PO4.
Молекула Na2HPO4 в реакциях ионного обмена может использовать один ион водорода, два однозарядных иона Na+, каждый из которых эквивалентен одному иону водорода, либо трехзарядный ион PO43-, который эквивалентен трем ионам водорода. Таким образом, для данной соли максимальное число эквивалентов в реакциях ионного обмена равно трем.
В зависимости от конкретной реакции, молекула Na2HPO4 может содержать один, два или три эквивалента. А эквивалент данной соли может составлять соответственно одну молекулу Na2HPO4, ½ молекулы Na2HPO4 или ⅓ молекулы Na2HPO4.
Приведем примеры таких реакций.
1а.
Na2HPO4+H3PO4=2NaH2PO4
В данной реакции Na2HPO4 превращается в NaH2PO4. При этом один ион Na+ замещается на ион водорода H+, т.е. молекула Na2HPO4 содержит один эквивалент. Эквивалент Na2HPO4 в данной реакции составляет одна молекула Na2HPO4:
Э={Na2HPO4}
1б.
Na2HPO4+NaOH=Na3PO4+H2O
В данной реакции Na2HPO4 превращается в Na3PO4. При этом один ион водорода H+ замещается на ион Na+, т.е. молекула Na2HPO4 содержит один эквивалент. Эквивалент Na2HPO4 в данной реакции составляет одна молекула Na2HPO4:
Э={Na2HPO4}
2а.
Na2HPO4+CaCl2=CaHPO4↓+2NaCl
В данной реакции Na2HPO4 превращается в CaHPO4. При этом два иона Na+, каждый из которых эквивалентен одному иону водорода, замещаются на ион Ca2+, т.е. молекула Na2HPO4 содержит два эквивалента. Эквивалент Na2HPO4 в данной реакции составляет ½ молекулы Na2HPO4:
Э=½{Na2HPO4}
2б.
Na2HPO4+H2SO4=Na2SO4+H3PO4
В данной реакции Na2HPO4 превращается в H3PO4. При этом два иона Na+ замещаются на ионы водорода H+, т.е. молекула Na2HPO4 содержит два эквивалента. Эквивалент Na2HPO4 в данной реакции составляет ½ молекулы Na2HPO4:
Э=½{Na2HPO4}
3.
Na2HPO4+FeCl3+CH3COONa=FePO4↓+3NaCl+CH3COOH
В данной реакции Na2HPO4 превращается в FePO4. При этом один ион водорода H+ и два иона Na+, каждый из которых эквивалентен иону водорода, замещаются на ион Fe3+, т.е. молекула Na2HPO4 содержит три эквивалента. Эквивалент Na2HPO4 в данной реакции составляет ⅓ молекулы Na2HPO4:
Э=⅓{Na2HPO4}
Молекула NaH2PO4 в реакциях ионного обмена может использовать два иона водорода, один однозарядный ион Na+, который эквивалентен одному иону водорода, либо трехзарядный ион PO43-, который эквивалентен трем ионам водорода. Таким образом, для данной соли максимальное число эквивалентов в реакциях ионного обмена равно трем.
В зависимости от конкретной реакции, молекула NaH2PO4 может содержать один, два или три эквивалента. А эквивалент данной соли может составлять соответственно одну молекулу NaH2PO4, ½ молекулы NaH2PO4 или ⅓ молекулы NaH2PO4.
Приведем примеры таких реакций.
1.
NaH2PO4+H2SO4=NaHSO4+H3PO4
В данной реакции NaH2PO4 превращается в H3PO4. При этом один ион Na+ замещается на ион водорода H+, т.е. молекула NaH2PO4 содержит один эквивалент. Эквивалент NaH2PO4 в данной реакции составляет одна молекула NaH2PO4:
Э={NaH2PO4}
2.
NaH2PO4+2NaOH=Na3PO4+2H2O
В данной реакции NaH2PO4 превращается в Na3PO4. При этом два иона водорода H+ замещаются на ионы Na+, т.е. молекула NaH2PO4 содержит два эквивалента. Эквивалент NaH2PO4 в данной реакции составляет ½ молекулы NaH2PO4:
Э=½{NaH2PO4}
3.
NaH2PO4+AlCl3+2CH3COONa=AlPO4↓+3NaCl+2CH3COOH
В данной реакции NaH2PO4 превращается в AlPO4. При этом два иона водорода H+ и один ион Na+, который эквивалентен иону водорода, замещаются на ион Al3+, т.е. молекула NaH2PO4 содержит три эквивалента. Эквивалент NaH2PO4 в данной реакции составляет ⅓ молекулы NaH2PO4:
Э=⅓{NaH2PO4}
Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.
Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:
Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.
В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.
А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.
Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.
Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:
Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:
Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.
Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.
Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:
В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:
И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.
В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:
В другой реакции гидроксида калия и фосфорной кислоты:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:
И в третьем случае:
Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:
Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:
Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.
Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?
Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?
Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:
Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.
Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:
У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:
Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:
Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:
Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:
Например:
Для оснований:
Например:
Для кислот:
Например:
Для солей:
Например:
Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.