Эквивалент- количество
вещества, которое входе реакции
присоединяет, замещает, выделяет 1 моль
(атомов) ионов водорода. В ОВР под
эквивалентом понимают такое количество
вещества, которое отдает или присоединяет
1 моль элементов.
Молярная
концентрация(С)-отношение количества
растворенного вещества, к общему
раствора.
С=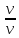
моль/л или М
Нормальная
концентрация(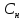 )-
)-
отношение числа эквивалента вещества
к объему раствора.
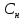 =
=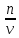 экв/л или Н
экв/л или Н
Связь нормальной и
молярной концентрации С= F*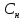
(С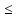
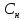 )
)
Эквивалентная
масса(Э)-масса одного эквивалента
вещества, выраженная в граммах. Э гр/экв
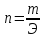
Расчет эквивалентных
масс для соединений различных классов.
1 Оксиды- молярную
массу вещества делят на число атомов
элемента в оксиде, умноженное на его
степень окисления.
Э(CuO)=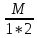 =
=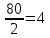 гр/экв (ν=
гр/экв (ν=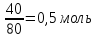 )
)
CuO
+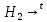
Cu +
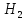 O
O
2 моль H → 1 моль CuO
1 моль H → 0,5 моль CuO
 + 3
+ 3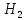 → 2Fe + 3
→ 2Fe + 3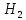 O
O
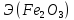 =
=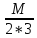 =
=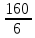 =27
=27
г/экв
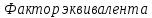 -концентрация,
-концентрация,
на которую надо умножить массу при
расчете эквивалентной массы.
f (
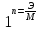 ) f =
) f =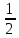
2 Кислоты – молярную
массу делят на число атомов водорода,
замещенных в молекуле кислоты входе
реакции.
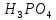 + 3NaOH
+ 3NaOH
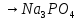 +3
+3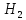 O
O
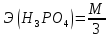 =
=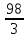 = 33 г/экв f =
= 33 г/экв f =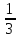
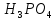 +
+
2NaOH
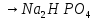 + 2
+ 2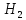 O
O
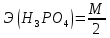 =
=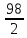 = 49 г/экв f =
= 49 г/экв f =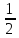
Для одноосновных
кислот молярная масса и эквивалент
равны .
3 Основания( щелочи
) – молярную массу делят на число
гидроксильных групп, замещаемых в
молекуле основания входе реакции.
 +
+
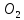 → 2NO
→ 2NO
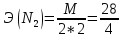 = 7 г/экв f =
= 7 г/экв f =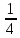
4 Соли- молярную
массу делят на число атомов металла
,умноженных на его валентность.
Закон эквивалентов-
в химических реакциях вещества реагируют
и образуются в количествах, равных
эквивалентам ( сколько эквивалентов
в-ва расходовано, столько же эквивалентов
другого в-ва образовалось)
Объемный анализ-
является одним из методов количественного
анализа. Сущность метода заключается
в измерении объема раствора реактива
известной концентрации, затраченного
на реакцию. При анализе раствор реактива,
концентрация которого известна, из
калиброванного по объему сосуда (бюретки)
по каплям приливают к исследуемому
раствору до тех пор, пока тем или иным
способом не будет установлено, что все
вещество в исследуемом растворе
прореагировало с добавляемым реактивом.
Эта процедура называется титрование
4.Электронное
строение атомов. Корпускулярно-волновой
дуализм электронов. Атомная орбиталь.
Энергетические уровни и подуровни.
Квантовые числа, их физический смысл.
Электронное строение
атома.
В атоме, с точки
зрения механики, электрон рассматривается
одновременно и как частица(имеет массу
и заряд) и как волна(явление дифракции)или
как говорят, обладает корпускулярно-волновым
дуолизмом.
Область околоядерного
пространства, в котором наиболее вероятно
нахождение электрона -атомная орбиталь
.В этой области как бы «размазан» заряд
электронов.
Электроны с
приблизительно равной энергией,
находящиеся приблизительно на одинаковом
расстоянии от ядра, образуют электронный
слой(энергетический уровень). В пределах
одного энергетического уровня электроны
могут незначительно различаться по
энергии, располагаясь на различных
энергетических подуровнях.
Движение электронов
в атоме описывается волновым уравнением
Шредингера, решение которой- волновая
функция пси (Ψ)- может быть отображено
набором целых чисел, называемых квантовыми
числами.
Главное квантовое
число (n)-принимает значение натуральных
чисел, показывает на каком энергетическом
уровне от ядра расположен электрон.
Орбитальное(побочное)
квантовое число(l)-зависит от n, принимая
значения от 0 до n-1 включительно. Показывает
на каком энергетическом подуровне
находится электрон, определяет форму
орбитали электрона. Число значений l
для данного n показывает число подуровней
на данном энергетическом уровне.
Числовым значениям
l поставлено в соответствии буквенное
обозначение.
|
Главное |
0 |
1 |
2 |
3 |
|
Буквенное |
s |
p |
d |
f |
|
Форма |
|
|||
|
Число |
1 |
3 |
5 |
7 |
|
Максимальное |
2 |
6 |
10 |
14 |
Электронное строение
атомов всех хим. элементов описывается
четырьмя видами орбиталей: s, p,
d, f.
Электроны, располагающиеся на s подуровне-
s электроны, и т. д
Магнитное квантовое
число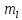
зависит от l, принимает целые значения
от –l…., 0….,+l. Определяет взаимную
ориентацию орбиталей. Число значений
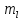 определяет число орбиталей на данном
определяет число орбиталей на данном
подуровне.
Для полного описания
электрона в атоме потребовалось ввести
четвертое квантовое число-
Спиновое квантовое
число
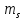
которое принимает 2 значения ±0,5. В
приближенной форме можно сказать, что
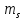 отражает возможность вращения электрона
отражает возможность вращения электрона
вокруг своей оси как по часовой стрелке,
так и против нее.
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Эквивалент – это реальная или условная
частица, которая в кислотно-основных реакциях присоединяет
(или отдает) один ион Н+ или ОН–, в
окислительно-восстановительных реакциях принимает (или отдает) один
электрон, реагирует с одним атомом водорода или с одним эквивалентом
другого вещества. Например, рассмотрим следующую
реакцию:
H3PO4 + 2KOH
®
K2HPO4 + 2H2O.
В
ходе этой реакции только два атома водорода замещаются на атомы
калия, иначе, в реакцию вступают два иона Н+ (кислота
проявляет основность 2). Тогда по определению эквивалентом
H3PO4
будет являться условная частица 1/2H3PO4,
т.к. если одна молекула H3PO4
предоставляет два иона Н+, то один ион Н+ дает
половина молекулы H3PO4.
С
другой стороны, на реакцию с одной молекулой ортофосфорной кислотой
щелочь отдает два иона ОН–, следовательно, один ион ОН–
потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом
кислоты является условная частица 1/2Н3РО4, а
эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы
или другой частицы вещества соответствует эквиваленту, называется
фактором эквивалентности (fЭ).
Фактор эквивалентности – это безразмерная величина, которая меньше,
либо равна 1. Формулы расчета фактора эквивалентности приведены в
таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу
вещества, можно составить формулу эквивалента какой-либо частицы,
где фактор эквивалентности записывается как химический коэффициент
перед формулой частицы:
fЭ
(формульная единица вещества)
º
эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты,
соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4
и КОН также могут происходить и другие реакции. При этом кислота
будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH
®
K3PO4 + 3H2O
fЭ(H3PO4)
= 1/3
H3PO4 + KOH
®
KН2PO4
+ H2O fЭ(H3PO4)
= 1.
Следует учитывать, что эквивалент одного
и того же вещества может меняться в зависимости от того, в какую
реакцию оно вступает. Эквивалент элемента также может быть
различным в зависимости от вида соединения, в состав которого он
входит. Эквивалентом может являться как сама молекула или
какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 –
Расчет фактора эквивалентности
|
Частица |
Фактор |
Примеры |
|
Элемент |
где В(Э) – |
|
|
Простое вещество |
где |
fЭ(H2)
fЭ(O2)
fЭ(Cl2)
fЭ(O3) |
|
Оксид |
где |
|
|
Кислота |
где |
fЭ(H2SO4) или
fЭ(H2SO4) (основность равна 2) |
|
Основание |
где |
fЭ(Cu(OH)2)
fЭ(Cu(OH)2)
|
|
Соль |
где |
|
|
Частица в |
где |
Fe2+
fЭ(Fe2+)
MnO4–
fЭ(MnO4–) |
|
Ион |
где |
fЭ(SO42–) |
Пример.
Определите фактор эквивалентности и эквивалент у солей: а)
ZnCl2, б) КНСО3, в)
(MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в
таблице 1.1.
а)
ZnCl2 (средняя соль):
![]() .
.
fЭ(ZnCl2)
= 1/2, поэтому эквивалентом ZnCl2
является частица 1/2ZnCl2.
б) КНСО3
(кислая соль):
![]() .
.
fЭ(КНСО3) = 1,
поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4
(основная соль):
![]() .
.
fЭ(
(MgOH)2SO4
) = 1/2, поэтому эквивалентом
(MgOH)2SO4
является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой
(молярным объемом) и определенным
количеством вещества
nэ.
Молярная масса эквивалента (МЭ)
– это масса одного моль эквивалента. Она равна
произведению молярной массы вещества на фактор эквивалентности:
Молярная масса
эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного
вещества равна сумме молярных масс эквивалентов образующих его
составных частей, например:
МЭ(оксида) = МЭ(элемента)
+ МЭ(О) = МЭ(элемента)
+ 8
МЭ(кислоты) = МЭ(Н)
+ МЭ(кислотного остатка) = 1 + МЭ(кислотного
остатка)
МЭ(основания) = МЭ(Ме)
+ МЭ(ОН) = МЭ(Ме) +
17
МЭ(соли) = МЭ(Ме)
+ МЭ(кислотного остатка).
Газообразные вещества помимо молярной массы эквивалента имеют
молярный объем эквивалента (![]()
или VЭ)
– объем, занимаемый молярной массой эквивалента или объем одного
моль эквивалента. Размерность «л/моль».
При н.у. получаем:
![]()
Закон
эквивалентов был открыт в 1792 г. И. Рихтером.
Современная формулировка закона:
вещества реагируют и образуются согласно их эквивалентам.
Все вещества в уравнении реакции связаны законом эквивалентов,
поэтому:
nэ(реагента1)
= … = nэ(реагентаn)
=
nэ(продукта1)
= … =
nэ(продуктаn)
Из закона эквивалентов следует, что массы (или объемы)
реагирующих и образующихся веществ пропорциональны молярным массам
(молярным объемам) их эквивалентов. Для любых двух веществ,
связанных законом эквивалентов, можно записать:
где m1 и
m2 – массы реагентов и
(или) продуктов реакции, г;
![]() ,
, ![]() –
–
молярные массы эквивалентов реагентов и (или) продуктов реакции,
г/моль;
V1, V2
– объемы реагентов и (или) продуктов реакции, л;
![]() ,
,![]() –
–
молярные объемы эквивалентов реагентов и (или) продуктов реакции,
л/моль.
Л.А. Яковишин
Как найти эквивалент
Эквивалентом называется частица, которая химически равноценна (эквивалентна) в кислотно-основных реакциях одному иону водорода, а в реакциях окислительно-восстановительного типа – одному электрону. Эквивалент выражается числом без размерности, тогда как эквивалентная масса измеряется в г/моль.

Вам понадобится
- – калькулятор;
- – периодическая таблица
Инструкция
Чтобы можно было найти эквивалент того или иного вещества, вы должны использовать формулу: 1/z (какое-то вещество),где 1/z – фактор эквивалентности (fэ), то есть число, которое показывает, какая доля частицы вещества равноценна эквиваленту. Эта величина всегда меньше или равна единице. Проще говоря, фактор эквивалентности – это некий коэффициент, который записывается непосредственно перед формулой вещества при нахождении эквивалента. Например, вам надо найти эквивалент фосфорной кислоты при ее взаимодействии с гидроксидом натрия. Запишите уравнение реакции:2NaOH + H3PO4 = Na2HPO4 + 2H2OОтсюда видно, что на атомы натрия замещаются только два атома водорода, то есть кислота является двуосновной (в реакции участвуют 2 иона Н+). Таким образом, согласно определению, эквивалентом фосфорной кислоты будет условная частица ½ H3PO4.
Учтите, что эквивалент одного и того же вещества изменяется в зависимости типа реакции, в которую это вещество вступает. Кроме того, эквивалент элемента находится в зависимости от вида соединения, в состав которого входит. Возьмите те же вещества, что и в предыдущем случае, но реакция пусть пойдет по-другому:3NaOH + H3PO4 = Na 3PO4 + 3H2O.Здесь fэ(H3PO4) = 1/3, fэ(NaOH) =1. Следовательно, эквивалент фосфорной кислоты – частица 1/3 H3PO4, а эквивалент щелочи равен единице.
Для успешного нахождения эквивалентов различных веществ вам необходимо запомнить формулы для нахождения fэ в зависимости от типа химического соединения. Так для простых элементов fэ = 1/ валентность элемента. Пример: fэ ( H2SO4) = 1/6, а эквивалент серы в H2SO4 равен 6.Для солей – fэ = 1/n (мет.) – B(мет.) = 1/ n (к.о.) – B(к.о.), гдеn (мет.) – количество атомов металла,B(мет.) – валентность металла,n (к.о.) – количество кислотных остатков,B(к.о.) – валентность кислотного остатка и т.д.
Сложнее находить эквивалент вещества в реакциях окислительно-восстановительного типа, так как расчет вы будете вести по числу электронов, которые принимают участие в процессе восстановления или окисления. Дано задание найти эквивалент гидроксида марганца в реакции: 2Mn(OH)2 + 12NaOH + 5Cl2 = 2NaMnO4 + 10NaCl + 8H2OИз уравнения видно, что марганец отдает 5 электронов и переходит из Mn +2 в Mn +7. Значит, фактор эквивалентности Mn(OH)2 – 1/5, а эквивалент гидроксида равен 5.
Полезный совет
При расчете не забывайте о том, что эквивалентом может быть сама молекула или же какая-нибудь другая единица вещества.
Источники:
- эквивалент кислоты
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
как вычисляется эквивалент кислот и оснований
Профи
(757),
закрыт
13 лет назад
Алексей
Мудрец
(14272)
13 лет назад
покажу напримере HCLO4
Э (HClO4)= молярная масса (HClO4)/кол-во атомов водорода=100.5/1=100.5 г/моль
Эквивалент простого в-ва= молярная масса в-ва/валентность
эквивалент кислоты= молярная масса/кол-во атомов водорода
эквивалент основания=молярная масса/кол-во гидроксильных групп
эквивалент соли=молярная масса/валентность металла*его кол-во
Татьяна Иванова
Гений
(56765)
13 лет назад
Уточню: делим на число атомов водорода (или гидроксогрупп) , замещаемых в данной реакции.
Например, если 2-основная кислота в недостатке, и замещается только 1 атом водорода (получается кислая соль) , то молярную массу надо делить не на 2 (число атомов водорода в молекуле кислоты) , а на 1 (число ЗАМЕЩЁННЫХ в данной реакции атомов водорода)

