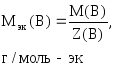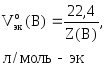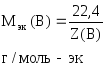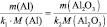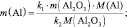Эквивале́нт вещества́ или просто эквивале́нт — реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-осно́вных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции 



Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число молей вещества, эквивалентное одному молю катионов водорода в рассматриваемой реакции.
Эквивалентная масса[править | править код]
Эквивалентная масса — это масса одного эквивалента данного вещества.
Эквивалентная молярная масса вещества[править | править код]
Молярная масса эквивалентов обычно обозначается как 

Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества:
Фактор эквивалентности[править | править код]
Отношение эквивалентной молярной массы к собственной молярной массе вещества называется фактором эквивалентности (обозначается обычно как 
Число эквивалентности[править | править код]
Число эквивалентности 


Например, в реакции
эквивалентом является мнимая частица 



| вещество | реакция | |||
|---|---|---|---|---|
| простое * | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |

|
число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |

|
характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
*Для инертных газов 
Фактор эквивалентности помогает сформулировать закон эквивалентности.
Закон эквивалентов[править | править код]
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2 = m2Э1
См. также[править | править код]
- Электрохимический эквивалент
Примечания[править | править код]
- ↑ IUPAC Gold Book internet edition: «equivalent entity».
- ↑ International Union of Pure and Applied Chemistry (1998). Compendium of Analytical Nomenclature (definitive rules 1997, 3rd. ed.). Oxford: Blackwell Science. ISBN 0-86542-6155. section 6.3.
Литература[править | править код]
- Кремлёв А. М. Эквиваленты химические // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Обозначение
nэк(В),
единицы измерения моль-эк.
Если известна масса вещества и молярная
масса эквивалентов, то количество
вещества эквивалентов рассчитывают по
формуле:
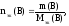 (21)
(21)
где
m(В)
– масса вещества, г;
Мэк(В)
– молярная масса эквивалентов вещества,
г/моль-эк.
Для
газообразных веществ можно рассчитать
nэк(В),
зная объем газа, который он имеет при
н.у.:
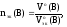 (22)
(22)
где
Vo(В)
– объем газа при н.у., л;
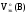 –молярный
–молярный
объем эквивалентов газа при н.у., л/моль-эк
Между
количеством вещества эквивалентов
nэк(В)
и количеством вещества n(В)
существует простая зависимость :
nэк(В)
= n(В)
· Z(В)
(23)
Пример.
Рассчитать Z(В),
Мэк(В) всех веществ, принимающих участие
в реакциях а) и б), а так же
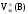 газообразных веществ в реакции а).
газообразных веществ в реакции а).
а)
Fe2O3
(т)
+ 3CO(г)
= 2Fe(т)
+ 3CO2(г)
б)
Al2(SO4)3
+ 6NaOH = 2Al(OH)3
+ 3Na2SO4
Решение.
Прежде всего необходимо определить к
какому типу реакций (обменная или
окислительно – восстановительная)
относится данная реакция, для чего
рассчитывают степени окисления атомов
или групп атомов в формульных единицах
всех веществ.
Реакция
а)
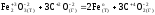
является
окислительно-восстановительной.
Находим
атомы, которые изменяют степени окисления,
и выписываем их, с учетом числа в составе
одной формульной единицы и числа отданных
и принятых электронов:
а)
для реагентов

б)
для продуктов
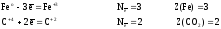
Расчеты
всех величин приведены в таблице 5.
Таблица
5
|
ФЕ |
|
Z(B) |
M(B), |
|
|
|
Fe2O3 |
6 |
6 |
160,0 |
26,7 |
– |
|
CO |
2 |
2 |
28,0 |
14,0 |
11,2 |
|
Fe |
3 |
3 |
56,0 |
18,7 |
– |
|
CO2 |
2 |
2 |
44,0 |
22,0 |
11,2 |
Реакция
б)
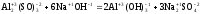
является
обменной, т.к. степени окисления атомов
и групп атомов в ходе реакции не
изменяются. Далее необходимо выбрать
те части формульных единиц (положительно
или отрицательно заряженных) по которым
будет производится расчет суммарного
заряда замещающихся ионов, а далее –
Z(B)
и Мэк(В). Расчеты приведены в таблице 6.
Таблица
6.
|
ФЕ |
Замещаю- щиеся ионы |
qi |
Ni |
Z(В)= |
М(В), г/моль |
|
|
Al2(SO4)3 |
SO4–2 |
–2 |
3 |
3·2=6 |
342,0 |
57,0 |
|
NaOH |
Na+ |
+1 |
1 |
1·1=1 |
40,0 |
40,0 |
|
Al(OH)3 |
OH– |
–1 |
3 |
3·1=3 |
78,0 |
26,0 |
|
Na2SO4 |
Na+ |
+1 |
2 |
2·1=2 |
142,0 |
71,0 |
6. Закон эквивалентов.
Согласно
закону эквивалентов все
вещества реагируют и образуются в
эквивалентных количествах.
Например,
для реакции
2CO
+ O2
= 2CO2
(24)
nэк(CO)
= nэк(O2)=nэк(CO2)
(25)
Для
реакции в общем виде:
nAA
+ nBB
= nCC
+ nDD
, (26)
где
A,B
– реагенты;
C,D
– продукты реакции;
nA,nB,nC,nD
– стехиометрические коэффициенты,
закон
эквивалентов
имеет вид:
nэк(A)
= nэк(B)
= nэк(C)
= nэк(D)
(27)
Т.е.
количество вещества эквивалентов всех
участвующих в реакции (26) веществ
(реагентов А и В и образовавшихся
продуктов C
и D)
одинаковы. Поэтому, если количество
вещества эквивалентов одного из веществ
(реагента или продукта) известно по
условию задачи, то определены и nэк
всех остальных веществ, участвующих в
реакции, и необходимость их расчета
отпадает. В этом состоит преимущество
проведения расчетов по закону эквивалентов.
Для
любой химической реакции (см. уравнение
реакции в общем виде (26)) соблюдается
условие (27), которое также может быть
представлено следующим образом:
n(А)
· Z(A)=
n(В)
· Z(B)=
n(С)
· Z(C)=
n(D)
· Z(D)
(28)
Условие
(28) упрощает определение эквивалентного
числа в сложных реакциях.
Пример.
Определить Z(Cr2(SO4)3)
в обменной реакции, выраженной уравнением
Cr2(SO4)3
+ 12KOH = 2K3[Cr(OH)6]
+ 3K2SO4
Решение.
Для приведенной реакции запишем условие
(28):
n(
Cr2(SO4)3)
· Z(Cr2(SO4)3)=
n(
KOH) · Z(KOH)
Из
уравнения реакции:
n(
Cr2(SO4)3)
= 1 n(KOH)
= 12
Поскольку
Z(KOH)
= 1 (не может быть другим, см. табл. 2), то
![]()
![]()
Если
известны массы веществ, участвующих в
реакции, то используя уравнения (21) и
(27) можно записать:
![]() (29)
(29)
или
![]() (30)
(30)
Уравнение
(30) является математическим выражением
закона эквивалентов.
Если
одно из веществ уравнения (26), например
B,
находится в газообразном состоянии и
известен его объем при н.у., то количество
вещества эквивалентов этого газа можно
рассчитать по уравнению (22), а математическая
запись закона эквивалентов для веществ
A
и B
будет иметь вид:
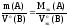 (31)
(31)
Пример.
Рассчитать массу алюминия, вступившего
в реакцию с разбавленной серной кислотой,
если в результате реакции образуется
10,2 л водорода (н.у.).
Решение.
Запишем уравнение реакции и укажем
степени окисления атомов и заряды ионов:
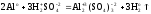
Реакция
окислительно-восстановительная. Находим
атомы, которые изменяют степени окисления,
и выписываем их, с учетом числа в составе
одной формульной единицы и числа отданных
и принятых электронов:
Alo
–
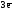 =
=
Al+3 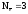 Z(Al) = 3
Z(Al) = 3
H2o
–
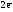 =
=
2H+1  Z(H2)
Z(H2)
= 2
Согласно
закону эквивалентов:
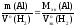 .
.
Отсюда
выражаем массу алюмиия:
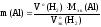
Рассчитаем
Мэк(Al)
и
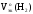 :
:
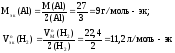
Подставив
полученные значения Мэк(Al)
и
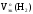 ,
,
а так жеVo(H2),
рассчитаем массу алюминия:
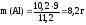
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.

Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:

Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.

В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.

А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.

Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.

Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:

Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:

Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.

Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.

Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:

В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:

И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.

В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:

В другой реакции гидроксида калия и фосфорной кислоты:

Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:

И в третьем случае:

Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:

Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:

Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
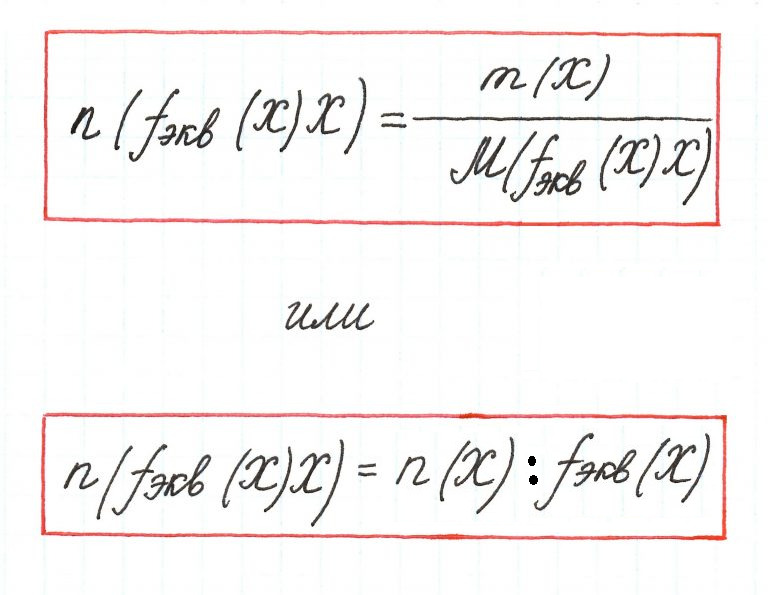
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.

Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?

Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?

Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:

Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.

Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:

У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:

Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:

Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:

Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:

Например:

Для оснований:

Например:

Для кислот:

Например:

Для солей:

Например:

Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

§ 2.1.3. Закон эквивалентов. Закон приведённого количества вещества
Закон эквивалентов гласит:
Вещества взаимодействуют друг с другом равными количествами молярных масс эквивалентов:
nЭ1 = nЭ2,
где nЭ1 – количество молярных масс эквивалента одного вещества; nЭ2 – количество молярных масс эквивалента другого вещества, взаимодействующего с первым. Действительно, если рассчитать количества молярных масс эквивалентов взаимодействующих веществ для любой из рассмотренных выше реакций, то они окажутся равными.
Последнее равенство можно представить иначе:
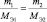
или 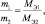
где m1 и m2 – массы реагирующих веществ; МЭ1 и МЭ2 – молярные массы их эквивалентов.
Все три последние равенства являются математическими формами записи закона эквивалентов.
Согласно закону эквивалентов для реакции:
k1А + k2B = k3C + k4D
должно выполняться
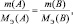
где m(A) и m(B) массы веществ А и В соответственно, МЭ(А) и МЭ(B) – молярные массы их эквивалентов. Или в соответствии с (2):
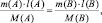
где M(A) и M(B) молярные массы веществ А и В, l(A) и l(B) количества активных связей в молекулах А и В соответственно.
После простейшего преобразования можно легко получить:
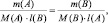
поскольку, в данном случае l(B) = k1; l(A) = k2, то:
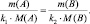 (2.3)
(2.3)
Так как последнее равенство справедливо для любой пары участвующих в реакции веществ (исходных и продуктов), то можно утверждать, что
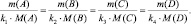
То есть, в пределах любой одной и той же химической реакции
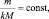 (2.4)
(2.4)
где 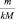 – приведённое количество вещества.
– приведённое количество вещества.
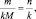
где n – количество вещества.
Приведённым количеством вещества называется отношение количества вещества к его стехиометрическому коэффициенту.
Равенства (2.3) и (2.4) представляют собой математические формы записи закона приведённого количества вещества, согласно которому
приведённые количества веществ участвующих в реакции (исходных и продуктов) равны между собой.
Закон приведённого количества вещества вытекает также из простого анализа привычных пропорций:
k1А + k2B = k3C + k4D;
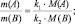
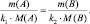
В общем случае
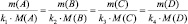
или 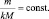
Согласно следствию закона приведённого количества вещества
приведённые количества элементов одного и того же сложного вещества равны между собой
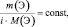
где m(Э) – масса или процентное содержание одного из элементов в данной навеске вещества; М(Э) – молярная масса этого элемента; i – индекс этого элемента в данном веществе, величина 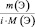 – приведённое количество элемента.
– приведённое количество элемента.
Иногда, в одной и той же реакции вещество может проявлять различные молярные массы эквивалента, что может некорректно восприниматься как нарушение закона эквивалентов. Например, при реакции разбавленной азотной кислоты с медью:
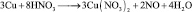 (2.5)
(2.5)
из восьми молекул азотной кислоты 2 молекулы являются окислителями, превращаясь в NO, а 6 молекул участвуют в процессе, не сопровождающемся изменением степени окисления. То есть, вся реакция делится на два взаимодействия:
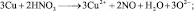

Хотя, реально частица O2– не существует, однако, из приведённой схемы видно, что в первом взаимодействии.
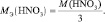
А во втором взаимодействии
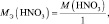
при этом, в обоих случаях закон эквивалентов выполняется – количества молярных масс эквивалентов всех взаимодействующих веществ и частиц равны шести.
При составлении уравнений окислительно-восстановительных реакций, стехиометрические коэффициенты перед восстановителем (kв), отдающим nв электронов, и перед окислителем (kо), принимающим nо электронов, можно рассчитывать с помощью следующих формул:
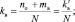 (2.6)
(2.6)
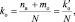 (2.7)
(2.7)
где mв – количество молекул восстановителя, не участвующих в восстановлении; mo – количество молекул окислителя, не принимающих участия в окислении; N – максимальное число, которому кратны все коэффициенты уравнения. Например, для реакции (2.5)
nо = 3; nв = 2; mo = 6; mв = 0; N = 1,
поэтому
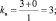
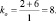
Примеры решения задач
1. Пользуясь, следствиями закона эквивалентов, определить массу алюминия, израсходованного на получение 5,1 г оксида алюминия, если молярная масса алюминия 27 г/моль, молярная масса оксида алюминия 102 г/моль.
Прежде, чем приступить к решению подобной задачи целесообразно записать уравнение реакции
4Al + 3O2 = 2Al2O3.
|
Дано: m(Al2O3) = 5,1 г M(Al) = 27 г/моль М(Al2O3) = 102 г/моль k1 = 4 моль k2 = 2 моль |
Решение: Согласно следствию закона эквивалентов:
или |
|
m(Al) – ? |
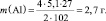
Ответ: m(Al) = 2,7 г.
2. Пользуясь равенствами 2.6 и 2.7 расставить коэффициенты в схеме реакции взаимодействия цинка с очень разбавленной азотной кислотой:
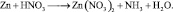
Решение
В данной реакции окислителем является азотная кислота, в которой атом азота принимает 8 электронов, то есть nо = 8. Поскольку mв = 0, то 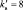 . Окисленной формы цинка в правой части уравнения также должно быть 8 атомов.
. Окисленной формы цинка в правой части уравнения также должно быть 8 атомов.
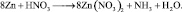
Из последней схемы видно, что mo = 16; nв = 2. Следовательно 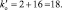 Восстановленной формы азота в правой части уравнения должно быть только два атома
Восстановленной формы азота в правой части уравнения должно быть только два атома
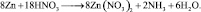
Все коэффициенты можно сократить на 2, то есть в данном случае N = 2. Поэтому, окончательно kв = 4; kо = 9
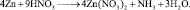
Задачи для самостоятельного решения
1. Пользуясь законом приведённого количества вещества, определить массу сульфита натрия, необходимую для полного превращения 0,2 моль перманганата калия в сульфат марганца по реакции:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O. (2.8)
Сколько грамм воды выделится в результате этой реакции?
2. Определить массу бихромата калия, необходимую для полного превращения 49,8 г. иодида калия в йод по реакции:
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O. (2.9)
Сколько грамм йода образуется в результате этой реакции?
Решить задачу двумя способами – пользуясь пропорциями и пользуясь законом приведёного количества вещества.
3. Пользуясь законом приведённого количества вещества, определить химическую формулу оксида меди, если в нём содержится 89 массовых процента меди, и 11 массовых процента кислорода.
4. Пользуясь равенствами (2.6) и (2.7) расставить коэффициенты в схеме реакции:
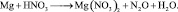
1. Сформулируйте закон эквивалентов и закон приведённого количества вещества.
2. Что такое приведённое количество вещества?
3. Выведите закон приведённого количества вещества из закона эквивалентов.
Как определить эквивалент вещества?
Ученик
(45),
закрыт
11 лет назад
NN
Мастер
(1513)
12 лет назад
Эквивалентная масса (молярная масса эквивалента вещества) mэкв также является одной из важнейших характеристик вещества. По определению эквивалент вещества – это такое количество химического вещества, которая реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений. Величина mэкв определяется или экспериментально, или, чаще всего, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений (мы будем рассматривать только неорганические соединения)
mэкв (оксида) = Моксида/(число атомов кислорода·2);
mэкв (основания) = Моснования/кислотность основания;
mэкв (кислоты) = Мкислоты/основность кислоты;
mэкв (соли) = Мсоли/(число атомов металла·валентность металла) .
Можно отметить, что в большинстве случаев кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты.
Например: mэкв (Fe2O3) = М (Fe2O3)/(3·2) = 160/6 = 26,7 г/моль;
mэкв (H2SO4) = M(H2SO4)/2 = 98/2 = 49 г/моль;
mэкв (Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль;
mэкв (Al2(SO4)3) = M(Al2(SO4)3) = 342/2 = 171 г/моль;
Эквивалентные массы веществ используют для количественных расчетов при химических взаимодействиях между веществами. Огромным преимуществом при этом является то, что для этого не нужно использовать уравнение химической реакции (которое во многих случаях написать затруднительно) , нужно только знать, что данные химические вещества взаимодействуют между собой или вещество является продуктом химической реакции.
Для количественных расчетов используется закон эквивалентов: массы реагирующих и образующихся веществ относятся друг к другу, как их эквивалентные массы.
Математическое выражение закона эквивалентов имеет следующий вид:
m1/m2 = mэкв (1)/mэкв (2)(1.2)
где: m 1 и m 2 – массы реагирующих или образующихся веществ,
mэкв (1) и mэкв (2) – эквивалентные массы этих веществ.
Пример: определить массу соды (карбоната натрия) Na2CO3, необходимую для полной нейтрализации 1,96 кг серной кислоты H2SO4.
Решение:
Воспользуемся законом эквивалентов
m(Na2CO3)/m(H2SO4) = mэкв (Na2CO3)/mэкв ( H2SO4)
Определяем эквивалентные массы веществ, исходя из их химических формул:
m (Na2CO3) = 106 /(2·1) = 53 г/моль;
mэкв (H2SO4) = 98/2·1 = 49 г/моль.
Тогда:
Х / 1,96кг = 53 г/моль / 49 г/моль
Х = 2,12 кг.
Ирина Миняшина
Мудрец
(12270)
12 лет назад
Для щёлочи молярная масса поделить на количество ОН, для кислоты – она же на количество Н, для соли – она же делить на произведение кол-ва атомов металла и валентоности этого металла.