Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение объема водорода
Задача № 11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
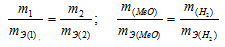
Та как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 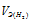 , молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
Тогда можно записать:
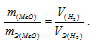
Отсюда:
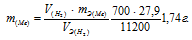
Ответ: 1,74г.
Определение эквивалентной массы вещества
Задача № 12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
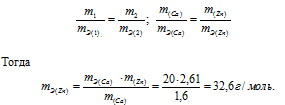
Ответ: 32,6г/моль.
Определение отношения масс реагирующих веществ
Задача № 13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Формула сульфата имеет вид MeSO4, а дигидроортофосфата – MeH2PO4. Таким образом, на образование сульфата затрачивается две эквивалентные массы щёлочи, а на образование дигидроортофосфата – одна эквивалентная масса щёлочи. Так как H2SO4 с двумя эквивалентными массами щёлочи, то её эквивалентная масса в реакции нейтрализации равна М/2 г/моль, а фосфорная кислота реагирует с одной эквивалентной массой щёлочи, то её эквивалентная масса равна М/1г/моль. Отсюда, отношение мас этих кислот, с учётом, что их молекулярные массы равны будет иметь вид:
mH2SO4 : mH3PO4 = ½M : 1M = 1 : 2
Это можно подтвердить уравнениями реакций нейтрализации этих кислот с гидроксидом натрия:
H2SO4 +2NaOH = Na2SO4 + 2H2O;
H3PO4 + NaOH = NaH2PO4 +H2O.
Ответ: mH2SO4 : mH3PO4 = 1 : 2.
Задача № 14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Согласно закону эквивалентов 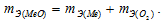 По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
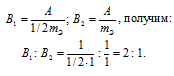
Таким образом, валентность меди в первом оксиде равна II, а во втором – I.
Ответ: 2 : 1.
Определение значения эквивалентной массы вещества
Задача № 15
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты.
Решение:
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Эквивалент (эквивалентная масса) кислоты равна мольной массе (М) делённой на число атомов водорода, замещённых в данной реакции на металл (на число вступающих в реакцию атомов водорода). Так как при взаимодействии ортофосфорной кислоты со щёлочью образовалась соль Na2HPO4, т.е. на натрий заместилось два атома водорода в кислоте H3PO4. Следовательно, эквивалентная масса ортофосфорной кислоты в реакции со щёлочью при образовании гидрофосфата натрия равна М/2 = М(H3PO4)/2 = 98/ 2 = 49г/моль.
Ответ: 49г/моль.
Задача № 16
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
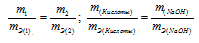
Эквивалентная масса гидроксида натрия равна М(NaOH)0/1 = 40г/моль.
Тогда
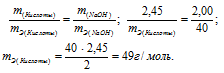
Ответ: 49г/моль.
Задача № 17
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
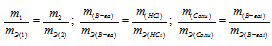
Эквивалентная масса хлороводорода равна М(HCl) = 36,5/1 = 36,5г/моль.
Тогда
а) Находим эквивалентную массу вещества:
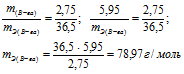
б) Находим эквивалентную массу соли:
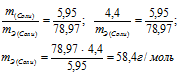
Ответ: а) 58,4г/моль; б) 78,97 г/моль.
Определение эквивалентного объема водорода
Задача № 18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Если одно из веществ находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
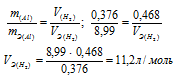
Ответ: 11,2л/моль.
В какой массе гидроксида натрия (NaOH) содержится столько же эквивалентов, сколько в 140 граммах гидроксида калия (KOH)?
Решение задачи
Рассчитаем молярную массу эквивалента гидроксида калия (KOH) по формуле:
![]()
Напомню то, что молярная масса эквивалента (Mэкв.) – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Получаем:
![]()
![]()
Фактор эквивалентности (fэкв) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Следовательно, в 140 г гидроксида калия (KOH) содержится 140/56 = 2,5 эквивалентов.
Рассчитаем молярную массу эквивалента гидроксида натрия (NaOH) по формуле:
![]()
Получаем:
![]()
Отсюда:
2,5 эквивалента составляют 40 г/моль ∙ 2,5 моль = 100 (г).
Ответ:
масса гидроксида натрия равна 100 грамм.
Найдите эквивалент гидроксида натрия
Опубликовано 29/08/2019
Легкое задание по химии:
Найдите эквивалент гидроксида натрия
Решается оно очень быстро. Так выглядит ответ:
Нам нужно найти эквивалент гидроксида натрия. В дано запишем гидроксид натрия NaOH. Для решения задания мы должны воспользоваться формулой, которая дана выше во втором столбце. Необходимо в неё подставить все известные нам данные из таблицы Менделеева и посчитать. Сорок разделить на один получится 40. Именно такой показатель и является эквивалентом гидроксида натрия. Это и будет правильный ответ на поставленный вопрос.
чему равна эквивалентная масса гидроксида натрия
Найдите правильный ответ на вопрос ✅ «чему равна эквивалентная масса гидроксида натрия …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » чему равна эквивалентная масса гидроксида натрия
Эквивалентом
вещества
называется такое его количество, которое
соединяется с 1 молем атомов водорода
или замещает один моль атомов водорода
в химических реакциях.
Закон
эквивалентов:
массы взаимодействующих веществ
пропорциональны их эквивалентным
массам.
Эквивалентной
массой
называется масса 1 эквивалента вещества,
выраженная в г/экв. или в г/моль.
На
основе закона эквивалентов можно вывести
формулу для вычисления эквивалентных
масс сложных веществ.
![]() ,
,
где n
зависит от класса неорганического
соединения.
Для
оксидов n
=число атомов элемента умноженное на
валентность элемента.
Для
кислот n
= основности кислоты (число атомов
водорода).
Для
оснований n
= число гидроксогрупп.
Для
соли n
= число атомов металла умноженное на
валентность металла.
Пример1.
Определить массу гидросульфата натрия,
образующегося при нейтрализации серной
кислотой раствора, содержащего 8 г NaOH.
Решение.
Из закона эквивалентов следует, что при
решении любой задачи нет необходимости
знать как проходит реакция, а тем более
как выглядит уравнение химических
реакции. Нам нужно знать массу одного
из реагирующих веществ. Значение
эквивалентной массы можем вычислить
по приведенным выше выражениям.
Определим
эквивалентную массу гидроксида натрия.
Эm(NaOH)=M(NaOH)/1=40
г/моль. Следовательно, число эквивалентов
NaOH,
которое принимает участие в реакции,
составляет Z
= 8/40 =0,2 моль.
Эквивалентная
масса соли гидроксида натрия
![]() г/моль.
г/моль.
Согласно
закону эквивалентов
![]() ,
,
отсюда следует, что
![]() г.
г.
Пример
2. При
соединении 5,6 г железа с серой образовалось
8,8 г сульфида железа. Найти эквивалентную
массу железа Э(Fe)
и его эквивалент, если известно, что
эквивалентная масса серы равна 16 г/моль.
Решение:
Из условия задачи следует, что в сульфиде
железа на 5,6 г железа приходится
8,8-5,6=3,2 г серы. Согласно закону эквивалентов:
5,6
г (Fe)
– 3,2 г (S)
Э
(Fe)
– 16 г/моль, где 16 г/моль – эквивалентная
масса серы.
Следовательно:
Э(Fe)=5,6∙16/3,2=28
г/моль.
Масса
одного моля железа равна 56 г. Поскольку
эквивалентная масса железа 28 г/моль,
эквивалент железа Z=1/2
моль.
При решении задач,
с участием газообразных соединений,
целесообразно пользоваться значением
эквивалентного объема.
Эквивалентным
объемом
называется объем, занимаемый при данных
условиях 1 эквивалентом вещества.
![]() л/моль,
л/моль,
![]() л/моль.
л/моль.
Пример
3. Некоторое
количество металла, эквивалентная масса
которого равна 28 г/моль, вытесняет из
кислоты 0,7 л водорода, измеренного при
нормальных условиях. Определить массу
металла.
Решение.
Согласно
закону эквивалентов,
![]() ,
,
отсюда следует что,
![]() г.
г.
Задания к разделам I, II
Написать
реакции образования кислых, основных
и средних солей, полученных при
взаимодействии предложенных кислоты
и основания. Полученые соли назвать.
Написать их графические формулы:
1.Сернистая
кислота + гидроксид хрома(III).
2.Серная кислота
+ гидроксид магния.
3.Селеновая кислота
+ гидроксид алюминия.
4.Хромовая
кислота + гидроксид железа(II).
5.Угольная кислота
+ гидроксид натрия.
6.Ортофосфорная
кислота + гидроксид калия.
7.Пирофосфорная
кислота + гидроксид цезия.
8.Марганцевая
кислота + гидроксид никеля(III).
9.Азотистая
кислота + гидроксид висмута(III).
10.
Азотная кислота + гидроксид железа(III).
11.Сероводородная
кислота + гидроксид магния.
12.Хлороводородная
кислота + гидроксид олова(IV).
13.Хлорная
кислота + гидроксид железа(III).
14.Ортомышьяковая
кислота + гидроксид калия.
15.Сероводородная
кислота + гидроксид бария.
16.Метакремниевая
кислота + гидроксид стронция.
17.Хлорноватистая
кислота + гидроксид хрома(III).
18.Ортокремниевая
кислота + гидроксид калия.
19.Дихромовая
кислота + гидроксид висмута(III).
20.Метаоловянная
кислота + гидроксид стронция.
21.Марганцовистая
кислота + гидроксид железа(II).
22.Борная кислота
+ гидроксид бария.
23.Метафосфорная
кислота + гидроксид никеля(III).
24.Хлористая кислота
+ гидроксид алюминия.
25.Пирофосфорная
кислота + гидроксид кобальта(II).
26.Селеновая
кислота +гидроксид никеля (III).
27.Ортофосфорная
кислота + гидроксид железа (II).
28.Ортомышъяковая
кислота + гидроксид кальция.
29.Иодноватистая
кислота + гидроксид висмута (III)
30.Селеноводородная
кислота + гидроксид марганца (II)
31.сернистая
кислота + гидроксид олова (II).
Написать
эмпирические и графические формулы
указанных солей. Представить данные
соли как продукты взаимодействия:
a)
основного и кислотного оксидов; б)
кислоты и основания:
32.Метафосфат
алюминия, нитрит натрия.
33.Перхлорат
никеля(III),
селенат калия.
34.Бихромат
цезия, ортоборат алюминия.
35.Бромат
кальция, ортосиликат бериллия.
36.Карбонат
алюминия, ортофосфат рубидия.
37.Нитрит
железа (III),
перманганат магния.
38.Пиросульфат
стронция, тетраборат натрия.
39.Метаалюминат
калия, сульфит кальция.
40.Гипоиодит
алюминия, перманганат калия.
41.Хлорат
натрия, нитрит меди(II).
42.Ортоарсенат
натрия, метасиликат алюминия.
43.Метаборат
натрия, сульфат никеля(III).
44.Метахромит
цезия, гипохлорит кальция.
45.Манганат
рубидия, пирофосфат алюминия.
46.Метастаннат
бария, сульфит хрома(III).
47.Тетраборат
калия, хлорит магния.
48.Ортоарсенит
кальция, перхлорат рубидия.
49.Хромат
серебра, ортоарсенат калия.
50.Метафосфат
железа(III),
бихромат калия.
51.Метаалюминат
бария, ортофосфат кальция.
52.Хлорат
калия, перманганат свинца(II).
53.Сульфат
железа(III),
перхлорат стронция.
54.Нитрит
алюминия, сульфат кальция.
55.Гипобромит
железа(III),
сульфит бария.
56.Метаборат
калия, пиросульфат кальция.
57.Метаарсенит
натрия, бромат кальция.
58.Тетраборат
калия, хлорат магния
59.Гипохлорит
висмута (III),
дихромат натрия
60.Манганат
кальция, селенат натрия.
61.Пирофосфат
хрома (III),
нитрит магния
62.Периодат
стронция, метахромит цезия.
Определить
эквивалентные массы следующих соединений
63.
Cr2O3,
Cu(OH)2,
H2SO4
64.
ZnO, Fe(OH)3,
HCl
65.
Fe2O3,
CuCl2,
H3PO4
66.
CaO, Al2(SO4)3,
Zn(OH)2
67.
K2O,
H4P2O7,
NiCl2
68.
H2SO3,
Fe(OH)2,
Na2CO3
69.
HMnO4,
Bi2O3,
H2S
70.
KMnO4,
SnO2,
HClO4
71.
Cl2O3,
Ba(OH)2,
H2PbO3
80.
Ni2O3,
H2CO3,
K2S
81.
Cl2O5,
Bi(OH)3,
KNO3
82.
SbCl3,
Ca(OH)2,
P2O3
83.
Na2S2O3,
FeO, H2B4O7
84.
Na2CrO4,
Cl2O7,
Cr(OH)3
85.
Pb(NO3)2,
H2SO3,
P2O5
86.
ZnSO4
, H4SiO4
B2O3
87.
NaHCO3,
Cl2O3,
H3PO4
88.
FeCl3,
H2S2O3
Mg(OH)2
89.
Na2HPO4,
Cl2O,
H3AsO4
90.
CoCl3,
CH3COOH,
Sn(OH)2
91.
NiSO4,
Al2O3,
H4P2O7
92.
Sn(SO4)2
, SeO3,
H2MnO4
93.
CuSO4,
As2O5,
HClO3
94.
H2S2O7,
Mn2O7,
Ni2(SO4)3
95.
H2SiO3,
F2O,
FeBr3
96.
MnSO4,
H2CO3,
H2O2
97.
Al2O3,
H3AsO4,
NiSO4
98.
Cl2O,
CoCl3,
Sn(OH)2
99.
Mg(OH)2,
Cl2O7,
ZnSO4,
100.
H3PO4,
SnO2,
As2O5,
Решить
задачу с использованием закона
эквивалентов.
101.
На нейтрализацию 2 г основания израсходовано
2,14 г HCl. Вычислить эквивалентную массу
основания.
102.
Определить число эквивалентов Cu(OH)2,
если его масса составляет 97,5г.
103.
Определить эквивалентную массу хрома
в его оксиде, если в нем содержится 23,53
% кислорода.
104.
0,501 г металла вытеснили 0,04 г водорода,
вычислить эквивалентную массу металла.
105.
Определить эквивалент Сu
в его соединениях: CuS,
Cu3P2
106.
Определить эквивалентную массу серы в
ее соединениях: SO2,
SO3
107.
2, 14 г металла вытесняют 2 л водорода н.у.
Определить эквивалент металла.
108.
Определить массу вытеснившего из кислоты
0,7 л водорода н.у., если эквивалентная
масса металла равна 27 г/моль.
109.
Оксид металла содержит 28, 57 % кислорода,
а галогенид того же металла 48,72 %
галогена. Найти эквивалент галогена.
110.
На восстановление 3,6 г оксида металла
израсходовано 1,7 л водорода н.у. Рассчитать
эквивалентную массу металла.
111.
При нейтрализации 9,797 г ортофосфорной
кислоты израсходовано 7,998 г гидроксида
натрия. Вычислить эквивалентную массу
кислоты в данной реакции.
112.
Некоторый элемент образует оксид,
содержащий 31, 58% кислорода. Написать
формулу оксида элемента, если валентность
элемента равна 3.
113.
При восстановлении 1,2 г оксида металла
водородом образовалось 0,27 г воды.
Вычислить процентное содержание металла
в его оксиде.
114.
Эквивалент металла равен 56,2 г/моль.
Вычислить процентное содержание металла
в его оксиде.
115.
Написать эмпирическую формулу соединения,
содержащего 64,9 % золота и 35 % хлора.
116.
2 г двухвалентного металла вытесняют
1,12 л водорода н.у. Вычислить эквивалентную
массу металла и написать его формулу
117.
Определить эквивалентную массу металла,
зная, что его сульфид содержит 52 %
металла.
118.
Сколько литров водорода н.у. потребуется
для восстановления 112 г оксида металла,
содержащего 71,43 % металла?
119.
Масса 1 л кислорода н.у. равна 1,4 г. Сколько
литров кислорода расходуется при
сгорании 2,1 г магния?
120.
Мышьяк образует оксид, который содержит
65,2% мышьяка. Определить валентность
мышьяка в оксиде, написать формулу
оксида.
121.
При разложении 0,4638 г оксида металла
образовалась 0,4316 г металла. Определить
эквивалентную массу металла.
122.
1г двухвалентного металла н.у. вытесняет
921 мл. водорода н.у. Какой это металл?
123.
Элемент образует водородное соединение,
содержащее 8,9 % водорода. Определить,
какой это элемент, если валентность
равна 3. Составьте формулу его гидрида.
124.
Мышьяк образует оксид, который содержит
75,7 % мышьяка. Определить валентность
мышьяка в оксиде, написать формулу
оксида.
125.
При прокаливании 0,954 г металла в кислороде
образовалось 1,194 г оксида металла. Найти
эквивалентную массу металла.
126.
Масса 1 л кислорода н.у. равна 1,4 г. Сколько
литров кислорода расходуется при
сгорании 2,1 г магния?
127.Сколько
эквивалентов и сколько молей содержится
в а) 200 г карбоната кальция, б) 1,96 г
ортофосфорной кислоты?
128.
В каком количестве КОН содержится
столько же эквивалентов, сколько в 370г
Ca(OH)2?
129.
Вычислить эквивалентную массу висмута,
если при окислении 8,71 г его образовалось
9,71 г оксида. Написать формулу полученного
оксида.
130.
Определить эквивалентную массу железа,
если 7 г его прореагировали с 0,25
эквивалентами серной кислоты.
131.
2,8 г натрия и 3,4 г железа вытесняют из
кислот одинаковое количество водорода.
Найти эквивалентную массу железа и
объем выделившегося водорода.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
